Что такое перевиваемые опухоли
В статье рассматриваются модели (перевиваемые, индуцированные опухоли, экспериментальные модели, использующие опухоли человека и молекулярно-генетические модели) для проведения бор-нейтронзахватной терапии злокачественных опухолей.
Ключевые слова: перевиваемые, индуцированные опухоли, экспериментальные модели, использующие опухоли человека, молекулярно-генетические модели
Известно, что при использовании бор-нейтронзахватной терапии (БНЗТ) нормальные клетки, окружающие опухоли, подвергаются воздействию тепловых нейтронов, приводящему к вызванному радиацией повреждению нормальной ткани. Повреждение здоровых клеток может произойти как из-за радикалов, генерированных излучением при БНЗТ, так и при прямом повреждении ДНК клетки нейтронным потоком. Концентрация препаратов бора 10B в здоровых клетках ниже, чем в опухолевых клетках. Поэтому, диапазон нейтронного излучения применительно к нормальным клеткам ниже, чем в опухолевых клетках. Следовательно, радикалы могут играть важную роль в повреждении нейтронами здоровой ткани. Есть данные, что вызванные радиацией радикалы длительного действия (нескольких часов), могут играть более важную роль в индукции мутации, чем радикалы короткого действия [7]. Радикалы короткого действия вызывают повреждение клеток и их гибель, с другой стороны, радикалы длительного действия (не менее 20 часов) не вызывают повреждения самой клетки, но способны вызывать мутации гена [7]. В эксперименте в культуре ткани была использована аскорбиновая кислота, которую добавляли после воздействия нейтронов, что позволило снизить число мутаций в клетках [9].
В качестве экспериментальных моделей для оценки клеточных реакций в онкологии широко используют так называемые перевиваемые или постоянные клеточные линии, которые представляют собой клетки различных опухолевых и неопухолевых тканей человека, способные к росту и размножению in vitro. Процесс получения клеточных линий чрезвычайно сложен и длителен. Обычно выход культивированных in vitro опухолей человека в постоянные клеточные линии не превышает 1–2 %.
Так, клеточные линии используют в качестве экспериментальных моделей для изучения закономерностей опухолевого роста, межклеточных взаимодействий, морфологических и других особенностей клеток различных опухолей, влияния препаратов химического и биологического происхождения на опухолевые и нормальные клетки. Эти исследования осуществляют с применением современных методов культивирования, клонирования клеток и их трансдукции разными генами, а также иммунологических, вирусологических, биохимических, морфологических и цитогенетических методов. Благодаря наличию этих клеточных моделей осуществляется создание и тестирование активности новых противоопухолевых средств, антиангиогенных, иммуномодулирующих и противовирусных препаратов, а также проводится определение токсикологических свойств солей металлов и других химических соединений, с которыми человек сталкивается на работе и в быту.
Остановимся подробно на вариантах экспериментальных моделей опухолей для БНЗТ. Современный арсенал моделей экспериментальной онкологии включает спонтанные, перевиваемые и индуцированные опухоли животных; опухоли человека, перевитые иммунодефицитным животным; культуры опухолевых клеток человека и животных; молекулярно-генетические модели, что позволяет изучать особенности различных опухолей, закономерности их возникновения и роста, механизмов их метастазирования и т. д. Наиболее часто в этих целях используют перевиваемые опухоли, культуры клеток и молекулярно-генетические модели, процесс получения которых трудоемок и длителен [8].
Перевиваемые опухоли. Создание инбредных линий позволило ввести в арсенал моделей экспериментальной онкологии перевиваемые опухоли. Онкологам-экспериментаторам уже не надо было дожидаться появления спонтанных опухолей. При прививке они могли получить достаточное для исследований количество опухолей [3]. Это делало возможным постановку эксперимента с большим числом сравниваемых групп животных. Трансплантация опухоли с одной особи на другие в пределах одной линии мышей всегда успешна. Любую спонтанно возникшую или индуцированную опухоль можно превратить в перевиваемый штамм, т. е. опухоль, сохраняющую свои свойства при последующих перевивках. Штамм можно подвергнуть замораживанию с применением криопротекторов и хранить в таком состоянии в контейнере с жидким азотом сколь угодно долго. В случае надобности штамм размораживают и трансплантируют животным. В онкологических центрах и лабораториях существуют банки, где хранятся сотни перевиваемых штаммов опухолей. С использованием перевиваемых опухолей инбредных мышей получаются более воспроизводимые и статистически достоверные результаты, причем на меньшем числе животных. Все это делает перевиваемые опухоли незаменимой моделью для исследований в области экспериментальной терапии. Как правило, неизвестный препарат испытывают на нескольких штаммах, причем в этот список непременно включают метастазирующие штаммы опухолей, а также штаммы, обладающие лекарственной устойчивостью. Все химиопрепараты, применяющиеся в онкологической клинике в настоящее время, непременно проявили противоопухолевую активность на какой-нибудь перевиваемой опухоли животных. Наряду с явными преимуществами перевиваемые опухоли как модели имеют один существенный недостаток. Дело в том, что при прививке опухоль переносится в организм здорового животного. По отношению к онкологическим заболеваниям человека это искусственная ситуация. Более адекватными в этом смысле моделями являются спонтанные и индуцированные опухоли, так как в этих случаях опухоль возникает из клеток организма, подвергшихся злокачественной трансформации [2]. Получение перевиваемых опухолей заключается в трансплантации спонтанной или индуцированной опухоли подопытным животным (мышам, крысам, кроликам, собакам [5, 6] с последующими многократными пассажами клеток опухоли от одного животного к другому [1].
Индуцированные опухоли. При исследовании индуцированных канцерогенными веществами опухолей были получены факты, необходимые для понимания сущности процесса злокачественного роста.Опухоли могут быть индуцированы у животных также онкогенными вирусами. Первым вирусом, для которого доказана роль в возникновении опухолей, был открытый в 1910 году П. Раусом из Рокфеллеровского университета США вирус саркомы кур.
В отличие от животных, у которых открыты десятки опухолеродных вирусов, лишь для относительно небольшого числа опухолей человека доказана роль вирусов в их возникновении. Модели индуцированных вирусами опухолей животных, а также модели злокачественно трансформированных под влиянием вирусов клеток, культивируемых в условиях in vitro, позволили не только раскрыть многие тайны вирусного канцерогенеза, но и создать общую концепцию молекулярных механизмов возникновения опухолей.
Опухоли могут быть индуцированы также различными видами облучения. У людей, подвергшихся действию ионизирующей радиации, возникают опухоли кроветворной ткани, костей, легких, печени, щитовидной железы и других органов. В экспериментах на животных при воздействии облучения возникают опухоли такого же широкого спектра. Нарушения баланса гормонов могут играть одну из главных ролей в патогенезе злокачественных опухолей. Моделями исследования этого процесса служат опухоли животных, образующиеся вследствие введения гормонов или наоборот удаления желез внутренней секреции (гипофиза, яичников) [2].
Экспериментальные модели, использующие опухоли человека. Исследования опухолей животных, спонтанных, индуцированных и перевиваемых, показали, что полной корреляции между экспериментальными и клиническими данными нет и, следовательно, прямой перенос результатов в клинику опухолей человека невозможен. Последнее касается, прежде всего, отбора противоопухолевых препаратов. Это заставляло онкологов искать подходы к использованию опухолей человека в экспериментальных моделях. Различные опухоли человека можно выращивать на питательных средах. В этом обзоре нет возможности рассмотреть все разнообразие культуральных моделей. Назову лишь самые распространенные из них: органные, тканевые и клеточные культуры, культуры в агаре.
Многие фундаментальные проблемы онкологии решены с использованием культуры опухолевых клеток. С практической точки зрения, важным является применение культуры клеток опухолей человека для отбора противоопухолевых препаратов, установления индивидуальной чувствительности опухоли к химиопрепаратам, а также для испытания генотоксических свойств веществ. В этой модели самым привлекательным является то, что экспериментатор имеет дело с опухолями человека. Однако они находятся вне организма, в искусственных условиях. Это главный недостаток данной модели. Тем не менее, на ней можно испытывать препараты, оказывающие токсический эффект на клетки, хотя при этом об избирательности их действия на опухолевые клетки судить невозможно. Для тестирования препаратов, обладающих опосредованным эффектом на опухоли, эта модель не годится. Также непригодна она и для исследования веществ, подвергающихся в организме метаболической активации. Поэтому исследователи прилагали усилия для получения модели, позволяющей опухолям человека расти в организме животных. С этой целью используют гетеротрансплантацию опухолей человека. Для того чтобы опухоли человека развивались в организме животных, необходимо преодолеть или обойти барьер тканевой несовместимости между опухолью и реципиентом. Для этого опухоли человека трансплантируют в так называемые привилегированные органы. В этих органах на чужеродные трансплантаты (гетеротрансплантаты) иммунные реакции не развиваются. К таким органам относятся передняя камера глаза, мозг, семенники, защечные мешки у хомячков. При прививке опухоли в эти органы можно работать только с опухолями маленьких размеров. Как только опухоль прорастает окружающие ткани, привилегированность данного района отменяется, и опухоль отторгается.
Гетеротрансплантацию опухолей человека можно производить также на развивающийся куриный эмбрион. И в этом случае недостатки модели те же. В связи с этим подобные трансплантации широкого применения в экспериментальной онкологии не нашли. Более адекватной является трансплантация человеческих опухолей животным в диффузионных камерах. Кусочки опухоли помещают в миллипоровую камеру, размер пор которой предотвращает проникновение в нее клеток иммунной системы. На этой модели можно отбирать противоопухолевые препараты, требующие активации в организме. Однако исследования с использованием диффузионных камер весьма трудоемки. Кроме того, при этом есть трудности в оценке противоопухолевого эффекта. Это является серьезным препятствием для применения модели, в частности для установления индивидуальной чувствительности опухоли к химиопрепаратам.
Наиболее пригодной для трансплантации опухолей человека являются созданные недавно мыши SCID/Hu. Это мыши с тяжелым комбинированным иммунодефицитом, которым в раннем возрасте трансплантированы кусочки тимуса и печени человека. Метаболические процессы у этих мышей максимально приближены к человеческим. Такие животные с трансплантированными им опухолями человека используются в настоящее время в различных онкологических экспериментах [2].
Особенностью реакции нейтронного захвата 10В(n,α) и 7Li является образование высокоэнергетической α-чаcтицы (4He), отличающейся высокой величиной пробега в ткани (порядка 5–9 мкм), сопоставимой с размером клеточного ядра. Все это и создает условия для повреждения лишь непосредственно в зоне локализации атома бора. Таким образом, селективная доставка атомов бора 10B к опухоли позволяет после воздействия тепловыми нейтронами рассчитывать на локальное повреждение только самой мишени [4]. Основная доза излучения, поражающая опухолевые ткани, формируется непосредственно в самой опухоли в результате вторичного излучения, которое возникает в результате поглощения тепловых нейтронов ядрами некоторых элементов (наиболее часто используют изотопы бора 10B и реже 157Gd), входящих в состав специальных препаратов [5].
Таким образом, при использовании БНЗТ здоровые клетки, окружающие опухоль, подвергаются воздействию тепловых нейтронов, приводящему к их повреждению как из-за радикалов, генерированных излучением при БНЗТ, так и при прямом повреждении ДНК клетки нейтронным потоком.
Список литературы
- Гончарук Е. И. Применение карбоцианиновых флуоресцентных зондов для оценки функционального состояния культивированных клеток после криоконсервирования / Е. И. Гончарук [и др.] // Biopolymers and cell. – 2008. – Т. 24, № 3. – С. 225–230.
- Попова Н. А. Модели экспериментальной онкологии / Н. А. Попова // Соросовский образовательный журнал. – (http://www.pereplet.ru/obrazovanie/stsoros/1014.html)
- Ситдикова С. М. Специфичность рецидивирования и метастазирования экспериментальных перевиваемых опухолей карциномы Эрлиха и меланомы В16 / С. М. Ситдикова [и др.] // Бюллетень экспериментальной биологии и медицины. – 2007. – Т. 143, № 1. – С. 86–88.
- Хмелевский Е. В. – М. : Российский научный центр рентгенорадиологии Росмедтехнологий. – (http://vestnik.rncrr.ru/vestnik/v7/papers/khmelevsky_v7.htm)
- Dagrosa M. Biodistribution of p-borophenylalanine (BPA) in dogs with spontaneous undifferentiated thyroid carcinoma / М. Dagrosa [et al.] // Neutron capture therapy of epidermal growth factor (+) gliomas using boronated cetuximab (IMC-C225) as a delivery agent : Topics in neutron Capture therapy: Proceedings of the Eleventh World Congress on Neutron Capture Therapy. – 2004. – Vol. 61, N 5. – P. 911–917.
- French J. L. Bayesian Methods for a Three-State Model for Rodent Carcinogenicity Studies / J. L. French, J. G. Ibrahim // Biometrics. – 2002. – Vol. 58, N 4. – Р. 906–916.
- Koyama S. Radiation-induced long-lived radicals which cause mutation and transformation / S. Koyama [et al.] // Mutat. Res. – 1998. – Vol. 421. – P. 45–54.
- Miyata S. Biodistribution and Imaging studies on F98 rat glioma by convection enhanced delivery of transferrin targeting PEG liposomes encapsulating both BSH and iodine contrast agent / S. Miyata [et al.] // A new option against cance : 13th International Congress on Neutron Capture Therapy. – Florence, 2008. – Р. 303–306.
- Ueno A. Ascorbate, added after irradiation, reduces the mutant yield and alters the spectrum of CD59-mutations in A(L) cells irradiated with high LET carbon ions / А. Ueno [et al.] // J. Radiat. Res. (Tokyo). – 2002. – Vol. 43 (Suppl.). – Р. 245–S249.
Государственная лицензия ФГБОУ ВО НГМУ Минздрава России
на образовательную деятельность:
серия ААА № 001052 (регистрационный № 1029) от 29 марта 2011 года,
выдана Федеральной службой по надзору в сфере образования и науки бессрочно
Свидетельство о государственной аккредитации ФГБОУ ВО НГМУ Минздрава России:
серия 90А01 № 0000997 (регистрационный № 935) от 31 марта 2014 года
выдано Федеральной службой по надзору в сфере образования и науки
на срок по 31 марта 2020 года
Адрес редакции: 630091, г. Новосибирск, Красный проспект, д. 52
тел./факс: (383) 229-10-82, адрес электронной почты: mos@ngmu.ru
Средство массовой информации зарегистрировано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) —
Свидетельство о регистрации СМИ: ПИ № ФС77-72398 от 28.02.2018.
08.02.2016
Уважаемые авторы! Открыт прием статей во 2-й номер 2016 года (выход номера — середина мая 2016 г.).
Подробнее >>
11.01.2016
Уважаемые авторы! Продолжается прием статей в 1-й номер 2016 года (выход номера — конец февраля 2016 г.).
Подробнее >>
28.12.2015
Уважаемые авторы! Сетевое издание входило в Перечень ВАК до 30 ноября 2015 г. Работа по включению издания в новый Перечень ВАК продолжается.
Информация о формировании Перечня ВАК
Подробнее >>
"Модель – это ложь, которая помогает увидеть правду"
Говард Скиппер, американский онколог
О том, что животных можно использовать в качестве моделей для изучения различных воздействий, ученые догадались достаточно давно. Еще в Древней Греции Аристотель проводил эксперименты на живых животных. Позднее Авицена тестировал новые хирургические процедуры на животных, прежде чем выполнить их у пациентов. 
В наше время в онкологии животные модели используются с различной целью:
- изучение эффективности и безопасности лекарственных препаратов, которые предполагается внедрить в клиническую практику - доклинические исследования;
- дальнейшая интерпретация результатов клинических исследований - пост-клинические исследования;
- скрининг в поисках новых лекарств;
- изучение биологии опухоли;
- изучение механизмов противоопухолевого лечения: взаимодействие препарата с мишенью.
Чтобы получить представление о роли экспериментальных исследований на животных в развитии онкологии, обратимся к двум историческим примерам.
Пример 1
В 1954 году в США был принят законопроект, поручавший Национальному институт онкологии разработать программу по целенаправленному и эффективному поиску лекарств для химиотерапии. За десять лет на миллионе мышей было протестировано около 83 тысяч синтетических веществ, 115 тысяч продуктов ферментации и свыше 17тысяч веществ растительного происхождения. В итоге, в распоряжении врачей для лечения детей с острым лимфобластным лейкозом было 4 препарата - метотрексат, преднизон, 6-меркаптопурин и винкристин. Все они использовались, но по отдельности. Лечение лейкемии у детей продолжало оставаться паллиативным.
На этой модели Скиппер впервые описал два важных наблюдения:
- Химиотерапия в каждый момент убивает определенный процент от общего числа клеток, вне зависимости от того, сколько их в организме.
Так, если взять мышь, у которой сто тысяч лейкозных клеток, и применить вещество, убивающее за один раз девяносто девять процентов этих клеток, то каждый новый прием будет убивать ровно эту долю, а в результате после каждого раза таких клеток будет оставаться все меньше и меньше: сто тысяч, тысяча, десять – и, наконец, после четвертого цикла упадет до нуля. - При комбинированном применении противоопухолевые лекарства работают синергически, усиливая действие друг друга.
При использовании нескольких препаратов и нескольких повторных циклов химиотерапии с малыми промежутками между ними Скипперу удавалось на своей мышиной модели добиться полного исцеления от лейкемии.
Было решено испробовать схему, сочетающую в себе четыре лекарства: винкристин, аметоптерин, меркаптопурин и преднизон. Эта схема получила сокращенное название по первым буквам каждого лекарства: ВАМП.
В первом же небольшом исследовании у 14 из 16 пациентов была достигнута полная ремиссия, а отдаленная безрецидивная выживаемость отмечена у трех из них.
Позже концепцию сочетания противоопухолевых препаратов и их курсового введения, выработанную на экспериментальной модели, применили для поздних стадий лимфомы Ходжкина. Было решено взять четыре препарата – метотрексат (позже замененный на более сильнодействующее средство – прокарбазин), винкристин, азотистый иприт (или мустарген) и преднизон. Получился не менее токсичный, чем ВАМП, коктейль с аббревиатурой МОМП (МОПП – с прокарбазином), а курс лечения был увеличен с 2,5 мес. до 6. 
Более половины испытуемых выздоровели окончательно и бесповоротно. Для поздних стадий лимфомы Ходжкина подобный ответ на лечение и количество ремиссий был беспрецедентен. Успехи комбинированной химиотерапии разительным образом изменили прогнозы пациентов с ранее неизлечимыми III и даже IV стадиями лимфомы Ходжкина. И изначально это стало возможным благодаря модели лейкемии Л1210 у мышей.
Пример 2
Еще один яркий пример использования животных моделей в онкологии – это создание анти Her2-препаратов. В 1982 в лаборатории Роберта Вайнберга выделили очередной онкоген из крысиной опухоли под названием нейробластома. Ген окрестили neu в честь типа рака, из которого этот ген был получен. От многих других открытых в то же время онкогенов его отличало то, что он не прятался в глубине клетки, а проходил через мембрану, причем так, что большой фрагмент его торчал наружу, доступный любому лекарству, т.е. это была идеальная мишень. Но эксперимент по связыванию этой мишени имеющимися в лаборатории антителами не был проведен.
Теперь от истории вернемся к предмету разговора – моделям опухолей. Классическими объектами экспериментальной онкологии являются млекопитающие, прежде всего мыши и крысы, которые хорошо адаптируются к условиям жизни в неволе и дают многочисленное потомство. Нет ни одной проблемы онкологии, которую не исследовали бы с использованием этих грызунов.
- У животных встречаются спонтанные опухоли (особенно это относится к опухолям молочной железы); подобные модели довольно близки по своей картине к клинической ситуации.
Ограничение - невозможно набрать в конкретный срок требуемое количество животных с опухолями схожих размеров и этапов развития, чтобы провести эксперимент.
- Химически индуцированные опухоли.
Например, бензпиреновые опухоли индуцируются введением мышам однократно подкожно бензпирена в масляном растворе. Это приводит к равномерному развитию подкожных фибросарком у всех животных в месте инъекции в течение 4-5 недель после введения.
Ограничения: эффекты канцерогена на поведение самой опухоли, риск для других животных и персонала.
- Генетически созданные мышиные модели (genetically engineered mouse models – GEMM).
Такие модели позволяют достаточно точно моделировать спорадические человеческие опухоли за счет контролируемого изменения генома мышей, что обеспечивает развитие конкретной опухоли с определенными свойствами в заданной локализации. Так, создаются линии животных, которые целенаправленно лишены определенного гена, или, напротив, имеют встроенный дополнительный ген.
Ярким примером трансгенных мышей является линия мышей с повышенной экспрессией онкогена HER2. У этих животных в возрасте от 2 месяцев появляются опухоли молочных желез (HER2/neu-положительных).
Ограничения: несмотря на гистологическое и генетическое сходство со злокачественными новообразованиями у человека, для большинства GEMM характерно асинхронное развитие опухолей в организме-хозяине. Такие модели, как правило, гетерогенны с точки зрения частоты развития опухолей, времени задержки в развитии опухолей и характеристик роста.
- Перевиваемые опухоли – это самая многочисленная подгруппа.
Здесь можно выделить два принципиально разных способа перевивки.
Первый, когда фрагмент мышиной/крысиной опухоли в последующем перевивается животному той же линии.
Во втором случае животным (обязательно иммунодефицитным) вводится культура опухолевых клеток человека. Такие модели получили название ксенографтных.

Усовершенствованным и наиболее перспективным вариантом стандартной ксенографтной модели является модель, для создания которой используются фрагменты опухолей, полученные непосредственно от пациентов, т.е. осуществляется прямой перенос опухолевого материала, взятого у пациента, в организм животного с иммунодефицитом без предварительного культивирования опухолевых клеток (patient-derived xenografts – PDX). Подобные PDX-модели продемонстрировали способность точно предсказывать положительный клинический ответ на лечение у 90% пациентов, и резистентность к проводимой терапии у 97% больных. Цифры, близкие к этим были получены в целом ряде исследований.
Ограничения использования данной модели обусловлены техническими особенностями ее создания, для которого необходим доступ к опухолевой ткани определенного качества непосредственно после ее получения от пациента, а также определенной материально-технической базы лаборатории, позволяющей проводить соответствующую обработку полученного материала и поддерживать опухоль через серию пассажей в организме-хозяине.
GEMM и PDX-модели, несмотря на свои недостатки, сегодня рассматриваются как наиболее ценные и перспективные с точки зрения тестирования вновь создаваемых противоопухолевых препаратов.
Г.С. Киреева, кандидат биологических наук,
научный сотрудник научной лаборатории канцерогенеза и старения
Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова.
Было решено испробовать схему, сочетающую в себе четыре лекарства: винкристин, аметоптерин, меркаптопурин и преднизон. Эта схема получила сокращенное название по первым буквам каждого лекарства: ВАМП.
Одним из ценных методов в изучении проблемы опухолевого роста являются экспериментальные исследования.
Трансплантация опухолей. Первые систематические исследования по трансплантации (пересадке) опухолей были произведены М. А. Новинским в 1875 г. Ему удалось перевить щенкам саркому от собак и лошадям - рак от лошади. Особенно благоприятным объектом для экспериментального изучения опухолевого роста (по преимуществу злокачественного) являются крысы и мыши (рис. 64).
Спонтанные опухоли у крыс и мышей могут быть перевиты от одного животного другому. Для перевивки существуют специально выделенные и хорошо проверенные штаммы опухолей, например мышиный рак Эрлиха, крысиная саркома Иенсена, кроличий рак Броуна-Пирс, куриная саркома Роуса и др.
По своим свойствам перевитые опухоли не могут считаться вполне идентичными опухолями человека. Поэтому результаты экспериментальных исследований над перевитыми опухолями нельзя безоговорочно переносить на людей. Однако экспериментальные данные при сопоставлении с результатами клинических наблюдений облегчают понимание генеза опухолей.
Для удачной перевивки необходимо перенести от одного животного другому живую ткань опухоли.
Фактически трансплантация опухоли представляет собой экспериментальный метастаз в организме нового животного. Большая часть клеточных элементов трансплантированных тканей гибнет, но остающиеся в живых, размножаясь, вызывают возникновение опухоли, которая обладает (особенно при первых перевивках) свойствами той опухоли, которая была трансплантирована.
В некоторых случаях не требуется наличия в трансплантате живых клеток для того, чтобы возникла соответствующая опухоль у реципиента. Так бывает, например, при перевивке куриной саркомы Роуса. Перевивка этой опухоли удается также при помощи бесклеточного фильтрата. По-видимому, фактор злокачественности иногда отделим от опухолевых клеток и может привести к малигнизации, т. е. к приобретению нормальными клетками злокачественных свойств. Именно об этом говорят факты возникновения опухолей от воздействия бесклеточных фильтратов из опухолевой ткани.
Данные опытов с перевивкой опухолей привели к некоторым общим выводам о закономерностях возникновения и развития опухолевого роста.
Значение видовой специфичности. Трансплантация удается лишь в случаях перевивок опухоли от одного животного другому того же вида - от крыс крысам, от мышей мышам (видовая специфичность опухоли).
Лишь в некоторых случаях удавалась перевивка от животного одного вида животному другого вида, например перевивка куриной саркомы утятам либо мышиной карциномы - крысам, лишенным селезенки, либо перевивка опухоли одного вида эмбрионам другого.
Однако все эти данные, противоречащие ранее установленным фактам видовой специфичности опухоли, требуют дальнейших, более углубленных исследований, которые могли бы окончательно подтвердить тождественность перевиваемой опухоли с вновь растущей и определить наличие в организме реципиента всех характерных для трансплантата особенностей роста.
На успешную трансплантацию опухолей влияют факторы как внутренней, так и внешней среды.
Влияние внутренних факторов. Ученые неоднократно обращали внимание на значение психической травмы в заболевании опухолями. Депрессия создает неблагоприятный фон для развития и течения опухоли.
Экспериментальные наблюдения над собаками показали, что длительная травматизация нервной системы путем вызывания хронического экспериментального невроза способствует опухолевому росту (развитию папиллом, фибром и сарком). У мышей травматизация нервной системы электрическим током усиливала рост опухолей и ускоряла их возникновение под влиянием канцерогенных веществ, например дибензантрацена (М. К. Петрова).
Различные воздействия на подкорковую область и периферическую нервную систему также оказывали некоторое влияние на развитие трансплантированных опухолей и локализацию метастазов. Об этом свидетельствуют результаты экспериментов с трансплантацией опухолей и последующими добавочными раздражениями нервной системы то в виде перерезки нервов, то в виде воздействия на них формалином или кротоновым маслом, то путем введения в субарахноидальное пространство канцерогенных веществ. Во всех этих случаях эффект заключался в ослаблении или усилении опухолевого роста или в изменениях распределения метастазов опухолей (А. Д. Сперанский и сотрудники).
Состояние глубокого торможения в высших отделах центральной нервной системы ускоряло развитие и метастазирование опухолей, тогда как возбуждение повышало устойчивость к их возникновению (Р. Е. Кавецкий).
Экспериментальные исследования подтверждают наблюдения о влиянии эндокринных желез на возникновение, развитие и исход опухолевого роста.
Наиболее достоверные данные имеются относительно влияния на опухолевый рост половых желез и гипофиза. Кастрация в раннем возрасте самок-мышей, принадлежащих к высокораковой породе, предупреждает развитие рака молочных желез. Инъекция больших доз гормона яичников эстрона усиливает рост и даже вызывает развитие опухолей у самцов. Введение же андрогена (гормон яичек) тормозит развитие опухоли.
Расстройства эндокринной функции половых желез и их влияние на опухолевый рост могут возникать от изменений гонадотропной функции передней доли гипофиза. Оказалось, что мыши низкораковой породы имеют относительно низкий уровень гонадотропной функции гипофиза, а высокораковые животные характеризуются более высокой гонадотропной активностью гипофиза. После удаления гипофиза развитие опухоли заметно тормозится. Введение самототропного гормона гипофиза стимулирует опухолевый рост.
В возникновении и росте экспериментальных опухолей особенно важное значение имеют факторы внешней среды.
Значение питания. Применение различных диет у животных, которым делалась пересадка, показывает, что характер питания имеет значение для развития опухоли. Рост перевитых опухолей у крыс тормозится при кормлении их растительными белками, лишенными лизина, аргинина и гистидина, или желатиной, не содержащей циклических аминокислот. Усиливает опухолевый рост пища, обогащенная углеводами, холестерином и калием. Длительное кормление животных пищей, лишенной тиамина, рибофлавина или холина, может способствовать возникновению рака.
Химические канцерогены. Опухоли удается вызвать в эксперименте воздействием некоторых химических раздражителей.
Посредством длительного (в течение 6 месяцев) смазывания дегтем ушей кроликов удалось получить разрастание раковой опухоли на коже (Ямагива и Ишикава, 1915). Позднее с помощью каменноугольного дегтя рак был получен и у мышей. Эти опыты были вскоре воспроизведены и подтверждены многими исследователями. Некоторые сорта дегтя, как оказалось, обладают высокой активностью и в течение 3 месяцев (после 50 смазываний кожи мышей) вызывают рак почти у всех животных.
Из каменноугольного дегтя при высокой температуре его перегонки (400 - 600°) выделены чистые канцерогенные вещества - полициклические углеводороды, которые впоследствии были получены также синтетическим путем. Они обладают способностью в зависимости от дозы и длительности действия вызывать у животных злокачественные опухоли. Такими канцерогенными свойствами отличаются производные антрацена и фенантрена: 3,4-бензпирен, диметил-1,2-бензантрацен, метилхолантрен и др. (табл. 2).
Примечание. Плюсами обозначена степень канцерогенности.
Кроме полициклических углеводородов, канцерогенным свойством обладают некоторые другие вещества.
В развитии уже давно известных данных об анилиновом раке ныне обнаружено в экспериментах канцерогенное действие таких веществ, как азосоединения (например, ортоаминоазотолуол, диметиламиноазотолуол), нафтиламин и вещества более простого строения (например, четыреххлористый углерод и хлороформ). К неорганическим канцерогенным веществам относятся соли мышьяка, цинка, хрома, кобальта, бериллий и др. До настоящего времени получено около 500 химических канцерогенных веществ.
При смазывании кожи животных канцерогенными веществами после скрытого периода в несколько месяцев обычно развивается злокачественная опухоль (рис. 65). Резорбция канцерогенных веществ при введении под кожу, внутримышечно, внутрибрюшинно или перорально вызывает рак или саркому в зависимости от того, какая ткань подверглась их воздействию. Чем выше доза вещества, тем быстрее проявляется его канцерогенное действие. Некоторые из этих веществ обладают высокой канцерогенной активностью. В редких случаях даже однократное смазывание 0,6% раствором метилхолантрена в бензоле вызывало у мышей рак.

Рис. 65. Рак у кролика, вызванный канцерогенным веществом (9:10 диметил, 1, 2-бензатрацен). Ухо смазывали этим веществом 2 раза в неделю в течение 29 недель
Однако строгая специфичность канцерогенности этих веществ окончательно не подтверждена.
Злокачественный рост может быть получен трансплантацией не только опухолей, но также нормальной ткани, культивированной в среде с добавлением к ней канцерогенных веществ.
Макрофаги селезенки куриного эмбриона, культивируемые в плазме с прибавлением канцерогенных веществ, превращались в саркоматозные клетки и, будучи введены подкожно курам, вызывали опухолевый рост. Но превращение нормальных клеток в бластоматозные при культивировании их на питательной среде с добавлением канцерогенного углеводорода возможно лишь при наличии также фактора молока (А. Д. Тимофеевский). Например, превращение нормальных клеток подкожной клетчатки мышей в бластоматозные происходит только в том случае, если ткань взята от мышеи раковой линии, т. е. в условиях, когда невозможно исключить наличие в ней фактора молока.
Большинство канцерогенных веществ - производных фенантрена - по своему химическому строению имеют некоторое сходство с эстрогенными гормонами, в частности с фолликулярным гормоном (общее ядро фенантрена). Подобно фолликулину, они оказывают эстрогенное действие (вызывают течку у животных). В особых условиях и фолликулярный гормон может способствовать опухолевому росту, а примененный в больших дозах (в хронических опытах) обладает даже канцерогенными свойствами.
Химическая общность установлена также между канцерогенными углеводородами, с одной стороны, и стеринами, гормонами коры надпочечников, желчными кислотами и витамином D - с другой. Из желчных кислот удалось синтезировать канцерогенный углеводород метилхолантрен. Дезоксихолевая кислота, содержащаяся в нормальной желчи, в условиях эксперимента обладает слабо выраженными канцерогенными свойствами.
При повторном введении мышам вытяжки из печени и легких людей, умерших от рака, а также из печени и легких трупов людей, не болевших раком, было установлено, что у мышей в известном проценте случаев развиваются злокачественные опухоли. При этом опухоли возникали чаще при введении вытяжек из органов людей, болевших раком (Л. М. Шабад).
Значение всех этих наблюдений заключается в том, что они позволяют поставить вопрос о зависимости патогенеза злокачественных опухолей от образования канцерогенных веществ в самом организме в связи с расстройством обмена веществ, особенно обмена стеринов (эндогенные канцерогенные вещества). Однако их роль в возникновении опухолей окончательно не выяснена.
Физические канцерогены. При длительном воздействии механических раздражителей на ткань могут возникать опухоли. Например, у морских свинок рак желчного пузыря возникает через большой промежуток времени после зашивания в него камешков.
Рак у крыс и мышей могут вызывать малые дозы ионизирующего излучения, например γ-лучей. Эти лучи в зависимости от дозы вызывают появление новообразований, ускоряют или тормозят их рост.
В этом отношении особое внимание обращено на заболеваемость опухолями в связи с попаданием в организм различных радиоактивных веществ, например стронция, накоплением их в тканях и длительным действием на организм. Канцерогенное действие радиоактивных веществ зависит от характера излучения (например, от степени жесткости . -лучей), химической природы изотопов, периода их полураспада, а также скорости выведения из организма.
Существуют отдельные наблюдения, указывающие на возникновение злокачественных опухолей от длительного действия ультрафиолетовых лучей и даже при известных условиях от массивного и длительного облучения солнцем не покрытой шерстью кожи у крыс (Н. Н. Петров). Ультрафиолетовые лучи с длиной волн в пределах 280 - 335 mμ могут вызывать опухолевый рост.
Биологические факторы. Установлена связь между возникновением опухолей и хроническими раздражениями, исходящими от воздействия на организм некоторых биологических агентов.
Так, экспериментальный рак желудка у крыс возникал при кормлении их тараканами, в мускулатуре которых содержались глисты Spiroptera neoplastica. Однако в метастазах опухоли эти паразиты не были обнаружены.
Саркомы печени у крыс вызывались глистами Taenia crassicolis, паразитирующими в кишечнике кошки.
Все эти опыты свидетельствуют о том, что наряду с другими раздражителями макропаразиты также могут вызывать опухоли. Однако их роль сводится лишь к неспецифическим физическим или химическим раздражениям ткани, которые в конце концов и ведут к возникновению бластоматозного роста.
Опухоли у кур удавалось вызывать инъекцией бесклеточного фильтрата куриной саркомы Роуса, т. е. с помощью какого-то агента, отделимого от клеток опухоли (рис. 66). Этот агент обладает признаками, свойственными фильтрующимся вирусам. Например, он способен количественно увеличиваться по мере роста опухоли, переходить в дочерние клетки и даже распространяться в организме животного, т. е. обладает способностью размножения. Химический анализ показал, что вирус представляет собой рибонуклеопротеин с липоидным и углеводным компонентом.
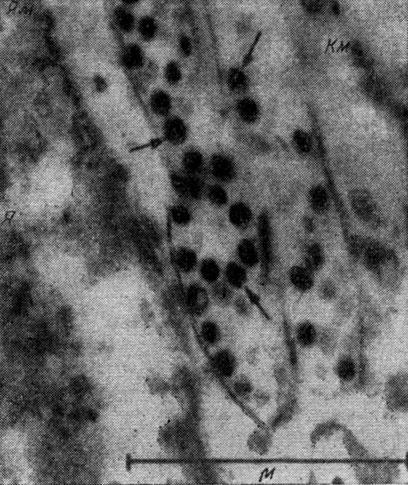
Рис. 66. Вирусные частицы в цитоплазме саркомы Роуса (обозначены стрелками). Я - ядро клетки; Ям - мембрана ядра; Км - клеточная мембрана. Электронная микроскопия; х 45 000 (по В. Бернгарду)
К опухолевым вирусам относят также упомянутый выше фактор молока (Биттнер). В пользу вирусной природы фактора молока приводят его способность размножаться в культурах ткани, физические и химические свойства, отношение к различным внешним агентам (например, термическому воздействию, высушиванию), его ультраструктуру и цикл развития в пораженной клетке, сходные с тем, что свойственно уже известным вирусам. Все же до сих пор нельзя считать окончательно установленным, является этот фактор действительно вирусом или близким вирусам своеобразным продуктом жизнедеятельности опухолевых клеток, обладающим аутокаталитическим действием, или способностью вызывать в новом организме образование себе подобных веществ.
В последнее время у некоторых диких пород кроликов обнаружена опухоль - папиллома, которая перевивается домашним кроликам также при помощи бесклеточного ее фильтрата (папиллома Шопа). Но и здесь возникают сомнения, так как не вполне установлено, является ли эта опухоль истинной опухолью или реактивным разрастанием ткани. Такие разрастания у кроликов могут действительно превращаться в раковые опухоли. Но тогда бесклеточный экстракт образовавшейся таким образом злокачественной опухоли опухолевого роста не вызывает.
Вообще необходимо отметить, что количество достоверно известных вирусов, вызывающих опухоли, пока незначительно. Кроме упомянутых, к вирусным опухолям относят аденокарциному и лейкоз мышей, мышиную опухоль околоушной железы, вызываемую вирусом полиомы, и некоторые другие.
Результаты изучения свойств вируса полиомы поколебали существующее положение о видовой и тканевой специфичности опухолевых вирусов, так как оказалось, что вирус полиомы может вызывать опухоль не только у мышей, но и у некоторых других животных (хомяки, крысы) и притом в разных органах.
Хроническая регенерация и хроническая воспалительная пролиферация. Вызванная воздействием на ткань различных раздражителей хроническая пролиферация или регенерация может дать начало развитию опухолевого роста. Эти предшествующие опухолевому росту изменения рассматриваются многими исследователями как благоприятная почва для появления опухоли.
В связи с этим важно также отметить, что хроническое отравление мышей и крыс дегтем может вызвать усиленное предрасположение таких животных к возникновению опухоли на месте действия какого-либо дополнительного раздражителя (ко-канцероген), например при воздействии подпороговых доз канцерогенных веществ в сочетании с воспалительным агентом (кротоновое масло).
Подверженность отдельных тканей опухолевому росту проявляется также в опытах с растущими вне организма моноцитами и макрофагами селезенки куриного эмбриона, которые чаще других клеток переходят в саркоматозные клетки под воздействием химически чистых канцерогенных веществ в сочетании с бесклеточными фильтратами некоторых опухолей.
Очевидно в возникновении экспериментальных опухолей имеют значение не только внешние факторы раздражения, но также реактивные свойства тканей, в частности размножающиеся пролиферирующие молодые тканевые элементы.
Иммунитет к опухолям. В эксперименте неоднократно пытались доказать существование иммунитета к опухолям на основании возможности возникновения естественно приобретенной устойчивости к ним после самопроизвольного рассасывания спонтанных опухолей. Искусственно приобретенная устойчивость наблюдается после рассасывания ранее привитого кусочка. Иммунитет к опухолям объясняется различно. Одни исследователи в выработке иммунитета решающее значение придают (без достаточных оснований) только местной реакции ткани, окружающей трансплантированную частицу опухоли (так называемая тканевая резистентность). Другие исследователи отвергают это утверждение и главное значение в иммунитете к опухолям приписывают (с большим основанием) иммунобиологическим свойствам организма, в частности по отношению к некоторым нуклеопротеидам, выделенным из опухолей.
Однако строгая специфичность такого иммунитета еще не может считаться доказанной. До сих пор не удалось в связи с перевивкой опухоли обнаружить строго специфические антитела в крови, а также получить пассивный иммунитет к опухолям инъекциями сыворотки крови животного, уже перенесшего заболевание.
Читайте также:

