Частота встречаемости острых лейкозов
Частота возникновения лейкозов у детей определяется исключительно частотой их острых форм. Хронические миелоидные лейкозы у детей являются редкими заболеваниями, а хронические лимфоидные формы у детей не описаны. До последних лет частота лейкозов у детей изучалась главным образом по данным смертности или по статистике госпитализаций. С конца 60-х годов эти методы не могут быть надежными ориентирами уровней заболеваемости, так как повышение эффективности лечебных мероприятий привело к увеличению числа детей с большой длительностью жизни и практически выздоровевших от острого лейкоза.
Вопрос о показателях заболеваемости и смертности особенно остро обсуждался 15-20 лет назад, когда многочисленные исследователи приводили подтверждения неуклонного роста частоты лейкозов как у взрослых, так и у детей. Очень близкие данные по смертности детей в США в 30-40-х годах приводит J. Cooke. Не менее убедительны в отношении роста смертности от лейкозов и данные Е. Bjelke по Норвегии.
Тенденции роста заболеваемости и смертности затрагивали все возрастные группы, но особенно выраженными оказались для лиц старческого возраста и для детей. Некоторой иллюстрацией этого положения для Англии и Уэльса являются данные, цитируемые М. Alderson.
С конца 60-х годов в связи с совершенствованием методов лечения острых лейкозов начинается последовательное снижение смертности от лейкозов у детей и молодых взрослых. Довольно быстро достигается почти двукратное снижение смертности детей, но в последующие годы дальнейшее снижение происходит очень медленно.
Кроме хронологических сдвигов смертности в отдельных странах мира, имеются и существенные различия по ее географическому распределению. Обращает на себя внимание значительное отличие уровней смертности от лейкозов между разными странами.
Есть страны с очень высокими показателями смертности от лейкозов (Дания, Франция, Бельгия, ФРГ имеют средний общий показатель - 8,3), и страны с показателями, относительно низкими - Сирия, Гватемала, Египет и СФРЮ со средним показателем- 1,4. Причины этих различий очень сложны и включают в себя как истинные различия в заболеваемости лейкозами людей разных расовых и этнических групп, так и различия в полноте патоморфологического исследования и клинического распознавания болезни.
В результате специального цитоморфологического исследования всех заболевших лейкозами, формируется статистика заболеваемости, смертности от различных цитоморфологических форм лейкозов.
Данные о заболеваемости лейкозами в мировой литературе представлены значительно хуже, чем данные смертности. Тем не менее, следует подчеркнуть, что среди публикаций отсутствуют сведения о тенденции к снижению заболеваемости в последние десятилетия и приводятся данные либо о стабильных уровнях заболеваемости детей, либо о ее незначительном нарастании, чаще в отдельных возрастно-половых или этнических группах. Наиболее представительными сводками заболеваемости последних лет в Великобритании является работа С. Stiller и J. Dreper; обобщение литературных источников по заболеваемости детей в США приводят P. Greenber и I. Sinister.
Как следует из статистических данных, в периоды - 9 лет для Великобритании и 14 лет для США - происходило увеличение заболеваемости лимфобластными формами лейкозов, однако для Великобритании оно оказалось существенным в группе мальчиков, а для США - преимущественно в группе девочек. Таким образом, отмечающиеся в развитых странах сдвиги в сторону уменьшения смертности от лейкозов следует объяснять исключительно влиянием лечения и роста продолжительности жизни больных детей.
Все исследователи вопроса отмечают как своеобразное свойство эпидемиологии острого лейкоза у детей - формирование пика заболеваемости и смертности в возрастной категории от 2 до 4 лет.
Пик заболеваемости, соответственный возрастной группе 2-4 года, выявляется в разных странах и в разных половых подгруппах неодновременно. Впервые он был отмечен в 20-х годах текущего столетия в Англии, затем к началу 40-х годов он появляется у мальчиков белого населения США; к концу 40-х годов - у белых девочек США; в начале 60-х годов этот пик описан у детей Японии и со значительно меньшей определенностью - у негритянских детей США.
Опираясь на эти факты, некоторые авторы считают, что японские дети и негры в США поздней вступили в контакт с некоторым лейкемогенным фактором, чем дети Англии и других стран Европы.
В настоящее время младенческий пик установился в картине заболеваемости детей многих стран мира. Его констатируют в Скандинавских странах, государствах Латинской Америки, Японии.
Здесь же нужно подчеркнуть, что со времени внедрения методов цитологической дифференцировки лейкозов все исследователи писали о том, что младенческий пик заболеваемости лейкозами связан исключительно с лимфоидными формами.
Все основные статистические данные о заболеваемости и смертности детей от лейкозов показывают определенное преобладание мальчиков над девочками. Однако, по данным статистики США, в последние десятилетия происходит сглаживание половых различий заболеваемости и смертности от лейкозов в детском возрасте.
Общая динамика заболеваемости представляет собой как бы двухкомпонентный ряд - в первые 15 лет имел место закономерный рост заболеваемости, а с 1964 г. происходит ее волнообразное изменение, близкое к синусоидальной кривой с периодом около 10 лет.
Для анализа динамических рядов заболеваемости использовался комплекс статистических методов. К ним относятся:
- анализ достоверности различий по числу больных в отдельные годы и периоды исходя из границ доверительных интервалов показателей, подчиняющихся распределению Пуассона;
- анализ линейности тренда по тесту непараметрической корреляции;
- анализ закономерности (случайности) числа точек перегиба кривой или экстремумов;
- анализ числа фаз и их длительности;
- исследование динамического ряда на соответствие линейной или периодической функции.
Рост заболеваемости в первые 15 лет удовлетворял критериям линейного тренда с коэффициентом Спирмена. В последние два десятилетия линейного роста заболеваемости отметить уже нельзя, однако цикличность изменений заболеваемости подтверждается по тесту экстремумов и фаз. Примерно аналогичные закономерности свойственны и динамическим рядам заболеваемости по отдельным возрастным группам детей. Вместе с тем, в повозрастных динамических рядах заболеваемости не удалось выявить достоверных закономерностей по распределению фаз различной длительности или изменению числа экстремумов.
Ярко выраженная и почти линейная тенденция роста заболеваемости по всем возрастным группам свойственна только первым 15 годам изучаемого периода; в остальные годы отсутствовали не только линейные, но и другие закономерные сдвиги заболеваемости. Между возрастными динамическими рядами заболеваемости отмечена непараметрическая корреляционная связь слабой степени по всему периоду и сильная за первые 15 лет. В 1965-1984 гг. корреляционная связь вообще не выявлена.
Представляют интерес и некоторые особенности динамики заболеваемости у мальчиков и девочек, во всех сдвигах заболеваемости мальчики включаются первыми.
Анализ возрастного распределения заболеваемости показывает существенно более высокую подверженность детей 2-4 лет. Можно видеть и менее определенный подъем заболеваемости после 11-12 лет, главным образом у мальчиков.
Особый интерес представляет изучение заболеваемости в когортных динамических рядах, где представлена частота лейкозов у детей по годам их рождения. Сопоставление обычных (календарных) показателей и когортных динамических рядов очень важно для суждения о возможной роли пренатальных влияний на изменения заболеваемости.
Интересные сравнения могут быть проведены при изучении возрастного распределения больных в когортах и при обычном изучении заболеваемости.
Можно отметить, что дети в когорте намного старше, чем в обычной регистрации. Средний возраст детей в когорте составляет 8,93 г, в то время как средний возраст больных за соответствующие годы составил 4,2 г. Это несоответствие может быть объяснено только тем, что через 10 лет от начала изучаемого периода значительно возросла заболеваемость и возрастной состав когорты сместился в сторону старших возрастов. Это опять является отражением пассивного переноса характерных закономерностей календарной заболеваемости в когортную форму регистрации. Приведенные различия возрастного распределения достоверны.
И эта методика дает парадоксальные результаты - средний возраст детей в когортах с высокой заболеваемостью, как правило, не ниже и даже выше, чем в когортах с низкой заболеваемостью. Такое положение возможно только в том случае, если мы имеем дело не с когортой по существу, имеющей какую-то общую характеристику по чувствительности к лейкемогенам и заболеваемости, а с когортой в формальном плане, т. е. иной формой записи календарной заболеваемости. Очевидно, тенденция увеличения заболеваемости у детей вряд ли объяснена наличием закономерно нарастающей лейкемогенной ситуации, имеющей точку приложения во внутриутробном и раннем постнатальном периоде развития детей.
Обращают на себя внимание различия возрастных кривых для частных форм лейкозов: пик частоты острого миелолейкоза (ОМЛ) приходится на первый год жизни (немногим более 1/100 000), а острый лимфолейкоз (ОЛЛ) в 6—7 раз более высокий [(7—9): 100 000] между 3-м и 4-м годами жизни. Распределение ОЛЛ асимметрично: после пика наступает пологий спад до возраста адолесценции, в котором некоторые исследователи регистрируют слабовыраженный второй пик.
В экономически развитых странах общая частота острых лейкозов у детей до 15 лет составляет 3,5—4,5 на 100 тыс. в год; показатель варьирует незначительно. ОЛЛ составляет более 80 % от всех лейкозов и 30— 35 % всех новообразований у детей.
Последние 40—50 лет в развитых странах частота детских лейкозов, а также положение и уровень младенческого ее пика стабильны. У неевропейских народов пик не так высок, а в Африке практически не выражен. В младенчестве заболеваемость выше среди девочек, а затем среди мальчиков с соотношением частоты 1:1,3. Более редкая форма — Т-клеточный ОЛЛ в основном встречается у мальчиков.
В детском возрасте острый миелолейкоз (ОМЛ) составляет 20 % от всех лейкозов и занимает 7-е место среди новообразований у детей. Частота ОМЛ у детей наиболее высока в Азии (1,1 на 100 тыс.) и относительно велика на Ближнем Востоке, в Индии и Новой Зеландии. В Западной Европе и США заболеваемость ОМЛ в среднем 0,5—0,6 на 100 тыс. детей до 15 лет. После пика на первом году жизни заболеваемость стабильна до позднего подросткового возраста (0,4 на 100 тыс.), затем наблюдается постепенный подъем до уровня 5,0 на 100 тыс. на восьмом десятке жизни.
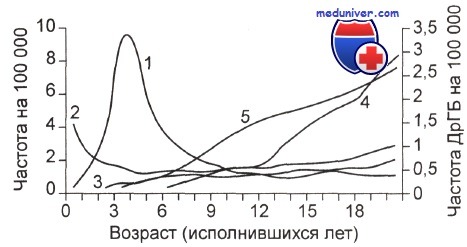
Стандартное возрастное распределение частоты заболеваний гемобластозами у детей.
1 - ОЛЛ; 2 - ОНЛЛ; 3 - ХМЛ; 4 - ЛГ; 5 - НХЛ. Показатели заболеваемости ОЛЛ даны в логарифмической шкале ввиду значительного преобладания этой формы в раннем детском возрасте.
Редко обнаруживается в детском и юном возрасте хронический миелолейкоз (ХМЛ). В России его доля у детей составляет 6,5 %. В африканских странах зарегистрирована несколько большая доля ХМЛ в молодом возрасте по отношению к общему числу лейкозов: от 10 % в Нигерии, до 19 % в Судане. ХМЛ не формирует детского пика заболеваемости и демонстрирует постепенный подъем вплоть до максимума в старшем возрасте.
Второе место среди гемобластозов по заболеваемости детей в западных странах занимают злокачественные лимфомы, включающие НХЛ и ЛХ. Частота НХЛ около 0,7 на 100 тыс.; как и при других гемобластозах, преобладают лица мужского пола в соотношении 2,5:1 — 3,0:1. У детей до 2 лет НХЛ не встречаются.
Детские неходжкинские лимфомы (НХЛ) всегда относятся к группе злокачественных, практически все они диффузного типа и генерализованы к моменту обнаружения. Три основных гистологических типа, по классификации REAL: 22—24 % — лимфобластная лимфома, 18—22 % —крупноклеточная лимфома (В-клеточный и Т-клеточный анапластические типы), 40— 50 % — лимфома Беркитта (ЛБ) (в основном в Африке) и беркиттоподобные лимфомы. Только 1 % лимфом детского возраста относятся к неагрессивным формам, более типичным для взрослых.
Лимфома Ходжкина в тех же гистологических вариантах, что и у взрослых, встречается у детей немоложе 5-лет. До 15 лет частота ее очень медленно нарастает, после чего наблюдается подъем, с которым связано начало первого максимума в возрасте 20—30 лет. В странах экваториальной Африки ЛХ по частоте занимает 2-е место после ЛБ.
До возраста 7—9 лет среди заболеваний гемобластозами в западных странах доминируют лейкозы, причем на первом году жизни ОМЛ. У детей старше 10 лет постепенно все чаще диагностируются лимфомы, а к возрасту 20 лет они составляют очевидное большинство.
Острые лейкозы представляют собой разнородную группу гемобластозов, которые характеризуются первичным нарушением функции костного мозга морфологически незрелыми бластными клетками с вытеснением ими нормальных элементов и инфильтрацией ими различных тканей и органов.
Все острые лейкозы (ОЛ) возникают из одной мутировавшей кроветворной клетки.
Принадлежность бластных клеток к линии кроветворения, степень их дифференцировки обусловливают особенности течения лейкозов, его терапию, эффективность лечения и прогноз [Воробьев А.И., 1985; Scheinberg D.A. et al, 1997].
ОЛ составляют около 3% всех злокачественных опухолей человека [Волкова М.А., 2001], а среди гемобластозов острых лейкозов занимают одно из первых мест по частоте встречаемости. В год заболеваемость ОЛ составляет в среднем 5 случаев на 100000 населения. 75% случаев заболевания выявляется у взрослых больных.
При этом соотношение острых миелоидных лейкозов (ОМЛ) к острым лимфоидным лейкозам составляет 6:1. После 40 лет жизни у 80% больных выявляется ОМЛ, поэтому острые миелоидные лейкозы называют болезнью пожилых людей. Чаще всего это заболевание выявляется в возрасте 60-65 лет [Ковалева Л.Г., 1990; Lukens J.N., 1993; Scheinberg D.A. et al, 1997].
Этиология
Острый плазмобластный лейкоз представляет собой редкое заболевание и чаще всего диагностируется в качестве последнего этапа опухолевой прогрессии у больных множественной миеломой. Тем не менее, он встречается в 1-4% случаев. Чаще всего болеют люди в возрасте 40-50 лет [Воробьев А.И., 2002].
Острые нелимфобластные лейкозы (ОНЛЛ) диагностируют в любом возрасте, однако частота их возникновения увеличивается в старших возрастных группах. Наиболее часто диагноз ОНЛЛ ставят больным в возрасте 60-65 лет. В среднем острые нелимфобластными лейкозами заболевают 2 человека на 100000 населения в год. Частота возникновения ОНЛЛ увеличивается при взаимодействии с такими веществами, как торатраст, этилена оксид, пестициды, красители, каучук и т.д. [Ковалева Л.Г., 1990; Воробьев А.И., 2002].
Среди острых нелимфобластных лейкозов взрослых миелобластная и миеломонобластная формы составляют 80-90%, а все ОНЛЛ у взрослых составляют около 85% всех ОЛ [Перилов А.А. с соавт., 1987; Воробьев А.И., 2002; Burnett A., 1998]. По данным Ellison (1983), средний возраст больных ОМЛ - 38 лет, а больных миеломонобластным лейкозом - 50 лет.
По данным Воробьева А.И. (2002), острый монобластный лейкоз наблюдается у 6,3% взрослых. Острый эритробластный лейкоз встречается менее 5% случаев ОНЛЛ взрослых [Воробьев А.И., 2002]. К очень редким формам относится острый мегакариобластный лейкоз, который составляет 1-3% случаев [Берман М.А с соавт., 1974; Стренева Т.Н. с соавт, 1977; Воробьев А.И., 2002; Chan et al, 1971].
К вторичным острым лейкозам относятся индуцированные цитостатиками, радиационными и химическими воздействиями лейкозы, возникшие у больных, леченных по поводу других заболеваний. Это всегда острый нелимфобластный лейкоз. Чаще диагностируются у лиц старше 50 лет, но могут возникать и у молодых людей. В среднем вторичный ОНЛЛ возникает через 2-3 года после химиотерапевтического воздействия [Воробьев А.И., 2002; Burnett A.K. et al, 1997].
В большинстве случаев конкретная причина возникновения ОЛ остается неизвестной. Однако существуют предрасполагающие факторы, которые значительно увеличивают риск развития этого заболевания. В первую очередь среди них можно выделить врожденные и приобретенные хромосомные аномалии.
В частности, изменения, связанные с 21-й парой хромосом, могут приводить к развитию лейкоза. На это указывает часто определяемая при острых миелоидных лейкозах транслокация хромосом (8; 21). У людей с синдромом Дауна вероятность возникновения ОЛ в 20 раз выше, чем в здоровой популяции.
Высока вероятность развития острых лейкозов при врожденном агранулоцитозе, синдромах Эллиса-ван-Кревелда, Блюма, целиакии, анемии Фанкони, синдромах Вискотта-Олдрича, Клайнфельтера, нейрофиброматозе Реклинг-хаузена и т.д. за счет повышенной хромосомной нестабильности [Волкова М.А., 2001; Lukens J.N., 1993; Scheinberg D.A., 1997].
Большинство авторов отмечают возникновение генетических и хромосомных нарушений при ОЛ. Так Yip S.F. et al. (2006) пишут о различном клиническом течении ОЛЛ при трисомии 4 пары хромосомы. Christiansen D.H. et al. (2005), Yanada M. еt al. (2005) и Nanri T. et al. (2005) описывают мутации генов в рецепторе тирозинкиназы при ОНЛЛ.
Alvarez Y. et al. (2005) отмечают генетические нарушения, связанные с (12; 21) хромосомами, и их влияние на выживаемость у пациентов с В-ОЛЛ. Chrzanowska K.H. et al. (2006) выявляли частую мутацию локуса 657 к 15 в NBS1 гене у польских детей, страдающих спорадическими лимфоидными озлокачествлениями. Козлов И. с соавт. (2005) утверждают, что в диагностике ОМЛ очень важна экспрессия CD79a t(8; 21).
Эпидемиология
Значение цитогенетических нарушений при ОМЛ отмечали Harani M.S. et al. (2006). Мутации гена нуклеофосмина (NPM1) при острых миелоидных лейкозах отмечали Verhaak R.G. et al. (2005) и Schnittger S. et al. (2005). Bowen D.T. et al. (2005) выявляли RAS - мутации при остром нелимфобластном лейкозе. Sutcliffe M.J. et al. (2005), по данным независимых исследований Детской раковой группы и Педиатрической онкологической группы, выявляли, что наилучший прогноз у детей ОЛЛ при комбинированной трисамии 4; 10 и 17 хромосом.
Роль вирусов в развитии лейкозов доказана в отношении коров, приматов и других видов животных. При этом наибольшее значение имеют РНК-ретровирусы, в лейкемических клетках обнаруживается обратная транскриптаза, которая и свидетельствует об инфицировании ретровирусами [Савченко В.Г., Паровичникова Е.Н., 2001]. У людей доказано, что вирус HTLV-1 вызывает Т-клеточный лейкоз/лимфому взрослых.
Данное заболевание встречается у жителей Карибского бассейна и Японии, при этом от момента инфицирования до проявления заболевания проходит несколько лет [Scheinberg D.A. et al, 1997]. Имеются данные, что из ДНК- вирусов только вирус Эпштейна-Бара участвует в онкогенезе лимфомы Беркитта, ряда В-клеточных ОЛЛ и лимфом, ассоциированных с вирусом приобретенного иммунодефицита [Волкова М.А., 2001].
Увеличивались количества случаев гематологических заболеваний у ликвидаторов Чернобыльской аварии [Перехрестенко Т.П. с соавт., 2002]. Вторичные лейкозы, как результат противоопухолевой терапии, описаны U. Duhrsen (2005). Увеличиваются количества ОЛ после воздействия радиации [Klymenko S. et al, 2005; Khuder S.A., Mutgi A.B., 2005].
Доказано, что между курением и риском развития ОЛ существует дозовая зависимость, которая особенно наблюдается у лиц старше 60 лет. Ряд исследователей считают, что в 20% случаев ОНЛЛ развивается вследствие курения [Greer J.P., Kinney M.C., 1993; Scheinberg D.A. et al, 1997].
Длительное воздействие бензола повышает риск возникновения острых лейкозов. При использовании облучения в сочетании с программами, включавшими применение мустаргена, риск заболеть ОЛ составляет 10%. Мутагенный эффект доказан у прокарбазина, хлорбутина, циклофосфана, ломустина, тенипозида, этопозида.
Так, при еженедельном использовании этопозида или тенипозида в программах поддерживающего лечения детских ОЛЛ риск развития вторичного ОНЛЛ возрастает до 13% [Pui C., 1989]. Риск развития вторичного острыго нелимфобластныго лейкоза наиболее высок в период от 2 до 9 лет после завершения предшествующей химиотерапии. 85% случаев вторичных лейкозов возникают в срок до 10 лет после окончания лечения [Scheinberg D.A. et al, 1997].
Для ОНЛЛ более четко, чем для ОЛЛ доказана связь с радиацией, химическими факторами (бензол), алкилирующими препаратами (мустар-ген), эпидофилотоксинами (этопозид) [Воробьев А.И., 2002].
Таким образом, до конца точно неизвестны этиологические факторы, вызывающие появление и развитие острых лейкозов. Хромосомные аномалии, вирусы, ионизирующая радиация, химио- и радиотерапии, курение, химические вещества и наследственный фактор могут способствовать появлению того или иного гемобластоза.
О.В. Смирнова, А.А. Савченко, В.Т. Манчук
В рамках франко-американско-британской морфологической классификации (ФАБ, FAB) выделяют 8 основных вариантов ОМЛ.
Некоторые очень редкие разновидности ОМЛ не включены в этот список. Варианты ОМЛ с М3 по М7, имеющие собственные названия и некоторые специфические особенности, более подробно рассмотрены в отдельных разделах нашего справочника.
ОМЛ составляет у детей около 15% всех случаев онкологических заболеваний кроветворной системы, то есть встречается у них заметно реже, чем острый лимфобластный лейкоз. Среди детей до 14 лет частота ОМЛ составляет приблизительно 0.6-0.8 случаев на 100 тысяч человек в год, однако в возрасте после 40-45 лет происходит резкий подъем заболеваемости. Большинство больных ОМЛ – пожилые люди. В отличие от острого лимфобластного лейкоза, наиболее характерного для детского возраста, при ОМЛ дети составляют всего 10% больных.
В большинстве случаев ОМЛ невозможно назвать непосредственную причину заболевания. Однако некоторые факторы повышают вероятность возникновения ОМЛ: воздействие ряда химических препаратов, ионизирующей радиации (в том числе в ходе предшествующего лечения других онкозаболеваний), иногда – случаи заболевания ОМЛ среди ближайших родственников, что говорит об определенной роли генетической предрасположенности.
Развитию ОМЛ могут предшествовать некоторые заболевания кроветворной системы, такие как миелодиспластический синдром. Наконец, риск ОМЛ повышен при определенных генетически обусловленных аномалиях, включая синдром Дауна, анемию Фанкони и некоторые другие состояния.
Так как большинство симптомов может быть связаны и с другими заболеваниями и не специфично для ОМЛ, перед началом лечения необходимо уточнение диагноза на основании лабораторных методов, которое в срочном порядке производится в больничных условиях.
При ОМЛ возникают изменения в обычном клиническом анализе крови: недостаток эритроцитов и тромбоцитов, чаще всего избыток лейкоцитов, причем многие из них представлены незрелыми формами. Но надежно поставить диагноз можно только при исследовании образца костного мозга. Согласно критериям Всемирной организации здравоохранения, диагноз ОМЛ ставится, если содержание миелобластов в костном мозге не менее 20% (согласно франко-американо-британской классифиции FAB, пороговым значением является 30%).
Точная диагностика ОМЛ и его вариантов иногда представляет собой сложную задачу, требующую участия высококвалифицированных гематологов и гемопатологов в диагностическом процессе.
Как и при остром лимфобластном лейкозе, результаты диагностических исследований при ОМЛ используются для отнесения пациента к той или иной группе риска. Это необходимо для того, чтобы определить тактику лечения, оценить как вероятность ответа на химиотерапию, так и риск последующего рецидива. У пациентов, принадлежащим к группе низкого риска, больше шансов достичь долговременной ремиссии при стандартном химиотерапевтическом лечении, а при высоком риске для успеха терапии может понадобиться трансплантация костного мозга.
Группу риска определяют многие факторы. Перечислим некоторые из них:
- Возраст: у больных среднего и пожилого возраста прогноз в среднем хуже, чем у детей и молодых людей.
- Хромосомные изменения в лейкемических клетках. Так, транслокации t(15;17) или t(8;21) определяют у больных более низкий риск. В то же время, например, определенные изменения хромосом 5 и 7 связаны с ухудшением прогноза.
- Вариант лейкоза. Некоторые варианты ОМЛ (такие как М0, М6, М7) связаны с высоким риском, а некоторые, напротив, сравнительно хорошо поддаются современной терапии (ОМЛ М3).
- С более высоким риском связан вторичный лейкоз, возникший на фоне другого гематологического заболевания – такого как миелодиспластический синдром или анемия Фанкони, – или после прохождения лечения (химиотерапия, облучение) по поводу какой-либо злокачественной опухоли. Риск также резко повышается при рецидиве лейкоза.
Главным методом лечения ОМЛ является химиотерапия. Как в случае острого лимфобластного лейкоза, лечение включает фазы индукции ремиссии и консолидации; иногда применяется также поддерживающая терапия.
Специфической особенностью терапии при остром промиелоцитарном лейкозе (ОМЛ М3) является использование лекарства ATRA (полностью транс-ретиноевая кислота, третиноин).
Если в результате терапии индукции оказывается, что в костном мозге стало менее 5% бластных клеток и у пациента нет других проявлений болезни (в том числе признаков нейролейкемии), то констатируется достижение ремиссии.
В результате курсов индукции удается достичь ремиссии у подавляющего большинства пациентов. Однако достигнутая ремиссия не может быть стойкой без терапии консолидации, то есть закрепления ремиссии. В фазе консолидации уничтожаются остаточные количества аномальных бластных клеток во избежание рецидива заболевания. Важнейшим препаратом в фазе консолидации при лечении ОМЛ является цитарабин, часто в высоких дозах; в разных сочетаниях используются также даунорубицин, 6-меркаптопурин, ифосфамид, митоксантрон, этопозид и др.
На этапах индукции и консолидации внутривенное введение химиотерапевтических препаратов производится в условиях больничного стационара.
Поддерживающая терапия используется далеко не во всех случаях (в отличие от острого лимфобластного лейкоза), однако при варианте ОМЛ М3 она важна. Эта терапия менее интенсивна, чем терапия индукции и консолидации, и не требует пребывания в больнице.
Нейролейкемия менее характерна для ОМЛ, чем для острого лимфобластного лейкоза. Чаще всего она встречается при вариантах ОМЛ М3, М4 и М5. Для ее лечения и профилактики могут использоваться цитарабин, метотрексат и глюкокортикостероиды, вводимые интратекально, посредством люмбальной пункции спинномозгового канала. Изредка может использоваться также облучение головы (краниальное облучение). У детей риск распространения лейкоза в центральную нервную систему выше, чем у взрослых, поэтому профилактическая химиотерапия для его предотвращения используется чаще.
Для снижения вероятности рецидива пациентам из группы высокого риска может быть показана трансплантация костного мозга. Показаниями к трансплантации могут служить, например,
- транслокации и другие цитогенетические изменения в лейкемических клетках, связанные с высоким риском,
- рецидив лейкоза,
- развитие ОМЛ на фоне миелодиспластического синдрома или другой болезни крови, а также после предшествующего лечения злокачественных опухолей.
Вероятность успеха трансплантации максимальна, если проводить ее после достижения первой ремиссии. У детей трансплантации производятся чаще, чем у взрослых, и в среднем более успешны.
В ходе интенсивной химиотерапии ОМЛ практически всегда в той или иной мере подавляется нормальное кроветворение. Поэтому многим больным ОМЛ необходимы переливания компонентов крови: тромбоцитов во избежание кровотечений и эритроцитов для лечения анемии. Переливания донорских лейкоцитов (гранулоцитов) нужны только в случаях тяжелых инфекционных осложнений.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения часто необходимы эффективные антибактериальные, противогрибковые и противовирусные лекарства для профилактики и терапии инфекционных осложнений. Опасность представляют как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Лечение ОМЛ накладывает ограничения на образ жизни больного. В ходе интенсивной химиотерапии необходимо соблюдать диету и строгие правила гигиены, а также минимизировать контакты с внешним миром во избежание инфекций. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Общая продолжительность лечения при различных формах ОМЛ составляет от нескольких месяцев до 2-3 лет.
Без лечения ОМЛ, как правило, приводит к гибели больного в течение нескольких месяцев, иногда даже нескольких недель. Однако при современном лечении многих можно спасти. Прогноз зависит от конкретной разновидности миелолейкоза, цитогенетических особенностей (т.е. хромосомной структуры лейкемических клеток), возраста, общего состояния больного и других факторов.
В настоящее время порядка 50-60% детей, заболевших ОМЛ, выздоравливают. В среднем и пожилом возрасте, к сожалению, результаты хуже.
Следует отметить, что большинство пациентов с ОМЛ – это именно пожилые больные. По сравнению с молодыми они тяжелее переносят лечение и хуже на него отвечают. Всего у 5-15% пациентов старше 60 лет удается достичь длительной ремиссии. Для остальных зачастую основным становится поддерживающее лечение (борьба с инфекциями, переливания компонентов крови, обезболивание) для некоторого продления жизни и улучшения ее качества.
Виды лейкозов
Все лейкозы (лейкемии) подразделяются на два вида — острые и хронические. Такое деление обуславливается различной способностью лейкозов к росту и развитию разрастающихся клеток.
При остром лейкозе развитие клеток практически отсутствует, в крови накапливается большое количество незрелых клеток на ранней стадии развития. Это приводит к угнетению нормального кроветворения всех ростков. Такие признаки выявляются в крови более чем в 80% случаев.
Хронический лейкоз дает популяцию равившихся гранулоцитарных клеток, которые постепенно замещают нормальные клетки периферической крови.
Следует отметить, что острый лейкоз никогда не перейдет в хронический и наоборот.
Все лейкоциты в организме человека делятся на 2 типа — гранулоцитарные и агранулоцитарные (зернистые и незернистые), эти две группы, в свою очередь, подразделяются на эозинофилы, базофилы, нейтрофилы (гранулоцитарные), и лимфоциты (В- и Т-типа) и моноциты (агранулоцитарные). В процессе созревания и развития (дифференцировки) все клетки проходят несколько этапов, первым из которых является бластный этап (лимфобласты). Из-за поражения костного мозга опухолью, лимфоциты не успевают достаточно развиться для того, чтобы полноценно исполнять свои защитные функции. По большей части, при остром лимфобластном лейкозе поражаются В-лимфоциты (примерно в 85% случаев), отвечающие за образование антител в организме. Различают два типа течения острого лимфобластного лейкоза ( ОЛЛ ): В-линейный и Т-линейный, в зависимости от типа клеток — лимфоидных предшественников.
Клинические симптомы острого лимфобластного лейкоза
Синдром интоксикации — слабость, лихорадка, недомогание, потеря веса. Лихорадка может быть связана и с наличием бактериальной, вирусной, грибковой или протозойной (реже) инфекцией, особенно у детей с нейтропенией (менее 1500 нейтрофилов в 1 мкл).
Гиперпластический синдром — увеличение всех групп периферических лимфоузлов. Инфильтрация печени и селезенки приводит к их увеличению, что может проявляться болями в животе. Могут появиться боль и ломота в костях из-за лейкемической инфильтрации надкостницы и суставной капсулы и опухолевого увеличения объема костного мозга. При этом на рентгенограммах можно обнаружить характерные для лейкемической инфильтрации изменения, особенно в трубчатых костях, возле крупных суставов.
Анемический синдром — бледность, слабость, тахикардия, кровоточивость слизистых полости рта, геморрагический синдром на коже, бледность. Слабость возникает в результате анемии и интоксикации.
Геморрагический синдром связан как с тромбоцитопенией, так и с внутрисосудистым тромбозом (особенно при гиперлейкоцитозе) и приводит к появлению петехий, экхимозов на коже и слизистых, кровоизлияниям, мелене, рвоте с кровью.
У мальчиков может обнаруживаться инициальное увеличение яичек ( 5-30% случаев первичного ОЛЛ). Это безболезненные, плотные, одно- или двусторонние инфильтраты. Особенно часто это бывает при гиперлейкоцитозе и Т-клеточном варианте ОЛЛ.
Дыхательные нарушения, связанные с увеличение лимфоузлов средостения, которые могут привести к дыхательной недостаточности. Этот признак характерен для Т-линейного ОЛЛ.
Могут появиться кровоизлияния в сетчатку глаза, отек зрительного нерва. При офтальмоскопии могут обнаруживаться лейкемические бляшки на глазном дне.
Из-за сильно сниженного иммунитета любое повреждение кожи является очагом инфекции, могут появиться паронихии, панариции, инфицированные укусы насекомых и следы инъекций.
Достаточно редкими осложнениями могут являться поражения почек в результате инфильтрации (клинические проявления могут и отсутствовать) и выпотной перикардит из-за нарушения лимфооттока между эндокардом и эпикардом.
Какие проявляются признаки при лейкемии по ссылке.
Острый лейкоз – это форма рака, которая очень быстро развивается и во время которой в крови и в костном мозге накапливаются измененные лейкоциты. Острый лейкоз бывает нескольких видов: лимфобластный лейкоз, возникающий чаще всего у детей, и гранулоцитарный лейкоз, который можно встретить чаще всего у взрослых.
В первом случае лейкоза измененные лейкоциты собираются в костном мозге или лимфоузлах, а в случае с гранулоцитарным лейкозом лейкоциты накапливаются в костном мозге.
Причины образования лейкоза
Причины лейкоза до сих пор остаются неизвестными. Существует мнение, согласно которого есть некоторые факторы, которые делают риск возникновения лейкемии более высоким. Таковыми являются генетические нарушения, проблемы с иммунной системой, воздействие радиации и некоторых химических веществ, которые подавляют кроветворение.
Симптоматика острого лейкоза
При возникновении острого лейкоза у человека наблюдается высокая температура, слабость в теле и другие симптомы, которые похожи на симптомы гриппа. Лимфатические узлы, а также печень и селезенка, увеличиваются. Чувствуется боль в костях. Плохо сворачивается кровь, от слабого прикосновения появляются синяки. Кровотечение провоцирует возникновение красных или пурпурных пятен на коже. Возникают частые инфекции, прогрессирует слабость.
Хронический лимфолейкоз — это онкологическое заболевание лимфатической ткани, при котором опухолевые лимфоциты накапливаются в периферической крови, костном мозге и лимфатических узлах. В отличие от острых лейкозов, опухоль растет достаточно медленно, вследствие чего нарушения кроветворения развиваются лишь в поздних стадиях развития заболевания.
Симптомы хронического лимфолейкоза
Слабость
Увеличение лимфатических узлов
Тяжесть в животе (в левом подреберье)
Склонность к инфекциям
Потливость
Снижение массы тела
Чаще всего первым симптомом хронического лимфолейкоза является увеличение размеров лимфатических узлов. Вследствие увеличения селезенки, возможно возникновение ощущения тяжести в животе. Нередко больные испытывают значительную общую слабость, теряют вес, у них повышена частота развития инфекционных заболеваний. Симптомы развиваются постепенно, в течение длительного времени. Примерно в 25% случаев заболевание обнаруживают случайно при анализе крови, назначенном по другому поводу (диспансеризация, обследование по поводу негематологического заболевания ).
Для того чтобы поставить диагноз хронического лимфолейкоза, необходимо осуществить следующие исследования:
Клинический анализ крови с подсчетом лейкоцитарной формулы
Исследование костного мозга позволяет выявить характерную для этого заболевания картину поражения.
Иммунофенотипирование клеток костного мозга и периферической крови выявляет специфические иммунологические маркеры, характерные для опухолевых клеток при хроническом лимфолейкозе.
Биопсия пораженного лимфатического узла с его морфологическим и иммунологическим исследованием.
Определение уровня β 2-микроглобулина помогает прогнозировать течение заболевания.
Цитогенетический анализ позволяет получить данные о характеристике опухолевых клеток, которые в ряде случаев имеют прогностическое значение.
Определение уровня иммуноглобулинов позволяет определить, насколько велик риск развития инфекционных осложнений у данного пациента.
Существует несколько подходов к определению стадий хронического лимфолейкоза — системы Rai, Binet и Международной рабочей группы по хроническому лимфолейкозу. Все они учитывают то факт, что продолжительность жизни больных хроническим лимфолейкозом зависит от степени распространенности опухоли (числа пораженных групп лимфатических узлов) и степени нарушения кроветворения в костном мозге. Нарушение костномозгового кроветворения, вызванное опухолевым ростом в костном мозге, ведет к развитию анемии (снижению числа эритроцитов в крови) и тромбоцитопении (снижению числа тромбоцитов). Определение стадии хронического лимфолейкоза позволяет принять решение о необходимости начать лечение и выбрать наиболее приемлемый для данного больного режим терапии.
Острый миелобластный лейкоз (острая гранулоцитарная лейкемия, острая миелоцитарная лейкемия) чаще возникают у взрослых, подтип зависит от уровня дифференцировки клеток. В большинстве случаев миелобластный клон клеток происходит из стволовых кроветворных клеток, способных к множественной дифференцировке в колониеобразующие единицы гранулоцитов, эритроцитов, макрофагов или мегакариоцитов, поэтому у большинства больных злокачественные клоны не имеют признаков лимфоидных или эритроидных ростков ОМЛ наблюдают наиболее часто; имеет четыре варианта (М0 — М3) mo и М1 — острый без дифференцировки клеток
М2 — острый с дифференцировкой клеток М3 — промиелобласт-ный лейкоз, характеризуется наличием аномальных промиелоцитов с гигантскими гранулами; часто сочетается с ДВС, обусловленным тромбопластическим эффектом гранул, что подвергает сомнению целесообразность применения гепарина при терапии. Прогноз при М:, более благоприятен, чем при М0-М, Миеломонобластный и монобластный лейкозы (соответственно М4 и М5) характеризуются преобладанием неэритроидных клеток типа монобластов. М
Читайте также:


