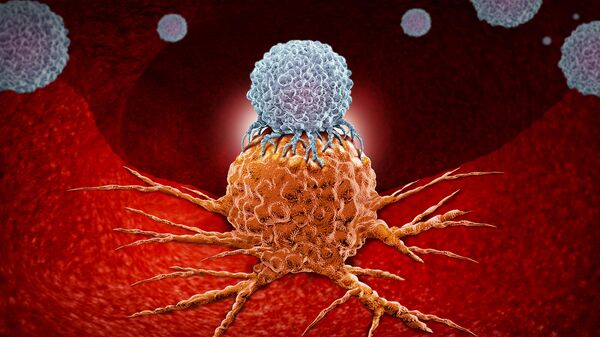
Борьба с раком антитела

Антитела в иммунной системе
Как антитела лечат рак?
Иммунная система использует как клетки, так и клеточные продукты для атаки на чужеродные вещества в организме. Антитела, один из самых известных продуктов иммунной системы, представляют собой огромные белки, которые прилипают к микроскопической области мишени, называемой антигеном. Антитела продуцируются В-лимфоцитами, также называемыми плазматическими клетками. Антитела дрейфуют и циркулируют в организме. Когда антитело входит в тесный контакт с антигеном, который он распознает, он связывает его или присоединяется к антигену.
Антитела, которые прикреплены к антигенам, служат, как красные флаги, другим частям иммунной системы.
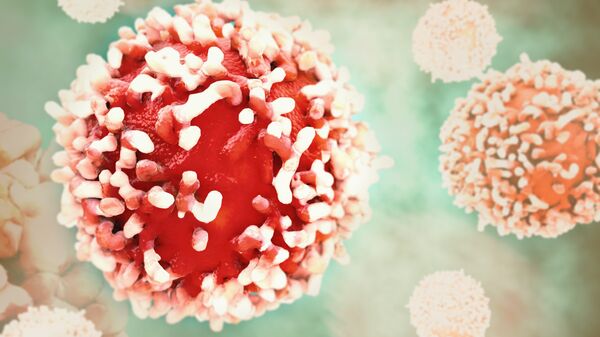
Моноклональные антитела
Антитела иммунной системы
Обычно иммунная система генерирует огромное количество антител, которые распознают целый ряд различных антигенов - и даже различные уголки и трещины одного и того же антигена.
В лаборатории ученые научились принимать одно специфическое антитело и делать много его копий. Термин моноклональный относится к процессу изготовления копий одного антитела из одного клона клеток, то есть одной уникальной родительской клетки и ее потомства из клеточного деления. Некоторые моноклональные антитела используют генную инженерию для объединения частей из разных источников в одно новое синтезированное антитело, имеющее характеристики, которые желательны для лечения.
Моноклональные антитела, которые работают самостоятельно
Моноклональные антитела используются вместе с другими противоопухолевыми препаратами, включая химиотерапию, облучение и хирургию.
Моноклональные антитела, которые отравляют раковые клетки
Поскольку химическое или токсическое вещество находится на антителе, оно концентрируется на раковые клетки, и идея состоит в том, что это уменьшит повреждение нормальных клеток по всему телу.
В поисках нового подхода к лечению злокачественных опухолей В-клеток, которые не поддаются лечению, группа исследователей, возглавляемая доктором Даниэлем Валлера, разрабатывает целенаправленный подход, который использует фрагменты антител. Используя генную инженерию, они делали антитела, которые связываются с CD19 и CD22 на клетках рака В-клетки, которые также имеют бактериальный дифтерийный токсин, присоединенный к антителу. В результате получился так называемый иммунотоксин, который называется DT2219.
Иммунотоксины не являются абсолютно новыми, однако их все еще активно исследуют и разрабатывают. На сегодняшний день большинство успехов достигнуто в лечении рака крови. Препятствия для успешного использования иммунотоксинов в солидных опухолях включают плохое проникновение в опухоль и иммунный ответ на токсиновый компонент терапии. Как только пациент устанавливает иммунный ответ на токсин, это ограничивает количество циклов терапии, которые могут быть получены.
8 февраля 2019 11:11
Человеку, оказавшемуся беспомощным в сложной жизненной ситуации, свойственно цепляться за самые эфемерные надежды. Время от времени распространялись слухи о необъяснимых исцелениях — вопреки прогнозам врачей, почти чудесным образом опухоль исчезала. Эти редчайшие случаи как бы намекали, что человек все же не полностью беззащитен перед болезнью. Есть в его распоряжении какая-то сила, неизвестная и неподконтрольная медицине.
Ключевой игрок — лимфоциты. В этих кровяных клетках происходят случайные перестройки особых генов, в результате чего в каждом лимфоците вырабатывается белок-иммуноглобулин, способный узнавать какую-то специфическую загогулину на других белковых молекулах. Когда такая загогулина — например, в составе оболочки зловредного вируса — появляется в поле зрения лимфоцита, он получает сигнал на размножение, производя множество потомков, готовых атаковать этот белок.
Тем не менее иммунной системе можно помочь — подтолкнуть ее к правильному выбору, слегка подрегулировать контрольные механизмы в сторону чуть меньшей толерантности, чуть большей ксенофобии. На этой идее и основаны методы иммунотерапии рака, которые начали развиваться в начале этого столетия.
Несмотря на исключительную важность проблемы рака для человечества и потраченные на эту проблему миллиарды, за победы в этой борьбе присуждено не так уж много Нобелевских премий. За вычетом тех, которыми были отмечены открытия по вирусной природе некоторых онкозаболеваний, их было всего три. Две из них присуждены за последнее десятилетие, и обе — за разные варианты иммунотерапии.
В 2011 году премию решили присудить Ральфу Штайнману, который разработал одну из самых сложных и дорогих методик иммунотерапии — дендритные вакцины. По воле судьбы именно эта терапия продлила его собственную жизнь на пару лет, которых едва хватило на то, чтобы номинироваться на премию (хотя присуждена она была через два дня после его смерти).
Тасуку Хондзё прославился исследованиями белка PD-1. Аббревиатура PD зловеща, и означает она Programmed Death — программируемую смерть. При хорошем варианте развития событий это вовсе не смерть пациента, а напротив, его благополучие. В конце 1990-х Хондзё и его коллеги из Токийского университета получили линию мышей, у которых белка PD-1 не было. Мышки эти были довольно несчастными: ужасно страдали от целого букета аутоиммунных расстройств. Стало быть, смекнули японцы, их белок как-то участвует в системе контроля иммунитета — тормозит иммунный ответ в тех ситуациях, когда он только все портит.
Сперва казалось, что PD-1 — ключ к аутоиммунным заболеваниям, но он оказался фрагментом еще одного пазла. Белок этот делает вот что: передает лимфоциту сигнал о том, что антитела, которые тот производит, никому не нужны, поскольку направлены на собственные клетки тела. А стало быть, такому лимфоциту следует немедленно совершить сеппуку, что он послушно делает.
Раковые клетки умеют казаться своими: они показывают на своих мембранах белковые сигналы, которые побуждают белок PD-1 считать их друзьями. Но если этот белок удастся блокировать, их старания будут тщетны: T-лимфоциты разыщут их и убьют.

Онколог Евгений Витальевич Ледин, к. м. н., руководитель Центра химиотерапии Клинической больницы МЕДСИ в Боткинском проезде, начал работать с чекпойнт-ингибиторами, а именно с пембролизумабом, еще на стадии клинических испытаний препарата. К нему мы и обратились за комментарием, чтобы он исправил наши ошибки и скорректировал (только, пожалуйста, не слишком!) наш чрезмерный оптимизм.
Я не могу отнести иммунотерапию к области чудес: это не более чем очередной шаг. Это появление дополнительных возможностей, которые никакого отношения к чудесам не имеют, лишь одна из опций, занимающая строго определенное место в общей системе лечения онкологических заболеваний.
Ɔ. А вообще бывают чудесные исцеления, когда вопреки прогнозам опухоль вдруг начинает сама собой исчезать?
Ɔ. Как на практике происходит терапия? Есть ли побочные действия?
Сама процедура — это просто получасовая капельница, которая, как правило, хорошо переносится. Сутки пациент может находиться в стационаре. Что касается побочных эффектов, они бывают у любого препарата. Я в своей практике видел такие побочные эффекты при приеме анальгина, что это было пострашнее любой иммунотерапии. Но иммунотерапия хороша еще и тем, что побочные эффекты в ней по сути разделены на черное и белое: либо все хорошо, либо плохо. В химиотерапии много промежуточных серых тонов: кто-то полностью теряет дееспособность, а большая часть пациентов находится в среднем состоянии. В иммунотерапии очень большая доля пациентов вообще никак не ощущает лечение. А у тех, кто переносит терапию плохо, онкологи научились отслеживать эти побочные эффекты и вовремя их останавливать. В целом иммунотерапия значительно комфортнее, чем другие виды противоопухолевой терапии.
То же самое с иммунотерапией: есть подтип опухолей, где работает данный механизм ускользания от иммунного ответа, и там чекпойнт-ингибиторы оказываются эффективны. Чаще это происходит при меланоме или, к примеру, при раке почки. На фоне прочих достижений это кажется чудесным: люди, которые раньше умирали в течение 6–8 месяцев, теперь стали долго жить: четверть пациентов переживают пятилетний рубеж, что в онкологии приравнивается к излечению. Но это не чудо: просто у этой четверти найденный ключик подходит к тому механизму, который лежит в основе их заболевания.
Но, конечно, такое открытие дает новую надежду пациентам и новую мотивацию онкологам. Когда я начинал работать, онкология была другой. Если сравнить ситуацию сейчас и 20 лет назад, то сейчас пациент в значительно более выгодном положении. Новых возможностей колоссальное количество.
Ɔ.

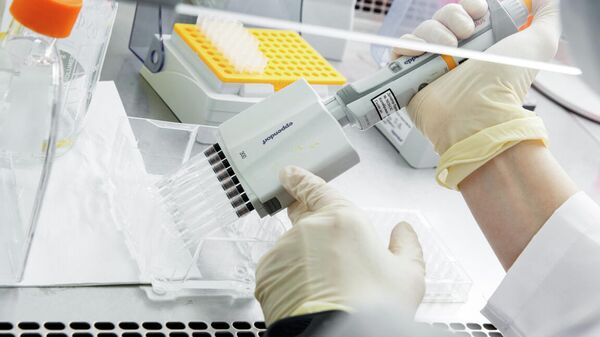
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
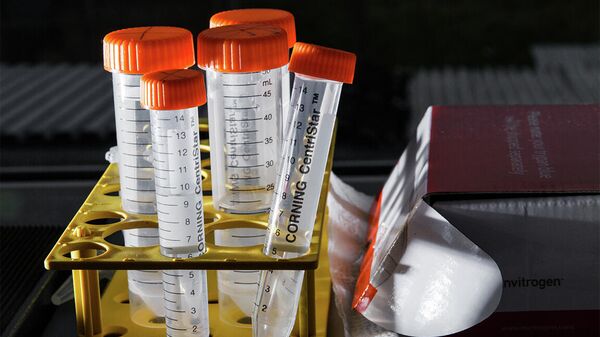
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела

С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Недавно в Москве разразился скандал: жители одного из домов требовали выселить онкобольных детей из подъезда, думая, что рак заразен. К счастью, для людей это не так. Однако есть существа, которых трансмиссивные (заразные) формы рака поставили на грань вымирания, — тасманские дьяволы. Их поражает особый вид лицевой опухоли, которая передается при контакте.
Впервые случаи рака описали еще древнеегипетские врачи, но неизвестно, какой процент людей за всю историю существования человека как вида умер от онкологических заболеваний. Примечателен случай Наполеона Бонапарта. Долгое время считалось, что он был отравлен: либо намеренно — англичанами, охранявшими его на острове Святой Елены, либо случайно — вдыхая летучие метаболиты плесневых грибков, в которые входил мышьяк, содержавшийся в красках для обоев. Однако настоящую причину смерти Наполеона выяснили лишь во второй половине ХХ века: оказалось, что император Франции умер от рака желудка. Этот пример иллюстрирует, насколько низким был уровень диагностики, доступный до ХХ века, даже у относительно обеспеченных людей.
Долгое время были известны лишь хирургические методы лечения онкозаболеваний. Другой вариант, уже на поздних стадиях, — паллиативная терапия для уменьшения страданий безнадежно больных пациентов.
Во время Первой мировой войны врачи обнаружили у солдат, отравленных ипритом, аномально низкий уровень лейкоцитов.
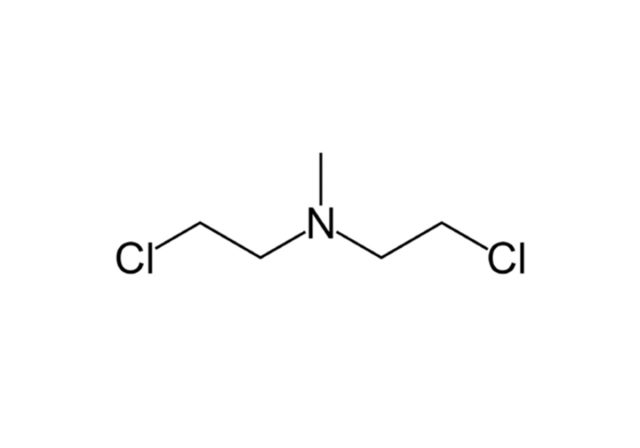
HN2. Источник 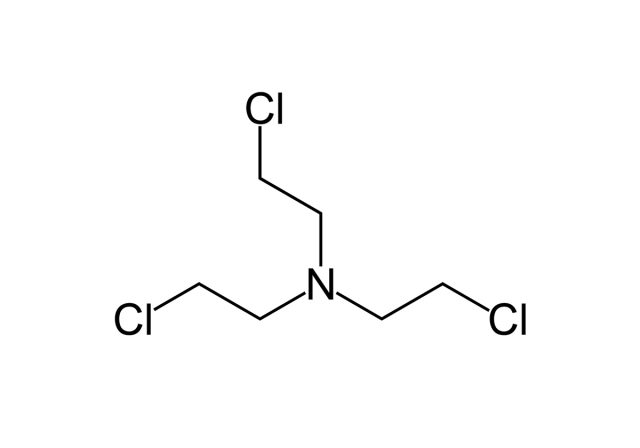
HN3. Источник
Пациенту лечение помогло, но ненадолго: в итоге он все-таки умер от лимфомы, так как изначально выбирали безнадежно больного добровольца. В те времена знали только о способности ипритов убивать лимфоциты. Однако было мало известно об их более глубоком молекулярном действии: если клетка выживала после такого удара и системы восстановления могли исправить поврежденную ДНК, возникал риск, что выздоровевшая клетка сама по себе станет раковой!
Ученые добивались, чтобы риск возникновения вторичного рака из-за повреждений ДНК здоровых клеток был минимальным.
Антитела — это молекулы, способные с высокой специфичностью связываться с одним определенным белком-мишенью (антигеном). На явлении высокоспецифичного связывания антитела с антигеном основано множество молекулярно-биологических методик, диагностических тестов, лекарственных терапий.
Но дело в том, что нельзя просто показать клетке белок, чтобы она начала производить к нему антитела, — для этого в клетке должна произойти генетическая VDJ-рекомбинация. По сути, это биологический аналог перебора паролей путем подстановки случайных символов. Здесь тоже перебираются возможные последовательности фрагментов антител, пока не найдется конструкция, которая наиболее эффективно и селективно свяжется с антигеном.
Когда мы встречаемся с каким-то антигеном (например, белком оболочки вируса гриппа), в нашем организме, конечно, присутствуют антитела. Но проблема в том, что они вырабатываются множеством разных В-клеток и потому различаются по своей аминокислотной последовательности. Открытие же Кёлера и Мильштейна позволило получать множество антител с одинаковой специфичностью и, самое главное, одинаковой последовательностью аминокислот.
Долгое время гибридомный метод использовали лишь как очередной удобный способ получения антител для различных нужд. Но всё изменилось в 1980-е, когда ученые уточнили антигенный состав мембраны Т-клеток. Оказалось, что, если заблокировать белок CD3 специфичным антителом, Т-клетка может погибнуть. Еще больше радости это открытие доставило онкологам, которые как раз искали средство для эффективного лечения Т-клеточных лейкозов. Таким средством стал муромонаб — моноклональное антитело, которое стали использовать еще и для профилактики отторжения донорских органов при пересадке.
Кроме того, антитела не оказывают прямого цитотоксического действия, то есть не вызывают некроз внутри злокачественной клетки. Для решения этой проблемы пришлось изобрести новый класс препаратов — конъюгаты лекарство-антитело (antibody-drug conjugate, или ADC).
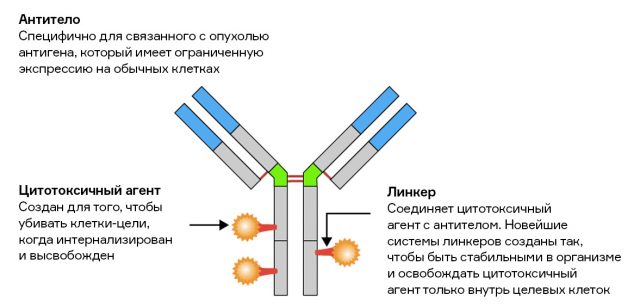
Источник
Радоваться стоит, но не сильно. Такой подход к лечению рака довольно эффективен и перспективен. Но нужно помнить, что любая таргетная (прицельная) терапия работает, только если выявлены четкие различия между антигенным составом или метаболизмом в клетках конкретного типа рака и здоровыми клетками.
Американские ученые случайно открыли необычное антитело, которое присоединяется к иммунным клеткам и заставляет их атаковать раковую опухоль, говорится в статье, сообщает РИА Новости со ссылкой на статью в журнале Science Immunology.
"Как нейробиолог я никогда не думал, что я опубликую статью, связанную с иммунотерапией рака.
Когда мы изучали особую группу Т-клеток, предположительно предотвращающих развитие аутоиммунных заболеваний, у нас появилась идея – если рак является своеобразным антиподом этих расстройств, то тогда мы можем использовать наши наработки для того, чтобы "включить" иммунную систему, а не "выключить" ее", — заявил Говард Уайнер (Howard Weiner) из Гарвардского университета (США).
Как сегодня считают ученые, иммунная система обычно неплохо справляется со сдерживанием первичных опухолей, клетки которых все время находятся внутри них. Когда клетки приобретают способность двигаться самостоятельно, возникают метастазы, которые иммунная система по каким-то причинам просто не видит и не пытается подавить раковые клетки.
С другой стороны, иммунные клетки крайне редко пытаются проникнуть внутрь опухоли и начать уничтожать ее изнутри, причины чего пока остаются предметом дискуссий среди врачей и биологов.
Многие ученые считают, что это происходит по той причине, что раковые клетки умеют вырабатывать особые "сигналы паники", которые заставляют так называемые "регулирующие Т-клетки", главные дирижеры иммунитета, не давать другим иммунным клеткам атаковать рак.
Как рассказывает Уайнер, его команда уже несколько лет работает над лечением рассеянного склероза – аутоиммунной болезни, при развитии которой иммунные клетки начинают атаковать нейроны мозга.
Ученые надеялись создать антитело, которое бы "научило" эти клетки не нападать на нервную ткань и переключило бы их на реальные угрозы здоровью человека.
Экспериментируя с мышами, биологи заметили, что в мозге у здоровых грызунов было необычно много особых Т-клеток, которые отсутствовали в нервной ткани у мышей с рассеянным склерозом и при этом присутствовали в большом числе в раковых опухолях.
Это открытие натолкнуло Уайнера и его коллег на мысль, что эти клетки, защищающие мозг от атак иммунитета, могут мешать другим клеткам иммунной системы проникать в раковые опухоли.
Они проверили эту идею при помощи антител, которые они создали для подавления подобных Т-клеток во время экспериментов на мозге мышей.
Добавив эти антитела в культуры иммунных клеток, ученые обнаружили, что их противораковая активность заметно повысилась за счет блокировки способности Т-клеток вырабатывать те "сигналы паники", молекулы бета-TGF, которые отпугивают лимфоциты, уничтожающие одиночные раковые клетки вне пределов опухоли.
Затем ученые проверили, смогут ли эти антитела способствовать уничтожению опухоли в теле мышей. Имплантировав несколько культур рака в организм грызунов, ученые ввели в их кровь антитела и проследили за тем, повлияет ли это на рост раковых клеток.
Как показал этот эксперимент, антитела действительно заставляли иммунные клетки проникать внутрь опухолей и, благодаря этому, их рост или замедлился, или полностью остановился.
Подобная реакция наблюдалась сразу для нескольких типов рака – меланомы, рака прямой кишки и рака мозга.
Более того, повторная имплантация опухоли через несколько месяцев после подобного лечения заканчивалась неудачей – организм мышей выработал своеобразный "иммунитет" к раку и активно защищался от него.
Как отмечает Уинер, этим открытием уже заинтересовалась компания Tilos Therapeutics, которая поможет ученым приспособить эти антитела для работы в организме человека и поможет им провести клинические испытания.
Этот процесс, по самым скромным оценкам биологов, займет несколько лет, поэтому не стоит ждать, что лекарства от рака на базе таких антител появятся в больницах уже завтра.
Поделитесь этой новостью в Whatsapp или в соцсетях
За последние десятилетия наука заметно продвинулась вперед в лечении рака, и хотя мы все еще довольно далеки от полной победы над этим страшным заболеванием – у врачей становится все больше инструментов, чтобы разрушать опухоли или ограничивать их рост. Главное – они дают онкологическим пациентам возможность жить все дольше.
В этой публикации мы постараемся прояснить вопросы: что такое иммунотерапия, как она работает и кому может помочь.

Джуди Перкинс. У неё был рак молочной железы в терминальной стадии, который полностью вылечили с помощью новейшего метода иммунотерапии
Скрытая угроза. Как возникает рак
Раковые клетки – это повстанцы-мутанты, сумевшие перехитрить систему.
В процессе жизни все клетки организма проходят строго определенные стадии развития, выполняют заданные функции, размножаются по строгим правилам, а со временем – стареют и умирают. Это естественный процесс. Запрограммированная смерть старых клеток, в которых накопилось много поломок, называется апоптоз.
Одну из основных ролей в этом процессе играют Т-лимфоциты, или, проще, Т-клетки. Они реагируют на антиген (чужеродное организму вещество), распознают и уничтожают потенциальных врагов: например, микробы или неподходящий донорский материал. В норме Т-лимфоциты убивают и клетки организма, начавшие мутировать и вести себя не по правилам. Поэтому рак возникает не у всех – у большинства иммунитет справляется с беспорядками до того, как они распространятся.
Особых успехов раковые клетки достигают в маскировке: некоторые из них убирают со своей поверхности особые белки-антигены, по которым их могут распознать Т-клетки. Другие выделяют особые молекулы, подавляющие иммунитет, а некоторые даже образуют гибриды с макрофагами (один из видов иммунных клеток) – и приобретают буквально суперспособности!
В этом им помогает, с одной стороны, родство с нормальными клетками организма – некая врожденная маскировка. С другой стороны, генетическая изменчивость раковых клеток дает им повышенную приспособляемость. Чем больше мутаций накопилось в ДНК клетки к моменту ее малигнизации (превращения в злокачественную), тем больше у нее шансов пережить иммунный ответ и выработать успешный план захвата.
Пробуждение силы. История Нобелевских открытий
Нобелевская премия по физиологии и медицине в 2018 году была присуждена американцу Джеймсу Эллисону и японцу Тасуку Хондзё за их независимые открытия в одной и той же области: как именно происходит это переключение из агрессивного в спокойный режим.
В 1987 году Эллисон обнаружил цитотоксический T-лимфоцитарный антиген-4 CTLA-4 (cytotoxic T-lymphocyte-associated antigen-4) – и выяснил, что по структуре этот белок похож на давно известный CD28, и тоже способен связываться с B7 – однако при этом действует совершенно обратным образом: останавливает иммунную реакцию.
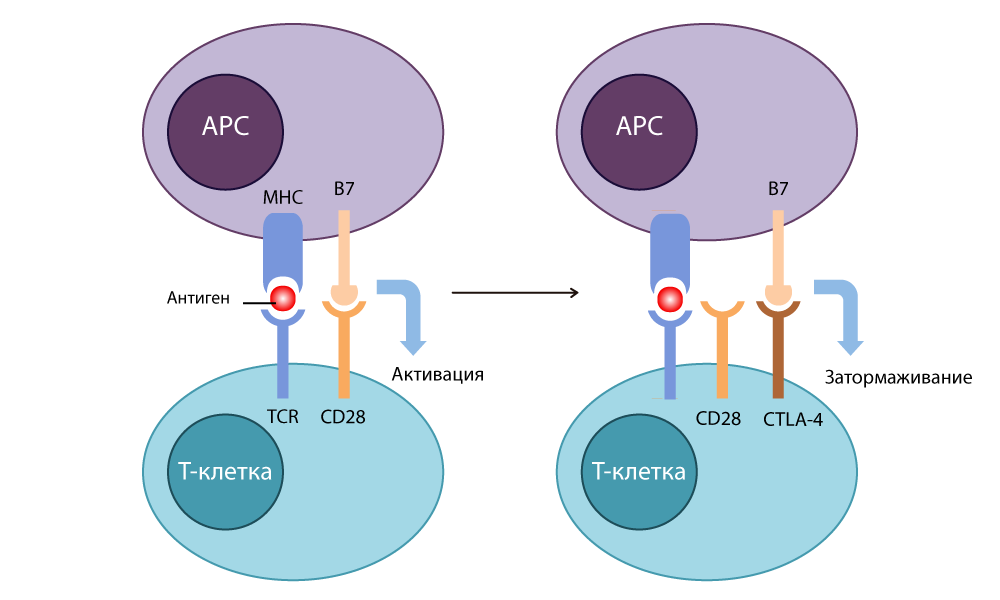
Действие CTLA-4
Он разработал антитело-ингибитор (выключатель), которое связывалось с CTLA-4 и не давало ему сомкнуться с B7, чтобы отключить иммунные реакции. Свободные молекулы B7 связывались с CD28, Т-клетка активировалась и снова была готова убивать. Когда он в 1995 году провел опыты на больных раком мышах, стало ясно, что от таких Т-лимфоцитов с отключенными тормозами не могут скрыться даже хитрые клетки раковой опухоли. В 2010 уже были проведены успешные исследования на безнадежных больных. У некоторых пациентов исчезла меланома вместе с метастазами – невероятный результат!
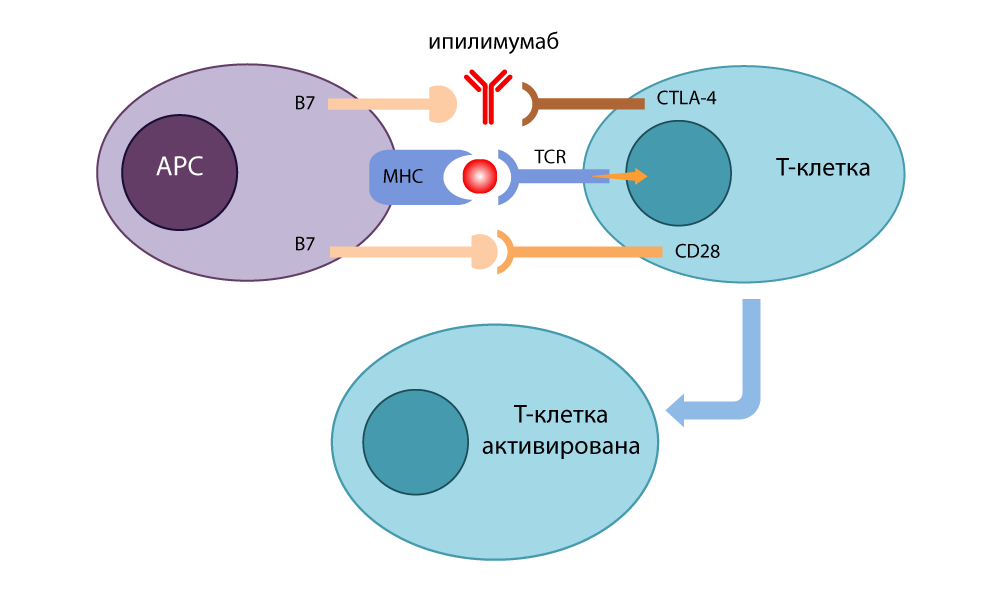
Действие ингибитора CTLA-4 — ипилимумаба
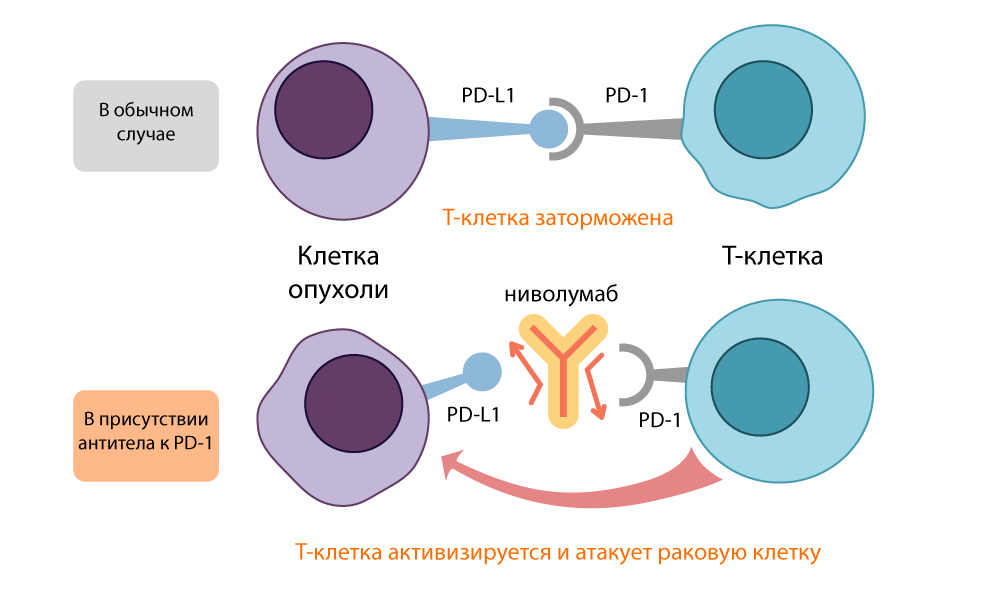
Действие ингибитора PD-L1 – ниволумаба
Иммунитет наносит ответный удар. От чего помогают ингибиторы контрольных точек
Эллисон и Хондзё сделали не просто серьезный вклад в понимание физиологических процессов, но и запустили волну принципиально новых практических исследований именно в прикладной медицине.
Открытие ингибирования иммунных контрольных точек (ИИКТ) открывает принципиально новую область поиска решений. Существующие до этого способы борьбы с раком: хирургия, лучевая и химиотерапия – были направлены непосредственно на саму опухоль, на уничтожение раковых клеток. Теперь у медиков есть огромное поле для исследования в совершенно ином направлении: изменение взаимодействия раковых клеток с их окружением.
Кстати, именно это принципиальное отличие дало медикам настоящий прорыв. До сих пор на опухоль действовали в зависимости от ее локализации. Для рака молочной железы один препарат, для рака желудка – совсем другой. А ингибитор ИКТ пембролизумаб в 2017 году был впервые в истории онкологии зарегистрирован как препарат для терапии любого рака в любом органе – если только тесты подтвердят, что опухоль имеет особое свойство: микросателлитную нестабильность. То есть ее ДНК особенно склонна к мутациям. Ранее ни разу не получалось сделать лекарство от рака по какому-то общему признаку. Это большое достижение.
Революцией стали результаты применения новых препаратов против самых агрессивных видов рака: метастатическая меланома на IV стадии считалась неизлечимой. А пациенты с таким диагнозом, которые прошли курс препарата ипилимумаб (блокатор CTLA-4) в 2010 году – получили дополнительный год жизни – настолько приостановилось развитие опухоли. У 58% из них опухоль уменьшилась на треть.
При лечении немелкоклеточного рака легкого ниволумабом (ингибитор PD-1) риск смерти пациентов снизился на 40%.
Препарат пембролизумаб (также ингибитор PD-1) показывал снижение роста опухоли на 43% в группе лечившихся от меланомы. 74% пациентов жили без ухудшения в течение года, в течение 18 месяцев их было 71%. Важно, что эффект от назначения препарата перевешивал побочные эффекты на всех стадиях развития болезни.
Сегодня с помощью препаратов ингибиторов CTLA-4 и PD-1 лечат меланому (в том числе неоперабельную), немелкоклеточный рак легкого, плоскоклеточный рак головы и шеи, почечно-клеточный рак, некоторые виды лимфом, рак прямой кишки, мочевого пузыря, и опухоли с микросателлитной нестабильностью.
Особенное внимание привлекают исследования, которые показывают эффективность комбинированной терапии одновременно анти-PD-1 и анти-CTLA-4 препаратами.
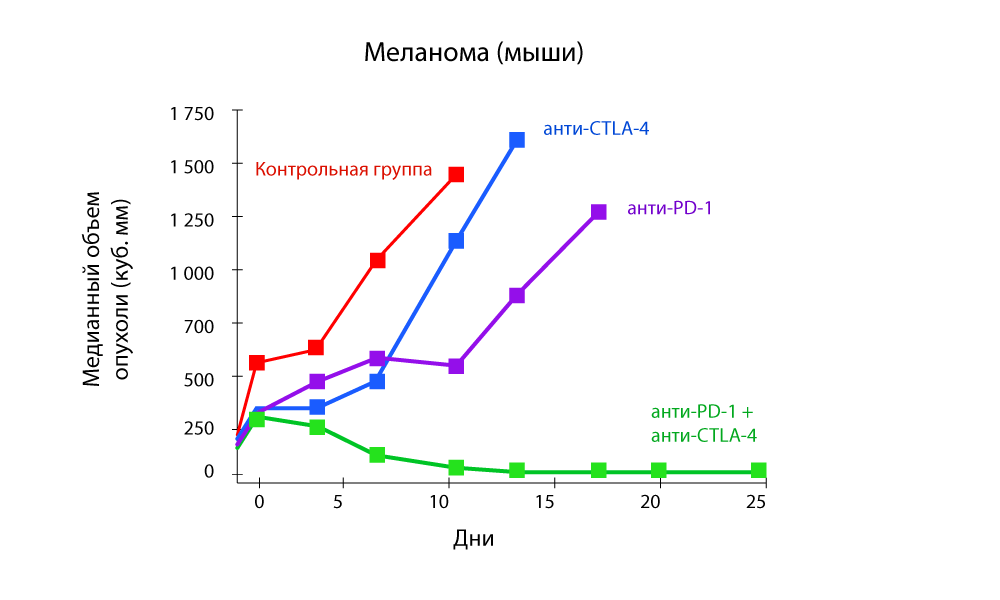
Изменение объема опухоли – резкое снижение при комбинации анти-PD-1 и анти-CTLA-4 препаратов
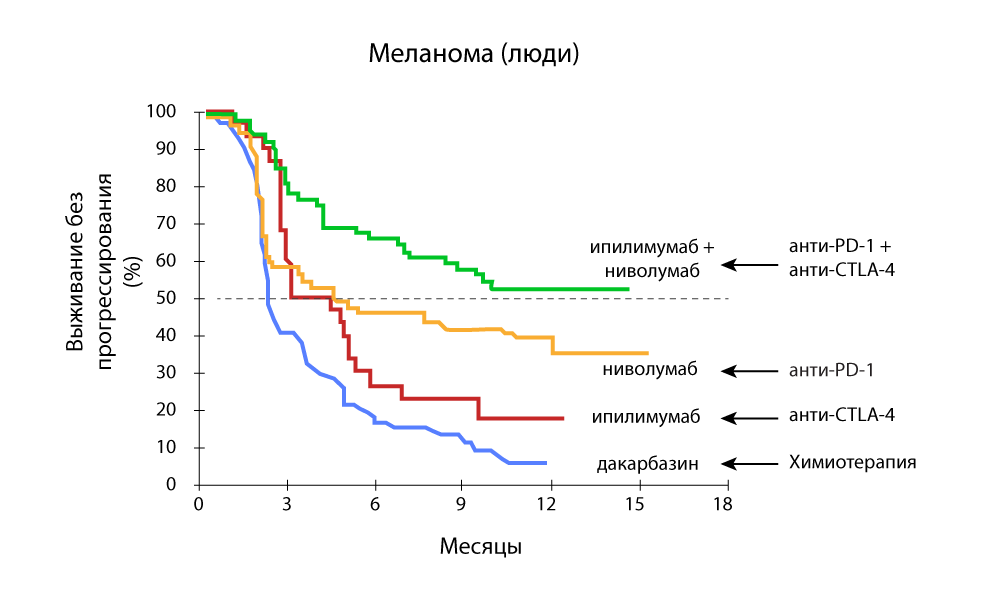
Выживаемость без прогрессирования – комбинация анти-PD-1 и анти-CTLA-4 препаратов более эффективна
Атака клонов. Генетически модифицированный иммунитет
Ингибиторы иммунных контрольных точек заслуженно находятся в центре внимания, но этот механизм пока небезупречен и не может вылечить любой рак. Хорошо, что в иммунотерапии активно развиваются смежные направления исследований. Одно из самых многообещающих – CAR-T терапия.
Буква Т в названии метода – все те же неизменные Т-клетки нашего иммунитета. CAR (Chimeric antigen receptor) – это химерный рецептор антигена. Почему рецептор называют химерным? Потому что он собран из нескольких частей, взятых от разных клеток – с помощью умений генных инженеров.
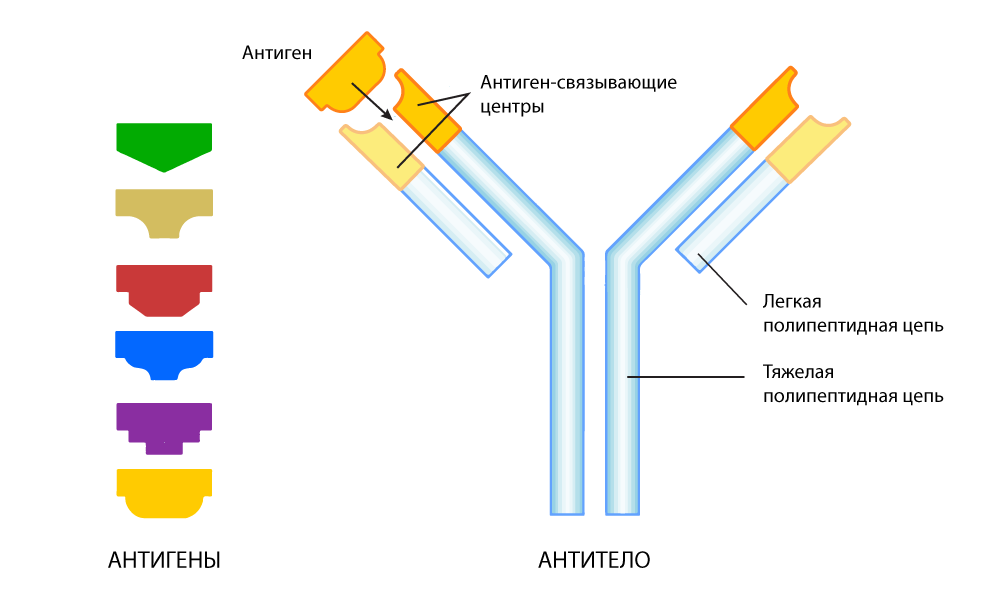
Антитело, приспособленное находить определенный антиген
Впоследствии он начал работать совместно с американским коллегой, Стивеном Розенбергом, у них получилось сделать химерный рецептор более эффективной конструкции, одновременно чувствительный и избирательный.
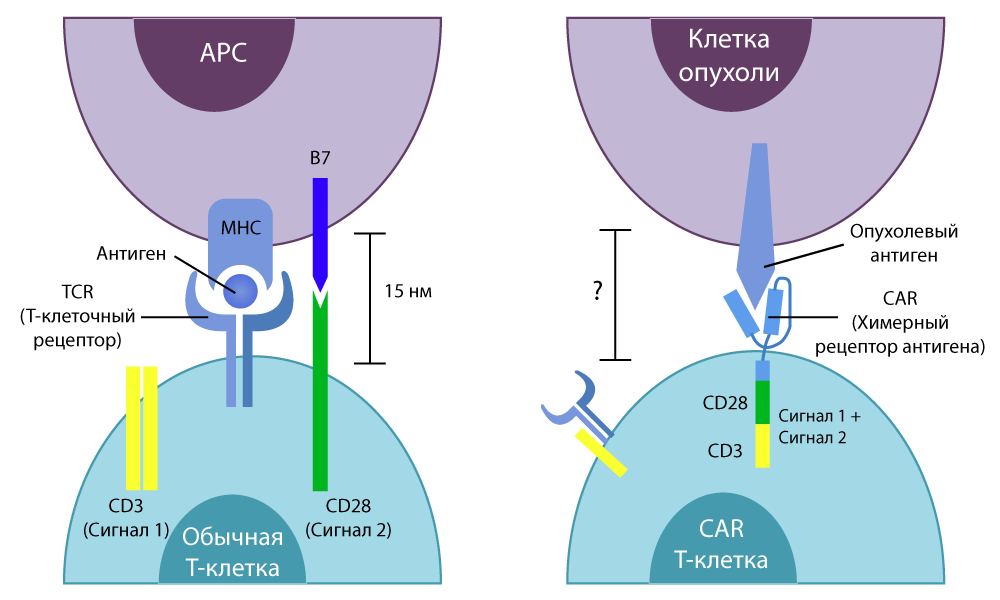
Разница между обычными Т-клетками и CAR-T-клетками
Исследования в пробирке показали хороший результат. Затем ученые снова лечили мышей, затем кропотливо переносили методику на человека.
Со временем терапию CAR-T привели к современному виду.
В 2018 в Nature Medicine появилась статья американских онкологов, где сообщалось, что уже два года они наблюдают пациентку, полностью здоровую после CAR-T терапии. Ее вылечили от метастатического рака молочной железы с метастазами. Это ее фотография в каяке приведена в начале статьи: после лечения она вернулась на работу и ходит в походы.
Новая надежда. Станет ли иммунотерапия панацеей?
Кроме PD-1, PD-L1/2, CTLA-4, CD28 и B7 на поверхностях Т-клеток и опухолевых клеток есть масса других ко-рецепторов, действие которых пока не изучено так хорошо, как работа контрольных точек, но они также влияют на иммунный ответ. Одно из направлений работы – влияние на эти ко-рецепторы.
Кроме того, терапия ИИКТ дополняется введением вакцин, цитокинов, бета-блокаторов – и такой подход тоже хорошо работает в ряде случаев.
CAR-T терапия все еще является крайне дорогой и пока еще только переходит в стадию коммерческого использования: ведутся разработки в научных группах Эшхара и Розенберга, других исследователей – каждая из групп создают особые виды CAR-Т с направленным действием против определенного вида рака. Но пока это только исследования, проверки и испытания. Пройдет несколько лет, прежде чем это превратится в отработанный массовый способ лечения – но и тогда нельзя будет давать 100% гарантий.
Если стандартно до сих пор иммунотерапевтические препараты включали в третью, в пятую линию (то есть очередь) терапии, то сейчас врачи движутся к тому, чтобы назначать их сразу, вместе с химиотерапией и терапией таргетными моноклональными антителами: такие пациенты часто показывают более хорошую динамику и в итоге живут дольше.
В России уже зарегистрированы все основные иммунопрепараты. Проблема, правда, что для каждого из них Минздрав отдельно оговаривает показания. То есть в оригинальной инструкции к препарату может быть прописано, например, девять разных видов рака, при котором препарат можно назначать, а у нас в стране он зарегистрирован только для шести из них. И так с каждым препаратом. В итоге, пока около 50% опухолей еще не включены в этот список. Соответственно, в рамках лечения по ОМС врач может выписать эти препараты далеко не всем пациентам.
Ну и частая проблема – отсутствие квалификации. Метод, хоть и успел проявить себя, пока для многих врачей в стране еще новый. Препараты все западные, и доходят до нас с опозданием на 2-3 года. А, учитывая, что активно применяется иммунотерапия всего несколько лет, у многих еще нет опыта работы с ними. Кроме того, использование иммунотерапии требует специфических знаний.
Общее и в частных, и в государственных клиниках – это сами пациенты. Они не всегда хорошо понимают, что это за метод, как он работает, отсюда недоверие. Мы надеемся, эта статья помогла разобраться и понять, что иммунотерапия сегодня совершенно заслуженно находится в фокусе пристального внимания онкологов. Судя по результатам, она уже готова встать на один уровень с классическими методами. Страшная болезнь отступит еще на шаг дальше.
Читайте также:

