Болевой синдром в онкологии исакова
Informo, ergo sum!

Московского
Онкологического
Общества
| №12 (573) 2010 ДЕКАБРЬ |
ЗАСЕДАНИЕ 573
состоится во вторник 16 декабря 2010 г. в 17:00
в конференц-зале клиники Российского онкологического
научного центра им. Н.Н. Блохина
Президиум: проф. А.И. Пачес, чл.-корр. РАМН, проф. Б.И. Долгушин, д.м.н. М.Е. Исакова, проф. Э.Д. Исагулян
БОЛЕВОЙ СИНДРОМ В ОНКОЛОГИИ.
ОБМЕН ОПЫТОМ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ
АНТИНОЦИЦЕПТИВНЫЕ ПРОЦЕДУРЫ
ПРИ ХРОНИЧЕСКОМ БОЛЕВОМ СИНДРОМЕ
(НЕЙРОАБЛЯЦИЯ, НЕЙРОСТИМУЛЯЦИЯ, НЕЙРОФАРМАКОЛОГИЯ)
Исакова М.Е. 1 , Косырев В.Ю. 1 , Исагулян Э.Д. 2 , Брюзгин В.В. 1
( 1 РОНЦ им. Н.Н.Блохина; 2 НИИ нейрохирургии им. Н.Н. Бурденко)
НЕЙРОЛИЗИС В ЛЕЧЕНИИ ХРОНИЧЕСКОЙ БОЛИ В ОНКОЛОГИИ
Долгушин Б.И., Косырев В.Ю., Нечипай А.М., Бурдюков М.С.,
Юричев И.Н., Тюрин И.Е., Молчанов Г.В.
(отдел лучевой диагностики и рентгенохирургических методов лечения РОНЦ им. Н.Н. Блохина)

РУКОВОДСТВО ПО ОБЕЗБОЛИВАНИЮ!
СОВРЕМЕННОЕ, СВОЕВРЕМЕННОЕ, СВОЕОБРАЗНОЕ…
Вопросы обезболивания – это вечно актуальная тема заседаний Московского онкологического общества. Тем более что в лечении пациентов, страдающих болевым синдромом достигнуты определенные успехи. Новшества представлены в единственной с 2000-х гг. отечественной монографии:
В этом труде последовательно изложены сведения о (пато)физиологии боли, болевых синдромах, принципах фармакотерапии.
Отмечено, что для возникновения болевого ощущения непременно должна быть активизирована ноцицептивная система. Ее активация происходит либо на уровне ноцицептивных рецепторов в тканях, либо – ноцицептивных афферентов при повреждении периферичечких нервов, либо – при поражении/дисфункции центральных ноцицептивных структур. Деятельность сложноорганизованной ноцицептивной системы контролируется эндогенной системой торможения проведения ноцицептивных сигналов – антиноцицептивной системой. Структуры антиноцицептивной системы угнетают передачу болевых импульсов, осуществляя торможение ноцицептивных нейронов… и т.д.
В целом, 384-страничная монография являются современным и весьма своевременным руководством по обезболиванию в онкологии. Несомненно, она будет востребована теми, для кого и предназначена в первую очередь – онкологами и альгологами (специалистами по устранению боли).
Однако книга читается с интересом – как и все новое, передовое. Имеются весомые основания дочитать ее до самой последней главы. В этом случае читатель будет вознагражден тем, что с изумлением обнаружит в публикации бесспорно интересные, и поэтому ранее уже опубликованные материалы Московского онкологического общества (не исключается, что Ваши собственные).
Несомненно, выявленные недостатки будут успешно устранены при последующих (и возможно многократных) переизданиях этого современного, своевременного и своеобразного руководства.
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY
№ 573 (December 16, 2010)
ANTINOCYCEPTIVE PROCEDURES
FOR CHRONIC PAIN IN PATIENTS WITH CANCER:
NEUROABLATION, NEUROSTIMULATION, NEUROPHARMACOLOGY
Report-1: ANTINOCYCEPTIVE PROCEDURES IN CANCER PATIENTS WITH CHRONIC PAIN: NEUROABLATION, NEUROSTIMULATION, NEUROPHARMACOLOGY. By Prof. M. Isakova 1 , Dr. V. Kosyrev 1 , Prof. E. Isagulian 2 , Prof. V. Bruzgin 1 ( 1 The N.N. Blokhin Russian Cancer Research Center; 2 The N.N. Burdenko Research Institute for Neurosurgery).
Report-2: NEUROLISIS IN CANCER PATIENTS WITH CHRONIC PAIN. By Prof. B. Dolgushin, Dr. V. Kosyrev, Prof. A. Nechipai, Dr. M. Burdukov, Dr. I. Yurichev, Prof. I. Turin, Prof. G. Molchanov (The N.N. Blokhin Russian Cancer Research Center).
АНТИНОЦИЦЕПТИВНЫЕ ПРОЦЕДУРЫ
ПРИ ХРОНИЧЕСКОМ БОЛЕВОМ СИНДРОМЕ
(НЕЙРОАБЛЯЦИЯ, НЕЙРОСТИМУЛЯЦИЯ, НЕЙРОФАРМАКОЛОГИЯ)
Исакова М.Е. 1 , Косырев В.Ю. 1 , Исагулян Э.Д. 2 , Брюзгин В.В. 1
( 1 РОНЦ им. Н.Н.Блохина; 2 НИИ нейрохирургии им. Н.Н. Бурденко)
Хроническая боль – это процесс, не имеющий нозологической характеристики. Болевой синдром возникает при действии внешних повреждающих факторов, а также при развитии патологических процессов во внутренних органах. Хронический болевой синдром онкологического генеза отличается от других видов боли – как острой, так и хронической. Постоянно нарастающая боль в сочетании с тяжелым психологическим состоянием трудноизлечимого больного создают сложный механизм патологической боли, которая вызывает комплекс дизадаптивных реакций и представляет опасность для биологической целостности организма. Хроническая боль онкологического генеза связана с опухолевым процессом (и проявлениями его прогрессирования); опухолевого процесса; побочными эффектами (последствиями) специального противоопухолевого лечения; сопутствующими заболеваниями. Очевидно, что необходимо такое облегчение боли, чтобы больной не испытывал страданий на всем протяжении его пребывания под наблюдением онколога.
Пути решения сложной медицинской и социальной проблемы обезболивания, устранения тяжелых патологических болевых синдромов привели к созданию научного направления – альгологии, развитию клиник и центров боли по всему миру. Организация центров и клиник боли основывается на мультидисциплинарном подходе, поскольку опыт убедительно показал, что в лечении тяжелых болевых синдромов не существует единственного эффективного метода – лечение должно быть комплексным.
Нейроаблация (невролиз; нейролизис) предусматривает разрушение (от латинского ablation – удаление, разрушение действием) ноцицептивного нервного пути. Как правило, это достигается в результате хирургического вмешательства, путем химической деструкции нерва, достижением постоянной блокады нервной передачи. В качестве химических агентов применяются инъекции этанола, фенола в глицерине, хлоркрезола, др. Возможно применение физических факторов воздействия – холода (криохирургия) или тепла (радиочастотная термоабляция). Успех нейроабляции (блокады нерва) зависит от концентрации применяемого препарата, степени поражения проводящих боль нервных волокон. Важное значение для эффекта химического невролиза имеет состояние больного, его способность перенести процедуру, требующую 30-40 минут пребывания в определенном, фиксированном положении на операционном столе.
Нейростимуляция – это регуляция болевой чувствительности немедикаментозными методами обезболивания. К таким методам относятся различные варианты электростимуляционной терапии болевых синдромов. В зависимости от уровня воздействия на анатомические структуры периферической или центральной нервной системы выделяют чрескожную, эпидуральную, транскраниальную, радиочастотную электронейростимуляции.
Нейрофармакология предусматривает воздействие фармакопрепаратов непосредственно на нервные (ноцицептивные) структуры. Примерами такого противоболевого воздействия являются эпидуральная или субарахноидальная анестезия – наиболее распространенные методы регионарной анестезии. Представляется, что введенные в эпидуральный канал наркотические анальгетики благодаря диффузии через оболочки и абсорбции сосудами, питающими спинной мозг, проникают в спинномозговой канал и связываются с опиат-рецепторами.
НЕЙРОЛИЗИС В ЛЕЧЕНИИ ХРОНИЧЕСКОЙ БОЛИ В ОНКОЛОГИИ
Долгушин Б.И., Косырев В.Ю., Нечипай А.М., Бурдюков М.С.,
Юричев И.Н., Тюрин И.Е., Молчанов Г.В.
(отдел лучевой диагностики и рентгенохирургических методов лечения РОНЦ им. Н.Н. Блохина)
Согласно современным представлениям боль – это интеграция ноцицептивных сигналов, которые генерируются в ответ на стимуляцию ноцицепторов. В этой связи: 1) подавление синтеза медиаторов, стимулирующих ноцицепторы; 2) активация антиноцицептивной системы; 3) устранение болезненного мышечного напряжения; 4) нормализация психологического состояния пациента; а также 5) ограничение ноцицептивной афферентной импульсации из зоны повреждения в ЦНС – являются основными принципами патогенетической терапии хронической боли у онкологических больных.
Эта интервенционная радиологическая процедура выполняется совместными усилиями рентгено-хирурга, выполняющего введение иглы, анестетика, нейролитика для воздействия на ту часть нервной ткани, которая является проводником патологических нервных импульсов, а также специалиста по лучевой диагностике, который обеспечивает наведение иглы и введение препарата под контролем рентгеноскопии, ультразвуковой визуализации или цифровой компьютерной томографии.
Существенным достоинством технологии является ее малоинвазивность. Возможно введение иглы чрескожно, под местной анестезией, и трансгастрально, с применением эндоскопа, оснащенного конвексным ультразвуковым датчиком, под лекарственной седацией. Метод может выполняться также во время лапаротомии, под эндоскопическим ультразвуковым контролем.
Наибольший опыт применения данной методики накоплен при нейролизисе чревных ганглиев у больных злокачественными новообразованиями органов брюшной полости и забрюшинного пространства, страдавших выраженным болевым синдромом (что требовало многократного введения наркотических анальгетиков).
Процедура выполняется чрескожным (передним либо задним доступами, под контролем УЗИ или КТ. Для нейролизиса необходим 1%-ный раствор лидокаина с целью местной анестезии, 0,5%-ный раствор наропина для блокады чревного сплетения и 96%-ный раствор этилового спирта – как нейролитик. Применяются иглы длиной 15-20 см и диаметром 22 G с мандренами (так называемые иглы chibo).
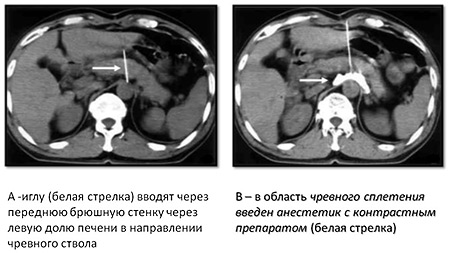
Рис. 1. Чрескожный нейролизис передним доступом
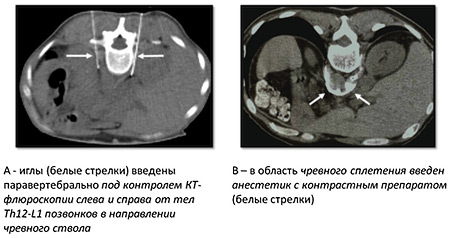
Рис. 2. Чрескожный нейролизис задним доступом
Под местной анестезией и под контролем КТ кончики игл максимально приближаются к чревному сплетению.
По этим иглам медленно, также под контролем КТ вводится раствор анестетика для блокады чревного сплетения. В него предварительно добавляется 1,0-1,5 мл контрастного препарата, который позволяет визуализировать инфильтрируемую область.
Через 5-10 минут начинается введение раствора этилового спирта со скоростью не более 2,0 мл в минуту.
Быстрый (через несколько минут) обезболивающий эффект наступает благодаря действию анестетика на чревные ганглии. В дальнейшем происходит их постепенный лизис, что усиливает обезболивающий эффект, который сохраняется длительное время.
Чрескожный нейролизис чревных ганглиев (задним доступом) выполнен в РОНЦ 17 больным в возрасте 21-59 лет (средний возраст – 51 год) по поводу рака поджелудочной железы (13), желудка (2), толстой кишки, карциноида поджелудочной железы. Осложнений не отмечено. Период наблюдения составил от 3 до 29 недель (в среднем – 8 недель). Достигнуто стойкое снижение интенсивности боли через 1 неделю после воздействия. Из 17 больных у 12 (70,6%) обезболивающий эффект в различной степени сохранялся в течение 8 недель.Отсутствие эффекта наблюдалось лишь у больного карциноидом поджелудочной железы.
Таким образом, метод чрескожного нейролизиса чревных ганглиев безопасносен и эффективен, как способ снижения интенсивности\подавления боли у онкологических пациентов.
ТРАНСГАСТРАЛЬНЫЙ ЭНДОСКОПИЧЕСКИЙ НЕЙРОЛИЗИС
Процедура нейролизиса выполняется с использованием конвексного эхоэндоскопа (в условиях, при которых ультразвуковая волна распространяется параллельно эндоскопу). При этом обезболивание самой процедуры может быть ограничено премедикацией, которая, по показаниям, дополняется внутривенной седацией.
Конвексный эхоэндоскоп позволяет добиться УЗ-визуализации не только паренхиматозных органов, сосудистых структур (аорты и отходящего от нее чревного ствола), но также и ганглиев чревного сплетения. Указанная техника обеспечивает безопасную навигацию иглы относительно сосудов в режиме допплеровского сканирования (рис. 3).
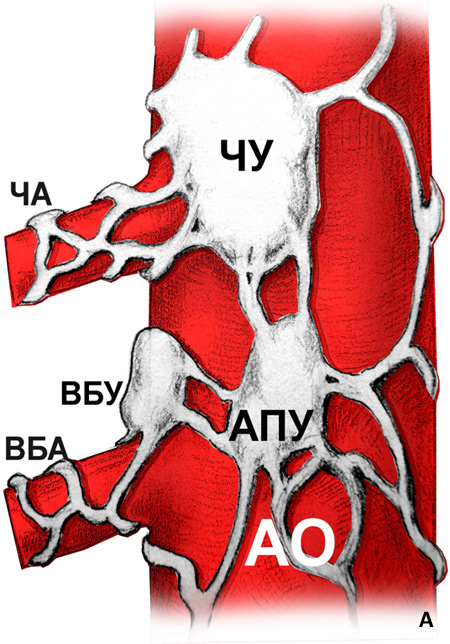

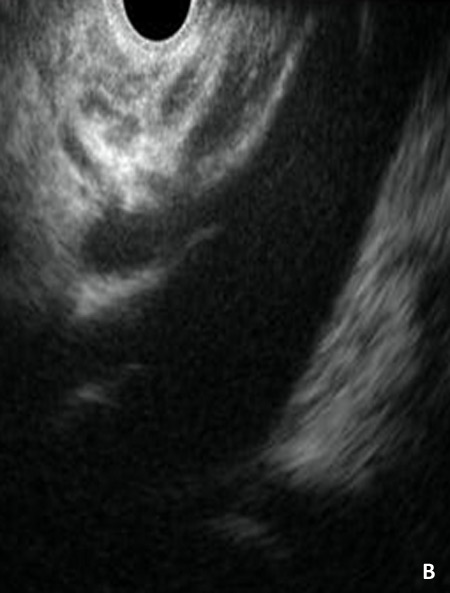
Рис. 3 (А-Б-В). Схематическое изображение зоны чревного сплетения представлено на рис. 3А. Оно аналогично таковому, получаемому при сагитальном КТ-скане (рис. 3Б). При конвескной эндосонографии (рис. 3В) получены аналогичные изображения, на которых визуализируется анатомия данной зоны: ножка диафрагмы, аорта, чревный ствол и расположенные чуть выше него нервные ганглии, верхняя брыжеечная артерия.
Особенностью специальных пункционных игл является наличие эхопозитивного дистального кончика, что оптимизирует условия контроля проведения пункции и обеспечивает максимальную безопасность при выполнении процедуры. Диаметр игл, используемых для тонкоигольной пункции – от 21G, их конструктивной особенностью является строение дистального кончика, который обеспечивает инфильтрацию тканей в зоне воздействия не в продольной, а в поперечной по отношению к игле плоскости.
Для выполнения эндоскопического малоинвазивного трансгастрального нейролизиса эндоскоп с конвексным ультразвуковым датчиком на дистальном конце проводится в желудок. После этого последовательно выполняются следующие действия: поиск анатомических ориентиров для позиционирования эндоскопа; визуализации чревного сплетения, в частности его ганглиев; пункция нервных ганглиев и введение лекарственного средства; проекционная визуализация зоны воздействия после ее лекарственной инфильтрации (рис.4).
Нейролизис под контролем эндосонографии выполнен в отд. эндоскопии №2 РОНЦ 11 больным в возрасте 47-59 лет (средний возраст – 53 года) по поводу рака головки (5) и тела (5) поджелудочной железы, а также – псевдотуморозного панкреатита. Из возможных, по данным литературы, побочных эффектов (диарея, гипотония, образование парапанкреатических абсцессов и обострение болевого синдрома) отмечено появление диареи у одного из пациентов (9%). Обезболивающий эффект отмечен в 91% случаев, при дальнейшем наблюдении (более месяца) он сохранялся у 72% пациентов. Срок наблюдения после нейролизиса составил от 1 до 24 недель.
Таким образом, эндосонография является методом, который позволяет прецизионно визуализировать ганглии чревного сплетения, или анатомические ориентиры, указывающие на область расположения ганглиев. Это позволяет безопасно и эффективно выполнять медикаментозную блокаду чревного сплетения. Целесообразно внедрение процедуры эндоскопического нейролизиса в практику; оценка эффективности метода возможна по мере накопления клинического опыта.
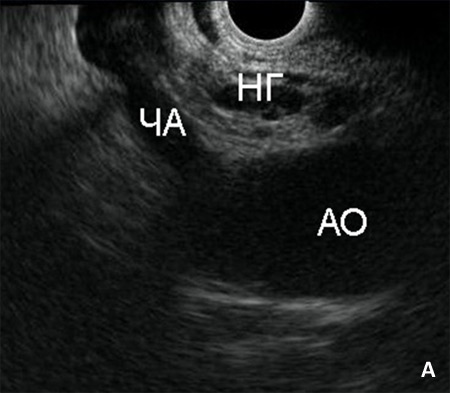
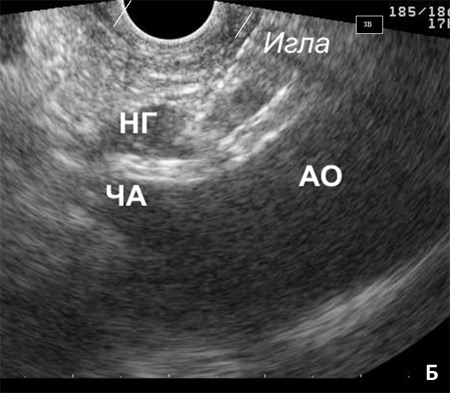
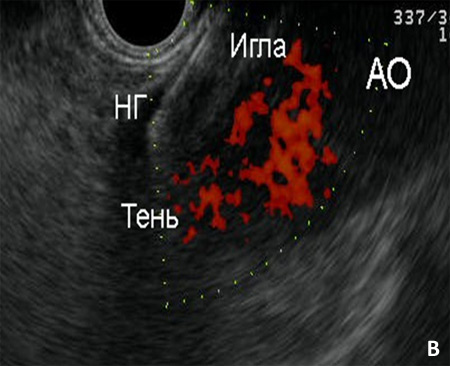
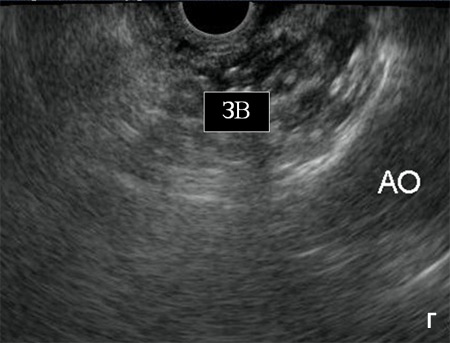
Рис. 4. Процедура трансгастрального эндоскопического нейролизиса. Эндоскоп с конвексным ультра-звуковым датчиком на дистальном конце проведен в желудок. А) Визуализисрованы аорта (АО), чревная артерия (ЧА) и нервные ганглии чревного сплетения (НГ). Б) Игла под эндосонографическим контролем введена в нервный ганглий (НГ). В) Выполнена инъекция этанола, после чего визуализирована эхонегативная тень, за которой постепенно исчезают анатомические ориентиры (эффект обусловлен микропузырьками воздуха, растворенного в этаноле). Г) Визуализирована зона воздействия (ЗВ) после инфильтрации р-ром этанола.
Онкологи Юсуповской больницы уделяют большое внимание лечению пациентов, страдающим от боли, причиной которой являются злокачественные новообразования. В клинике онкологии работают кандидаты и доктора медицинских наук, врачи высшей категории. Они для лечения пациентов и купирования болевого синдрома используют наиболее эффективные лекарственные препараты, обладающие минимальным спектром побочных эффектов.
Врачи применяют стандарты и протоколы ведущих стран мира, рекомендации Всемирной организации здравоохранения по лечению болевого синдрома в онкологии. Онкологи индивидуально подходят к подбору препаратов и их доз каждому пациенту. Для того чтобы выявить онкологическое заболевание и установить распространённость патологического процесса используют современные методы обследования. Юсуповская больница оснащена новейшим диагностическим оборудованием, позволяющим своевременно выявить злокачественное новообразование. Наиболее сложные диагностические процедуры и анализы пациенты имеют возможность пройти в клиниках-партнёрах. Пациентам, требующим постороннего ухода, оказывают помощь сиделки и медсестры.
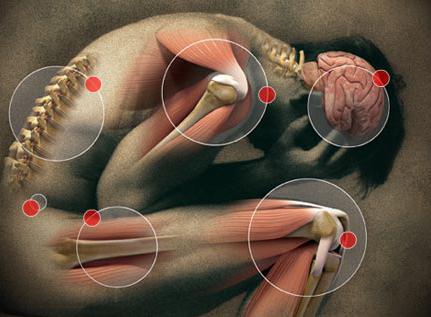
Болевой синдром при онкологических заболеваниях
Болевой синдром у пациентов, страдающих онкологическими заболеваниями, может развиться на любой стадии патологического процесса. Боль бывает острой и хронической. Длительность острой боли – 3 месяца, а о хронической боли врачи говорят, когда она беспокоит пациента больше трёх месяцев. Острая боль – это сигнал тревоги. Она свидетельствует о наличии заболевания. Врачи Юсуповской больницы проводят комплекс диагностических процедур для определения причины болевого синдрома.
Хроническая боль является постоянным патологическим раздражителем. Она нарушает качество жизни пациента. Интенсивность онкологической боли не зависит напрямую от типа или распространённости опухолевого процесса. У некоторых пациентов небольшое новообразование вызывает сильную боль, в то время как многие больные с наличием множественных метастазов боли не ощущают.
В случае онкологического заболевания врачи говорят о болевом синдроме, в котором симптомы являются результатом суммы эпизодов острых болей, превратившихся в хронические. В начале онкологического заболевания боль беспокоит только 10-20% пациентов. Врачи Юсуповской больницы при обращении пациентов с жалобами на постоянную, не снимающуюся анальгетиками боль, проявляют повышенную онкологическую настороженность. Они используют все диагностические методы, позволяющие выяснить причину болевого синдрома.
Довольно часто боль является признаком рецидива опухоли. Болевой синдром сопутствует далеко зашедшим стадиям заболевания. Боль нередко является результатом противораковой терапии, и онкологи Юсуповской больницы купируют её для того, чтобы избежать перехода в хроническую стадию.
Методы обезболивания в онкологии
Врачи индивидуально подбирают обезболивающий препарат, который устраняет или заметно уменьшает боли за 2–3 дня. Они назначают анальгетики таким образом, чтобы пациент получал очередную дозу препарата до прекращения действия предыдущей дозы. Вначале пациент принимает максимально слабо действующую дозу, а затем минимальную сильнодействующую.
При подборе анальгетика и начальной дозы учитывают следующие факторы:
- возраст пациента;
- степень его истощения;
- интенсивность боли;
- ранее применявшиеся обезболивающие средства и их эффективность;
- состояние функции почек, печени, степень усвоения препарата.
Сначала онкологи для снятия болевого синдрома назначают парацетамол, ибупрофен, мелоксикам, диклофенак. Нестероидные противовоспалительные препараты действуют на периферические болевые рецепторы. Иногда пациенты в течение первых дней приёма лекарств чувствуют сонливость и общую усталость. Эти симптомы проходят самостоятельно или после корректировки дозы препарата. Если после приёма таблеток боль не уменьшается, переходят к инъекционному введению обезболивающих лекарств.
Когда нестероидные противовоспалительные препараты становятся неэффективными, к ним подключают слабые опиаты – трамадол и кодеин. Болеутоляющий эффект достигают за счёт воздействия на опиатные рецепторы и замещения эндорфинов. Трамадол назначают в форме таблеток или инъекций. Препарат принимают совместно с нестероидными противовоспалительными средствами, так как трамадол воздействует на центральную нервную систему, а нестероиды – на периферическую нервную систему.
Если пациент испытывает мучительные, непрекращающиеся боли, ему назначают сильные опиаты, ключевым из которых является морфин. Врач может сначала назначить более щадящие лекарственные средства, вызывающие меньшее привыкание. К ним относится бупренорфин, пиритрамид или фентанил. Принимать их начинают с минимальной дозы, которую постепенно увеличивают.
На каждом этапе лечения онкологических больных врачи назначают коанальгетики. Это группа лекарственных средств, обладающих, кроме основного действия, эффектами, за счет которых они могут уменьшать боли: кортикостероиды, трициклические антидепрессанты, антиэпилептические препараты.
Кортикостероиды включают почти во все химиотерапевтические протоколы. Их применяют для симптоматического лечения за счёт мощного противовоспалительного, противоотёчного и кальцийснижающего действия. Кортикостероидные препараты снижают внутричерепное давление и компрессию спинного мозга. Их назначают в комбинации с обезболивающими препаратами при поражении опухолью нервных сплетений и костных метастазах.
В лечении нейрогенных болей у онкологических больных часто используют трициклические антидепрессанты. Они усиливают действие опиоидов, оказывают прямое обезболивающее действие, улучшают настроение независимо от анальгезирующего эффекта. Препаратом выбора является амитриптилин. В комбинации с морфином он эффективен при онкологической боли.
При сильных, стреляющих неврогенных болях применяют антиэпилептические препараты. Пациенты хорошо переносят карбамазепин в сочетании с антидепрессантами. При появлении побочных эффектов (сонливости, сухости во рту, гипотензии, запоров) врачи корригируют дозу препарата.
Если приём таблеток и инъекции обезболивающих препаратов не снимают боль, онкологическим больным лекарство вводят в эпидуральное пространство. Врачи также используют нейролизис – процесс разрушения болевого нервного пути. Анальгетик вводят через желудочно-кишечный тракт под ультразвуковым эндоскопическим контролем. Такие методы местного обезболивания применяют при злокачественных новообразованиях поджелудочной железы. У 90% пациентов обезболивающий эффект сохраняется больше месяца, в то время как наркотические анальгетики классическим способом пришлось бы вводить постоянно.
Миофасциальный болевой синдром выражается в спазме мышц и появлении в напряженных мышцах болезненных уплотнений, которые называются триггерными точками. Они болезненны при нажатии. После инъекции обезболивающего препарата в триггерную зону проходит боль и улучшается подвижность участка тела.
Вегетативные блокады предполагают введение препарата в место проекции нерва, который связан с поражённым органом. Процедуру проводят раз в год, раз в полгода или каждую неделю. После неё отмечается минимальное количество негативных последствий.
Хронический болевой синдром в онкологии
Хронический болевой синдром – это самостоятельное заболевание. Он не исполняет защитной функции. Хроническая боль ведёт к дезадаптации, ненормальному восприятию болевых импульсов и сопровождается различными нарушениями функций центральной нервной системы. Клиническая картина зависит от расположения очага поражения, конституции и психики пациента, индивидуального порога болевой чувствительности.
Основная причина возникновения хронического болевого синдрома – длительно существующая постоянная боль, вызывающая дисбаланс в работе периферической и центральной нервной системы. Болевые раздражители постоянно стимулируют спинной и головной мозга. Боль продолжается даже после устранения её причины.
Боль, вызванная опухолевым процессом, имеет свою специфику. Раковые клетки быстро растут, сдавливают прилежащие здоровые ткани или периферические и центральные структуры нервной системы. В процессе роста и развития опухоль выделяет специфические вещества, которые возбуждают или повышают восприимчивость периферических рецепторов и нервных волокон к раздражителям. Опухолевые клетки вырабатывают протеолитические ферменты. Они постоянно возбуждают и дестабилизируют сенсорную симпатическую иннервацию. Это приводит к нейропатической боли.
Хроническую боль вызывают метастазы опухоли. Ноцицептивная висцеральная боль возникает при повреждении органов, иннервируемых симпатической нервной системой. Помощь онкологическим больным, страдающим хронической болью, в Юсуповской больнице оказывают специалисты отделения паллиативной помощи. Опытные медицинские сёстры знают особенности течения опухолевого процесса. Они помогают пациентам справиться с болью.
Выбор конкретного метода обезболивания при раке зависит от многих факторов. Запишитесь на приём к онкологу по телефону. Врачи Юсуповской больницы индивидуально подберут схему обезболивания.

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Согласно определению Международной ассоциации по изучению боли (IASP), к хронической относят боль, которая сохраняется более 3 месяцев. Это достаточно типичная ситуация для онкологического больного. При прогрессировании опухолевого процесса хроническая боль отягощает жизнь пациента и окружающих его людей, представляет серьезную медицинскую и социальную проблему. У онкологических пациентов болевые ощущения не являются временными или преходящими, в них нет биологической целесообразности, они не играют защитной роли. Возникшая у онкологического пациента боль ведет к дезадаптации, к ненормальному восприятию болевых импульсов и сопровождается различными нарушениями функции центральной нервной системы (ЦНС).
Клиническая картина болевого синдрома зависит от локализации очага поражения, патогенетического типа боли, индивидуального порога болевой чувствительности, предшествующего болевого опыта.
Этиология
Выделяют следующие основные причины хронической боли у онкологических больных:
- боль, вызванная самой опухолью (поражение костей, мягких тканей, кожи, внутренних органов, органов пищеварительной системы, окклюзия сосудов и др.);
- боль при осложнениях опухолевого процесса (патологический перелом, некроз, изъязвление, воспаление, инфицирование тканей и органов, тромбозы);
- боль при паранеопластических синдромах (артро-, нейро- и миопатии);
- боль как следствие астенизации (пролежни, трофические язвы, запор);
- боль, обусловленная противоопухолевым лечением:
- при осложнениях хирургического лечения рака (фантомная боль, боли при спайках, рубцах, отеках);
- при осложнениях химиотерапии (мукозиты, полинейропатия, генерализованная миалгия, асептический некроз, артралгии);
- при реакциях и осложнениях лучевой терапии (поражение кожи и слизистых оболочек, костей, фиброз, неврит, плексит, миелопатия и др.).
Типы боли и механизм их развития
Выделяют три патогенетических типа боли: ноцицептивный, нейропатический и психогенный. При ноцицептивном типе боли происходит раздражение специфических периферических болевых рецепторов (ноцицепторов), которые расположены во всех органах и тканях: в коже, слизистых оболочках, стенках полых органов, капсулах паренхиматозных органов, в костях и надкостнице.
Повреждения, сопровождающие опухоли, приводят к деструкции клеточных мембран, в результате этого запускается цепь гистохимических реакций с высвобождением тканевых альгогенов, к числу которых в настоящее время относят более 30 различных субстанций. Важнейшими из них принято считать простагландин Е2 (ПГЕ2), гистамин, серотонин и другие биоактивные вещества. В патологическом очаге также активны альгогены, поступающие из плазмы. К ним относятся брадикинин и каллидин. Как плазменные, так и тканевые альгогены взаимодействуют с соответствующими структурами на поверхности болевых рецепторов,резко повышая их чувствительность.
В результате этих разнообразных и частых воздействий генерируются болевые импульсы. По афферентным нервным волокнам болевой импульс поступает в задние рога спинного мозга, откуда по спиноталамическому тракту — в вышележащие отделы ЦНС, ядра таламуса. В дальнейшем вся сенсорная болевая информация поступает в нейроны серого вещества проекционных зон коры больших полушарий, где происходят ее обобщение, обработка и анализ (перцепция), после чего организм осознает боль и степень опасности произошедшего повреждения.
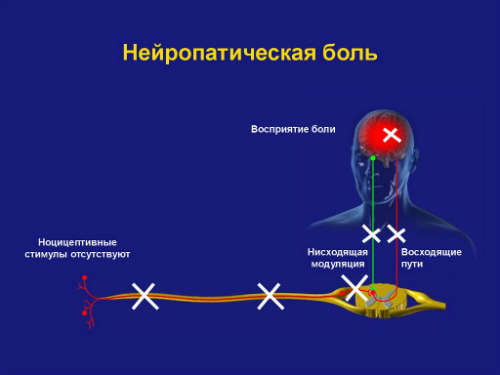
Нейропатическая боль имеет принципиальное отличие от ноцицептивной в механизмах формирования. Нейропатическая боль у онкологических пациентов может возникать как результат повреждений на разных уровнях нервной системы — от периферических нервов до нейронов коры головного мозга.
При повреждении головного или спинного мозга развивается центральная нейропатическая боль. При повреждениях структур периферической нервной системы (корешков спинномозговых нервов, нервных сплетений, периферических нервов) развивается периферическая нейропатическая боль.
Нейропатическая боль у онкологических пациентов часто гетерогенна, так как может иметь одновременно несколько причин, например, компрессия нервов (79%), деафферентационное повреждение нервов (16%), симпатически усиленная боль (5%). Симпатически усиленная боль — каузалгия, которая проявляется локальной вазодилатацией, гипертермией, повышенным потоотделением, трофическими расстройствами, извращенными сенсорными реакциями.
Опухоли, неудержимо разрастаясь в объеме, способны сдавливать структуры периферической нервной системы либо прорастать непосредственно в нервные сплетения, корешки и ветви периферических нервов, вызывая боль, нарушая сенсорную и моторную функции. Длительно существующая опухолевая компрессия, как и инфильтрация нервных структур, приводит к повреждению волокон нерва, вызывая дегенеративные изменения и деафферентацию (централизацию) боли.
Психогенная боль возникает в ответ на индивидуальное эмоционально значимое переживание (депрессия, стресс, страх, истерия, бред, боли, галлюцинации и т.п.). Эти эмоциональные проявления могут вызывать изменения в симпато-адреналовой системе, системе выработки гипофизарных гормонов, что ведет к дисбалансу в работе висцеральных систем.
Лекарственная терапия хронической онкологической боли
Основным методом симптоматического лечения хронической боли онкологического генеза является системная фармакотерапия. Принципы медикаментозного лечения хронической боли включают следующие основные положения:
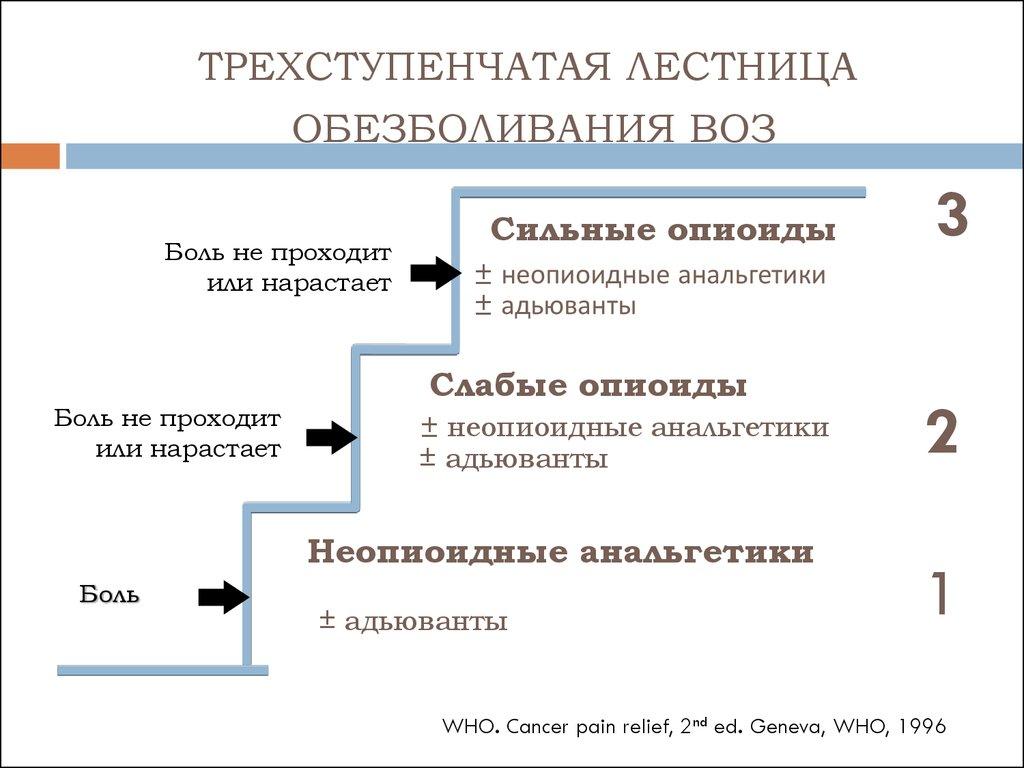
1-я ступень НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
2-я ступень СЛАБЫЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
3-я ступень СИЛЬНОДЕЙСТВУЮЩИЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
В целом такая тактика лечения хронической боли позволяет достичь удовлетворительного обезболивания у 77-90% онкологических больных. В России зарегистрированы основные лекарственные препараты как из группы НПВП, так и из группы опиоидов для лечения хронической боли, рекомендуемые ВОЗ.
Для длительной плановой терапии предпочтительны в лекарственные формы продленного действия (депо-формы).
Применение НПВП показано на всех этапах терапии боли у онкологических больных. У больных с опухолями и/или метастазами, поражающими мягкие ткани и кости, всегда развивается выраженное перифокальное воспаление. В начале 70-х годов ХХ века было установлено, что болеутоляющее, жаропонижающее и противовоспалительное действие НПВП обусловлено подавлением синтеза простагландинов. НПВП снижают продукцию простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ).

На сегодня выделяют три изоформы ЦОГ. Считают, что избирательное угнетение ЦОГ-2 приводит к подавлению воспаления и боли. В то же время сохранение активности ЦОГ-1 определяет репаративные процессы в желудке, кровоток в почках. Было отмечено, что парацетамол и метамизол слабо влияют на синтез простагландинов в периферических тканях, но подавляют продукцию простагландинов в ЦНС. В последние годы появились сведения о том, что в ЦНС имеется третий, отличный от первых двух тип ЦОГ, названный ЦОГ-3. Ингибирование ЦОГ-3 головного мозга сопровождается подавлением боли и снижением температуры тела при лихорадке.
Все НПВП могут вызывать осложнения со стороны желудочно-кишечного тракта (ЖКТ): диспепсию, язвы, кровотечения и перфорацию верхних и нижних отделов ЖКТ, железодефицитную анемию.
Все НПВП могут оказывать негативное влияние на функцию почек и печени (особенно при наличии заболеваний последних), а в ряде случаев вызывать серьезные нефро- и гепатотоксические реакции.
Препараты группы противопоказаны при эрозивно-язвенных поражениях желудочно-кишечного тракта (ЖКТ) в стадии обострения, состояниях гипокоагуляции (в том числе при гемофилии, геморрагическом диатезе, тромбоцитопении), при бронхиальной астме, тяжелой хронической сердечной недостаточности, гиповолемии, тяжелой почечной и печеночной недостаточности, состояниях, сопровождающихся гиперкалиемией, могут вызвать обострение и осложнения воспалительных заболеваний кишечника (ВЗК).
НПВП могут вызывать кожные реакции и бронхоспазм. Риск развития осложнений со стороны указанных органов и систем существенно отличается при использовании различных НПВП. Для предотвращения осложнений необходим учет факторов риска и выбор наиболее безопасного НПВП.
Для снижения риска развития НПВП гастропатии необходимо дополнительное назначение препаратов из группы ингибиторов протонной помпы и применение низких доз аспирина для снижения риска кардиоваскулярных осложнений. В настоящее время НПВП классифицируются по степени селективности ингибирующей активности в отношении разных изоформ ЦОГ.
Литература:
- Исакова М.Е. Болевой синдром в онкологии. — М.: Практическая медицина, 2011. — 384 с.
- Каприн А.Д., Абузарова Г.Р., Хороненко В.Э. и др. Фармакотерапия хронического болевого синдрома у онкологических пациентов. Медицинская технология. — М.: МНИОИим. П.А. Герцена, 2015. — 48 с.
- Машфорт М.Л., Купер М.Г., Кохен М.Л. и др. Боль и аналгезия. Руководство для практикующих врачей / Перевод сангл. А.Н. Редькин; ред. рус. изд. Бунятян А.А., НасоновЕ.Л., Никода В.В. — М.: Литтерра, 2004. — 488 с.
- Новиков Г.А., Осипова Н.А. Лечение хронической боли онкологического генеза: учебное пособие. Москва. — 83 с.
- Новиков Г.А. Контроль симптомов в паллиативной медицине. — М.: ГЭОТАР-Медиа, 2013. — 248 с.
- Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы клинического применения наркотических и ненаркотических аналгетических средств при острой и хронической боли. Методические указания. Практическое руководство для врачей. М., 2005. — 79 с.
- Штрибель Х.В. Терапия хронической боли. Практическое руководство / Пер. с нем.; ред. Осипова Н.А., ДаниловаА.Б., Осипова В.В. — М.: ГЭОТАР-Медиа, 2005. — 303 с.
- Ahmedzai S.H., Leppert W., Janecki M., Pakosz A., LomaxM., Duerr H., Hopp M.
- Long-term safety and efficacy of oxycodone/naloxoneprolonged-release tablets in patients with moderate-to-severechronic cancer pain. Support Care Cancer. 2015 Mar; 23 (3):823-30.
- Caraceni A., Hanks G., Kaasa S. et al. Use of opioid analgesicsin the treatment of cancer pain: evidence-basedrecommendations from the EAPC // Lancet Oncol. 2012 Feb;13 (2): e 58-68.
- Mystakidou K., Parpa E., Tsilika E. et al. Pain management ofcancer patients with transdermal fentanyl: a study of 1828 stepI, II, & III transfers. // J. Pain. 2004; 5: 119–13212. Skaer T.L. Transdermal opioids for cancer pain. // HealthQual. Life Outcomes. 2006 Mar 31; 4: 2413. World Health Organization. Cancer pain relief: with a guide toopioid availability. 2. Geneva: WHO; 1996.14. Zech D.F., Grond S., Lynch J., Hertel D., Lehmann K.A.Validation of World Health Organization guidelines forcancer pain relief: A 10-year prospective study. Pain. 1995;63: 65–76.
Читайте также:





