Аутоиммунная гемолитическая анемия может перейти в лейкоз








Случай манифестации острого лейкоза в виде аутоиммунной гемолитической анемии
Актуальность проблемы острый лейкоз представляет собой редкое заболевание - лишь 3% от всех злокачественных опухолей человека, прогрессирующее течение заболевания при отсутствии своевременной диагностики на ранних этапах неизбежно ведущее к смерти больного, диктует необходимость знания диагностики данной патологии врачами любой специальности.
В настоящее время от 10 до 80% больных (в зависимости от возраста, формы заболевания, группы риска) могут рассчитывать на длительную выживаемость и выздоровление.
ОЛ составляет 2-3% злокачественных опухолей человека. Заболеваемость ОЛ в среднем составляет 3-5 случаев на 100 тысяч населения. В 75% случаев заболевание диагностируется у взрослых, в 25%- у детей. Среднее соотношение миелоидных и лимфоидных ОЛ составляет 6:1. у взрослых старше 40 лет 80% составляют миелоидные, у детей 80-90% - лимфоидные формы ОЛ.
Острые лейкозы представляют собой гетерогенную группу опухолевых заболеваний системы крови, характеризующаяся клональным поражением красного костного мозга морфологически незрелым кроветворными клетками с вытеснением его нормальных элементов и инфильтрацией различных тканей и органов [3,5] .
Аутоиммунные гемолитические анемии (ЛИГА) - группа заболеваний, обусловленных выработкой аутоантител против антигенов эритроцитов В результате происходит ускоренное разрушение эритроцитов, аутосенсибилизированных иммуноглобулинами различных классов и комплементом .
Выделяют острый лимфобластный и нелимфобластный лейкозы.
Острый лимфобластный лейкоз (ОЛЛ) и острый миелобластный (или миелоидный) лейкоз (ОМЛ) - это рак кроветворной системы.[2]
Острый лейкоз возникает вследствие мутации клоногенной кроветворной клетки, что приводит к нарушению контроля над клеточным циклом, изменению транскрипции и продукции ряда ключевых белков. В результате бесконтрольной пролиферации в отсутствие дифференцировки происходит накопление патологических клеток. В большинстве случаев конкретная причина острого лейкоза остается неизвестной. К факторам, значительно повышающим риск развития заболевания, относятся генетические нарушения и повышенная хромосомная нестабильность (синдром Дауна, врожденный агранулоцитоз, анемия Фанкони, синдром Вискотта-Олдрича, синдром Кляйефельтера), Т-лимфотропные вирусы, лучевая и химиотерапия, прием лекарственных средств, контакт с органическими растворителями, курение и др. [4,6]
Клинические проявления острого лейкоза обусловлены угнетением нормального кроветворения вследствие лейкемической инфильтрации костного мозга. [3,5]
Классификации острых лейкозов
Различия между ОЛЛ и ОМЛ базируются на морфологических, цитохимических и иммунологических особенностях названных типов лейкозов. Точное определение типа лейкоза имеет первостепенное значение для терапии и прогноза. Как ОЛЛ, так и ОМЛ в свою очередь подразделяются на несколько вариантов согласно FAB- классификации (French-American-British). Так, существуют три варианта ОЛЛ - L1, L2, L3 и семь вариантов ОМЛ:
· М0 - недифференцированный ОМЛ;
· М1 - миелобластный лейкоз без созревания клеток;
· М2 - миелобластный лейкоз с неполным созреванием клеток;
· М3 - промиелоцитарный лейкоз;
· М4 - миеломоноцитарный лейкоз;
· М5 - монобластный лейкоз;
· М7 - мегакариобластный лейкоз.
Классификация ВОЗ (1979 год)
Данная классификация построена на выделении подгрупп заболеваний в зависимости от их клонального происхождения и прогностической значимости.
I. Острые миелоидные лейкозы.
1.ОМЛ с характерными цитогенетическими транслокациями:
- Острый промиелоцитарный лейкоз
- ОМЛ с патологической костномозговой эозинофилией
- ОМЛ с 11q23 (MLL) дефектами
2.ОМЛ с мультилинейной дисплазией:
-С предшествующим миелодиспластическим синдромом или миелодисплазией с миелопролиферацией.
- Без предшествующего миелодиспластического синдрома, но с диспластическими изменениями 50% клеток в двух и более миелоидных линиях.
3.Вторичные ОМЛ и миелодиспластический синдром, связанные с проходимым ранее лечением:
- Алкилирующими препаратами или облучением
- Ингибиторами топоизомеразы II
4.ОМЛ никак более не категоризованные:
- ОМЛ с минимальной дифференцировкой
- ОМЛ без созревания
- ОМЛ с созреванием
- Острый миеломоноцитарный лейкоз
- Острый монобластный/моноцитарный лейкоз
- Острый эритроидный лейкоз
- Острый мегакариобластный лейкоз
- Острый панциелоз с миелофиброзом
II. Острые лимфобластные лейкозы:
- ОЛЛ из предшественников В-клеток
- ОЛЛ из предшественников Т-клеток
- Острый лейкоз Беркита
Распространенность заболевания
ОЛЛ возникает в возрасте 2 - 10 лет (пик в 3 - 4 года), и распространенность заболевания снижается, однако после 40 лет отмечается повторный подъем. ОЛЛ составляет около 85% лейкозов, встречающихся у детей. Но ОМЛ встречается у взрослых, причем частота его увеличивается с возрастом.
Стадии острого лейкоза
1. Первая атака - период между первыми клиническими проявлениями заболевания, постановкой диагноза и достижением первой полной ремиссии. Эта стадия характеризуется увеличением числа бластных клеток в миелограмме 20% и в периферической крови, клиническими проявлениями болезни, связанными с замещением патологическим клоном нормальных ростков кроветворения, инфильтрацией опухолевыми клетками внутренних органов и опухолевой интоксикацией. Картина периферической крови вариабельна. В дебюте заболевания в периферической крови может наблюдаться анемия, тромбоцитопения (редко тромбоцитоз), лейкопения или нейтропения, гиперлейкоцитоз, сдвиг лейкоцитарной формулы до промиелоцитов или бластов, лейкемический провал (наличие зрелых клеток и бластов, с отсутствием промежуточных форм).
2. Клинико-гематологическая ремиссия - бластных клеток в миелограмме ‹ 5% и отсутствуют внекостномозговые очаги поражения. В начале ремиссии в организме больного остается большое количество резидуальных (остаточных) клеток (10 8 -10 10 ), которые не выявляются обычными морфологическими методами исследования, но могут быть идентифицированы с помощью молекулярно-генетических и иммунологических методов. В связи с этим можно выделить стадию минимальной остаточной болезни ОЛ. Постремиссионная терапия ОЛ по сути дела направлена на полную элиминацию остаточных лейкозных клеток. При сохранении ремиссии в течение 5 лет говорят о гематологическом выздоровлении от ОЛ.
3. Рецидив диагностируется при количестве бластов в костном мозге более 20%, имеет место неоднократное обнаружение бластов в крови, выявление внекостномозговых лейкемических очагов. Если рецидив возникает после первой ремиссии, говорят о первом рецидиве и т.п. при неэффективности курсов химиотерапии, развитии полиорганной недостаточности и неуклонной прогрессии опухолевого роста говорят о терминальной стадии ОЛ, подразумевая невозможность достижения ремиссии с помощью существующего на сегодняшний день арсенала методов лечения.
Клиническая симптоматика отдельных форм острого лейкоза
Симптомы ОЛ бывают многообразными из-за этого их можно представить в виде следующих больших синдромов:
* Гиперпластический синдром - синдромом лейкемической пролиферации он обусловлен опухолевым ростом как в костном мозге, так и вне его (метастазирование):
- увеличение селезенки, печени, лимфатических узлов (периферические, в средостении, брюшной полости) и миндалин;
- поражения кожи (кожные лейкозные инфильтраты - неспецифическая гемодермия или лейкемиды), мозговых оболочек (нейролейкоз или нейролейкемия), почек, миокарда и легких.
* Геморрагический синдром - возникновение от мелкоточечных и мелкопятнистых единичных или редких высыпаний на коже и слизистых оболочках до обширных кровоизлияний и профузных кровотечений (носовые, маточные, почечные, желудочно-кишечные и пр.).
* Интоксикационный синдром - снижение массы тела, лихорадка, поты, выраженная слабость.
Описано несколько случаев манифестации аутоиммунной гемолитической анемии на фоне острого миелобластического лейкоза [11]. P . Niscola и соавт. [12] приводят описание случая В-лимфобластного лейкоза, возникшего спустя 9 месяцев после постановки диагноза аутоиммунной гемолитической анемии. D . Deeren наблюдал пациента с В-лимфобластным лейкозом, у которого клиническая картина характеризовалась наличием симптомов аутоиммунной гемолитической анемии, купировавшейся на фоне ремиссии лейкоза [13]. Имеются данные о возникновении аутоиммунной гемолитической анемии у больных острым лимфобластным лейкозом во время проведения поддерживающей терапии или после трансплантации костного мозга. [14]
Хочу отметить, что острые лейкозы без лечения приводят к смертельному исходу в течение недель или месяцев. Но проводя лечение, прогноз, особенно для детей, часто становится благоприятным. При хронических лейкозах больные живут без лечения в течение нескольких месяцев и лет. Хронические лейкозы могут трансформироваться в неподдающиеся лечению острые формы (бластный криз).
Список литературы
1. Цветаева Н В , Колодей С В , Никулина О Ф , Хорошко Н Д Лечение острых форм аутоиммунных гемолитических анемий // Врач, 2003 , №11, с 32-34
2. Dipl. Biol. Maria Yiallouros, erstellt am: 2010/02/04, редактор: Dr. Natalie Kharina-Welke, Разрешение к печати: Prof. Dr. med. Günter Henze, Переводчик: Dr. Maria Schneider, Последнее изменение: 2017/08/10
3. Клиническая онкогематология: руководство для врачей /Под ред. Проф. М. А. Волковой(2-е изд.). – М.: ОАО Изд-во Медицина, 2007. – 1120 с.
4. Раимжанов, А.Р. Некоторые аспекты диагностики и лечения омурзаматова стрых лейкозов (литературный обзор) / А. Р. Раимжанов, И. А. Цопова, Ш.А. Мурзаматова // вестник КРСУ. – 2015. – Т.15, № 11. – С. 138 -143 .
5. Руководство по гематологии / Под. ред. А. И. Воробьева (4 изд.). – М.: Ньюдиамед, 2007. – 1275 с.
Аутоиммунные осложнения возникают при хроническом лимфолейкозе (ХЛЛ) значительно чаще, чем при других лимфопролиферативных процессах. Аутоиммунная гемолитическая анемия (АИГА) развивается в течение заболевания у 10—25 % больных хроническом лимфолейкозе, что в 8 раз превышает ее частоту при неходжкинских лимфомах.
С. Engelfriet и соавт. в большой работе об аутоиммунной гемолитической анемии показали, что хронический лимфолейкоз является самой частой причиной ее развития. При хроническом лимфолейкозе частота аутоиммунного гемолиза в 2 раза выше, чем при системной красной волчанке, занимающей второе место среди заболеваний, при которых часто развивается аутоиммунная гемолитическая анемия. Положительный антиглобулиновый тест (проба Кумбса) выявляется еще чаще—у 20—35 % больных.
Аутоиммунные осложнения могут развиться в любом периоде болезни. Имеются наблюдения, в которых аутоиммунная гемолитическая анемия явилась первым симптомом хронического лимфолейкоза. Так же, как инфекции, аутоиммунные процессы чаще возникают у больных с развернутой клинико-гематологической картиной ХЛЛ. Среди больных с аутоиммунными анемиями и тромбоцитопениями мы наблюдали 72 % больных с выраженными клинико-гематологическими проявлениями ХЛЛ.
Эти данные подтверждаются наблюдениями других исследователей. Так, Т. Hamblin и соавт. обнаружили положительную пробу Кумбса у 2,9 % больных в стадии А, у 10,5 % в стадии В и у 18,2 % при прогрессировании заболевания. В наблюдениях F. Mauro и соавт., включивших 1203 больных ХЛЛ, 90 % больных с АИГА имели признаки прогрессирования. Частота АИГА в их наблюдениях достоверно коррелировала с высотой лейкоцитоза.
Аутоиммунный гемолиз эритроцитов может иметь характер остро и бурно развившегося гемолитического криза, сопровождаясь повышением температуры тела, появлением желтушного окрашивания кожи и темной окраской мочи, повышением содержания непрямого билирубина в сыворотке крови. Однако такие кризы составляют небольшую часть от общего количества случаев аутоиммунного гемолиза. Нередко аутоиммунный гемолиз развивается постепенно, и анемия выражена не так значительно, как у больных с острым гемолитическим кризом.
В подобных случаях, как правило, в костном мозге нет значительного увеличения эритрокариоцитов и заметного ретикулоцитоза крови. Иногда ретикулоцитоз отсутствует и при бурных проявлениях гемолитической анемии, особенно если гемолизу подвергаются эритрокариоциты. Антитела, обнаруживаемые на эритроцитах при АИГА, чаще относятся к классу IgG и только у 10—15 % больных — к классу IgM. Показано, что при обнаружении IgG прогноз значительно лучше. Значительно реже, чем АИГА, развивается анемия, обусловленная парциальной красноклеточной аплазией (ПКА).
По данным Т. Hamblin и соавт., ПКА развивается в 1 %, по данным G. Chikkappa и соавт. — в 6 % случаев хронического лимфолейкоза. ПКА характеризуется тяжелой анемией со снижением гематокрита до 25—20 %, отсутствием ретикулоцитов в крови и практически полным отсутствием эритрокариоцитов в костном мозге. Нет достаточного количества исследований, позволяющих установить причину развития ПКА при ХЛЛ.

Иммунная тромбоцитопения встречается реже, чем АИГА, всего у 2-3 % больных хроническим лимфолейкозом. Она, тем не менее, может представлять большую опасность, чем АИГА, из-за возможных и действительно часто имеющих место жизненно опасных кровотечений или кровоизлияний в головной мозг, служащих причиной смерти больных. Аутоиммунная тромбоцитопения может развиться как самостоятельное осложнение, но часто она сочетается с АИГА.
Еще реже встречается аутоиммунная нейтропения. Описано обнаружение антител к нейтрофилам, однако аутоиммунный характер нейтропении пока убедительно не доказан.
Существуют разные гипотезы о причинах аутоиммунных конфликтов при хроническом лимфолейкозе, в частности о причинах аутоиммунной гемолитической анемии. Увеличение CD5+-лимфоцитов при ревматоидном артрите и других аутоиммунных заболеваниях позволило высказать предположение о роли этих лимфоцитов в возникновении аутоиммунного гемолиза, тем более что они могут продуцировать аутореактивные IgM-антитела. Однако этой гипотезе противоречит поликлоновый характер антиэритроцитарных антител при ХЛЛ.
Описаны случаи аутоиммунного гемолиза после лечения флударабином, который подавляет преимущественно продукцию CD4 -лимфоцитов. В связи с этим ряд авторов высказывают предположение о нарушении соотношения популяций Т-лим-фоцитов как причине развития антиэритроцитарных антител при ХЛЛ. Однако хорошо известно, что в ряде случаев аутоиммунный гемолиз развивался у больных после лечения алкилирующими препаратами, не вызывающими избирательного подавления каких-либо фракций Т-лимфоцитов. Таким образом, в настоящее время нет убедительной концепции о причине столь частого развития аутоиммунного гемолиза эритроцитов при ХЛЛ.
Точно так же нет каких-либо данных, позволяющих предположить причины аутоиммунной тромбоцитопении.

Редким аутоиммунным осложнением при хроническом лимфолейкозе является паранеопластическая пузырчатка. Этот синдром описан в 1990 г. G. J. Anhalt и соавт.. Ими же впервые доказана его аутоиммунная природа. До сих пор в связи с редкостью этого осложнения публикуется практически каждое наблюдение. Нам пришлось наблюдать лишь одного больного с этим осложнением.
Еще более выраженными являются поражения слизистой оболочки полости рта: утолщение и эрозии слизистых оболочек щек и языка, красной каймы губ. Эти изменения часто затрудняют речь и прием пищи. Такие же эрозии можно обнаружить на слизистых оболочках глотки, пищевода, трахеи. Как правило, имеется яркий безболезненный коньюнктивит. У некоторых больных развивается поражение бронхов и бронхиол, заканчивающееся облитерирующим бронхиолитом.
Паранеопластическая пузырчатка описана при разных опухолях, наиболее часто при неходжкинских лимфомах, хронический лимфолейкоз и болезни Кастлемана. На хронический лимфолейкоз приходится около 30 % всех описанных случаев. Причины развития аутоиммунного конфликта неизвестны.
Лечение включает кортикостероидные гормоны (в расчете на преднизолон по 1 мг/кг в сутки), циклоспорин А, мабтеру, плазмаферез, но главным является незамедлительное лечение онкологического заболевания, которым страдает больной. Даже после успешного лечения основного заболевания симптомы паранеопластической пузырчатки исчезают очень медленно. Может наступить рецидив при ухудшении течения основного заболевания. При легочном поражении единственным эффективным методом лечения является трансплантация. Из описанных разными клиниками случаев 90 % закончились летально.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Аутоиммунная гемолитическая анемия вызывается антителами, которые взаимодействуют с эритроцитами при температуре 37 °С (гемолитическая анемия с тепловыми антителами) или температуре 75 г/л). Антитела при данной форме анемии представлены IgM. Степень гемолиза более выражена, чем выше температура (ближе к нормальной температуре тела), при которой эти антитела реагируют с эритроцитами.
Пароксизмальная холодовая гемоглобинурия (ПХГ, синдром Доната-Ландштейнера) является редким типом болезни Холодовых агглютининов. Гемолиз провоцируется охлаждением, которое может быть даже локальным (например, при употреблении холодной воды, мытье рук холодной водой). Аутогемолизины IgG связываются с эритроцитами при низкой температуре и вызывают внутрисосудистый гемолиз после согревания. Это происходит наиболее часто после неспецифической вирусной инфекции или у здоровых людей, встречается у больных с врожденным либо приобретенным сифилисом. Выраженность и быстрота развития анемии варьирует и может иметь фульминантное течение.
Симптомы аутоиммунной гемолитической анемии
Симптомы гемолитической анемии с тепловыми антителами обусловлены наличием анемии. При выраженном заболевании наблюдается повышение температуры тела, боли в грудной клетке, обмороки, признаки сердечной недостаточности. Умеренно выраженная спленомегалия является типичным явлением.
Болезнь Холодовых агглютининов проявляется в виде острой или хронической формах. Могут присутствовать и другие криопатические симптомы (например, акроцианоз, феномен Рейно, окклюзивные нарушения, ассоциированные с холодом). Симптомами ПНГ могут быть выраженная боль в спине и нижних конечностях, головная боль, тошнота, диарея, темно-коричневого цвета моча; может встречаться спленомегалия.
Диагностика аутоиммунной гемолитической анемии
АИГА предполагается у больных с гемолитической анемией, особенно при выраженных симптомах и наличии других характерных проявлений. Рутинные лабораторные тесты обычно подтверждают наличие внесосудистого гемолиза (например, отсутствие гемосидеринурии, нормальный уровень гаптоглобина), если анемия не проявляется внезапно и интенсивно или ее причиной является ПНГ. Типичными особенностями являются сфе-роцитоз и высокий показатель МСНС.
АИГА диагностируется при определении аутоантител с помощью прямого ан-тиглобулинового теста (Кумбса). Анти-глобулиновая сыворотка добавляется к отмытым эритроцитам больного; наличие агглютинации указывает на присутствие иммунолобулина, обычно IgG, или СЗ-компонента комплемента, связанных с поверхностью эритроцита. Чувствительность теста для АИГА около 98 %. Если титр антител очень низкий или если антителами являются IgA и IgM, возможны ложноотрицательные результаты тестов. В целом интенсивность прямого антиглобулинового теста коррелирует с числом молекул IgG или С3-компонента комплемента, связанных с мембраной эритроцита, и ориентировочно со степенью гемолиза. Непрямой антиглобулиновый тест (Кумбса) состоит в смешивании плазмы больного с нормальными эритроцитами для определения наличия антител в плазме. Позитивный непрямой антиглобулиновый тест и негативный прямой обычно указывает на наличие аллоантител, вызванных беременностью, предварительными трансфузиями или перекрестной реактивностью лектинов, а не наличием аутоиммунного гемолиза. Необходимо учитывать, что само по себе обнаружение тепловых антител не определяет наличие гемолиза, так как 1/10 000 нормальных доноров крови имеет позитивный тест на эти антитела.
При установлении с помощью теста Кумбса диагноза аутоиммунной гемолитической анемии необходимо произвести дифференциальную диагностику между гемолитической анемией с тепловыми антителами и болезнью с Холодовыми агглютининами, так же как и определить механизм, ответственный за гемолитическую анемию с тепловыми антителами. Эта диагностика часто может быть выполнена с помощью прямой антиглобулиновой реакции. Возможны три варианта:
- реакция позитивна с анти-lgG и негативна с анти-СЗ. Эта модель типична при идиопатической аутоиммунной гемолитической анемии, а также при лекарственном или метилдопа типе аутоиммунной гемолитической анемии, обычно при гемолитической анемии с тепловыми антителами;
- реакция позитивна с анти-lgG и анти-СЗ. Эта модель типична в случаях с СКВ или идиопатической аутоиммунной гемолитической анемии с тепловыми антителами и реже при лекарственно-ассоциированных случаях;
- реакция позитивна с анти-СЗ и негативна с анти-lgG. Это проявляется при идиопатической аутоиммунной гемолитической анемии с тепловыми антителами, когда имеются IgG низкой аффинности, в отдельных лекарственно-ассоциированных случаях, при болезни Холодовых агглютининов, пароксизмальной холодовой гемоглобинурии.
Другие диагностические исследования, применяемые при аутоиммунной гемолитической анемии, обычно не дают определенного результата. При болезни Холодовых агглютининов эритроциты агглютинируют в мазках крови, и автоматические анализаторы часто определяют повышение индекса MCV и ложно низкие уровни гемоглобина. После согревания рук и последующего пересчета результатов показатели изменяются в сторону их нормализации. Дифференциальная диагностика между гемолитической анемией с тепловыми антителами и болезнью Холодовых агглютининов может быть произведена с помощью определения температуры, при которой прямой антиглобулиновый тест является позитивным. Если тест позитивен при температуре > 37 °С, это указывает на гемолитическую анемию с тепловыми антителами, тогда как позитивный тест при низкой температуре указывает на болезнь Холодовых агглютининов.
Если подозревается наличие ПХГ, необходимо выполнить тест Доната - Ландштейнера, который является специфичным для ПХГ. Рекомендуется проведение лабораторных тестов на сифилис.

[5], [6], [7], [8], [9], [10], [11], [12], [13]
Что такое аутоиммунная гемолитическая анемия?
Аутоиммунная гемолитическая анемия — это аутоиммунное заболевание, характеризующееся преждевременным разрушением здоровых эритроцитов (клеток крови) аутоантителами.
Аутоиммунные заболевания возникают, когда естественная защита организма от чужеродных организмов (например, лимфоцитов, антител) разрушает здоровые ткани по неизвестным причинам. Обычно эритроциты имеют продолжительность жизни около 120 дней, прежде чем будут удалены селезенкой.
Медицинским термином для низких уровней циркулирующих эритроцитов является анемия. Анемия может вызывать усталость, бледный цвет кожи, пожелтение кожи и белых глаз (желтуха) и отток крови в моче (гемоглобинурия), что придаст моче темно-коричневый цвет.
Признаки и симптомы
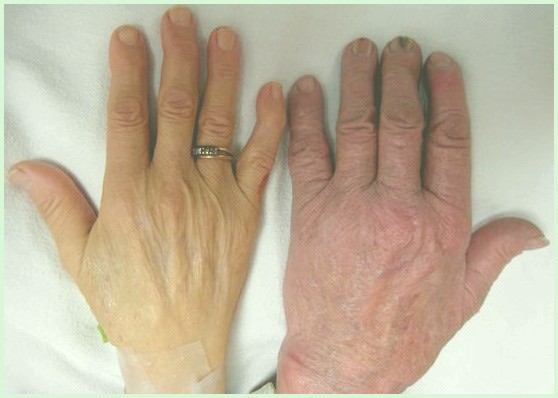
Симптомы аутоиммунной гемолитической анемии обычно развиваются медленно в течение периода от нескольких недель до месяцев, но в некоторых случаях могут развиваться внезапно в течение нескольких дней.
Конкретные симптомы, которые возникают, могут варьироваться от одного человека к другому и могут зависеть от скорости возникновения, скорости разрушения здоровых эритроцитов и наличия основного расстройства.
Некоторые люди, особенно те, у кого постепенно развивается анемия, могут не иметь каких-либо явных симптомов. У пострадавших людей могут в конечном итоге развиться:
- ненормальная бледность кожи;
- усталость;
- затрудненное дыхание при физической нагрузке;
- головокружение;
- учащенное сердцебиение.
Желтизна кожи и белых глаз (желтуха) и увеличение селезенки (спленомегалия) также часто встречаются у людей с аутоиммунной гемолитической анемией.
Спленомегалия может привести к тому, что у пострадавшего появится вздутие живота или ощущение полного отека в животе. Иногда у некоторых людей может происходить увеличение печени (гепатомегалия).
У людей с тяжелыми случаями, особенно с быстрым (острым) началом, могут развиться более серьезные осложнения, в том числе потеря сознания (обмороки), боль в груди (стенокардия), аномально быстрое сердцебиение (тахикардия) и сердечная недостаточность.
Причины аутоиммунной гемолитической анемии
Причина аутоиммунной гемолитической анемии обычно неизвестна (т. е. идиопатическая). Однако расстройство может возникать как часть более крупного расстройства, эти случаи известны как вторичная аутоиммунная гемолитическая анемия.
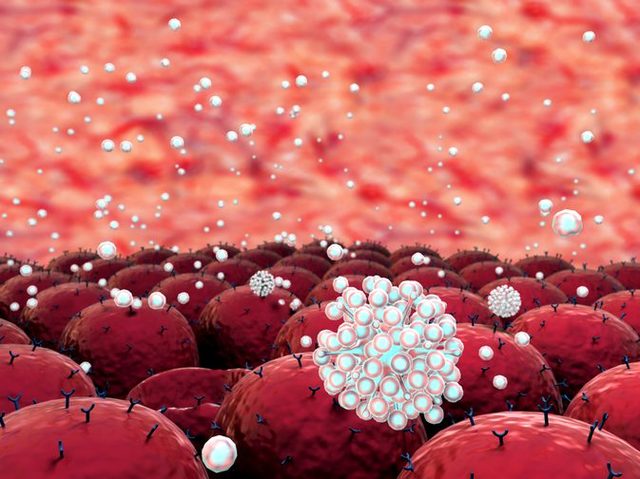
Аутоиммунная гемолитическая анемия является аутоиммунным расстройством — расстройством, при котором естественная защита организма от вторжения организмов (например, лимфоцитов, антител) разрушает здоровые ткани по неизвестным причинам. Антитела ошибочно атакуют здоровые эритроциты, вызывая преждевременное разрушение клеток, состояние, называемое гемолизом.
Антитела (которые также известны как иммуноглобулины) представляют собой специализированные белки, которые связываются с инвазивными организмами и вызывают их разрушение. Существует пять основных классов антител – IgA, IgD, IgE, IgG и IgM.
Большинство случаев данной анемии происходят из-за антител IgG, которые по ошибке атакуют здоровые эритроциты. Реже антитела IgM или IgA вызывают расстройство. Когда антитела атакуют здоровые ткани, их можно назвать аутоантителами.
Несколько основных расстройств связанных с гемолитической анемией, включают другие аутоиммунные расстройства, такие как системная красная волчанка и расстройства, характеризующиеся перепроизводством лейкоцитов (лимфопролиферативные расстройства), такие как лейкемия или лимфома.
Вторичная аутоиммунная гемолитическая анемия также может возникнуть как побочный эффект некоторых лекарств.
Затронутые группы населения
Гемолитическая анемия поражает мужчин и женщин в равных количествах. По оценкам, аутоиммунные гемолитические анемии затрагивают 1-3 человека на 100 000 населения в целом. У людей любого возраста, включая детей, может развиться данная болезнь, однако чаще она встречается у взрослых с пиковой заболеваемостью в возрасте 50-70 лет.
Диагностика
Диагноз гемолитической анемии можно заподозрить на основании тщательной клинической оценки, детальной истории болезни, выявления характерных симптомов и различных анализов, таких как анализы крови, которые измеряют гемоглобин и гематокрит. Гемоглобин — белок в красных кровяных клетках, который переносит кислород. Гематокрит — процент от общего объема крови, занимаемый эритроцитами.
Анализы крови могут также показать повышенный уровень незрелых эритроцитов (ретикулоцитов), который происходит, когда организм вынужден производить дополнительные эритроциты, чтобы восполнить те, которые преждевременно разрушились. Некоторые люди с гемолитической анемией имеют повышенный уровень билирубина в крови (гипербилирубинемия). Билирубин — желтоватый продукт, образующийся при метаболизме гемоглобина в печени.
Когда предполагается, что анемия вызвана дисфункцией иммунной системы (т. е. аутоиммунная гемолитическая анемия), могут проводиться специализированные тесты, такие как проба Кумбса. Этот анализ проводиться для обнаружения антител, которые действуют против эритроцитов. Образец крови берется и затем подвергается воздействию реагента Кумбса. Если эритроциты слипаются в присутствии реагента то, это указывает на наличие у пациента заболевания.
Лечение аутоиммунной гемолитической анемии
Лечение аутоиммунной гемолитической анемии является симптоматическим и поддерживающим. Пострадавших людей обычно лечат кортикостероидными препаратами, такими как преднизон, и обычно они контролируют болезнь при правильном лечении. Первоначально может быть рекомендована высокая доза этих лекарств с последующим постепенным снижением дозы в течение следующих нескольких недель или месяцев.
Людям, которые не отвечают на терапию кортикостероидами или развивают непереносимые побочные эффекты, могут быть назначены иммунодепрессанты или хирургическое удаление селезенки (спленэктомия). Иммуносупрессивные лекарственные средства, такие как циклофосфамид, представляют собой лекарственные средства, которые подавляют или блокируют иммунную систему, и помогают некоторым людям с гемолитической анемией, которые не реагируют на преднизон или спленэктомию.
Спленэктомия обычно используется у людей с тяжелыми случаями, которые требуют постоянного преднизона для контроля. У пациентов с основным нарушением лечение этого расстройства обычно приводит к заметному улучшению анемии.
Ритуксимаб — это моноклональное антитело, искусственно созданное антитело, которое нацелено на определенные лейкоциты, которые создают антитела, которые преждевременно разрушают эритроциты. Ритуксимаб оказался полезным для некоторых пациентов с аутоиммунной гемолитической анемией, которые не реагировали на преднизон. Уровень ответов может достигать 80% у взрослых и 60% у детей. Ритуксимаб может быть использован до спленэктомии или может использоваться у людей, у которых наблюдается рецидив после спленэктомии.
Переливание эритроцитов также может быть необходим для поддержания надлежащего уровня эритроцитов у людей с тяжелыми случаями. Этот поддерживающий метод обеспечивает временное облегчение состояния, но не лечит основную причину расстройства.
Профилактика
Предотвратить аутоиммунную гемолитическую анемию не возможно, но врачи могут помочь людям, у которых есть вирусная инфекция или которые используют определенные лекарства, чтобы болезнь не развивалась.
Тяжелая анемия может усугубить многие проблемы, такие как болезни сердца и легких. Люди должны обратиться к врачу, если они испытывают какие-либо симптомы, которые могут указывать на гемолитическую анемию.
Читайте также:

