Алексеев б я рак предстательной железы
Ученый секретарь Российского общества онкоурологов, член Европейской ассоциации урологов (EAU) и Международного общества урологов (SIU).
Член научного совета Международного Агентства по Изучению Рака (МАИР).
Заведующий кафедрой онкологии Института медико-социальных технологий.
С 2009 г. заведующий курсом онкоурологии кафедры урологии ФПК МР РУДН.
С 2013 г. член экспертного совета ВАК при Министерстве образования и науки Российской Федерации по хирургическим наукам.
Б. Я. Алексеев является высококвалифицированным специалистом – онкоурологом, выполняет широкий спектр оперативных вмешательств на всех органах мочевыделительной и мужской половой системы, им разработаны и внедрены высокотехнологичные методы хирургического и малоинвазивного лечения онкоурологических больных. Б. Я. Алексеевым предложены новые методики оперативного лечения больных раком предстательной железы, которые защищены патентами РФ, оригинальные способы лапароскопических хирургических вмешательств при опухолях почки, надпочечника, предстательной железы. Под руководством Б. Я. Алексеева проводятся научные исследования по разработке и усовершенствованию методов диагностики и лечения рака предстательной железы, почки, мочевого пузыря, яичка и надпочечников, по изучению молекулярно-генетических маркеров у онкоурологических больных, по внедрению оригинальных лапароскопических и малоинвазивных методов лечения в онкоурологии, комбинированных и реконструктивно-пластических операций при опухолях малого таза.
В качестве главного исследователя Б. Я. Алексеев участвует в проведении более 30 международных научных исследований, регулярно выступает с докладами на конференциях в России и за рубежом.
Под научным руководством Б. Я. Алексеева защищены 13 диссертационных работ на соискание ученой степени кандидата медицинских наук, 1 диссертация на соискание степени доктора медицинских наук.
- КЛЮЧЕВЫЕ СЛОВА: Алексеев, интервью, онкоурология
– Прежде всего совершенствование ранней диагностики и улучшение результатов лечения, в том числе путем внедрения в клиническую практику новейших методов, продемонстрировавших свою эффективность в фундаментальных и клинических исследованиях.
– Распространенность анализа крови на простатический специфический антиген способствовала диагностированию клинически незначимого рака предстательной железы. Эта опухоль имеет низкую вероятность прогрессирования до клинических симптомов и/или летального исхода. Имеющиеся в распоряжении врача методы диагностики не всегда позволяют разграничить клинически незначимый рак и потенциально летальную опухоль. Использование генетических методов, а также методов протеомного анализа позволит стратифицировать больных на группы прогноза течения заболевания и уже обоснованно обратиться к активному лечению или ограничиться наблюдением (малоинвазивным лечением).
– На сегодняшний день существует большое количество препаратов для консервативной терапии онкоурологических заболеваний. Выбрать оптимальный препарат порой бывает очень сложно, поскольку в некоторых случаях необходимо определить предикторы чувствительности к инновационному лекарственному средству. Выявлением и изучением клинических, биохимических и молекулярно-генетических предикторов мы сейчас и занимаемся.
Благодаря достижениям молекулярной биологии созданы новые классы препаратов для лечения рака почки (ингибиторы ангиогенеза) и предстательной железы (антиандрогены и химиопрепараты нового поколения), разрабатываются вакцины от рака.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Ключевые слова: рак предстательной железы, радикальная простатэктомия, дистанционная лучевая терапия, брахитерапия.
Для цитирования: Алексеев Б.Я., Нюшко К.М., Крашенинников А.А., Воробьев Н.В., Сафронова Е.Ю., Калпинский А.С., Сергиенко С.А., Тараки И.А., Темиргереев М.З., Каприн А.Д. Хирургическое лечение больных локализованным и местнораспространенным раком предстательной железы: результаты одноцентрового исследования. РМЖ. 2017;27:2019-2025
Surgical treatment of patients with localized and locally advanced prostate cancer: the results of a single center study
B.Ya. Alekseev, K.M. Nyushko, A.A. Krasheninnikov, N.V. Vorobiev, E.Yu. Safronova, A.S. Kalpinskiy, S.A. Sergienko, I.A. Taraki, M.Z. Temirgereev, A.D. Kaprin
National Medical Research Radiological Center, Moscow
Key words: prostate cancer, radical prostatectomy, remote radiation therapy, brachytherapy.
For citation: Alekseev B.Ya., Nyushko K.M., Krasheninnikov A.A. et al. Surgical treatment of patients with localized and locally advanced prostate cancer: the results of a single center study // RMJ. 2017. № 27. P. 2019–2025.
Представлены результаты исследования хирургического лечения больных локализованным и местнораспространенным раком предстательной железы. Преимуществами хирургического лечения является возможность точного стадирования и выявления неблагоприятных патоморфологических факторов, что позволяет выработать рациональную тактику лечения. У больных с неблагоприятными послеоперационными факторами прогноза рекомендовано рассмотрение вопроса о проведении адъювантной терапии с целью улучшения показателей выживаемости.
Только для зарегистрированных пользователей
You’re currently using an unsupported browser.
Please upgrade to one of the following supported, modern browsers. It’s easy and free.
Продолжая использовать этот веб-сайт, Вы соглашаетесь с политикой конфиденциальности.
Настоящим я даю свое согласие на обработку моих персональных данных (при условии их предоставления). С условиями предоставления согласия на обработку моих персональных данных и правом на отзыв моего согласия на обработку персональных данных ознакомлен(-а).
Этот веб-сайт использует файлы cookie, чтобы сделать контент более интересным и подходящим для Вас.
понедельник, 16 апреля 2018
Вебинар Б.Я. Алексеева «Современные подходы к гормональной терапии рака предстательной железы*
Лекция была направлена на аудиторию онкоурологов, урологов и онкологов, которые занимаются ведением пациентов с метастическим и местно-распространенным раком предстательной железы (РПЖ). Профессор Алексеев охватил множество вопросов, которые встают перед лечащим врачом, назначающим гормональную терапию (ГТ) больному РПЖ — это и проблемы выбора препарата для андрогенной депривации, методы достижения наилучшего эффекта при проведении ГТ, а именно, быстрое снижение тестостерона до кастрационных значений, а также вопросы минимазации побочных эффектов и осложнений, которые нередко возникают при проведении такой терапии.
В докладе Борис Яковлевич отметил преимущества терапии дегареликсом**, единственным на сегодняшний день зарегистрированным в России препаратом из класса антагонистов ЛГРГ, — немедленная супрессия тестостерона, в отличие от отложенного эффекта, который характерен для группы агонистов ЛГРГ, увеличение времени до биохимического прогрессирования, а также увеличение безрецидивной выживаемости.
Кроме того, профессор рассказал о международных рекомендациях по проведению комбинированного лечения больных РПЖ, а также новейших подходах к терапии больных метастическим РПЖ с использованием химиотерапии и антиандрогенов последнего поколения.
Посмотреть запись трансляции Вы можете по ссылке.
О компании Ferring Pharmaceuticals
Ferring Pharmaceuticals – биофармацевтическая компания, которая занимается поиском, разработкой и реализацией инновационных продуктов в таких областях, как охрана репродуктивного здоровья, онкология, урология, гастроэнтерология, эндокринология и ортопедия. Исследовательская деятельность и продукция компании связаны единой целью – создавать специализированные препараты, способные бороться с различными заболеваниями и патологиями, используя ресурсы и функциональный потенциал организма. Подразделения маркетинга, медицинских услуг, розничных и оптовых продаж компании Ferring работают почти в 60 странах, а управление осуществляется из головного офиса в городе Сент-Пре в Швейцарии.
Компания Ferring разрабатывает и производит препараты для лечения рака предстательной железы. Симптомы этого заболевания на ранних стадиях практически не проявляются, и часто обнаруживаются в ходе рутинной проверки. Варианты лечения зависят от стадии рака на момент постановки диагноза. Основным методом лечения гормонозависимого рака предстательной железы является андрогенная депривация, направленная на достижение кастрационного уровня тестостерона и минимизацию рисков прогрессирования болезни.
*Представленная информация отражает мнение отдельных медицинских специалистов, носит научный характер и адресована исключительно вниманию медицинских специалистов, не является рекламой и не гарантирует безопасности и/или эффективности указанных в информации лекарственных препаратов. По всем вопросам, связанным с назначением и/или применением указанных лекарственных препаратов, необходима обязательная предварительная консультация с медицинскими специалистами.
**Дегареликс включен в перечень ЖНВЛП на 2018 г. Распоряжением Правительства РФ от 23.10.2017 № 2323-p
ЛГРГ: лютеинизирующий гормон рилизинг-гормон.
Полный текст:
Рак предстательной железы (РПЖ) является одной из актуальных проблем современной онкоурологии. Заболеваемость данной патологией неуклонно растет во всем мире. Несмотря на широкое использование ПСА-диагностики и введения программ, направленных на раннее выявление данного заболевания, частота диагностики запущенных форм РПЖ остается высокой. Кроме того, ряд аспектов терапии данного заболевания до настоящего момента остается спорным. С 3 по 5 октября 2012 г. в Москве состоялся VII конгресс Российского общества онкоурологов, на котором освещались некоторые вопросы комбинированного лечения местно-распространенных форм РПЖ. В статье освещен ряд спорных вопросов при проведении терапии больных РПЖ в различных клинических ситуациях.
1. Yossepowitch O., Eggener S.E., Bianco F.J. Jr et al. Radical prostatectomy for clinically localized, high risk prostate cancer: critical analysis of risk assessment methods. J Urol 2007;178(2):493−9.
2. D’Amico A.V., Whittington R., Malkowicz S.B. et al. Pretreatment nomogram for prostate-specific antigen recurrence after radical prostatectomy or external-beam radiation therapy for clinically localized prostate cancer. J Clin Oncol 1999; 17(1):168−72.
3. Lawton C.A., Winter K., Murray K. et al. Updated results of the phase III Radiation Therapy Oncology Group (RTOG) trial 85-31 evaluating the potential benefit of androgen suppression following standard radiation therapy for unfavorable prognosis carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001;49(4):937−46.
4. Pilepich M.V., Winter K., John M.J. et al. Phase III radiation therapy oncology group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001;50(5):1243−52.
5. Bolla M., Gonzalez D., Warde P. et al. Improved survival in patients with locally advanced prostate cancer treated with radiotherapy and goserelin. N Engl J Med 1997;337(5):295−300.
6. Hanks G.E., Lu J., Machtay M. et al. RTOG protocol 92-02: A phase III trial of the use of long term androgen suppression following neoadjuvant hormonal cytoreduction and radiotherapy in locallyadvanced carcinoma of the prostate. Proc Am Soc Clin Oncol 2000:19:1284.
7. Ward J.F., Slezak J.M., Blute M.L. et al. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing: 15-year outcome. BJU Int 2005;95(6):751−6.
8. Weckermann D., Hamm M., Dorn R. et al. Sentinel lymph node dissection in prostate cancer. Experience after more than 800 interventions. Urologe A 2006;45(6):723−7.
9. Klevecka V., Musch M., Roggenbuck U. et al – Extended pelvic node dissection allows better identification of lymph node metastasis in patients with clinically localized prostate cancer. J Urol 2006;175:450.
10. Heidenreich A., Von Klobloch R., Varga Z. et al. Extended pelvic lymphadenectomy in men undergoing radical retropubic prostatectomy (RRP) – an update on > 300 cases. J Urol 2004;171:312.
11. Bader P., Burkhard F.C., Markwalder R., Studer U.E. Disease progression and survival of patients with positive lymph nodes after radical prostatectomy. Is there a chance of cure? J Urol 2003;169(3):849−54.
12. Schulman C.C., Debruyne F.M., Forster G. et al. 4-Year follow-up results of a European prospective randomized study on neoadjuvant hormonal therapy prior to radical prostatectomy in T2-3N0M0 prostate cancer. European Study Group on Neoadjuvant Treatment of Prostate Cancer. Eur Urol 2000; 38(6):706−13.
13. Soloway M.S., Pareek K., Sharifi R. et al. Neoadjuvant androgen ablation before radical prostatectomy in cT2bNxMo prostate cancer: 5-year results. J Urol 2002;167(1):112−6.
14. Gleave M.E., Goldenberg S.L., Chin J.L. et al. Randomized comparative study of 3 versus 8-month neoadjuvant hormonal therapy before radical prostatectomy: biochemical and pathological effects. J Urol 2001;166(2):500−6.
15. Messing E.M., Manola J., Yao J. et al. Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 2006;7(6):472−9.
16. Ghavamian R., Bergstralh E.J., Blute M.L. et al. Radical retropubic prostatectomy plus orchiectomy versus orchiectomy alone for pTxN+ prostate cancer: a matched comparison. J Urol 1999;161:1223−8.
17. Dorff T.B., Flaig T.W., Tangen C.M. et al. Adjuvant androgen deprivation for high-risk prostate cancer after radical prostatectomy: SWOG S9921 study. J Clin Oncol 2011; 29(15):2040−5.
18. Wiegel T., Bottke D., Steiner U. et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 2009;27:2924−30.
19. Bolla M., Van Poppel H., Collette L. et al. Postoperative radiotherapy after radical prostatectomy: a randomized controlled trial (EORTC trial 22911). Lancet 2005;366:572−8.
20. Nudell D.M., Grossfeld G.D., Weinberg V.K. et al. Radiotherapy after radical prostatectomy: treatment outcomes and failure patterns. Urology 1999;54(6):1049−57.
21. Zietman A.L., Prince E.A., Nakfoor B.M.et al. Androgen deprivation and radiation therapy. Int J Radiat Oncol Biol Phys 1997; 38(5):1067−70.
22. Roach M. 3rd, Bae K., Speight J. et al. Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: long-term results of RTOG 8610. J Clin Oncol 2008; 26(4):585−91.
23. Porter A.T., Elhilali M., Manji M. et al. A phase III randomized trial to evaluate the efficacy of neoadjuvant therapy prior to curative radiotherapy in locally advanced prostate cancer patients. A Canadian Urologic Oncology Group study. Proc Am Soc Clin Oncol 1997;16 (Abstr. 1123).
24. Denham J.W., Steigler A., Lamb D.S. et al. Short-term androgen deprivation and radiotherapy for locally advanced prostate cancer: results from the Trans-Tasman Radiation Oncology Group 96.01 randomised cont rolled trial. Lancet Oncol 2005; 6(11):841−50.
25. Bolla M., de Reijke T.M., Van Tienhoven GEORTC Radiation Oncology Group and Genito-Urinary Tract Cancer Group. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009;360(24):2516−27.
Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Рак предстательной железы (РПЖ) является одной из актуальных проблем современной онкоурологии. Заболеваемость данной патологией неуклонно растет во всем мире. Несмотря на широкое использование ПСА-диагностики и введения программ, направленных на раннее выявление данного заболевания, частота диагностики запущенных форм РПЖ остается высокой. Кроме того, ряд аспектов терапии данного заболевания до настоящего момента остается спорным. С 3 по 5 октября 2012 г. в Москве состоялся VII конгресс Российского общества онкоурологов, на котором освещались некоторые вопросы комбинированного лечения местно-распространенных форм РПЖ. В статье освещен ряд спорных вопросов при проведении терапии больных РПЖ в различных клинических ситуациях.
1. Yossepowitch O., Eggener S.E., Bianco F.J. Jr et al. Radical prostatectomy for clinically localized, high risk prostate cancer: critical analysis of risk assessment methods. J Urol 2007;178(2):493−9.
2. D’Amico A.V., Whittington R., Malkowicz S.B. et al. Pretreatment nomogram for prostate-specific antigen recurrence after radical prostatectomy or external-beam radiation therapy for clinically localized prostate cancer. J Clin Oncol 1999; 17(1):168−72.
3. Lawton C.A., Winter K., Murray K. et al. Updated results of the phase III Radiation Therapy Oncology Group (RTOG) trial 85-31 evaluating the potential benefit of androgen suppression following standard radiation therapy for unfavorable prognosis carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001;49(4):937−46.
4. Pilepich M.V., Winter K., John M.J. et al. Phase III radiation therapy oncology group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001;50(5):1243−52.
5. Bolla M., Gonzalez D., Warde P. et al. Improved survival in patients with locally advanced prostate cancer treated with radiotherapy and goserelin. N Engl J Med 1997;337(5):295−300.
6. Hanks G.E., Lu J., Machtay M. et al. RTOG protocol 92-02: A phase III trial of the use of long term androgen suppression following neoadjuvant hormonal cytoreduction and radiotherapy in locallyadvanced carcinoma of the prostate. Proc Am Soc Clin Oncol 2000:19:1284.
7. Ward J.F., Slezak J.M., Blute M.L. et al. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing: 15-year outcome. BJU Int 2005;95(6):751−6.
8. Weckermann D., Hamm M., Dorn R. et al. Sentinel lymph node dissection in prostate cancer. Experience after more than 800 interventions. Urologe A 2006;45(6):723−7.
9. Klevecka V., Musch M., Roggenbuck U. et al – Extended pelvic node dissection allows better identification of lymph node metastasis in patients with clinically localized prostate cancer. J Urol 2006;175:450.
10. Heidenreich A., Von Klobloch R., Varga Z. et al. Extended pelvic lymphadenectomy in men undergoing radical retropubic prostatectomy (RRP) – an update on > 300 cases. J Urol 2004;171:312.
11. Bader P., Burkhard F.C., Markwalder R., Studer U.E. Disease progression and survival of patients with positive lymph nodes after radical prostatectomy. Is there a chance of cure? J Urol 2003;169(3):849−54.
12. Schulman C.C., Debruyne F.M., Forster G. et al. 4-Year follow-up results of a European prospective randomized study on neoadjuvant hormonal therapy prior to radical prostatectomy in T2-3N0M0 prostate cancer. European Study Group on Neoadjuvant Treatment of Prostate Cancer. Eur Urol 2000; 38(6):706−13.
13. Soloway M.S., Pareek K., Sharifi R. et al. Neoadjuvant androgen ablation before radical prostatectomy in cT2bNxMo prostate cancer: 5-year results. J Urol 2002;167(1):112−6.
14. Gleave M.E., Goldenberg S.L., Chin J.L. et al. Randomized comparative study of 3 versus 8-month neoadjuvant hormonal therapy before radical prostatectomy: biochemical and pathological effects. J Urol 2001;166(2):500−6.
15. Messing E.M., Manola J., Yao J. et al. Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 2006;7(6):472−9.
16. Ghavamian R., Bergstralh E.J., Blute M.L. et al. Radical retropubic prostatectomy plus orchiectomy versus orchiectomy alone for pTxN+ prostate cancer: a matched comparison. J Urol 1999;161:1223−8.
17. Dorff T.B., Flaig T.W., Tangen C.M. et al. Adjuvant androgen deprivation for high-risk prostate cancer after radical prostatectomy: SWOG S9921 study. J Clin Oncol 2011; 29(15):2040−5.
18. Wiegel T., Bottke D., Steiner U. et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 2009;27:2924−30.
19. Bolla M., Van Poppel H., Collette L. et al. Postoperative radiotherapy after radical prostatectomy: a randomized controlled trial (EORTC trial 22911). Lancet 2005;366:572−8.
20. Nudell D.M., Grossfeld G.D., Weinberg V.K. et al. Radiotherapy after radical prostatectomy: treatment outcomes and failure patterns. Urology 1999;54(6):1049−57.
21. Zietman A.L., Prince E.A., Nakfoor B.M.et al. Androgen deprivation and radiation therapy. Int J Radiat Oncol Biol Phys 1997; 38(5):1067−70.
22. Roach M. 3rd, Bae K., Speight J. et al. Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: long-term results of RTOG 8610. J Clin Oncol 2008; 26(4):585−91.
23. Porter A.T., Elhilali M., Manji M. et al. A phase III randomized trial to evaluate the efficacy of neoadjuvant therapy prior to curative radiotherapy in locally advanced prostate cancer patients. A Canadian Urologic Oncology Group study. Proc Am Soc Clin Oncol 1997;16 (Abstr. 1123).
24. Denham J.W., Steigler A., Lamb D.S. et al. Short-term androgen deprivation and radiotherapy for locally advanced prostate cancer: results from the Trans-Tasman Radiation Oncology Group 96.01 randomised cont rolled trial. Lancet Oncol 2005; 6(11):841−50.
25. Bolla M., de Reijke T.M., Van Tienhoven GEORTC Radiation Oncology Group and Genito-Urinary Tract Cancer Group. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009;360(24):2516−27.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Ключевые слова: рак предстательной железы, радикальная простатэктомия, дистанционная лучевая терапия, брахитерапия.
Для цитирования: Алексеев Б.Я., Нюшко К.М., Крашенинников А.А. и др. Хирургическое лечение больных локализованным и местнораспространенным раком предстательной железы: результаты одноцентрового исследования. РМЖ. 2017;27:2019-2025.
Surgical treatment of patients with localized and locally advanced prostate cancer: the results of a single center study
B.Ya. Alekseev, K.M. Nyushko, A.A. Krasheninnikov, N.V. Vorobiev, E.Yu. Safronova, A.S. Kalpinskiy, S.A. Sergienko, I.A. Taraki, M.Z. Temirgereev, A.D. Kaprin
National Medical Research Radiological Center, Moscow
At present prostate cancer (PC) is an extremely urgent oncological problem in Russia because of a steady increase in the incidence and mortality of men due to this pathology. The introduction of new methods of laboratory and radiation diagnostics allows not only to diagnose PC, but also to more accurately assess the clinical stage of the disease. A multidisciplinary individual approach to each patient provides more treatment opportunities. Many new methods of PC treatment are being developed and studied. Radical prostatectomy (RPE) and radiotherapy (remote radiation therapy, brachytherapy) are currently the "gold standard" for radical treatment of patients with PC, nevertheless surgical treatment remains the main method of therapy for patients with localized and locally advanced prostate cancer, demonstrating satisfactory oncological and functional results.
Aim: to evaluate immediate and long-term results of surgical treatment of patients with PC.
Patients and methods: professionals of the oncourology department of the Moscow Scientific Oncological Institute named after P.A. Herzen made a retrospective analysis of 1 846 patients with prostate cancer who underwent RPE from 1998 to 2016. A detailed analysis of preoperative characteristics of patients, data of pathomorphological study, intra- and postoperative complications, as well as distant functional and oncological results of surgical treatment is given. It has been revealed, that there is a tendency to an increase in the number of PC patients with a high risk of disease progression and the presence of unfavorable prognosis factors, requiring surgical treatment.
Conclusion: the accumulation of surgical experience allows to significantly optimize the results of treating the patients with PC, and to reduce the frequency of complications. The advantage of surgical treatment is the possibility of precise staging and detection of unfavorable pathomorphological factors, which allows to develop rational treatment tactics. In patients with adverse postoperative prognostic factors (lymphogenic metastases, including extracapsular invasion), an adjuvant therapy is recommended to improve survival rates.
Key words: prostate cancer, radical prostatectomy, remote radiation therapy, brachytherapy.
For citation: Alekseev B.Ya., Nyushko K.M., Krasheninnikov A.A. et al. Surgical treatment of patients with localized and locally advanced prostate cancer: the results of a single center study // RMJ. 2017. № 27. P. 2019–2025.
Представлены результаты исследования хирургического лечения больных локализованным и местнораспространенным раком предстательной железы. Преимуществами хирургического лечения является возможность точного стадирования и выявления неблагоприятных патоморфологических факторов, что позволяет выработать рациональную тактику лечения. У больных с неблагоприятными послеоперационными факторами прогноза рекомендовано рассмотрение вопроса о проведении адъювантной терапии с целью улучшения показателей выживаемости.
Исторически стандартным подходом к лечению больных РПЖ группы высокого риска, особенно при выявлении местнораспространенных опухолей, явлалось гормоно-лучевая терапия. Хирургическое лечение данной категории пациентов до недавнего времени применялось редко, и сейчас оно остается спорным методом лечения больных РПЖ группы очень высокого риска прогрессирования.
Meng et al. в 2005 г. на основе данных регистра
CaPSURE подтвердили, что пациенты группы высокого риска значительно реже подвергались хирургическому лечению, чем ДЛТ или ГТ [21]. Исследование Cooperberg и Carroll показало изменение подходов к лечению у больных РПЖ высокого риска [22]. За последние 5–8 лет количество РПЭ значительно выросло, тогда как от ГТ в монорежиме отказываются все больше специалистов, снизилась также частота применения ДЛТ. Тенденции лечения больных РПЖ высокого риска в последние годы меняются. Эти изменения вызваны большим числом исследований роли РПЭ и расширенной ТЛАЭ у больных РПЖ с высоким риском прогрессирования [23].
Akre et al. в 2011 г. опубликовали результаты когортного исследования, проведенного в Швеции. В анализ включено 12 184 больных местнораспространенным РПЖ (клиническая стадия T3–T4) или локализованным РПЖ сT2 с уровнем ПСА в 50–99 нг/мл, без данных за наличие отдаленных метастазов. Всем больным проводилась либо ГТ в различных вариантах, либо динамическое наблюдение и симптоматическая терапия. Опухолеспецифическая смертность к 8 годам наблюдения составила: 28% при наличии высокодифференцированного РПЖ (2–6 баллов по Глисону), 52% при дифференцировке опухоли 8 баллов по Глисону и 64% при дифференцировке 9–10 баллов. При анализе причин смерти у пожилых больных РПЖ установлено, что даже у мужчин старше 85 лет с наличием низкодифференцированного РПЖ (индекс Глисона 8–10) последний являлся причиной смерти в 42% случаев. Учитывая уровень заболеваемости и летальности при РПЖ высокого риска, возраст не должен рассматриваться как абсолютное противопоказание для радикального лечения [24].
Согласно данным, полученным Ward в 2005 г. [25], у 842 пациентов с клинической стадией cT3 (медиана времени наблюдения 10,3 мес.) опухолеспецифическая выживаемость (ОСВ) после РПЭ составила 90% и 79% при 10 и 15 годах наблюдения соответственно. Более 78% пациентов получали адъювантную ГТ или сальважную лучевую терапию. В 27% случаев выявлено гиперстадирование: при патоморфологическом исследовании диагностирован локализованный РПЖ (pT2NoMo). Показатели смертности при местнораспространенном и локализованном РПЖ сопоставимы, что подтверждает целесообразность хирургического лечения данной группы больных.
В 2008 г. Yossepowitch et al. опубликовали данные клиники Memorial Sloan Kettering Cancer Center (MSKCC), которые продемонстрировали удовлетворительные результаты ОСВ больных РПЖ высокого риска [26].
В 2009 г. Stephenson опубликовал данные по хирургическому лечению более 12 000 тыс. мужчин в 4-х академических центрах (Baylor, ClevelandClinic, MSKCC, U. Of Michigan) за 1987–2005 гг. Более 1900 больных РПЖ относились к группе высокого риска. Опухолеспецифическая смертность составила 8% (95% ДИ 7–10) и 19% (95% ДИ 14–24) для 10 и 15 лет наблюдения соответственно [27].
Mitchell et al. в 2012 г. опубликовали результаты 20-летнего наблюдения за больными РПЖ после лечения. В послеоперационном периоде 42% больных не получали ни один из видов ГТ, показатель ОСВ составил 81% [28].
Briganti в 2015 г. привел результаты хирургического лечения больных РПЖ высокого риска. Ретроспективно проанализрованы данные 2065 пациентов, которым выполняли РПЭ в 7 центрах с 1991 по 2011 г., все пациенты, получившие лучевую терапию или ГТ, исключены из анализа. При медиане наблюдения 70 мес. пятилетняя выживаемость без биохимического рецидива составила 55,2%. В зависимости от наличия неблагоприятных факторов риск развития биохимического рецидива снижался или оставался стабильным. Так, в случае верификации низкодифференцированной опухоли (индекс Глисона 8–10) риск биохимического рецидива постепенно снижался, а при выявлении местнораспространенных опухолей ≥pT3a риск рецидива оставался стабильным на протяжнии всего времени наблюдения. Показатель 10-летней опухолеспецифической смертности составил 14,8%. У больных с ранним биохимическим рецидивом после хирургического лечения ( 20 нг/мл, или дифференцировка опухоли по Глисону 8–10 баллов) отмечен у 1206 (65,3%) пациентов. В группе высокого риска локализованный РПЖ выявлен у 819 (67,9%) больных, местнораспространенные опухоли диагностированы у 387 (32,1%) пациентов. РПЖ крайне высокого риска прогрессирования (клиническая стадия сT3b) верифицирован у 117 (9,7%) больных. При пальцевом ректальном исследовании (ПРИ) узловые образования в предстательной железе выявлены у 719 больных группы высокого риска (59,6%), при трансректальном УЗИ (ТРУЗИ) опухолевые очаги визуализировались в 1152 (95,4%) случаях. В группе РПЖ умеренного риска показатели при ПРИ и ТРУЗИ составили 137 (34,4%) и 225 (56,5%) случаев соответственно. В группе низкого риска: при ПРИ опухоль пальпировалась у 40 (16,5%) больных, при ТРУЗИ опухолевые очаги выявлены у 77 (31,8%). Распределение больных РПЖ по группам риска показано на рисунке 1. 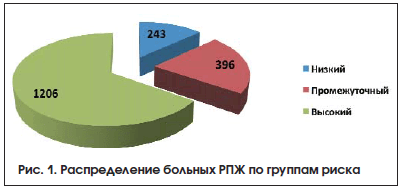
Позадилонная РПЭ выполнена 1755 больным, в т. ч. 114 пациентам с применением нервосберегающей методики; РПЭ промежностным доступом (РППЭ) выполнена 80 больным и лапароскопическая РПЭ – 11 больным.
Характеристика больных, которым выполнили позадилонную нервосберегающую РПЭ, представлена в таблице 2. 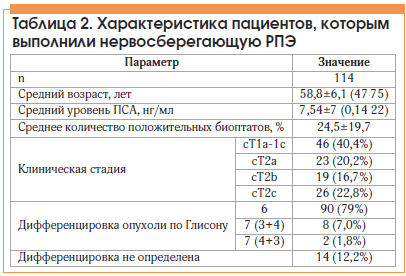
В числе больных, которым выполнили позадилонную РПЭ, 1665 больным дополнительно выполнили ТЛАЭ: 718 (43,1%) – стандартную ТЛАЭ (СТЛАЭ) (эти операции выполнены до 2008 г.), 947 (56,9%) – радикальную ТЛАЭ (РТЛАЭ). Характеристика пациентов представлена в таблице 3. 
Следует отметить, что РПЭ без ТЛАЭ и с СТЛАЭ у пациентов в группах промежуточного и высокого риска выполняли только до 2008 г., т. е. до внедрения в практику методики расширенной ТЛАЭ.
РППЭ выполнена 80 больным, характеристика больных данной группы представлена в таблице 4. В этой группе РПЖ низкого риска выявлен у 29 (36,25%) больных, умеренного риска – у 66 (82,5%), высокого риска – у 15 (18,75%). 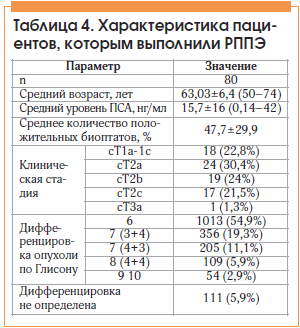
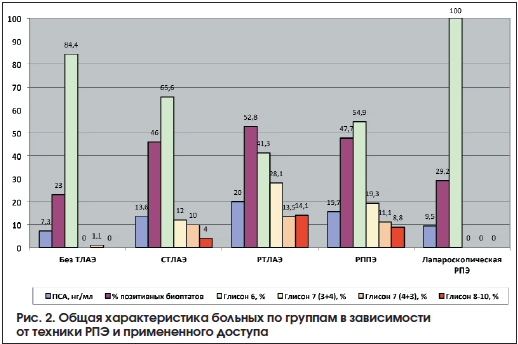
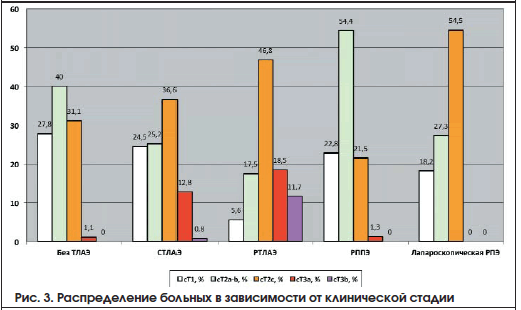
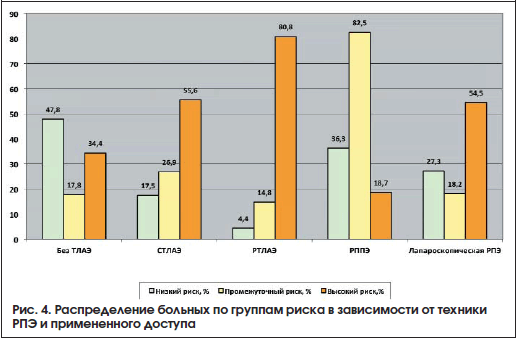
Лапароскопическая РПЭ выполнена 71 пациенту, в данную группу также вошли пациенты, у которых применяли нервосберегающую технику. Характеристика больных представлена в таблице 5. На рисунках 2-4 представлены общая характеристика больных (рис. 2), распределение больных в зависимости от клинической стадии (рис. 3), распределение больных по группам риска в зависимости от техники РПЭ и примененного доступа (рис. 4). 
Только для зарегистрированных пользователей
Читайте также:

