Рак пищевода эндоскопическая диагностика
Основными способами диагностики рака пищевода являются инструментальные методы исследования - рентгенография и эзофагоскопия. Они дают возможность определить локализацию, форму роста, размеры опухоли и состояние стенок пищевода вблизи нее.
Наиболее точным способом диагностики рака пищевода является эзофагоскопия (рис. 51, 52, 53). Данный метод исследования показан при подозрении на любое функциональное или органическое заболевание пищевода. Отказ от применения эзофагоскопии даже при минимальной местной клинической симптоматике следует считать грубой ошибкой.
С развитием фиброволоконной оптики этот метод исследования стал практически безопасным для больных. Различные тяжелые осложнения, наблюдавшиеся раньше при выполнении исследования жестким (тубусным) прибором, встречаются крайне редко при использовании фиброэндоскопов. Эзофагоскопия позволяет выявлять опухоли, язвы, эрозии, стенозы пищевода, объясняющие причину возникновения пищеводных болей. Главным достоинством эзофагоскопии является возможность получения биоптата измененных участков слизистой.
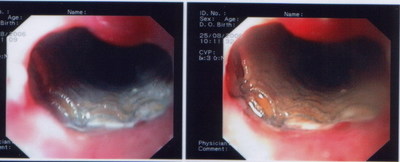
Рис. 51. Эзофагоскопия. Плоскоклеточный рак пищевода с эндофитным ростом


Рис. 52. Эзофагоскопия. Рак пищевода с экзофитным ростом и поверхностный рак пищевода.

Рис. 53. Эзофагоскопия. Инфильтративно-стенозирующий рак пищевода.
В процессе эзофагоскопии решаются следующие задачи:
1) выявление опухолевого поражения пищевода и оценка его макроскопической картины;
2) выявление воспалительных и неопухолевых изменений слизистой оболочки пищевода;
3) определение верхней и по возможности нижней границы поражения;
4) установление наличия циркулярного поражения стенок пищевода;
5) проведение эндоскопической биопсии (щипцовая, пункционная, эксцизионная, браш-биопсия);
6) оценка непосредственного эффекта лучевой или химиолучевой терапии;
7) оценка возможности использования фотодинамической терапии или лазерной деструкции опухоли (в случаях малых по протяженности опухолей пищевода, не прорастающих в мышечный слой стенки);
8) выявление наличия раннего рака пищевода с использованием диагностических препаратов гематопорфиринового ряда.
Расположение зоны патологических изменений пищевода регистрируется как расстояние от резцов до проксимальной и дистальной ее границ. Если для эндоскопической оценки доступна лишь проксимальная граница опухоли, важно установить, не являются ли изменения пищевода вторичными. В подобных случаях возрастает значение рентгенологического метода в уточнении особенностей поражения пищевода.
Эзофагоскопическая картина рака пищевода весьма разнообразна и зависит прежде всего от формы роста опухоли и ее размеров (рис. 51, 52).
При эндоскопическом исследовании выделяют следующие типы опухолевого поражения:
1) опухоли с преимущественно экзофитным ростом (рис. 52) - полиповидный, папилломатозный, крупнобугристый, блюдцеобразный рак;
2) опухоли с преимущественно эндофитным ростом (рис. 51) - очаговый плоский инфильтрат, язвенно-инфильтративный рак, инфильтративно-стенозирующий рак;
3) смешанные и язвенные формы опухоли.
При экзофитном росте выявляются бугристые опухолевые массы, выступающие в просвет пищевода (рис. 52), легко кровоточащие при дотрагивании эзофагоскопом. При эндофитной форме (рис. 51) слизистая оболочка длительное время остается интактной, отмечается лишь локальная ригидность стенки пищевода или изменение окраски слизистой оболочки. Изъязвленные формы (рис. 53) характеризуются наличием язв неправильной формы с неровными бугристыми краями.
Хромоэзофагоскопия. Это исследование предназначено для визуализации, уточнения характера, локализации и размеров поражения, а также для выполнения прицельной биопсии. Для витальной окраски слизистой пищевода используют красители, которые по механизму действия подразделяются на 3 группы:
I. Контрастные красители (индигокармин) не окрашивают нормальные клетки слизистой оболочки пищевода, распределяясь по поверхности слизистой, окрашивают только ее измененные участки.
II. Абсорбирующиеся красители:
1) водный раствор Люголя (2-3%) используется для визуализации минимальных изменений слизистой оболочки пищевода, он окрашивает в коричневый цвет нормальный плоский эпителий, измененные участки слизистой оболочки пищевода остаются неокрашенными и таким образом визуализируются (рис. 54, 55);
2) раствор метиленового синего абсорбируется клетками метаплазированного и диспластического эпителия, участки измененной слизистой оболочки окрашиваются в голубой или фиолетовый цвет и становятся отчетливо видимыми на фоне неизмененной бледно-розовой слизистой оболочки пищевода;
3) раствор толуидинового синего прокрашивает ядра призматического эпителия желудка и цилиндрического интестинального эпителия и используется для выявления участков метаплазированного эпителия при пищеводе Барретта, на фоне которого часто возникает рак пищевода.
III. Реактивные красители (конго красный и фенол красный) не применяются для витальной окраски слизистой оболочки пищевода. Они предназначены для изучения кислотопродуцирующих зон (конго красный) и инфицирования Helicobacter pylori слизистой желудка (фенол красный).
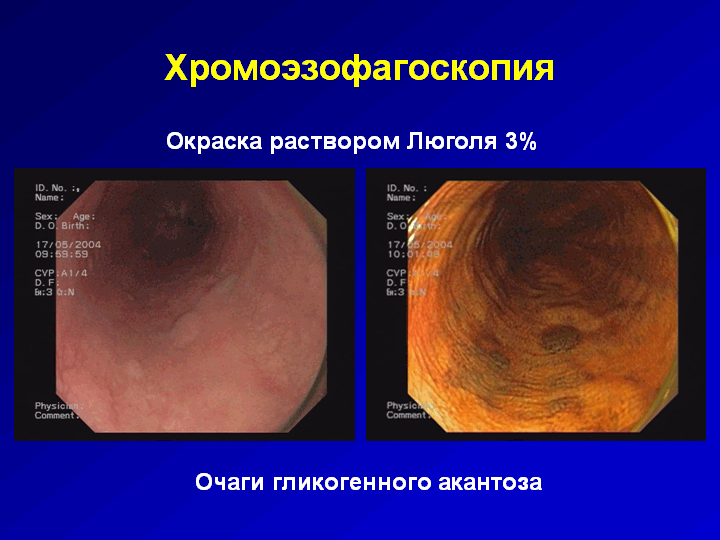

Рис. 54. Эзофагоскопия. Очаги гликогенового окантоза.
Окраска раствором Люголя 3%.
По данным S. Yoshida, проведение хромоэзофагоскопии радикально изменяет неблагоприятную ситуацию. Орошение слизистой оболочки пищевода раствором Люголя позволяет визуализировать невидимые патологические очаги, выполнить их прицельную биопсию, получить адекватный биопсийный материал для морфологического исследования, уточнить истинный характер измененных участков слизистой пищевода, планировать и провести лечение больного с учетом реальной распространенности опухоли, улучшить результаты лечения и прогноз заболевания. Использование данной методики дало возможность за счет увеличения доли больных с ранним раком увеличить 5-летнюю выживаемость до 44%.
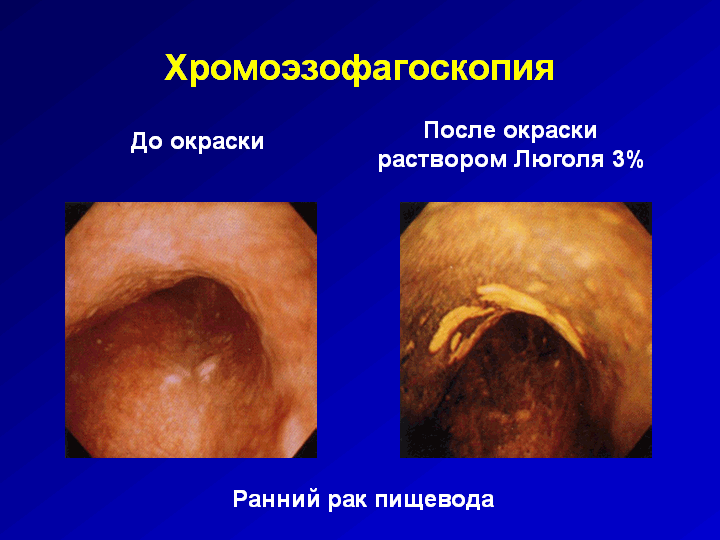

Рис. 55. Эзофагоскопия. Визуализация невидимых патологических очагов.
Окраска раствором Люголя 3%.
Основой активного выявления рака пищевода является динамическое эндоскопическое наблюдение с повторными биопсиями из участков измененной слизистой оболочки. Поэтому одним из современных скрининговых методов ранней диагностики рака является эзофагоскопия с витальной окраской слизистой оболочки пищевода.
Таким образом, тщательная оценка изменений слизистой оболочки пищевода с использованием хромоэзофагоскопии дает возможность выявлять значительно большее количество больных с ранним раком. Эндоскопическое исследование в качестве скрининга для выявления метаплазии Барретта и раннего рака пищевода показано: пациентам старше 40 лет с симптомами ГЭРБ более 3 лет, пациентам с эзофагитом, пациентам со стриктурой пищевода, пациентам после операций на пищеводе и желудке. Проведение массового скрининга остается нерешенной проблемой. На сегодняшний день целесообразным является выделение групп риска и проведение диспансерного наблюдения. При выявлении ПБ проводится тщательный поиск диспластических изменений. Если дисплазия не выявлена, эндоскопическое исследование проводится раз в год. При выявлении дисплазии низкой степени назначается консервативная терапия с повторными биопсиями. Выявление дисплазии высокой степени является показанием к оперативному лечению.
Всем больным с установленным раком пищевода выполняют трахеобронхоскопию. Поскольку стенка пищевода в пределах средостения лишена хорошо выраженной наружной оболочки, инвазивный рост опухоли пищевода довольно рано распространяется на трахею и бронхи. Исследование направленно на поиск вовлечения стенок трахеобронхиального дерева в опухолевый инфильтрат, а также наличия возможной злокачественной пищеводно-респираторной фистулы.
1. Оценка состояния слизистой бронхиального дерева.
2. Выявление сужений просвета трахеи и бронхов и степень его выраженности за счет прорастания или сдавления извне метастатическими лимфатическими узлами. При выявлении сужения просвета трахеи или бронхов за счет сдавления опухолью более чем на 1/3 резектабельность опухоли весьма сомнительна.
3. Определение расстояния до бифуркации трахеи.
4. Выявление первичной множественности опухолевого процесса (поражения бронхиального дерева синхронными опухолями легкого).
Соноэзофагоскопия. В начале 1980-х годов фирмой Olympus Optical Co. Ltd. был разработан принципиально новый диагностический прибор - эхоэндоскоп, соединивший в себе ультразвуковой датчик и гибковолоконный эндоскоп. Методика исследования получила название эндоскопическая ультрасонография - соноэзофагоскопия, синонимы: эндосонография, эхоэндоскопия, эндоскопический ультразвук, эндо-УЗИ. Сочетание стандартного эндоскопического исследования и сонографии в единой диагностической процедуре дает возможность врачу под визуальным контролем подвести ультразвуковой датчик к объекту исследования и получить эхограмму не только патологически измененного участка стенки органа, но и, в зависимости от применяемой частоты сканирования, прилегающих органов, лимфатических узлов и других анатомических структур.
При использовании эхоэндоскопов возможно изменение частоты сканирования во время исследования от 5 до 20 МГц. Высокочастотное (15-20 МГц) сканирование обладает большей чувствительностью в определении глубины инвазии опухоли, особенно при поверхностном поражении (раннем раке), но уступает низкочастотному (5-12 МГц) в оценке состояния регионарных лимфатических узлов.
Существуют также УЗ-зонды, проводимые через биопсийный канал стандартных эндоскопов. Это исследование особенно ценно при сужениях пищевода различной этиологии. В свою очередь, при применении зондовой методики эндоскопического УЗИ сканирование выполняется только на высоких частотах, что ограничивает его диагностические возможности (рис. 56).
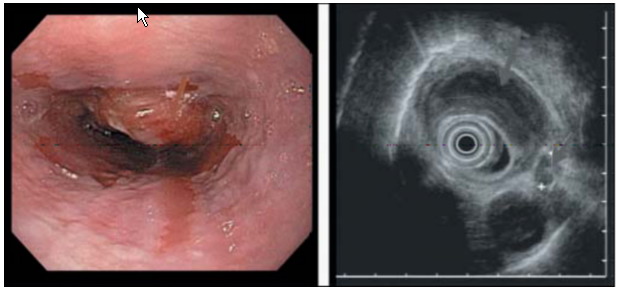
Рис. 56. Эндоскопическая картина и эндосонограмма
при плоскоклеточном раке пищевода.
Ультразвуковое исследование в диагностике рака пищевода с разработкой внутриполостных датчиков приобретает значительно большее значение, чем компьютерная (КТ), магниторезонансная (МРТ) и позитронная эмиссионная (ПЭТ) томография. Точность данной методики для категории Т колеблется от 77 до 92%, для категории N - 50-88%. Эндосонография особенно информативна при описании опухолей, ограниченных слизистым и подслизистым слоем, то есть в тех случаях, когда КТ, МРТ, ПЭТ не могут достоверно отразить опухолевое поражение.
При определении состояния регионарных лимфатических узлов точность эндоскопического УЗИ составляет 81% (чувствительность - 95%, специфичность - 50%). Особо отмечен приоритет внутриполостного УЗИ в определении глубины опухолевого поражения при ранних стадиях, когда КТ и МРТ малоинформативны.
Важность дифференциации слоев состоит в том, что вероятность поражения лимфатических узлов резко увеличивается для опухолей, которые распространяются на подслизистый слой. При поражении только слизистого слоя метастазы в лимфатических узлах, как правило, отсутствуют, в то время как при поражении подслизистого слоя частота метастазирования в лимфатические узлы возрастает до 30-40%.
При радиальном сканировании стенка неизмененного пищевода равномерно 5-слойная, некоторые авторы различают 7 слоев. Первый, тонкий гиперэхогенный слой представляет собой собственно слизистую оболочку. Непосредственно под ним визуализируется тонкий гипоэхогенный слой, что соответствует мышечной пластинке слизистой оболочки. Следующий гиперэхогенный слой - подслизистая основа. Мышечная оболочка пищевода хорошо определяется как гипоэхогенный слой, далее визуализируются гиперэхогенные адвентиция и окружающие ткани (рис. 57). Слоистое строение пищевода при ЭСГ менее четкое, чем желудка. Пассивное движение пищевода, связанное с дыханием и работой сердца, также в некоторой степени искажает эндосонограммы.
| эпителий |
| собственная пластинка |
| базальная мембрана |
| адвентиций |
| мышечная оболочка |
| подслизистая основа |
| мышечная пластинка |
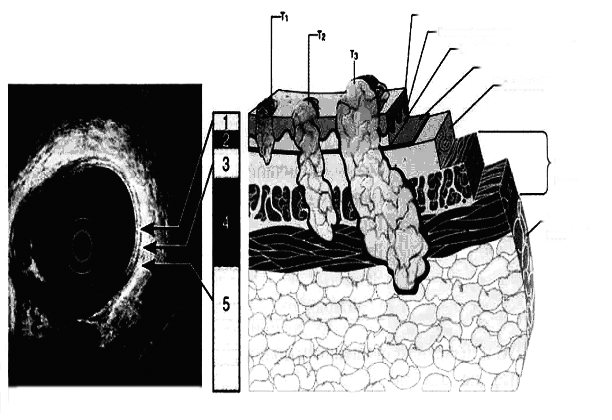
Рис. 57. Эндосонография. Радиальное сканирование стенки пищевода и соответствующие оболочки органа.
Забор биопсийного материала на гистологию и цитологию. Взятие фрагмента ткани опухоли для гистологического исследования является неотъемлемой частью эндоскопического исследования. Однако далеко не у всех больных удается получить морфологическое подтверждение диагноза. Это связано с тем, что в целом ряде случаев наблюдается преимущественно подслизистый рост опухоли. В подобных ситуациях необходима повторная эзофагобиопсия.
Весьма эффективным является цитологическое исследование промывных вод из пищевода. Многие авторы считают, что данный метод более эффективен в диагностике рака пищевода, чем гистологическое исследование биоптата из опухоли. Особенно велика ценность цитологического исследования в диагностике раннего рака пищевода, когда рутинная рентгенография и эзофагоскопия не в состоянии выявить специфические признаки опухолевого заболевания. При отсутствии выраженного стеноза целесообразно также исследование промывных вод желудка, куда попадают слущенные клетки из опухоли пищевода.
При анализе гистологической картины биоптатов слизистой оболочки пищевода могут быть выявлены выраженные в той или иной степени изменения эпителия. Эпителиальный пласт редко сохраняет обычную толщину, это бывает только при катаральном эзофагите и длительности заболевания от нескольких месяцев до 1-2 лет. Чаще выявляется атрофия эпителия, истончение эпителиального слоя, но изредка наряду с атрофией могут быть обнаружены участки гипертрофии эпителиального пласта. Слоистость эпителия местами нарушена, при этом эпителиальные клетки (эпителиоциты) находятся в состоянии дистрофии, выраженной в той или иной степени. В отдельных случаях дистрофия завершается некрозом клеток, особенно ярко выраженным в поверхностных слоях эпителия. Базальная мембрана эпителия в большинстве случаев сохраняет обычные размеры, но у некоторых больных может быть утолщена и склерозирована.
Наряду с выраженными дистрофически-некротическими изменениями эпителия отмечается гиперемия сосудов, во всех случаях количество сосочков значительно увеличено, причём у большинства больных с длительным анамнезом количество сосочков увеличено прямо пропорционально давности заболевания. В толще эпителия и в субэпителиальном слое выявляются очаговые (как правило, периваскулярные), а местами диффузные лимфоплазмоцитарные инфильтраты с примесью единичных эозинофилов и полинуклеарных нейтрофилов. Инфильтраты располагаются как в области сосочков, так и в более глубоких слоях под эпителием, при этом отмечается разволокнение мышечных волокон. В отдельных случаях длительно текущего заболевания среди воспалительных инфильтратов могут быть обнаружены сосуды с явлениями продуктивного васкулита. Инфильтрат, как правило, чрезвычайно полиморфный, доминируют моноциты, плазматические клетки, лимфоциты, макрофаги, а при длительно текущем эзофагите - фибробласты. При активно текущем эзофагите количество нейтрофилов оказывается значительным, при этом часть нейтрофилов обнаруживается в толще эпителиального пласта внутри клеток (лейкопедез эпителия). Данную картину можно наблюдать преимущественно в нижней трети эпителиального пласта. В единичных случаях наряду с нейтрофилами обнаруживаются межэпителиальные лимфоциты и эритроциты.
В небольшом проценте случаев морфологических проявлений активно текущего воспалительного процесса не обнаруживается. При этом в слизистой оболочке пищевода отмечается разрастание рыхлой, а местами плотной волокнистой соединительной ткани (склероз). В полях склероза нередко встречаются фибробласты и разрушенные макрофаги. Гладкомышечные клетки собственной пластинки слизистой оболочки подвержены выраженной дистрофии или атрофии, а в редких случаях - коагуляционному некрозу.
В отдельных случаях клетки нижней трети эпителиального пласта оказываются полиморфными с умеренно гиперхромными ядрами, в единичных клетках наблюдаются фигуры митозов. Подобные изменения характерны для слабо выраженной дисплазии эпителия.
При гистологическом исследовании может быть выявлена метаплазия плоского неороговевающего эпителия пищевода, которая приводит к появлению цилиндрического эпителия с фундальными железами (выявляются париетальные, главные и добавочные клетки в железах, а покровный эпителий формирует типичные валики, покрытые покровно-ямочным эпителием). При этом железы немногочисленны, сдавлены разрастаниями соединительной ткани и диффузным лимфоплазмоцитарным инфильтратом.
Если метаплазия приводит к появлению цилиндрического эпителия кардиального или фундального типа слизистой желудка, то риск развития аденокарциномы пищевода не увеличивается. Однако, если метаплазия приводит к появлению специализированного тонкокишечного цилиндрического эпителия, риск озлокачествления становится явным. Специализированный цилиндрический эпителий при этом диагностируется как неполная тонкокишечная метаплазия с наличием бокаловидных клеток
Рак пищевода встречается нечасто, ежегодно поражает чуть более 7,5 тысяч россиян или 8–9 человек из 100 тысяч населения, преимущественно пожилого возраста. Самые высокие показатели, двадцатикратно превышающие российские, отмечены в Китае, Корее, Японии, Монголии, Иране и Бразилии.
В структуре мужской онкологической заболеваемости рак пищевода взял 2, 5%, тогда как среди женских раков — только 0,5%. Это совсем не женское заболевание, мужчины болеют почти в четыре раза чаще и начинают болеть раньше. В мужской когорте средний возраст выявления онкологического поражения пищевода 64 года, то в женской — после 70 лет.
- Факторы риска
- Клиническая картина
- Диагностика
- Лечение рака пищевода
- Паллиативное лечение распространённого рака пищевода
Факторы риска
Есть ещё одна проблема — проблема личности. Для жителей Средней Азии, пьющих обжигающий чай, рак пищевода — традиционная болезнь. Злокачественная опухоль пищевода поражает пьющих крепкие алкогольные напитки, курящих, потребляющих некачественную пищу. Не минует рак пищевода и граждан с избыточным весом.
Второе заболевание, с довольно высокой частотой приводящее к развитию аденокарциномы пищевода — пищевод Барретта. При пищеводе Барретта нормальный природный плоский эпителий слизистой оболочки в месте перехода в желудок локально, буквально гнёздами, замещается нетрадиционным цилиндрическим эпителием, такое состояние частичной замены называется метаплазией. И то воздействие различных жизненных факторов, которое легко переносит плоский эпителий, совершенно не подходит цилиндрическому, он страдает и сбивается с курса, давая рост раковым клеткам. Все больные пищеводом Барретта должны наблюдаться и лечиться, во избежание развития рака.
Эти факторы риска развития рака пищевода устранимы. Но есть и неустранимый — ахалазия пищевода, двадцатикратно увеличивающая вероятность рака. Заболевание обусловлено ненормальным регулированием нервной системой сокращений пищевода при передвижении по нему пищи и правильного открытия сфинктера у входа в желудок. Пищевод сужается циркулярными рубцами, а над сужением возникает чрезмерное расширение. Особенность в том, что твёрдая пища проходит легко, а вот жидкая — плохо. При этом состоянии пища проходит очень плохо, подолгу застаиваясь в расширении и формируя хроническое воспаление слизистой оболочки. При воспалении начинается избыточное деление клеток эпителия слизистой, и сбой одной клетки с правильной программы может дать начало раку.
Клиническая картина
В пищеводе есть физиологические сужения, где преимущественно и начинается злокачественный рост. Сужения эти обусловлены прохождением вблизи других анатомических образований — аорты и развилки трахеи на бронхи, в местах перехода глотки в пищевод и пищевода в желудок тоже имеется небольшое сужение. Считается, что здесь слизистая более подвержена мелким травмам грубой пищей, значит, чаще возникает воспаление. Тем не менее, в шейном отдела частота рака составляет 10%, в нижней трети пищевода — 30%, а 60% раков образуется в среднем сегменте.
Злокачественные клетки не только растут в толщу органа, как бывает при большинстве раковых образований, они ещё и мигрируют по мелким лимфатическим сосудикам. Сосудики формируют внутри пищеводной стенки полноценную лимфатическую сеть, распространяя опухоль внутри, поэтому протяжённость опухоли может быть и 5, и 10, и 15 сантиметров.
В запущенной стадии локализация определяет симптоматику, а первыми признаками считается ощущение прилипания пищи к одному и тому же месту или царапание слизистой кусочком еды. По мере прогрессирования появляется затруднённое прохождение сначала твёрдых кусочков, потом каши, далее жидкости. Всё этот называется дисфагия. Сначала пациент запивает кусочки еды водой, проталкивая их, после это уже не помогает, нарушается питание, человек худеет. Соприкосновение опухоли с пищей приводит к воспалению, появляется неприятный гнилостный запах, при регулярной травме рыхлая слизистая опухоли начинает кровоточить, может развиться опасное для жизни кровотечение.
Присоединяются боли, поскольку пищевод сокращается перистальтическими волнами, боль имеет спастический характер. Прорастание опухоли через всю толщу пищеводной стенки делает боль постоянной, локализуется она между лопатками. Инфильтрация опухолью клетчатки средостения вовлекает в процесс возвратный нерв, отвечающий за движение голосовых связок, появляется осиплость и попёрхивание при питье. Нерв могут сдавить увеличенные метастазами лимфатические узлы и пропадёт звучность голоса.
Как и при ахалазии, над сужением пищевода опухолью образуется расширение, где копится еда. Ночной заброс скопившихся пищевых масс в дыхательное горло тоже может привести к пневмонии. А днём беспокоит сильная слабость, температура. Если в процесс вовлечены дыхательные пути, то может сформироваться соустье между пищеводом и трахеей или крупными бронхами — свищ, по которому крошки еды будут попадать в дыхательную трубку, вызывая кашель и пневмонию. Если такой свищ откроется из пищевода в клетчатку средостение, то её воспаление приведёт к смерти.
Диагностика
Современная диагностика, сделавшая с конца прошлого века рывок в развитии, активному выявлению опухоли пищевода помогает мало, только у 6,4% из всех заболевших опухоль находят до появления ярких клинических признаков. Как и в докомпьютерную медицинскую эру рак пищевода на I–II стадии выявляют только у 28,2%, на III стадии — у 36,4%, и треть попадает к доктору уже с отдалёнными метастазами. По причине запущенности 60% больных с момента выявления рака не проживут и года, а 5 лет проживают только 32,3%.
Статистические показатели у россиян хуже только при раке печени и поджелудочной железы, действительно высокозлокачественных опухолях с весьма высоким метастатическим потенциалом. По степени злокачественности рак пищевода отнюдь не под стать им, просто у 73% рак выявляется в распространённом варианте, когда возможности терапии ограничены сугубо паллиативной помощью.
Лечение рака пищевода
Главный и основной метод терапии — хирургия, но выявление опухоли в запущенном состоянии при невозможности замены всей пищеводной трубки аналогичной анатомической структурой — техническое ограничение хирургических возможностей, не всегда даёт желаемый результат. Поэтому к операции подключают лекарственную и лучевую терапии. Выбор ведущего метода лечения диктуется размерами и локализацией опухоли, состоянием больного и сопутствующими заболеваниями.

Паллиативное лечение распространённого рака пищевода
В этой ситуации на передний план выходит полная невозможность питания через практически закрытый опухолью пищевод. Часто прибегают к расширению — реканализации или установке специального стента в пищеводе. Стенты обязательны при соединении пищевода и трахеи или бронхов соустьем — опухолевым свищом, что предотвращает заброс пищи в дыхательное дерево и уберегает от пневмонии. В некоторых случаях во время эндоскопии опухоль частично разрушают лазером, используя фотодинамическую терапию. Вариантов лечения рака пищевода достаточно, надо вовремя и умело их использовать.
Рак пищевода представляет собой опухоль злокачественного характера, происходящую из эпителиальных клеток пищевода. Заболевание берет начало с внутреннего слоя, то есть слизистой оболочки, а затем распространяется наружу, преодолевая подслизистый и мышечный слои.
Существует два основных вида такого заболевания:
- Плоскоклеточный рак. Он возникает из клеток, составляющих слизистую оболочку пищевода. Чаще всего встречается в зоне шеи, а также двух верхних третей грудной клетки.
- Аденокарцинома, другими словами – железистый рак. Чаще всего диагностируется в нижней трети пищевода. Вначале происходит замещение железистого эпителия плоскоклеточным (при пищеводе Барретта).
Статистика
Чаще всего (до 80% случаев) новообразование находится в нижне- и среднегрудном отделах пищевода. С частотой 10-15% случаев диагностируется рак шейного отдела пищевода.
Факторы риска
Основные факторы риска возникновения и развития такой болезни:
- мужской пол, потому что мужчины чаще подвержены вредным привычкам – курению и употреблению спиртного в больших количествах;
- возраст – чем он больше, тем выше риск, лишь 15% пациентов были младше 55-ти лет;
- избыточная масса тела;
- курение и злоупотребление спиртным;
- употребление очень горячих напитков и еды;
- пищевод Барретта (когда в нижней части пищевода возникает клеточное перерождение, вызываемое кислотным повреждением хронической формы);
- рефлюкс;
- ахалазия (когда нарушена запирательная функция отверстия между желудком и пищеводом);
- рубцы в пищеводе, приведшие к его сужению;
- синдром Пламмера-Винсона (для такого синдрома характерна триада, то есть три вида нарушений одновременно: нарушенная глотательная функция, суженный пищевод, железодефицитная анемия);
- контакт с химикатами.
Примерно у 1/3 заболевших диагностирован ВПЧ (вирус папилломы человека).
Риск заболеть этим видом рака можно снизить, если разнообразно питаться, не пить крепкий алкоголь, а при наличии синдрома Барретта отслеживать изменения в слизистой оболочке.
Скрининг этого заболевания не проводится. Однако при повышенном риске появления рака пищевода рекомендуется проходить эндоскопическое исследование, при необходимости с биопсией подозрительной зоны.
Симптомы
Обычно рак пищевода обнаруживается на поздних стадиях, когда терапия уже осложнена, или случайно.
Наиболее частая симптоматика включает следующее:
Есть и более редкие симптомы:
- кашель;
- икота;
- хриплый голос;
- рвота;
- костные боли (при наличии метастазов);
- пищеводное кровотечение (после того как кровь проходит по ЖКТ, стул окрашивается в черный цвет);
- как следствие кровотечения – анемия (человек становится бледным, слабым, быстро утомляется, испытывает постоянную сонливость).
Важно! Наличие подобных симптомов еще не означает рак. Однако нужно обязательно обратиться к врачу и обследоваться.
Классификация рака пищевода
По области возникновения:
- внутригрудной отдел пищевода;
- шейный отдел (от нижней границы перстневидного хряща до входа в грудную полость);
- верхняя грудная зона (от входа в грудную полость до области бифуркации трахеи);
- средняя грудная область (проксимальная часть пищевода распространяется от зоны бифуркации трахеи до соединения пищевода с желудком);
- нижняя грудная область (дистальная часть пищевода примерно 10 см в длине, включая абдоминальную часть пищевода, распространяется от зоны бифуркации трахеи до соединения пищевода и желудка).
По характеру роста опухоли:
- в просвет пищевода (экзофитный);
- язвенный (эндофитный);
- круговая форма (инфильтративный склерозирующий).
По степени дифференцировки новообразования:
- степень не определена – Gx;
- высокодифференцированное образование – G1;
- умеренно дифференцированное – G2;
- малодифференцированное – G3;
- недифференцируемое – G4.

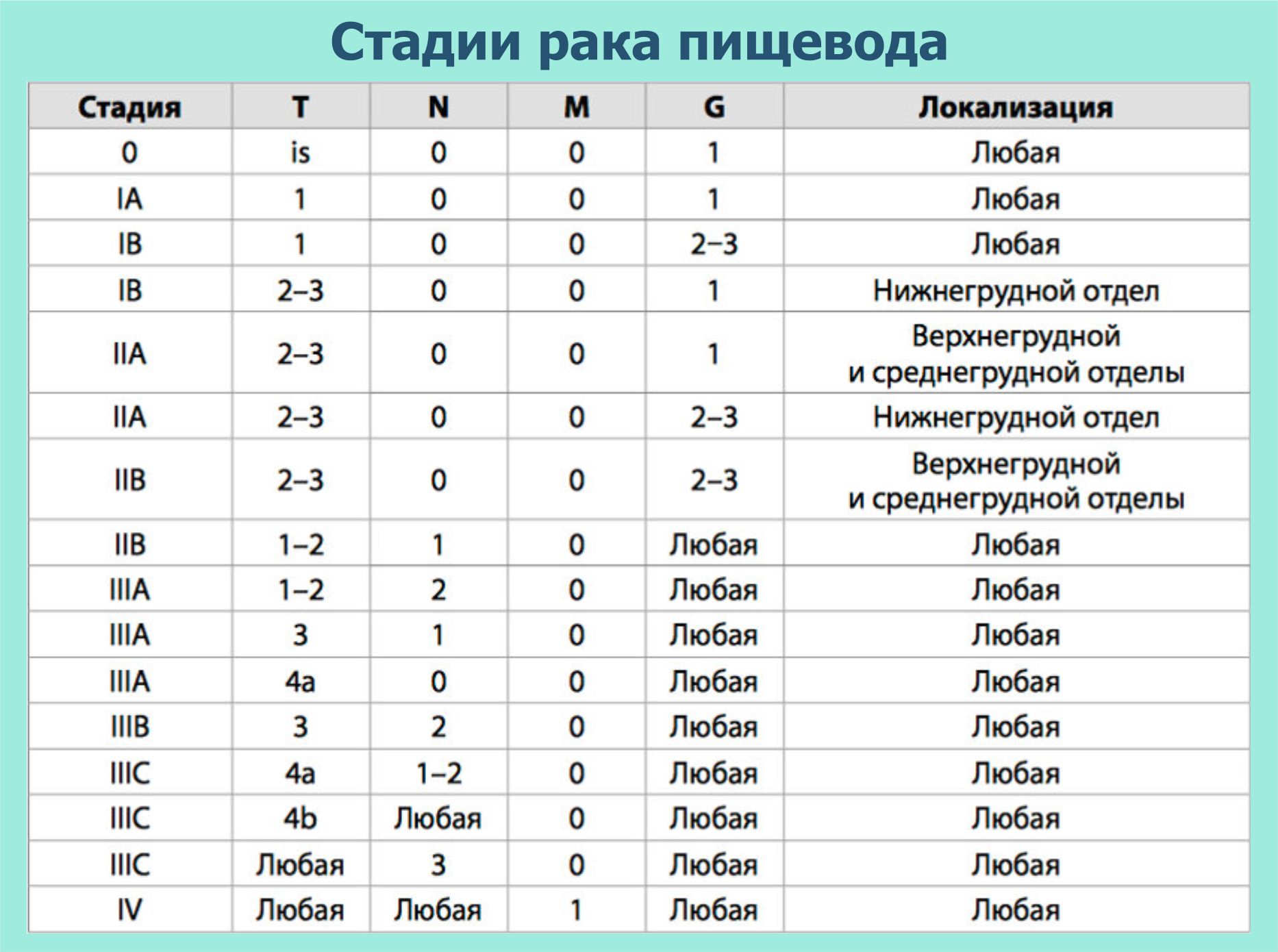
Стадии рака пищевода
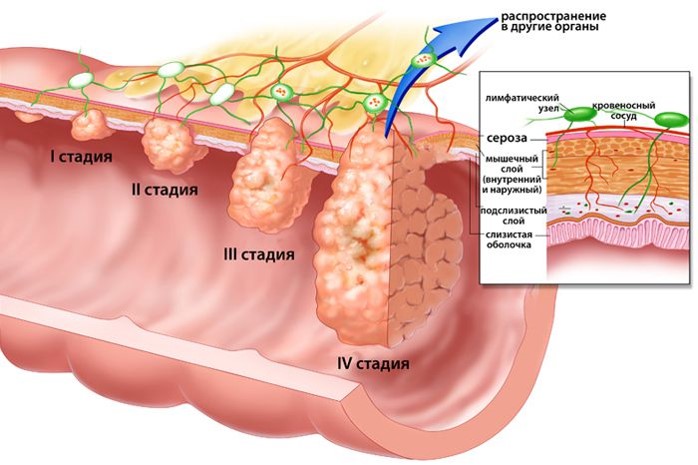
Предлагаем ознакомиться с таблицей стадирования заболевания:
Диагностика
Диагностирование осуществляется инструментальными и лабораторными методами.
-
Рентгенография с бариевым контрастом. Пациент принимает внутрь сульфат бария, который обволакивает стенки пищевода. Это позволяет увидеть на снимке рельеф стенок и обнаружить сужение просвета. На ранней стадии рак может иметь вид небольших круглых выпуклостей, то есть бляшек. На поздней стадии развития новообразование принимает вид большой опухоли неправильной формы, которая может вызывать сильное сужение пищевода. Рентгенография также позволяет диагностировать трахеопищеводную фистулу, то есть когда из-за разрушения новообразованием стенки пищевода на всю толщину пищевод начинает сообщаться с трахеей.
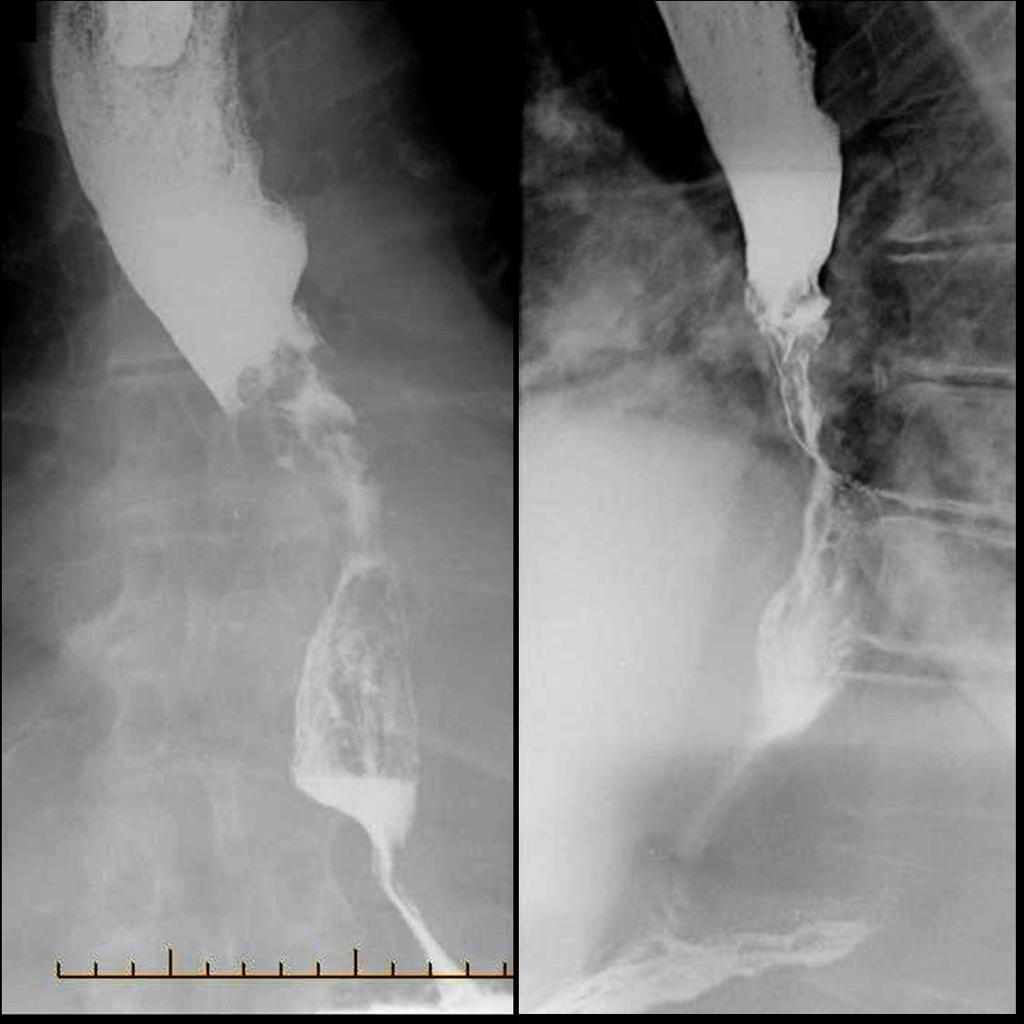
Рентгенодиагностика рака пищевода
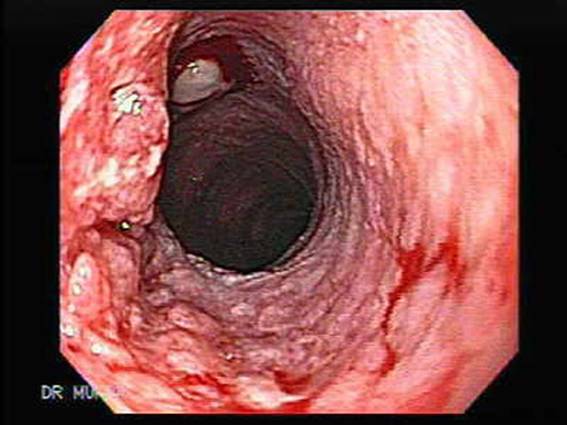
Эндоскопическая картина аденокарциномы
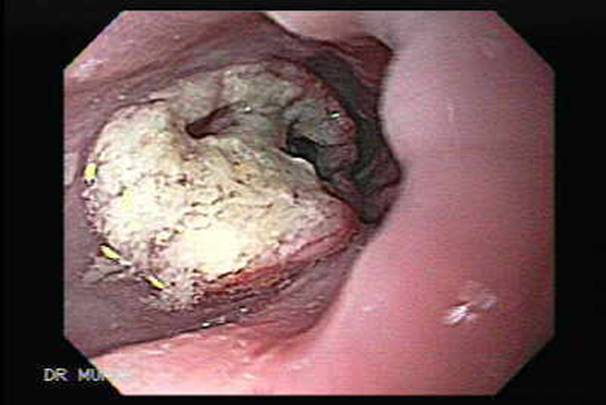
Эндоскопическая картина плоскоклеточного рака
- Клинический анализ крови. Позволяет выявить анемию, которая возникает из-за кровотечения или скудного рациона.
- Биохимический анализ крови. Он показывает состояние внутренних органов, а именно почек, печени и др.
- Анализ на онкомаркеры СА 19-9, РЭА.
- Исследование биоматериала, взятого во время биопсии. В нем определяют рецепторы белка HER2. При их наличии против новообразования можно использовать таргетную терапию.
Лечение
Основной метод лечения – хирургическая операция, однако комплексный подход позволяет улучшить результаты. Поэтому различные методики комбинируются.
В ходе операции удаляют пищевод целиком или его часть, все зависит от распространенности и локализации патологического процесса.
Когда опухоль находится в шейном отделе, удаляют большую часть пищевода. После этого желудок поднимают и подшивают к оставшейся части пищевода. Кроме того, вместо удаленной части методом пластической операции может быть использована часть толстой или тонкой кишки. При возможности выполнения резекции шейного отдела пищевода может быть выполнена пластика кишкой с микрососудистым анастомозом сосудов на шее.
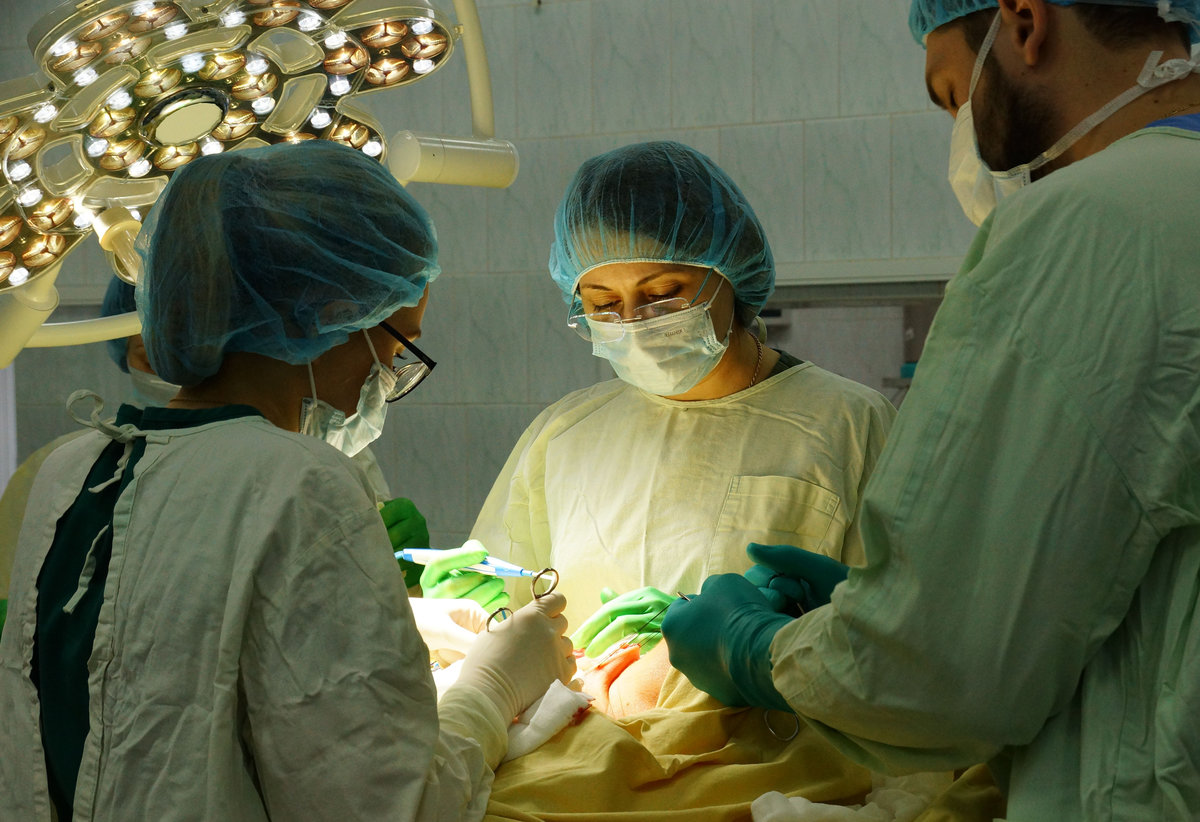
При локализации опухоли в шейном отделе пищевода с большим распространением приходится выполнять операцию в объеме: удаления фаринголарингоэктомии с одномоментной пластикой пищевода желудочным трансплантатом, с пришиванием его к корню языка.
Хирургическое вмешательство по удалению части пищевода с последующим замещением трансплантатом может быть проведено открытым способом или методом торакоскопии и лапароскопии.
При любом типе вмешательства удаляют регионарные лимфоузлы, которые потом исследуют в лаборатории методом гистологии. Если в них обнаруживаются раковые клетки, то после операции пациенту прописывают лучевое лечение или химиотерапию в комбинации с ЛТ.
Также существуют паллиативные операции. Их проводят для того, чтобы пациент мог питаться, если из-за опухоли он не может глотать. Этот тип вмешательства называется гастростома, то есть введение через переднюю брюшную стенку в желудок специальной трубки для питания.
Применяется ионизирующее излучение с целью уничтожения клеток новообразования. Такая терапия может проводиться:
Разновидности лучевого лечения:
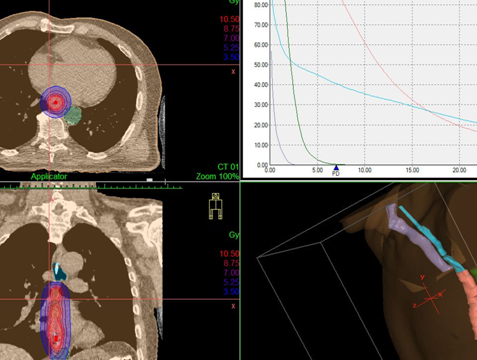
Дозное распределение, получаемое при дистанционной конформной лучевой терапии и внутрипросветной брахитерапии
Данная методика представляет собой введение в организм препаратов, затормаживающих жизнедеятельность опухолевых клеток или уничтожающих их. Лекарственные средства принимаются внутрь или вводятся в вену, после чего попадают в кровоток и достигают почти всех областей организма.
Химиотерапия осуществляется циклами. Это связано с тем, что действие препарата направлено на те клетки, которые постоянно делятся. Введение повторяется через определенное число дней, что связано с клеточным циклом. Циклы химиотерапии, как правило, имеют продолжительность 2-4 недели, больным обычно показано несколько циклов.
Как и облучение, химиотерапия показана в адъювантном и неоадъвантном режимах. Также она применяется, чтобы облегчить симптоматику тем больным, у которых рак распространен и не поддается хирургическому лечению.
Направлена на блокировку роста новообразования путем воздействия на определенные мишени, то есть на те молекулы, которыми определяются деление и рост опухоли. Если в биоматериале, взятом методом биопсии, находят такие белковые молекулы, то может быть эффективна именно таргетная терапия.
При проведении паллиативной терапии применяют следующие методики:
- Бужирование, то есть расширение пищевода.
- Установку стентов эндоскопическим методом. Стенты – это полые цилиндры, которые устанавливаются в просвет пищевода, чтобы обеспечить проходимость пищи.
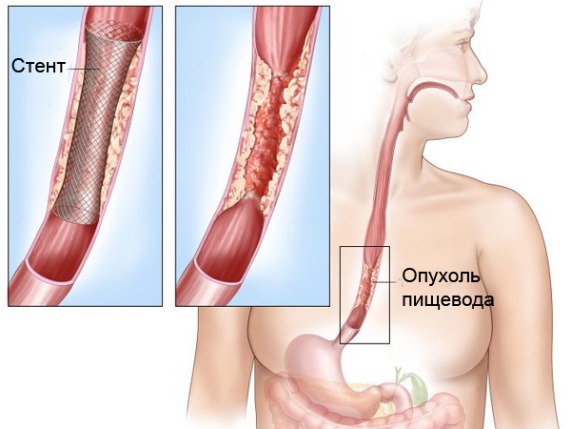
Стентирование рака пищевода
Лечение рака пищевода изменяется в зависимости от стадии
Обычно применяются эндоскопические методики лечения:
- PDT, или фотодинамическая терапия;
- RFA, то есть радиочастотная абляция;
- EMR, эндоскопическое удаление опухоли слизистой оболочки (после этого обеспечивается длительное наблюдение с применением эндоскопии, чтобы вовремя заметить рецидив, если он возникнет).
Новообразование затрагивает мышечную или собственную пластинку слизистой, но не поражает другие органы и лимфоузлы.
- Рак T1. Заболевание на ранней стадии, когда оно находится только в небольшой зоне слизистой и не достигло подслизистой основы (новообразования Т1а), может быть удалено путем эндоскопической резекции в рамках слизистой или подслизистого слоя. Иногда медики рекомендуют хирургически удалить часть пищевода, а затем провести облучение и химиотерапию.
- Рак Т2. Опухоль затрагивает мышечную пластинку слизистой. Таким пациентам перед операцией проводятся химиотерапия и облучение. Исключительно хирургическое удаление рекомендовано, только когда новообразование менее 2 см в размере.
Когда рак локализуется в зоне шеи, вместо операции в качестве основного метода лечения могут быть рекомендованы облучение и химиотерапия.
На второй стадии опухоль распространяется на главный мышечный слой пищевода либо его наружную оболочку. Также новообразование поражает 1 или 2 расположенных рядом лимфоузла.
При третьей стадии новообразование прорастает на наружную оболочку пищевода, может распространяться на соседние органы, им поражены регионарные лимфоузлы. Рекомендовано комбинированное лечение, которое включает операцию и предваряющие ее химиотерапию либо химиотерапию в сочетании с облучением. Если по состоянию здоровья для пациента есть риск не пережить операцию, то химиотерапия в сочетании с облучением становится основным методом лечения.
Рак затрагивает отдаленные лимфоузлы, есть метастазы в отдаленных органах (легких, печени). На такой стадии основная цель лечения – как можно более долгий контроль над распространением и размером новообразования. Пациентам проводится симптоматическое лечение для облегчения боли, восстановления возможности питаться и др. Применяется лучевая терапия и химиотерапия.
Профилактика
Чтобы предупредить такое заболевание, нужно исключить алкоголь и курение, контролировать массу тела. Если у человека присутствует повышенный риск развития этого типа рака (это такие патологии, как пищевод Барретта, ахалазия кардии, стриктуры пищевода, хронические эзофагит), то он должен регулярно обследоваться с обязательным применением эндоскопии.
Важно! Если рано диагностировать рак пищевода, то его можно вылечить с вероятностью от 85% до 100%.
Когда лечение рака завершено, нужно регулярно проходить контрольные обследования:
- После радикального лечения, сочетающего хирургию, химиотерапию и лучевую терапию: в первые 2 года – каждые 3-6 месяцев, в следующие 3-5 лет – каждые 6-12 месяцев, затем – каждый год.
- Тем, у кого был обнаружен ранний рак и кто подвергся эндоскопическому удалению слизистой: в первый год – каждые 3 месяца эндоскопическое обследование, во 2-й и 3-й годы – каждые полгода, затем – каждый год.


Авторская публикация:
Бекяшева Зоя Салаватовна
Ординатор хирургического отделения опухолей головы и шеи
НМИЦ онкологии им Н.Н. Петрова

Под научной редакцией:
Раджабова Замира Ахмедовна
Заведующий отделением опухолей головы и шеи, врач-онколог, научный сотрудник, доцент, кандидат наук
НМИЦ онкологии им. Н.Н. Петрова
Читайте также:

