Петров с в руководство по иммуногистохимической диагностике опухолей человека
Гиляров Александр Владимирович – кандидат медицинских наук
БТIII – бета-тубулин III
ГАМК – ?-аминомасляная кислота
ГЭБ – гематоэнцефалический барьер
ДААК – декарбоксилаза L-ароматических аминокислот
мРНК – матричная рибонуклеиновая кислота
НСК – нейральные стволовые клетки
ПФ – промежуточный филамент
ЦНС – центральная нервная система
ABC-метод – avidin and biotinylated horseradish peroxidase macro-molecular сomplex
AIF-1 – allograft inflammatory factor-1
AP – щелочная фосфатаза
AS-MX – нафтол АС-Микс фосфат
BSA – бычий сывороточный альбумин
CAM – молекула клеточной адгезии
CDK – циклин-зависимая киназа
CNP – 2?,3?-циклический нуклеотид 3?-фосфодиэстеразы
EDTA – этилендиаминтетрауксусная кислота
ENO1 – ненейрональная енолаза (?)
ENO2 – нейронспецифическая енолаза (?)
ENO3 – мышечная енолаза (?)
FITC – флуоресцеина изотиоцианат
GFAP – глиальный фибриллярный кислый белок
HRP – пероксидаза хрена
LAB – авидин-биотиновая методика
LSAB – стрептавидин-биотиновая методика
MAG – миелин-ассоциированный гликопротеин
МАР2 – микротубулин-ассоциированный протеин 2
MBP – основной белок миелина
MOBP – основной белок олигодендроцитов, связанный с миелином
MOG – миелиновый гликопротеин олигодендроцитов
MRF-1 – microglia response factor
NCAM – нейрональная молекула клеточной адгезии
NF-H – высокомолекулярные белки нейрофиламентов
NF-L – низкомолекулярные белки нейрофиламентов
NF-M – среднемолекулярные белки нейрофиламентов
NSE – нейронспецифическая енолаза
OSP – олигодендроцит-специфический белок
PAP – пероксидаза-антипероксидазный метод
PBS – фосфатно-солевой буфер
PCNA – ядерный антиген пролиферирующих клеток
PGP – протеиновые генные продукты
PI – пропидий иодид
PKA – сАМР-зависимая протеинкиназа
PLP – протеолипидный белок
PRD – домен, богатый пролином
PSA – полисиаловая кислота
TBS – трис-солевой буфер
TRITC – тетраметилродамин изотиоцианат
В последние годы методы иммуногистохимии заняли одно из главных мест среди методов морфологической диагностики.
Отличительной особенностью данного руководства является сочетание необходимых сведений о теоретических основах методов иммуногистохимии с примерами их практического использования на основе оригинальных и усовершенствованных авторами протоколов обработки препаратов, помещенных в приложении. Поскольку в круг интересов авторов входит изучение органов нервной системы, книга дополнена теоретическими сведениями и практическими рекомендациями по использованию важнейших нейрональных и глиальных маркеров дифференциации, что, несомненно, будет полезным как для нейроморфологов, так и для нейрофизиологов.
Настоящее руководство отражает современный уровень развития иммуногистохимии как науки и аккумулирует многолетний опыт сотрудников лаборатории функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии НИИ экспериментальной медицины СЗО РАМН, связанный с использованием методов иммуногистохимии.
Авторы надеются, что внесенные изменения и дополнения увеличили информативность второго издания руководства, которое адресовано работникам практического здравоохранения и научным сотрудникам, использующим методы иммуногистохимического исследования в своей повседневной деятельности.
В настоящее время основными задачами иммуногистохимии можно считать разработку и теоретическое обоснование новых методов молекулярного анализа внутриклеточных структур, изучение продуктов экспрессии генов, изучение пролиферации и гибели клеток, гистотипирование опухолей (часть молекулярной и клеточной диагностики) и методическое обеспечение иммуноморфологии – области гистологии, в которой используются иммуногистохимические методы для изучения тканевой организации, развития тканей и клеточной дифференциации.
В нашей стране в настоящее время иммуногистохимические методы достаточно широко используются при патогистологической диагностике онкологических заболеваний (Петров С. В. [и др.], 2004). Морфологические диагностические подходы, основанные на использовании методов иммуногистохимии постепенно внедряются и в судебно-медицинской экспертизе (Коржевская В. Ф. [и др.], 2011).
Коржевская В. Ф., Сухорукова Е. Г., Кирик О. В. [и др.]. Особенности судебно-гистологического исследования головного мозга при смерти от тупой травмы головы. – СПб.: Изд-во СПбМАПО, 2011. – 35 с.
Петров С. В., Райхлин Н. Т. Руководство по иммуногистохимической диагностике опухолей человека. – Казань, 2004. – 456 с.
Coons A. H., Creech H. J., Jones R. N. Immunological properties of an antibody containing a fluorescent group // Proc. Soc. Exp. Biol. Med. – 1941. – Vol. 47. – P. 200–202.
Coons A. H., Creech H. J., Jones R. N. [et al.]. The demonstration of pneumococcal antigen in tissues by use of fluorescent antibody // J. Immunol. – 1942. – Vol. 45. – P. 159–170.
Coons A. H., Kaplan M. H. Localisation of antigen in tissue cells // J. Exp. Biol. Med. – 1950. – Vol. 91, № 1. – P. 1–13.
K?hler G., Milstein С. Continuous cultures of fused cells producing antibody of pre-defined specificity // Nature. – 1975. – Vol. 256, № 5517. – P. 495–497.
Антитела – это растворимые гликопротеины глобулиновой фракции сыворотки крови и других биологических жидкостей, образующиеся в ответ на введение или проникновение антигена (чужеродных веществ, в том числе бактерий, вирусов, токсинов) в организм теплокровных животных (Ройт А. [и др.], 2000). На сегодняшний день антитела являются наиболее важными реагентами для использования в фундаментальных и прикладных исследованиях, что обусловлено их способностью к высокоспецифическому связыванию с антигеном, вызвавшим их образование.
Применяя определенные методические приемы, можно добиться образования антител к практически неограниченному набору антигенов. Однако стоит отметить, что стоимость коммерческих антител и затраты на их получение в условиях лаборатории могут различаться в десятки раз в зависимости от требуемой чистоты, специфичности и области применения, поэтому еще на этапе планирования исследования стоит уделить особое внимание правильному подбору антител. В этом может помочь и данное руководство.

Рис. 1. Структура кроличьего иммуноглобулина IgG. Тяжелые и легкие цепи образуют вариабельный и константный домены, которые соединены дисульфидными мостиками (?). При помощи папаина (цистеиновой эндопротеазы) протеолиз разделяет молекулу, в результате чего образуются два антигенсвязывающих фрагмента (Fab) и один кристаллизующийся фрагмент (Fc). Под действием пепсина (аспартатной кислой эндопептидазы) происходит отщепление двухвалентного антигенсвязывающего фрагмента (Fab?)2 (по: Boenisch T., 2001; с изменениями)
В зависимости от размера, заряда, аминокислотной последовательности и содержания углеводов в составе тяжелой цепи различают пять изотипов (классов) антител: IgM, IgG, IgA, IgE и IgD. Класс IgG подразделяется на четыре подкласса (IgG1, IgG2, IgG3, IgG4), которые различаются по антигенной структуре и спектру биологических функций (Burton D. R. [et al.], 1996). IgG – это наиболее широко представленный класс иммуноглобулинов, на его долю приходится 70 – 75 % их общего количества. Класс IgA разделяют на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех теплокровных. Кроме того, IgM является пентамером, т. е. пять молекул соединяются между собой, а IgA – димером.
При помощи папаина антитела можно расщепить на два одинаковых антигенсвязывающих Fab-фрагмента (fragment antigen binding) и Fc-фрагмент (fragment cristalizable), способный к кристаллизации. Область Fab образована гипервариабельными участками Ни L-цепей и определяет антигенную специфичность; Fc-фрагмент осуществляет эффекторные функции (связывание иммуноглобулина с клетками, компонентами комплемента) (Atassi M. Z., 1984). К Fc-фрагменту антител можно присоединять различные вещества, что используется при постановке иммунохимических реакций.
В 1993 г. группой бельгийских ученых было сделано важное открытие: кроме классических антител в крови некоторых животных (верблюдов, лам и др.) обнаруживаются особые, неканонические антитела с упрощенной структурой. Они состоят из димера укороченной (без CH1-домена) тяжелой цепи; легкая цепь отсутствует, т. е. антигенузнающий участок формируется лишь вариабельными доменами тяжелых цепей. Такие антитела принято называть однодоменными антителами, или мини-антителами. Благодаря малым размерам (молекулярная масса однодоменных антител составляет примерно 12 – 15 кДа) и компактности антигенсвязывающего участка, можно получить мини-антитела, способные узнавать участки антигенов, недоступные для классических антител, в этом состоят весомые преимущества мини-антител (Тиллиб С. В., 2011).
Небольшой участок антигена, с которым будет связываться антитело, называется эпитопом. Обычно в эпитоп входит от одной до шести молекул моносахаридов или аминокислот, расположенных на поверхности антигена. Антитела распознают не отдельные химические группы в структуре антигена, а пространственную форму эпитопов. Они способны улавливать различия в распределении зарядов на поверхности антигена, оптическую и стереоизомерию, минимальные различия в первичной структуре. Вследствие этого б|ольшая часть антител способна связываться только с нативными антигенами или с фрагментами антигена, сохраняющими третичную структуру. Следовательно, для успешного взаимодействия антигена и антитела эпитоп должен находиться на поверхности молекулы. Следует учитывать, что при денатурации молекул (например, под действием фиксирующих жидкостей, экстремальных значений pH буферных растворов и др.) эпитоп может повышать или понижать свою иммуногенность.
Большие молекулы (например, белки) имеют несколько эпитопов, поэтому они стимулируют образование антител нескольких видов к разным эпитопам одного и того же антигена. Такие антитела называют поликлональными. Они более толерантны к незначительным конформационным изменениям антигена (полиморфизму, различной степени гликозилирования, фосфорилирования, частичной денатурации), что дает больше возможностей экспериментатору при планировании исследований.
Антитела, реагирующие с одним единственным эпитопом, называют моноклональными. В отличие от поликлональных антител, они чувствительны даже к небольшим конформационным изменениям антигена. Например, можно получить моноклональные антитела, узнающие молекулу белка, фосфорилированную по определенному сайту. Благодаря высокой специфичности моноклональные антитела являются отличными первичными антителами, то есть антителами для выявления искомого антигена, так как они дают слабое неспецифическое связывание, а значит, и меньшее фоновое окрашивание. По сравнению с поликлональными антителами они обладают большей гомогенностью, что обеспечивает высокую воспроизводимость результатов. Однако связывание с единственным эпитопом обусловливает низкую чувствительность, проявляющуюся в слабом иммуноокрашивании на срезах. К тому же высока вероятность того, что фиксатор сделает этот единственный эпитоп недоступным для антител, в результате чего иммуноокрашивания вообще не произойдет. Кроме того, методы получения моноклональных антител более сложные и трудоемкие, чем методы получения поликлональных иммунных сывороток, что приводит к значительному увеличению их стоимости.
До недавнего времени большинство моноклональных антител являлись иммуноглобулинами мыши. Поэтому в исследовательской практике работы с лабораторными животными (мышами и крысами) применять их было неудобно из-за перекрестного взаимодействия вторичных реагентов с собственными иммуноглобулинами животного. За последние несколько лет появилось много новых моноклональных антител, являющихся кроличьими иммуноглобулинами (например, клоны SP от Spring Bioscience). Считается, что кроличьи моноклональные антитела позволяют добиться лучшей визуализации антигена по сравнению с мышиными. По крайней мере, у кроличьих моноклональных антител имеется очевидное преимущество: их удобно выявлять стандартными вторичными реагентами при проведении исследований с использованием мышей и крыс в качестве лабораторных животных.
РЕСПУБЛИКАНСКИЙ КЛИНИЧЕСКИЙ ОНКОЛОГИЧЕСКИЙ ДИСПАНСЕР МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ ТАТАРСТАН
ОБЩЕСТВЕННЫЙ ПРОТИВОРАКОВЫЙ ФОНД РЕСПУБЛИКИ ТАТАРСТАН
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ "РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ НАУЧНЫЙ ЦЕНТР ИМ. Н. Н. БЛОХИНА РАМН"
КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
РОССИЙСКОЕ ОТДЕЛЕНИЕ МЕЖДУНАРОДНОЙ АКАДЕМИИ ПАТОЛОГИИ
РУКОВОДСТВО ПО ИММУНОГИСТОХИМИЧЕСКОЙ ДИАГНОСТИКЕ ОПУХОЛЕЙ ЧЕЛОВЕКА
Издание 3-е, дополненное и переработанное
Под редакцией С.В.Петрова, Н.Т.Райхлина
Глава 1. История иммуногистохимии. И.Н. Чаиркин, Р.Ш. Хасанов
Глава 2. Методы иммуногистохимии. А. П. Киясов
Глава 3. Общие принципы иммуногистохимической диагностики и классификации опухолей. С. В. Петров, Н. Т. Райхлин
Глава 4. Иммуногистохимическая диагностика опухолей легкого, мезотелиомы. С. В. Петров
Глава 5. Молекулярно-генетическая диагностика опухолей лёгкого. Е.А. Коган
Глава 6. Иммуногистохимическая диагностика опухолей слюнных желёз, пищевода, желудка, толстой кишки, печени. С. В. Петров
Глава 7. Иммуногистохимическая диагностика опухолей поджелудочной железы. Л. Е. Гуревич
Глава 8. Иммуногистохимическая диагностика опухолей почек А.М. Романенко, А. Лломбарт-Бош (A. Llombart-Bosch)
Глава 9. Иммуногистохимическая диагностика опухолей мочевого пузыря. А.М. Романенко, Ш. Фукушима (Sh. Fukushima)
Глава 10. Иммуногистохимическая диагностика опухолей молочной железы. В. Д. Ермилова, С.В.Петров
Глава 11. Иммуногистохимическая диагностика опухолей вульвы, влагалища, шейки и тела матки. С.В.Петров
Глава 12. Иммуногистохимическая диагностика опухолей яичников. Б.Чернобильский (B. Czernobilsky)
Глава 13. Иммуногистохимическая диагностика герминогенных опухолей яичка. А.М. Романенко
Глава 14. Иммуногистохимическая диагностика опухолей предстательной железы. А.М. Романенко
Глава 15. Иммуногистохимическая диагностика опухолей щитовидной и паращитовидных желёз, вилочковой железы С.В. Петров
Глава 16. Иммуногистохимическая диагностика опухолей кожи. С.В. Петров
Глава 17. Иммуногистохимическая диагностика первичных и метастатических опухолей головного мозга. А. Г. Коршунов
Глава 18. Иммуногистохимическая диагностика аденом (апудом) гипофиза. И. Н. Чаиркин, Дж. Цервос - Наварро (Cervos-Navarro G.), В. Ениш (Jänisch W.), Г. Штольтенбург (Stoltenburg G.)
Глава 19. Иммуногистохимическая диагностика опухолей надпочечников. Г. А. Полякова
Глава 20. Иммуногистохимическая диагностика опухолей параганглионарных структур. К.М. Пожарисский
Глава 21. Иммуногистохимическая диагностика опухолей мягких тканей. А.В. Смирнов
Глава 22. Морфологические особенности лимфом в классификации ВОЗ (В-клеточные опухоли) Н.А. Пробатова
Глава 23. Иммуногистохимическая диагностика лимфом Н. Н. Тупицын
Глава 24. Иммуногистохимическая диагностика гистиоцитарных сарком А.И. Павловская
Глава 25. Иммуногистохимическая диагностика мелкокруглоклеточных опухолей. Антонио Лломбарт-Бош(A. Llombart-Bosch), C. Наварро (C.Navarro), А. Семпере (A. Sempere)
Глава 26. Цитокератины в иммуногистохимической диагностике опухолей.
М. Виберг (Vyberg M.), Р. Молл (Moll R.)
Глава 27. Прогностическое и предсказательное значение иммуногистохимических маркеров К.М. Пожарисский, Е.Е. Леенман
Глава 28. Гибридизация и ПЦР in situ в морфологической диагностике предопухолевых и опухолевых заболеваний. Л.Э. Завалишина, Г.А. Франк
Глава 29. АПУД-система (диффузная эндокринная система): основные представления, эндокринноклеточные опухоли (апудомы), иммуногистохимическая диагностика. Н. Т. Райхлин
Глава 30. Апоптоз – основные механизмы развития и роль в онкологической практике. Н.Т. Райхлин, А.Н. Райхлин.
Глава 31. Экономические аспекты иммуногистохимической диагностики опухолей Р.Ш. Хасанов, С.В. Петров
СПИСОК СОКРАЩЕНИЙ………………………….……….
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ………………………..…….
Диагностика опухолей в настоящее время должна основываться на комплексном применении последних достижений медико-биологических наук. Это обусловлено ростом числа онкологических больных и высокими требованиями современной онкологической практики. Одним из таких диагностических подходов, которому и посвящена книга, является иммунный метод выявления отдельных белковых молекул в гистологических срезах опухоли. Это уже 3-е издание книги и в нём представлена главная и исчерпывающая информация об этой новой и перспективной области онкологии. Отрадно отметить тот факт, что данная книга, являясь единственным отечественным подобным Руководством, издается именно в Казани, ученые которой были инициаторами распространения новой технологии по многим городам России и стран СНГ.
В книге, состоящей из 31 главы (с фотоприложением объемом 50 стр.) обобщены результаты иммуногистохимических исследований практически всех опухолей человека. Авторы глав - известные патологи России (Н.А. Пробатова, Г.А. Франк, К.М. Пожарисский, Н.Т. Райхлин, А.И. Павловская, Н.Н. Тупицын и др.), Украины (А.М. Романенко), Испании (А. Лломбарт-Бош и др.), Германии (Р. Молл), Израиля (Б. Чернобильский), Дании (М. Виберг).
Даются базовые сведения о молекулярно-биологических методах морфологической диагностики рака и предрака. Приводятся современные данные об экономической эффективности применения иммуногистохимии в онкологической клинике.
Монография предназначается для патологоанатомов, цитологов, онкологов, студентов старших курсов медицинских ВУЗ’ов, а также для медиков и биологов, занимающихся изучением опухолей человека.
Петров Семен Венедиктович, доктор медицинских наук, профессор кафедры патологической анатомии Казанского государственного медицинского Университета, руководитель лаборатории иммуногистохимии Клинического онкологического диспансера Министерства здравоохранения Республики Татарстан, г. Казань, Россия
Райхлин Натан Танфелевич, доктор медицинских наук, профессор, Заслуженный деятель науки Российской Федерации, ведущий научный сотрудник лаборатории гистохимии и электронной микроскопии отдела патологической анатомии опухолей человека НИИ клинической онкологии Российского Онкологического Научного Центра им. Н.Н. Блохина Российской Академии Медицинских Наук, г. Москва, Россия
Виберг Могенс, доктор медицины, профессор Института патологии госпиталя Университета, г. Аалборг, Дания
Гуревич Лариса Евсеевна, кандидат биологических наук, ведущий научный сотрудник отдела патологической анатомии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского (МОНИКИ), г. Москва, Россия
Ениш Вернер, доктор медицины, профессор Института нейропатологии Свободного Университета, г. Берлин, Германия
Ермилова Валерия Дмитриевна, кандидат медицинских наук, ведущий научный сотрудник отдела патологической анатомии опухолей человека НИИ клинической онкологии Российского Онкологического Научного Центра им. Н.Н. Блохина Российской Академии Медицинских Наук, г. Москва, Россия
Завалишина Лариса Эдуардовна, кандидат биологических наук, старший научный сотрудник отделения патологической анатомии Московского научно-исследовательского онкологического института им. П. А. Герцена, Москва, Россия
Киясов Андрей Павлович, доктор медицинских наук, профессор, заведующий кафедрой нормальной анатомии Казанского государственного медицинского Университета, г. Казань, Россия
Коган Евгения Александровна, доктор медицинских наук, профессор кафедры патологической анатомии Московской Медицинской Академии им. И.М. Сеченова, г. Москва, Россия
Коршунов Андрей Геннадьевич, доктор медицинских наук, профессор, заведующий отделением нейропатоморфологии НИИ нейрохирургии им. академика Н.Н. Бурденко Российской Академии Медицинских Наук, г. Москва, Россия
Леенман Елена Ефремовна – кандидат медицинских наук, ведущий научный сотрудник лаборатории иммуногистохимии Центрального Научно-исследовательского рентгенорадиологического института, г. Санкт-Петербург, Россия
Лломбарт-Бош Антонио, доктор медицины, профессор, заведующий кафедрой патологии медицинского факультета Университета, г. Валенсия, Испания
Молл Рональд, доктор медицины, профессор Института патологии Университета Филиппа, г. Марбург, Германия
Наварро Самуэль, сотрудник кафедры патологии медицинского факультета Университета, г. Валенсия, Испания
Павловская Алла Михайловна, кандидат медицинских наук, ведущий научный сотрудник отдела патологической анатомии опухолей человека НИИ клинической онкологии Российского Онкологического Научного Центра им. Н.Н. Блохина Российской Академии Медицинских Наук, г. Москва, Россия
Пожарисский Казимир Марианович – доктор медицинских наук, профессор, заведующий лабораторией иммуногистохимии Центрального Научно-исследовательского рентгенорадиологического института, г. Санкт-Петербург, Россия
Полякова Галина Александровна, доктор медицинских наук, профессор, ведущий научный сотрудник отдела патологической анатомии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского (МОНИКИ), г. Москва, Россия
Пробатова Наталья Александровна, доктор медицинских наук, профессор, ведущий научный сотрудник НИИ клинической онкологии Российского Онкологического Научного Центра им. Н.Н. Блохина Российской Академии Медицинских Наук, г. Москва, Россия
Райхлин Анатолий Натанович, кандидат медицинских наук, сотрудник кожновенерологического диспансера Комитета здравоохранения, г. Москва, Россия
Романенко Алина Михайловна, доктор медицинских наук, профессор, академик АМН и член-корреспондент НАН Украины Киев, заведующая отделом патологической анатомии Института урологии АМН Украины, Украина.
Семпере Алейджо, сотрудник кафедры патологии медицинского факультета Университета, г. Валенсия, Испания
Смирнов Андрей Вильямович, кандидат медицинских наук, ведущий научный сотрудник отдела патологической анатомии опухолей человека НИИ клинической онкологии Российского Онкологического Научного Центра им. Н.Н. Блохина Российской Академии Медицинских Наук, г. Москва, Россия
Тупицын Николай Николаевич, доктор медицинских наук, профессор, ведущий научный сотрудник, заведующий лабораторией иммунологии гемопоэза, НИИ клинической онкологии Российского Онкологического Научного Центра им. Н.Н. Блохина Российской Академии Медицинских Наук, г. Москва, Россия
Франк Георгий Авраамович, доктор медицинских наук, профессор, член-корреспондент РАМН, руководитель отделения патологической анатомии Московского научно-исследовательского онкологического института им. П. А. Герцена, Москва, Россия
Фукушима Шоджи, профессор отдела патологии медицинского факультета Университета, г. Осака, Япония
Хасанов Рустем Шамильевич, доктор медицинских наук, профессор, заведующий кафедрой онкологии и хирургии КГМА, главный врач Клинического онкологического диспансера Республики Татарстан, г. Казань, Россия
Цервос - Наварро Джордж, доктор медицины, профессор, ректор международного Университета Каталонии, г. Барселона, Испания
Чаиркин Иван Николаевич, доктор медицинских наук, профессор Мордовского государственного Университета им. Н. П. Огарева, г. Саранск, Россия
Чернобильский Бернард, доктор медицины, профессор патологии Иерусалимского Университета, заведующий лабораторией патологии при больнице Адасса, г. Несс-Зиона, Израиль
Штольтенбург Гизель, доктор медицины, профессор, директор Института нейропатологии Свободного Университета, г. Берлин, Германия
Ежегодно в мире раком мочевого пузыря заболевают 335,8 тыс. человек, с развитием летального исхода у 132 тыс. человек, то есть каждый третий умирает от данного заболевания. В России регистрируется ежегодно примерно 12700 новых случаев рака мочевого пузыря. Его доля в структуре онкологической заболеваемости среди мужского населения составляет 4,5 %, среди женского населения - 1,1 % [1].
В Российской Федерации выявление больных с поверхностной формой рака (I стадия) составляет всего лишь 20-30 % наблюдений, в противоположность зарубежным данным, в соответствии с которыми I стадия рака мочевого пузыря диагностируется в 80 % случаев [2]. В нашей стране в 11,6-15,6 % наблюдений выявляется IV стадия рака мочевого пузыря.
Следует указать и тот факт, что при адекватной диагностике и своевременном лечении жизнь умерших от рака мочевого пузыря можно было бы продлить в среднем на 14 лет. Именно поэтому, своевременная диагностика опухолей мочевого пузыря остается одной из важнейших задач современной онкоморфологии.
В современной литературе имеется большой объем опубликованных работ по применению диагностических иммуногистохимических маркеров при раке мочевого пузыря [3,5,6]. Однако, в клинических рекомендациях, выпущенных по инициативе Российского общества онкоурологов с разрешения Европейской ассоциации по урологии, в 2009 году сведения по применению конкретных иммуногистохимических маркеров для диагностики рака мочевого пузыря отсутствуют. Нет их и в стандартах диагностики и лечения рака мочевого пузыря, как в России, так и в Европе. Все вышесказанное позволило нам сформулировать цель нашего исследования.
Разработать панель иммуногистохимических маркеров ранней диагностики, стадирования и прогноза рака мочевого пузыря.
Материалы и методы исследования
Иммуногистохимические реакции проводили на серийных парафиновых срезах (5мкм), используя стрептавидин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, HRP (K0675), Dako, в качестве хромогена - диаминобензидин (Dako).
Иммуногистохимическое исследование 13 маркеров было проведено на биопсийном и операционном материале 66 пациентов. Все используемые моноклональные антитела были разделены на группы по функциональной значимости:
- маркеры пролиферативной активности - Ki67, PCNA, p63;
- супрессор опухолевого роста - р53;
- маркер апоптоза - Bcl2;
- рецептор эпидермального фактора роста - EGFR;
- цитокератиновый профиль - СК7, СК8, СК10/13, СК17, СК18, СК19.
Интенсивность реакций с антигенами, локализованными в цитоплазме (цитокератины 7,8,13,17,18,19) и на мембранах клеток (EGFR), оценивали полуколичественным способом по балльной шкале от 0 до 3, учитывая выраженность реакции и ее локализацию: 0 - отсутствие реакции, 1 - слабая реакция, 2 - умеренная реакция, 3 - сильная реакция.
Результаты реакций с антигенами, имеющими ядерную локализацию (PCNA, Ki67, p53, p63, bcl-2), оценивали по системе подсчета histochemical score. Система подсчета включает в себя интенсивность иммуногистохимической окраски по 3-балльной шкале и долю (%) окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски 0 - нет окрашивания, 1 - слабое окрашивание, 2 - умеренное окрашивание, 3 - сильное окрашивание.
Формула подсчета следующая: histochemical score = ∑ P (i) х I,
где i - интенсивность окрашивания, выраженная в баллах от 0 до 3.
P (i) - процент клеток, окрашенных с разной интенсивностью. Максимальное значение гистосчета должно соответствовать 300.
Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows.
Результаты исследования
При анализе показателей экспрессии иммуногистохимических маркеров, имеющих ядерное окрашивание, необходимо выделить маркер пролиферации Ki67, который четко показал отрицательную экспрессию в группе сравнения и имел корреляционную зависимость высокой степени значимости между стадией рака мочевого пузыря, процентом экспрессирующих клеток и интенсивностью иммуногистохимической реакции. То есть, с увеличением глубины инвазии опухоли возрастал процент экспрессирующих клеток и степень их экспрессии. Учитывая это, мы считаем, что данный маркер может использоваться в качестве критерия на ранних этапах диагностики рака мочевого пузыря.
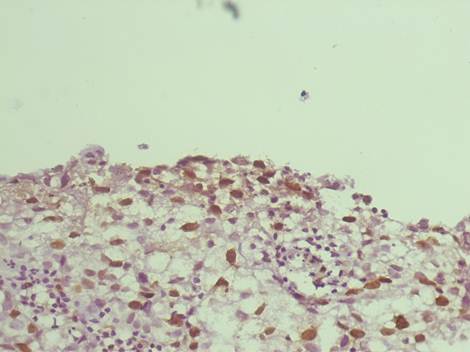
Рис. 1. Инвазивный уротелиальный рак. Умеренная и высокая экспрессия Кi-67 в ядрах уротелия
Равнозначные показатели получили при анализе экспрессии моноклонального антитела р53, являющегося белком-регулятором клеточного цикла и апоптоза. Отмечалось отсутствие окрашивания препаратов в группе сравнения, а интенсивность экспрессии и процент клеток с выраженной окраской имели четкую тенденцию к увеличению с возрастанием глубины инвазии опухоли. Раковые клетки с интенсивной иммуногистохимической реакцией маркера р53 появляются только в тех случаях, когда уротелиальная карцинома начинает прорастать в мышечный слой. Данные показатели позволяют использовать р53 как критерий прогноза заболевания, так и для определения глубины инвазии.
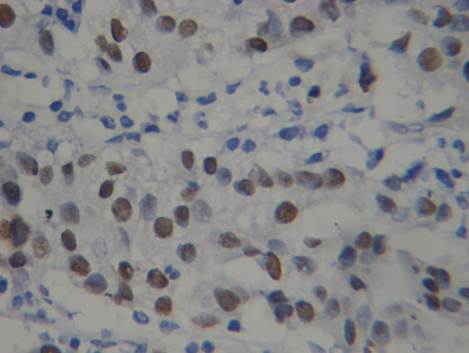
Рис. 2. Умеренная и выраженная экспрессия маркера Р53 в клетках инвазивной уротелиальной карциномы
Белок р63 также не дает экспрессии в группе сравнения. Однако достоверных различий частоты и интенсивности иммуногистохимической реакции в группах больных с различной стадией заболевания не выявлено.
При иммуногистохимической реакции на антигены, локализованные в цитоплазме, было установлено, что их экспрессия во всех исследованных группах больных является положительной. Достоверно значимых различий между группами больных по показателям иммуногистохимических реакций с цитокератинами (СК7, СК8, СК10/13, СК17, СК18, СК19) не установлено.
При исследовании полученных результатов иммуногистохимической реакции рецептора эпидермального фактора роста (EGFR) установлено, что его экспрессия отсутствует в группе сравнения и в группе больных с неинвазивными раками мочевого пузыря и нарастает с увеличением глубины инвазии. Таким образом, данное антитело не дает возможности на ранних этапах развития дифференцировать между собой доброкачественные процессы и злокачественные опухоли, поэтому данный маркер целесообразно использовать только для определения глубины инвазии опухоли.
Маркеры PCNA, Bcl2 не показали достоверной разницы в экспрессии ни в одной из изучаемых групп.
Выводы
Таким образом, проведенные исследования 13 моноклональных иммуногистохимических антител позволили разработать три основных направления в использовании данных маркеров:
- Для ранней и дифференциальной диагностики - определение маркеров Кi-67, р53, p63.
- Для глубины инвазии (стадирующая) - определение онкомаркера р53, рецептора эпидермального фактора роста (EGFR).
- Для прогноза заболевания - определение маркера пролиферативной активности Кi67.
Рецензенты:
Читайте также:

