Лучевая диагностика опухолей печени
а) Сравнительная анатомия и эмбриогенез:
1. Фиброполикистозные заболевания. Во время эмбрионального развития протоковой пластинки, окружающей воротную вену плода, могут возникать различные аномалии. В зависимости от стадии эмбрионального развития, во время которой они возникают, возможно формирование различных типичных и нетипичных аномалий печени и билиарного тракта, к которым относятся, например, врожденный фиброз печени, поликистоз печени, болезнь Кароли, билиарные гамартомы.
2. Сегментарная анатомия печени. Согласно классификации Куино печень делится на восемь сегментов условными плоскостями, проведенными вертикально через вены печени, и горизонтальной плоскостью, проведенной через правую и левую долевые ветви воротной вены. Понимание сегментарной анатомии становится особенно важным в свете недавних достижений хирургии печени и интервенционных вмешательств.
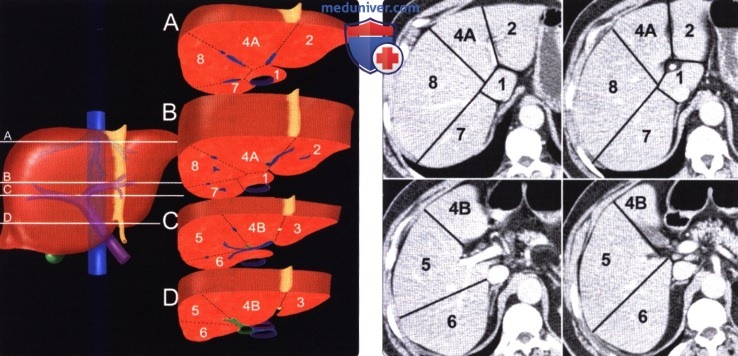
(Слева) На четырех срезах показаны восемь сегментов печени, отделенные друг от друга условными вертикальными плоскостями, проведенными через ветви печеночной вены, и горизонтальной плоскостью, проведенной через воротную вену.
(Справа) Аксиальные томограммы выполнены на уровне срезов, представленных на предыдущем изображении, сегменты печени пронумерованы. Плоскостью, проведенной через серповидную связку печени, медиальный (четвертый) сегмент отделен от латеральных (второй и третий сегменты левой доли). Третий сегмент на томограммах не показан.
в) КТ- и МР-протоколы. Томографические исследования, направленные на выявление диффузных или локальных поражений печени, должны быть многофазными и выполняться в различное время в момент введения контрастного вещества и после него.
У пациентов с гемохроматозом (или с наличием в ткани печени патологических очагов с повышенным содержанием железа, например, регенераторных узелков) определяется снижение интенсивности сигнала на МРТ и удлинение времени эха, обычно на томограммах in-phase. Нативная КТ позволяет оценить увеличение плотности печени у пациентов с гемохроматозом, при эффективной терапии из-за устранения избыточного количества ионов железа плотность паренхимы возвращается к нормальным значениям.
2. Ранняя артериальная фаза (18-25 секунд): позволяет наилучшим образом отобразить анатомию сосудов печени за счет реформатирования в трех плоскостях и создания трехмерных реконструкций (КТ- и МР-артериография) без помех, обусловленных примесью контрастного вещества в воротной вене. Тем не менее, изображения, полученные в раннюю артериальную фазу, обычно не позволяют достоверно определить очаговые объемные образования, даже если они являются гиперваскулярными.
3. Поздняя артериальная фаза (35-45 секунд): оптимальна для выявления гиперваскулярных образований в печени, например, гепатоцеллюлярного рака (ГЦР), очаговой гиперплазии, либо гиперваскулярных метастазов (в т.ч. первичных эндокринных опухолей).
4. Портально-венозная (паренхиматозная) фаза (60-70 секунд): характеризуется наиболее оптимальным отображением большинства гиперваскулярных опухолей печени, позволяет визуализировать печеночные вены и воротную вену. Портально-венозную фазу следует включать во все КТ- и МР-протоколы изолированно либо в сочетании с другими фазами.
При проведении исследования редко бывает необходимым выполнение более чем трех фаз для конкретного пациента; следует выбирать оптимальное сочетание фаз для получения наилучшего результата в оценке проявлений заболевания.
Гепатоспецифичные контрастные препараты для МРТ на основе гадолиния используются при динамическом контрастировании и в отсроченной фазе (Т1 ВИ).
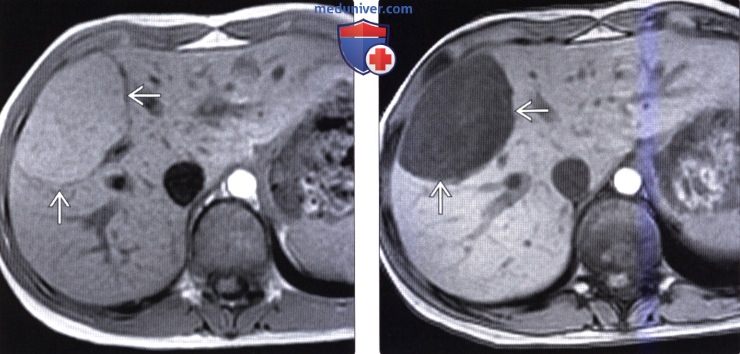
(Слева) На Т1 ВИ МР томограмме (in-phase) у девушки 18 лет, у которой ранее на КТ было случайно обнаружено объемное образование в печени, определяется равномерно гиперинтенсивная опухоль с тонкой капсулой.
(Справа) На Т1 ВИ МР томограмме (opposed-phase) у этой же пациентки определяется потеря сигнала от образования, что означает наличие жировой ткани в нем. Этот факт, наряду с наличием капсулы, молодым возрастом пациентки, отсутствием у нее других заболеваний, позволяет сделать заключение об аденоме печени.
д) Подходы к диагностике заболеваний и образований печени. Практически все очаговые изменения печени, которые возможно обнаружить, являются гиподенсными относительно паренхимы печени, накопившей контраст. Чтобы на заключение рентгенолога могли опираться клиницисты, необходимо вначале охарактеризовать выявленные изменения, а затем составить дифференциально-диагностический ряд.
Рекомендуется следующий подход к анализу патологических изменений со стороны печени: вначале необходимо оценить размеры, форму, плотность, степень васкуляризации и изменения во всех фазах контрастного усиления со стороны печени и любого обнаруженного патологического процесса.
Например, гепатомегалия в сочетании со снижением плотности печени обычно обусловлена стеатозом либо другим инфильтративным процессом. Уменьшение размеров печени на фоне увеличения хвостатой доли, уменьшения правой доли означает цирроз, либо является проявлением синдрома Бадца-Киари.
Окклюзия печеночной вены обычно возникает при синдроме Бадда-Киари, гиперкоагуляции, либо при сдавливании опухолью. Окклюзия воротной вены возникает чаще всего в результате портальной гипертензии, септического тромбофлебита (например, обусловленного дивертикулитом), гиперкоагуляции, сдавливания или опухолевой инвазии воротной вены.
Другие специфические изменения, используемые для характеристики поражений печени, включают в себя наличие или отсутствие кальцинатов, рубцов, кровоизлияний, капсулы и т. д.
При интерпретации результатов лучевых исследований всегда необходимо сопоставлять их с клиническими данными. Пример описания образования печени на КТ: «На КТ в артериальную фазу контрастного усиления определяется объемное образование в четвертом сегменте печени, имеющее округлую форму, равномерно накапливающее контраст, размером около 5 см, с наличием небольшого центрального рубца. Образование имеет плотность, практически не отличающуюся от плотности паренхимы печени в норме до контрастного усиления и в портально-венозную фазу.
е) Дифференциальный диагноз патологии печени:
1. Образования печени с центральным или эксцентрическим рубцом:
Частые:
• Очаговая узелковая гиперплазия
• Кавернозная гемангиома печени
Менее частые:
• Фиброламеллярный рак печени
• Гепатоцеллюлярный рак
• Холангиокарцинома (периферическая)
• Аденома печени
• Метастазы в печени
• Эпителиоидная гемангиоэндотелиома
2. Очаговые поражения печени с кровоизлиянием:
Частые:
• Повреждение печени
• Аденома печени
• Гепатоцеллюлярный рак
• Киста печени
• Врожденная аутосомно-доминантная поликистозная болезнь печени
Менее частые:
• Кровоизлияние в печень, обусловленное нарушением свертываемости крови
• Метастазы в печени
• HELLP-синдром
Частые:
• Очаговый сливной фиброз
• Периферическая холангиокарцинома
• Метастазы в печени и лимфома
• Гепатоцеллюлярный рак
• Метастазы по брюшине (имитируют новообразование в печени)
Менее частые:
• Эпителиоидная гемангиоэндотелиома
• Кавернозная гемангиома печени
• Первичный склерозирующий холангит
• Воспалительная псевдоопухоль печени
4. Объемное образование печени, содержащее жир:
Частые:
• Стеатоз (жировая инфильтрация печени) (может имитировать образование)
• Скопления жира около воротной вены
Менее частые:
• Гепатоцеллюлярный рак
• Аденома печени
• Метастазы в печени
• Гемангиолипома печени
• Опухоли печени после спиртовой абляции (имитируютжировое образование)
• Дефектный участок печени после оперативного вмешательства (имитирует жировое образование)
Редкие, но важные
• Тератома или липосаркома
• Очаговая узелковая гиперплазия
• Ксантоматозные очаги при гистиоцитозе X (Лангерганса)
5. Кистозные образования печени:
Частые:
• Киста печени
• Врожденная аутосомно-доминантная кистозная болезнь печени
• Пиогенный абсцесс печени
• Билиарная гамартома
• Билома/серома
• Стеатоз, жировая инфильтрация (имитирует)
Менее частые:
• Гидатидная киста печени
• Метастазы в печени или лимфома
• Билиарная цистаденокарцинома
• Кандидоз печени
• Болезнь Кароли
• Псевдокиста печени
• Холангиокарцинома (муцин-продуцирующий вариант)
6. Очаговые гиперваскулярные поражения печени:
Частые:
• Кавернозная гемангиома печени
• Очаговая узелковая гиперплазия
• Артерио-портальный шунт
• Преходящие различия плотности печени
• Гепатоцеллюлярный рак
• Метастазы в печени
• Аденома печени
• Артерио-венозная мальформация печени (болезнь Ослера-Вебера-Рендю)
Менее частые:
• Узловая регенеративная гиперплазия
• Фиброламеллярный рак печени
• Изменения, обусловленные обструкцией верхней полой вены
• Периферическая холангиокарцинома
• Пелиоз печени
• Ангиосаркома печени
7. Множественные гиподенсные очаги в печени:
Частые:
• Метастазы в печени и лимфома
• Простые кисты печени
• Кавернозная гемангиома печени
• Пиогенные абсцессы печени
• Врожденная поликистозная болезнь печени
• Гепатоцеллюлярный рак
• Саркоидоз печени
Менее частые:
• Аденома печени
• Амебные абсцессы печени
• Гидатидная кисты в печени
• Кандидоз печени
• Нодулярная регенеративная гиперплазия
Редкие, но важные:
• Ангиомиолипома печени
• Эпителиоидная гемангиоэндотелиома
• Болезнь Кароли
Частые:
• Метастазы в печени
• Пиогенный абсцесс печени
• Гепатоцеллюлярный рак
• Гематома печени
Менее частые:
• Аденома печени
• Гидатидная киста печени
• Амебный абсцесс печени
• Очаговая узелковая гиперплазия
• Нодулярная регенеративная гиперплазия
9. Очаговое гиперденсное объемное образование на КТ без контрастного усиления:
Частые:
• Цирротический регенеративный узел
• Любое образование в печени при жировом гепатозе (кажущийся эффект)
• Сохранный участок паренхимы печени на фоне жирового гепатоза
• Метастазы в печени
• Гематома печени
10. Снижение плотности или отек тканей по ходу воротной вены:
Частые:
• Расширенные желчные протоки (создают ложное впечатление об отеке)
• Системная гиперволемия
• Застойные явления в печени
• Острый гепатит
• Восходящий холангит
• Билиарный некроз или лимфедема после трансплантации печени
• Повреждение печени
Менее частые:
• Лимфаденопатия ворот печени
• Перибилиарные кисты при циррозе
• Тромбоз воротной вены
• Первичный склерозирующий холангит
• Стеатоз (жировая инфильтрация печени)
• Холангиопатия при СПИД
• Гепатоцеллюлярный рак
• Холангиокарцинома
• Метастазы в печени и лимфома
• Холангит, обусловленный химиотерапией
• Рецидивирующий пиогенный холангит
11. Диффузное снижение плотности печени:
Частые:
• Стеатоз (жировой гепатоз)
Менее частые:
• Гепатит
• Токсическое повреждение печени
• Инфаркт печени
• Метастазы в печени и лимфома
• Саркоидоз печени
• Оппортунистические инфекции кишечника
• Гепатоцеллюлярный рак
• Болезнь Вильсона
• Лучевой гепатит
• Синдром Бадда-Киари
• Болезни накопления гликогена
Видео признаки метастаза опухоли в печень на КТ, МРТ
Редактор: Искандер Милевски. Дата публикации: 20.2.2020

Как правило, новообразование печени впервые обнаруживают при УЗИ, однако чувствительность метода не позволяет выявить все малые опухоли и все имеющиеся узлы. К примеру, для выявления мелких метастазов, которые могут быть наряду с первичной опухолью, разрешающих возможностей ультразвукового исследования недостаточно. В то же время УЗИ навигация помогает контролировать выполнение чрескожной биопсии, что неотъемлемо при интервенционных вмешательствах и полезно в наблюдении за течением процесса.
Для первичной диагностики рака печени УЗИ не пригодно.
Как ставят диагноз рака печени?
В стандарты диагностики рака печени включены компьютерная (КТ) и магнитно-резонансная томографии (МРТ) обязательно с контрастными веществами, выявляющие типичную для гепатоцеллюлярного рака (ГЦР) васкуляризацию (сосудистую структуру) опухоли. Кровоснабжение опухоли идёт из других сосудов, нежели остальная ткань печени. В большинстве случаев злокачественные опухоли печени возникают на фоне хронической патологии, что тоже вносит изменение в картину КТ и МРТ, но есть типичные для каждого состояния моменты выведения контрастного вещества, которые хорошо знают специалисты.
Международные рекомендации считают доказанным гепатоцеллюлярный рак при независимой фиксации изменённого кровоснабжения печени во время динамической КТ и МРТ.
В России выполнение сразу двух исследований обычно не проводят, бывает достаточно и одного, но с совершенно типичной для рака картиной васкуляризации, не оставляющей каких-либо сомнений. Это может быть на выбор КТ с контрастным усилением или МРТ, то есть любой доступный метод объективной лучевой визуализации. Исследования позволяют оценить распространение злокачественного процесса, установить его стадию, оценить состояние всей печени.
Позитронно-эмиссионная томография для первичной диагностики рака печени пока не рекомендуется.
Биопсия печени
Полученный при биопсии материал может быть малоинформативным совсем не по вине хирурга, а из-за особенностей строения и патологических изменений печени пациента, тем более при наличии цирроза или хронического гепатита.
Манипуляция малоприятна, но больше психологически, чем физически. В хороших хирургических руках осложнения довольно редки. Вероятность кровотечения из-за повреждения сосуда составляет едва ли 1-2%. Опасения распространения опухолевых клеток по пункционному каналу оправданы, но при среднем полуторагодичном наблюдении такое возможно максимально в 11% случаев.
Биопсию печени не проводят, если изменённой в результате цирроза печени во время мультифазной компьютерной томографии выявлена васкуляризация, характерная для гепатоцеллюлярного рака, и диагноз подтверждается на контрастной МРТ.
Биопсия опухоли обязательна, если:
- новообразование печени без признаков цирроза;
- опухоль больше 2 см и на КТ и МРТ нетипичная васкуляризация;
- опухоль менее 2 см с типичным для ГЦР кровотоком, выявленном любым методом объективной визуализации;
- неоднозначная трактовка исследований при отсутствии изменений альфа-фетопротеина (АФП).
Биопсия не показана:
- не предполагается лечение из-за тяжёлой сопутствующей патологии;
- не планируется лечение из-за декомпенсированного цирроза печени;
- планируется резекция печени.

Лабораторные тесты
Анализы показывают функциональные возможности печени, но не способны что-либо сообщить о наличии или отсутствии злокачественной опухоли. То есть расскажут о циррозе и гепатите, но рак на показателях не отражается.
Роль альфа-фетопротеина (АФП) в диагностике рака печени несколько преувеличена. Этот маркёр повышается при любой патологии печени (и не только печени). При выявлении небольшого гепатоцеллюлярного рака АФП повышается у пятой части больных. Но при высоких показателях в несколько сот единиц и нарушениях васкуляризации при КТ или МРТ опухоли более 2 см, конечно, сомнений в злокачественности быть не может.
Наряду с методами визуализации маркёр АФП используется для контроля эффективности лечения рака печени, поскольку увеличивается при формировании сосудов в растущей опухоли.
" data-tipmaxwidth="500"data-tiptheme="tipthemeflatdarklight"data-tipdelayclose="1000"data-tipeventout="mouseout"data-tipmouseleave="false"data-tipcontent="html" title="Железы">железы , толстой кишки и желудка; низкая плотность бывает обусловлена некрозом центральной части метастаза (при саркомах). Однако метастазы муцинозных опухолей могут по плотности приближаться к паренхиме печени за счет множества мелких очагов обызвествления.
в. МРТ, по некоторым данным, превосходит КТ и УЗИ в диагностике опухолей печени.
Изотопные методы
Первичные и метастатические опухоли печени лишены купферовских клеток (в отличие от очаговой узловой гиперплазии и регенераторных узлов) и образуют дефекты накопления. Впрочем, МРТ, КТ и УЗИ сейчас вытеснили этот метод. 2) Сцинтиграфия с 67 Ga иногда позволяет отличить первичную опухоль от метастазов, так как печеночноклеточный Рак, -а; м. Злокачественная опухоль в организме, возникающая из эпителиальных тканей различных органов (напр. желудка, кишки, молочной железы и т. д.). Формы Р.: плоскоклеточный Р. (развивается преим. на коже или например, на слизистых оболочках, покрытых плоским эпителием), аденокарцинома и др.
" data-tipmaxwidth="500"data-tiptheme="tipthemeflatdarklight"data-tipdelayclose="1000"data-tipeventout="mouseout"data-tipmouseleave="false"data-tipcontent="html" title="Рак">рак захватывает цитрат галлия. | Определение стадии и прогноз А. Классификация по системе TNM часто пересматривается, поэтому следует сверяться с последними справочниками. Б. Оценка операбельности имеет первоочередное значение. Признаки неоперабельности могут быть обнаружены как при лапарото-мии или лапароскопии, так и с помощью КТ, МРТ и ангиографии. К ним относятся вовлечение обеих долей или четырех секторов печени, Тромбоз, -а; м. Закупорка просвета сосуда тромбом при некоторых заболеваниях (напр, флебите, сепсисе и др.), приводящая к нарушению кровоснабжения органов и инфаркту.
" data-tipmaxwidth="500"data-tiptheme="tipthemeflatdarklight"data-tipdelayclose="1000"data-tipeventout="mouseout"data-tipmouseleave="false"data-tipcontent="html" title="Недостаточность">недостаточность и портальная гипертензия — еще не противопоказания к операции. Прогностические факторы. Если опухоль ограничена печенью, основное прогностическое значение имеют число опухолевых узлов и инвазия крупных сосудов. Повышение уровня АФП и выраженность его повышения не влияют на прогноз. Выживаемость при операбельном печеночноклеточном раке зависит от следующих факторов.
- Количество, размеры и локализация узлов. При одиночной опухоли пятилетняя выживаемость составляет 45%, при множественных — 15—25%. Для опухолей размерами 2—5 см пятилетняя выживаемость составляет 40—45%, для более крупных — 10%. Прогноз лучше у больных без цирроза печени и при локализации опухоли в левой доле или в нижних (V и VI) сегментах правой доли.
- Вовлечение вен. Все больные с опухолевыми тромбами в воротной или печеночных венах умирают в течение 3 лет, тогда как в отсутствие поражения крупных сосудов пятилетняя выживаемость составляет 30%.
- Объем и вид операции. При радикальной резекции пятилетняя выживаемость составляет 55% по сравнению с 5% при наличии остаточной опухоли. После гемигепатэктомии пятилетняя выживаемость достигает 85%, после сегментэктомии — 50%, после краевой резекции — 20%. У оперированных больных 90% рецидивов возникает в печени.
- Функциональные резервы печени (их оценивают по накоплению индоцианина зеленого через 15 мин после введения) также влияют на выживаемость.
На ранних стадиях болезни, когда размеры новообразования невелики, а осложнения еще не имеют места, диагностика нередко представляет значительные трудности. В то же время в терминальных стадиях она предельно проста. Мнение прежних исследователей о невозможности правильной прижизненной диагностики опухолей печени в настоящее время имеет лишь историческое значение.
Применение специальных методов исследования дает возможность не только верифицировать диагноз, но и установить точную топографию и операбельность узла новообразования в печени. Однако нельзя не согласиться с мнением большинства онкологов, что диагноз рака печени представляется в настоящее время наиболее сложным из всех локализаций новообразований.
Клинические данные
Лабораторная диагностика
Кроме клинических данных в диагностике используют результаты лабораторных исследований. При всех очаговых поражениях печени происходит уменьшение количества альбуминов и увеличение количества γ-глобулинов в сыворотке крови (гипоальбуминемия, гипер-γ-глобулинемия). При раке печени информативно изучение белкового обмена, который более других подвержен изменениям.
Ряд авторов полагает, что для рака печени характерно снижение содержания общего белка, более значительное снижение концентрации альбуминов и повышение γ-глобулиновой фракции. При болезни Боткина содержание α-глобулина снижается, при раке увеличивается. При метастатических опухолях уровень γ-глобулинов увеличивается в еще большей степени. Многие ученые указывают на снижение уровня сахара крови при раке печени, но стойкая гипогликемия отмечается только при достаточно запущенных формах болезни.
Другие биохимические показатели изменяются в терминальных стадиях заболевания. Характерно для рака печени легкое возрастание активности трансаминаз в плазме (у 50% больных) и падение протромбинового индекса ниже 75% (у трети больных). Он же подчеркивает наличие увеличения щелочной фосфатазы.
Изменения лабораторных данных являются диагностическим подспорьем при раке печени.
Большое значение в диагностике гепатоцеллюлярного рака печени имеет определение в крови α-фетопротеина (АФП). Установлено, что положительная реакция на α-фетопротеин наблюдается у 83,8% больных гепатоцеллюлярным раком. Все же отмечаются ложно-положительные реакции у больных вторичным раком печени, при болезни Боткина и у некоторых женщин во второй половине беременности, α-фетопротеин был обнаружен у 50% больных раком печени в Европе и у 70-80% в Африке, В настоящее время ведутся работы по повышению чувствительности и специфичности указанной реакции.
В.Л. Ганнота (1991) при выявлении синдрома злокачественности приводит следующие данные лабораторного компонента этого синдрома: гипер-α-глобулинемия встречается при раке в 90,5%, увеличение СОЭ — в 88,5%; гипоальбуминемия — в 85,7%; гиперфибриногенемия — в 72,2%; лимфопения — в 66,7%; гиперасатемия — в 60,4%, гипербилирубинемия — в 47,4%; лейкоцитоз — в 39,6%; изменения протромбинового индекса — в 28,3% случаев. Концентрация α-фетопротеина выше дискриминационного значения 200 нг/мл наблюдалась у всех больных гепатоцеллюлярным раком.
Кроме α-фетопротеина, в крови определяется фактор СА-19-9. Повышение его более характерно для холангиоцеллюлярного рака печени [Борисов А.Е., 2003]. Также в диагностике метастатического рака применяются маркеры, среди которых наиболее известен раковоэмбриональный ангитен (РЭА). При метастазах рака он чаще позитивный, при локальном раке — негативный [Патютко Ю.И., 2005].
Лапароскопия
В ряде случаев лапароскопия помогает в диагностике рака печени, особенно если опухоль выходит на поверхность органа в зонах, доступных осмотру [Вагнер Е.А. и др., 1981]. Первичный рак печени представляется в виде белесовато-желтоватой бугристой опухоли характерного вида.

Лапароскопия. Первичный рак печени
Особенно трудна лапароскопическая диагностика рака-цирроза, когда приходится визуально дифференцировать раковые узлы на фоне цирротически измененной печени. Инструментальное исследование не дает возможности установить истинную распространенность процесса в печени, так как она может быть значительно больше, чем видимая на поверхности органа.

Лапароскопия. Метастатический рак печени
В.Л. Ганнота (1991) считает, что общая эффективность лапароскопии — 75,9%. На чувствительность метода влияют размер опухоли и локализация процесса в VI—VII—VIII сегментах печени, что снижает чувствительность метода до 66,7%. Лапароскопия инвазивный, но достаточно эффективный метод диагностики.
Показания к его применению:
- сомнительные результаты других методов исследования;
- предполагаемая локализация опухоли в зонах, доступных осмотру;
- необходимость решения вопроса о генерализации процесса;
- необходимость осуществления биопсии печени.
Пункционная биопсия
В выявлении рака печени играет важную роль. Метод получил новое развитие с применением лапароскопической биопсии, когда под контролем лапароскопа осуществляется пункция опухолевого узла. После чего можно визуально убедиться в полноценности гемостаза или провести его дополнительно.
По сведениям А.Е. Борисова (2003), у 61,5% пациентов с первичным раком выявляют множественное поражение, а у 38,5% опухоли носят солитарный характер. Среди больных с метастатическим раком лапароскопия с прицельной биопсией позволили верифицировать диагноз в 95,8% случаев.
Гепатосканирование
Исследование существенно помогает в диагностике. На гепатосканах и сцинтиграммах при раке печени выявляются дефекты накопления изотопа в местах расположения опухолевых узлов величиной более 2-3 см.
Общая эффективность метода — 72,4% (Ганнота B.Л., 1991). Чувствительность метода не зависит от морфологической структуры опухоли, а определяется ее размерами и локализацией. Опухоли размером до 3 см, а также левосторонней или двусторонней локализации наименее доступны радионуклидному исследованию. При этом чувствительность метода снижается от 20 до 0%. При радионуклидном исследовании А.Е. Борисов (2003) отметил наличие в печени холодных очагов у 81,4% пациентов.
Диагноз первичного или метастатического поражения печени был установлен у 21% пациентов.
Недостаток метода — невозможность выявить характер опухолевого узла, его злокачественность и взаимоотношения с элементами ворот. При этом и киста печени, и доброкачественная опухоль, и
рак будут давать аналогичную картину на гепатосканах и сцинтиграммах.
Реогепатография
Изучение печеночного кровотока при топографической реогепатографии дает возможность при опухолях выявить изменения и извращения локального кровотока в зоне опухолевого узла, а при поражении ворот органа установить расстройства гемодинамики, характерные для этого поражения.

Рак печени. Реогепатография
Ультразвуковое исследование
Ультразвуковой диагноз первичного рака печени достаточно сложен. По мнению многих ученых, ультразвуковой диагноз этого заболевания удается поста-витьправильнов76—98,7% случаев В клинике Б.И. Альперовича ультразвуковая диагностика первичного рака печени детально изучена Т.Н. Ярошкиной (1991). По ее данным, характерными для первичного рака печени являются ровные четкие контуры объемного образования. В 100% случаев вокруг картины опухоли визуализируется эхонегативная окантовка.

УЗИ. Первичный рак печени
При этом изображение опухоли имело неправильную форму в 37,5% наблюдений. Эхогенная плотность наблюдалась у 43,8% исследованных. Т.Н. Ярошкина разработала ультразвуковые критерии для дифференциальной диагностики гепатоцеллюлярного и холангиоцеллюлярного раков. По ее данным, для гепатоцеллюлярного рака характерны: правильная форма опухоли (53,3%), ровные четкие контуры (73,3-100%), изоэхогенное изображение (53,3%), смешанная эхогенность (26,7%), эхонегативные включения (53,3%).

Дляхолангиоцеллюлярного рака характерны: правильная форма (60%), ровные четкие контуры (70-100%), гиперэхогенность (40%), эхонегативные включения (30%).

УЗИ. Холангиоцеллюлярный рак печени
Т.Н. Ярошкина выделяет три типа ультразвукового изображения рака печени. Подробнее об этом сказано в разделе об ультразвуковой диагностике очаговых поражений печени. Метод ультразвуковой диагностики заслуживает самой положительной оценки и дает возможность судить о характере процесса, его топографии, а также прогнозировать операбельность, так как позволяет судить о взаимоотношениях между опухолью и элементами глиссоновых и кавальных ворот печени.
Рентгеновская диагностика
Важное место в диагностике рака печени занимает рентгеновская диагностика. На обычной обзорной рентгенограмме, особенно на рентгенограмме, сделанной на фоне пневмоперитонеума, можно отметить увеличение и деформацию пораженных отделов печени, выбухание ее поверхности и оттеснение соседних органов. При раках обращает на себя внимание ригидность пораженного отдела (доли) печени при изменении положения тела.
На спленопортограммах и портограммах в зоне опухоли определяется дефект наполнения соответственно размерам опухоли.
Ангиография
Для первичного рака печени характерна картина измененной архитектоники сосудов в зоне опухоли. Для гепатоцеллюлярного рака характерна гиперваскуляризаиия в зоне опухоли. Околоопухолевые сосуды имеют ампутацию мелких ветвей со стороны опухоли. В зоне опухоли архитектоника сосудов изменена, имеются участки гиперваскуляризации по типу кровяных озер.

Первичный рак печени. Ангиограмма. Гиперваскуляризация по типу кровяных озер
При холангиоцеллюлярном раке также изменяется (сосудистая архитектоника в зоне опухоли, имеется гиповаскуляризация. При метастатических опухолях в зоне метастазов имеет место гиповаскуляризация.

Метастатический рак печени. Ангиограмма. Гиперваскуляризация в зоне опухоли
Для злокачественных опухолей характерно деструктивное действие опухоли на стенки сосудов. На ангиограммах это выглядит как сдавление, узурация и ампутация артерий.
В.Л. Ганнота (1991) считает, что для первичного рака характерны:
- наличие зон с уровнем васкуляризации, отличным от нормального для паренхимы печени: аваскуляризация, гиповаскуляризация или гиперваскуляризаиия, в зависимости от формы;
- деформация и смещение внутрипеченочных артерий, огибающих по периферии зоны извращенной васкуляризации или расположенных в непосредственной близости от них;
- нечеткость контуров и неравномерность калибра мелких сосудов, наличие множества анастомозов;
- при локализации объемного процесса в области ворот печени — оттеснение магистральных сосудов, а в запущенных случаях — их сдавление и прорастание.
На основании собственных исследований и данных литературы автор приходит к заключению, что ангиография — высокоэффективный инвазивный метод исследования. Чувствительность его приближается к 100%. Разрешающая способность не хуже 2,4 см. Бесспорным достоинством метода является возможность решения вопроса о взаимоотношениях опухоли с вне- и внутри-печеночными сосудами и соотношение опухоли с элементами ворот печени и нижней полой веной. Показанием к ангиографии считают недостаточно убедительные данные других методов исследования и неразрешимое подозрение на вовлечение в патологический процесс элементов ворот органа.
Л.Д. Линденбратен (1980) отмечает два главных признака рака печени: отображение на ангиограммах собственных кровяных пространств опухоли — опухолевых сосудов и застой крови в опухоли. Сосуды проходят через инфильтрат в разных направлениях, не имеют строгого ветвления. На ангиограммах отмечаются мешотчатые расширения и неровные контуры тени опухоли, наблюдаются скопления контрастного вещества — кровяные озера. Большинство авторов считают, что ангиография помогает дифференцировать рак печени от других ее очаговых образований и выяснить размеры опухоли и ее топографию.

Первичный рак печени. Ангиограмма. Мешотчатые расширения и опухолевые сосуды
При вторичных опухолях печени наиболее информативным исследованием является портогепатография через пупочную вену [Островерхое Г.Е., Никольский А.Д., СувороваТ.А., 1969]. А.Е. Борисов (2003) утверждает, что из больных первичным раком печени типичное ашиографическое изображение получено у 70,9% больных, а среди пациентов с вторичными опухолями — у 73,9% исследованных.
Компьютерная томография
Важный метод диагностики опухолей печени. Эффективность метода оказалась равной 100%. Чувствительность его также близка к 100%. При изучении чувствительности оказалось, что размер опухоли более 1 см не влияет на чувствительность метода. А.Е. Борисов (2003) утверждает, что метод позволяет выявить новообразования в печени диаметром 0,5-1,0 см в 90% наблюдений. Он также позволяет проводить дифференциальную диагностику между первичным и метастатическим раком печени.
Изучение рентгенологической плотности новообразований печени показали, что доброкачественные и злокачественные опухоли мало отличались между собой и визуализировались как низкоплотные очаги в среднем +40,92 ед. Хоунсфилда. Особый интерес представляет симптом внутреннего усиления.
В.Л. Ганнота считает, что во всех наблюдениях удавалось установить взаимоотношения опухолей и нижней полой вены. Он же, анализируя материалы клиники, приходит к заключению, что компьютерная томография является высокоинформативным методом диагностики, обладающим эффективностью 100%, чувствительностью 93,7%.

Первичный рак печени. Компьютерная томограмма
На чувствительность компьютерной томографии влияет только размер опухоли. С помощью метода можно предполагать характер процесса. Большое преимущество — возможность получения информации о взаимоотношениях опухоли с нижней полой веной и соседними органами.
Анализируя диагностические методы при раке печени, можно заключить, что прижизненный диагноз этого заболевания возможен, а современные методы исследования позволяют детализировать диагноз, выяснить топографию опухоли, ее распространенность и с известной долей достоверности судить об операбельности процесса.
Из всех методов диагностики наибольшее значение имеют клинические данные (очаговое увеличение печени, быстрый рост опухоли, похудание), реакция Абелева—Татаринова, изменения трансаминаз сыворотки крови, лапароскопия, артериальная ангиография и компьютерная томография с усилением изображения.
На особом месте стоит ультразвуковое исследование, которое может не только выявить наличие опухоли в печени, но и судить о ее размерах, топографии, операбельности процесса и, с известной долей вероятности, о морфологической форме патологического образования в печени. Интраоперационное ультразвуковое исследование особенно ценно для диагностики внутрипеченочных опухолей, поскольку на операции другие методы исследования мало применимы.
Алгоритм диагностики
• Клиническое исследование (появление опухоли в печени, ее быстрый рост, прогрессирующее похудание больного, выраженный болевой синдром).
• Лабораторные данные (нарастающая анемия, положительная реакция на α-фетопротеин).
• Ультразвуковое исследование (опухоль в печени с эхонегативным ободком и неровными контурами).
• Артериальная ангиография (наличие кровяных озер, патологических сосудов).
• Компьютерная томография.
• Лапароскопия с пункционной биопсией.
Дифференциальная диагностика
Читайте также:

