Рак яичников после удаления желудка
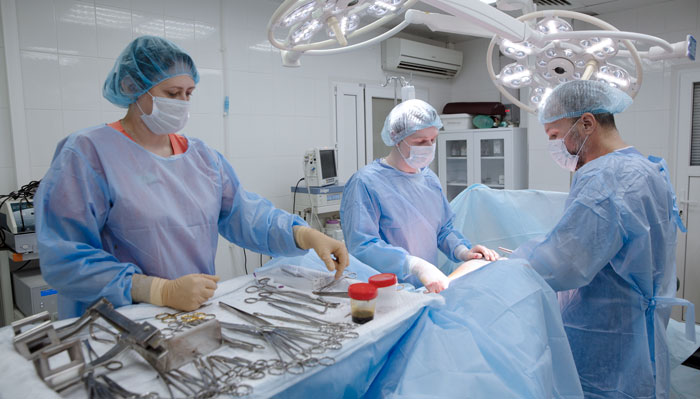
Удаление желудка или гастрэктомия — травматичное вмешательство, трудно дающееся больному и оставляющее пожизненные осложнения, но рак желудка не имеет шансов на излечение, если операцию не делать.
- Показания для операции удаления желудка при раке
- Как удаляют желудок при раке?
- Какой оперативный доступ при удалении лучше
- Этапы удаления желудка
- Восстановление после операции
- Осложнения после операции при раке
- Реабилитация после удаления желудка при раке
- Прогноз после удаления желудка
До операции онкологический больной редко думает, как жить после удаления желудка, ему важно быстро избавиться от опухоли, чтобы выжить. После хирургического лечения приходит понимание, что отсутствующий орган не заменят искусственным, и проблем со здоровьем уже не избежать.
Показания для операции удаления желудка при раке
Современная онкология стремится свести к минимуму объем удаляемых тканей, чтобы минимизировать осложнения после операции и последующие страдания пациента, тем не менее полное удаление желудка одна из самых частых операций при раке.
Гастрэктомия выполняется при опухоли, как 1, так и 3 стадии, абсолютное противопоказание для хирургического вмешательства — наличие отдалённых метастазов рака.
Гастрэктомию проводят, когда операция меньшего объёма невыполнима или не гарантирует отсутствие рецидива. Гастрэктомия — это последняя возможность для спасения, иным способом карциному излечить не удается.
Только в одном случае при 4 стадии желудочной карциномы существует относительное противопоказание к хирургии — метастазирование в яичник. Относительное оттого, что при возможности удаления первичной опухоли и пораженного метастазами яичника, одномоментно выполняется сразу две операции: гастрэктомия и овариэктомия, иногда и вместе с маткой. Но если что-то удалить невозможно, хирургический этап лечения заменяется на химиотерапию.

Как удаляют желудок при раке?
Подход к желудку через брюшную стенку — оперативный доступ - зависит от состояния пациента и протяженности опухолевого процесса в пищеводе. Во время операции пищевод пересекается на 5–7 сантиметров выше опухоли, полностью удаляется желудок и сальниковые сумки с лимфатическими узлами. В брюшной полости не должно остаться ни единого опухолевого очага.
Типичные разрезы кожи и мягких тканей живота:
- Классический разрез проходит по средней линии живота — это срединная лапаротомия.
- В некоторых случаях прибегают к продлению разреза с живота на грудную стенку — это тораколапоротомия.
- При необходимости удаления значительного участка пораженного пищевода дополнительно к срединной лапаротомии делают разрез между ребрами.
- К пораженному раком пищеводу можно подобраться и изнутри — через диафрагму, что возможно и при классическом доступе.
Какой оперативный доступ при удалении лучше
Не существует стандартов, определяющих где и сколько надо разрезать брюшной стенки и как далеко продвинуться в грудной полости, всё базируется на индивидуальных особенностях конкретного пациента и опухолевого поражения.
Хирург-онколог самостоятельно выбирает хирургический доступ, при максимальном обзоре поля деятельности позволяющий минимальное повреждение здоровых тканей и оптимальную технику операции, снижающую возможность осложнений после удаления желудка.
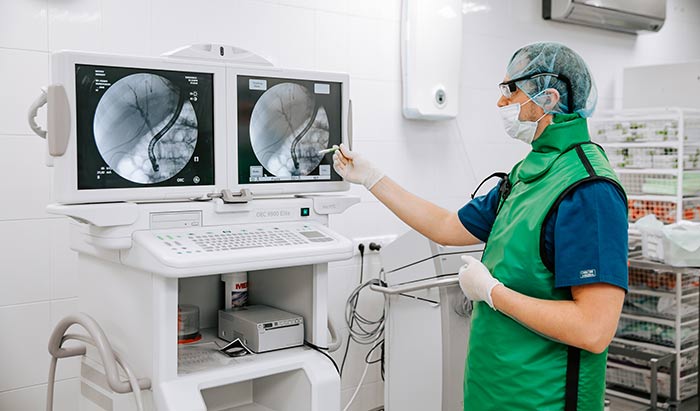
Сегодня при раннем раке открытые операции успешно заменяются эндоскопическими технологиями, лапароскопическая гастрэктомия, несомненно, технически сложнее, но для пациента выгоднее, поскольку не увеличивает осложнения после операции, восстановление пациента проходит быстрее.
Этапы удаления желудка
Ход операции удаления всего или только части органа (резекции) протекает по одному плану, но с разным объёмом удаляемых тканей.
- Сначала проводится мобилизация — отсечение органа от фиксирующих его внутренних связок, перевязка питающих артерий и вен. Одновременно проводится тщательный осмотр органов брюшной полости и на основе увиденного в план операции вносятся коррективы.
- Второй этап — собственно удаление, с отсечением желудка от пищевода и двенадцатиперстной кишки. При вовлечении в опухолевый конгломерат близлежащих органов брюшной полости, в том числе диафрагмы или печени, поджелудочной железы или толстого кишечника, если технически возможно, выполняются сложные и объемные комбинированные операции, то есть гастрэктомия и, например, резекция поджелудочной железы или печени.
- Третий этап — восстановление пищеварительного тракта, то есть соединение пищевода с кишечником, что обеспечит в дальнейшем передвижение пищи.
Восстановление после операции
Рак желудка приводит к серьёзным внутриклеточным изменениям, нарушаются все биохимические процессы, поскольку организм не получает необходимых ему веществ из-за нарушения всасывания в желудочно-кишечном тракте. Ещё несколько десятилетий назад после гастрэктомии погибал каждый четвёртый пациент, сегодня осложнения и смертность сведены к минимальным показателям.
Главное для больного — не торопиться после удаления желудка побыстрее покинуть клинику, так как незавершенность лечебных мероприятий впоследствии откликнется проблемами со здоровьем, которые могут основательно испортить жизнь.
Осложнения после операции при раке
Ранние осложнения немногочисленны, но при несвоевременном выявлении могут быть фатальными для пациента.
Нарушение оттока панкреатических секретов из-за отечности поджелудочной железы может привести к развитию острого панкреатита. На частоте панкреатита сказывается хирургическая техника, но определяющую роль играет объем удаленных тканей и исходное состояние органов желудочно-кишечного тракта. Главное — вовремя диагностировать осложнение и проводить адекватную медикаментозную профилактику.

Несостоятельность швов и панкреатит способны инициировать воспалительные процессы внутри брюшной полости, в частности, абсцесс или перитонит, кишечную непроходимость или локальное скопление жидкости.
Процент перечисленных патологических послеоперационных состояний небольшой, а в нашей клинике значительно ниже средних статистических величин, потому что на результате отражается талант и опыт хирурга-онколога в сочетании с отличными диагностическими возможностями.
Реабилитация после удаления желудка при раке
Рана зарастёт, но восстановление нормального питательного нутритивного статуса в измененном пищеварительном тракте проходит сложно — просто протертая и на пару приготовленная еда проблему не решает. А проблема сцеплена с недостаточностью иммунитета и отсутствием полноценного всасывания необходимых для организма питательных элементов.
Для скорейшего восстановления и продолжения противоопухолевого лечения требуется индивидуальная программа реабилитационных мероприятий.
Прогноз после удаления желудка
Онкологическая статистика знает, сколько живут больные карциномой желудка в зависимости от стадии. Нет литературных данных, сокращает ли жизнь удаление важнейшей части пищеварительного тракта, но точно известно, что продолжительность жизни больного зависит от распространенности первичной карциномы и биологических характеристик раковых клеток — дифференцировки, их чувствительности к химиотерапии и сопутствующих заболеваний.
Онкологическая наука очень точна, она знает, какой алгоритм диагностических исследований необходим при заболевании, сколько процентов больных разными стадиями и сколько лет в среднем живут, может предложить целый комплекс лечебных мероприятий при определенных морфологических характеристиках карциномы.
Одного не может онкология — дать конкретному пациенту рецепт оптимального лечения с точным расписанием необходимых ему манипуляций и процедур. Но это могут сделать и делают опытные онкологи Европейской клиники.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
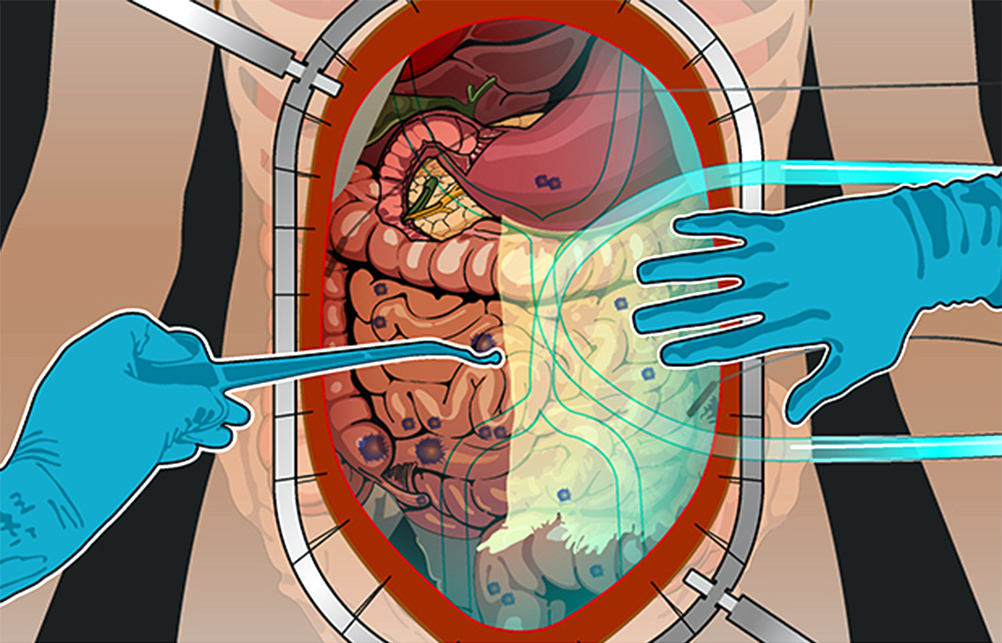
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
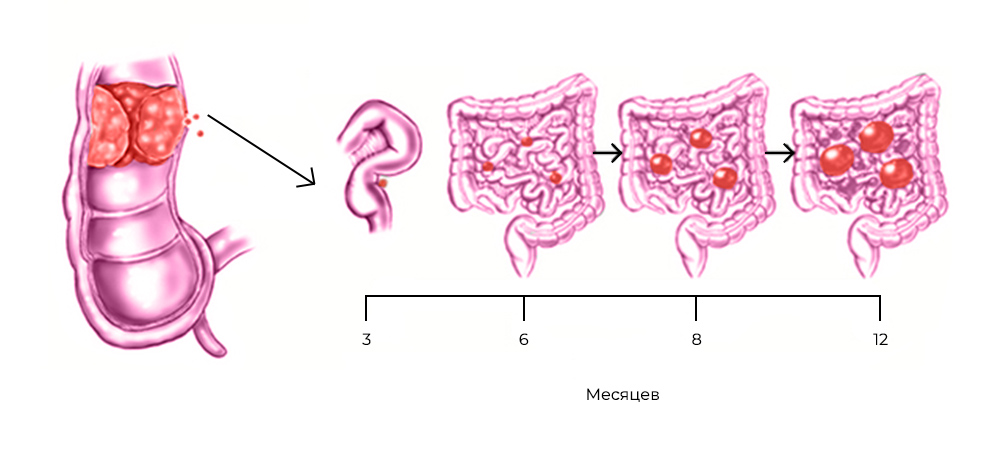
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
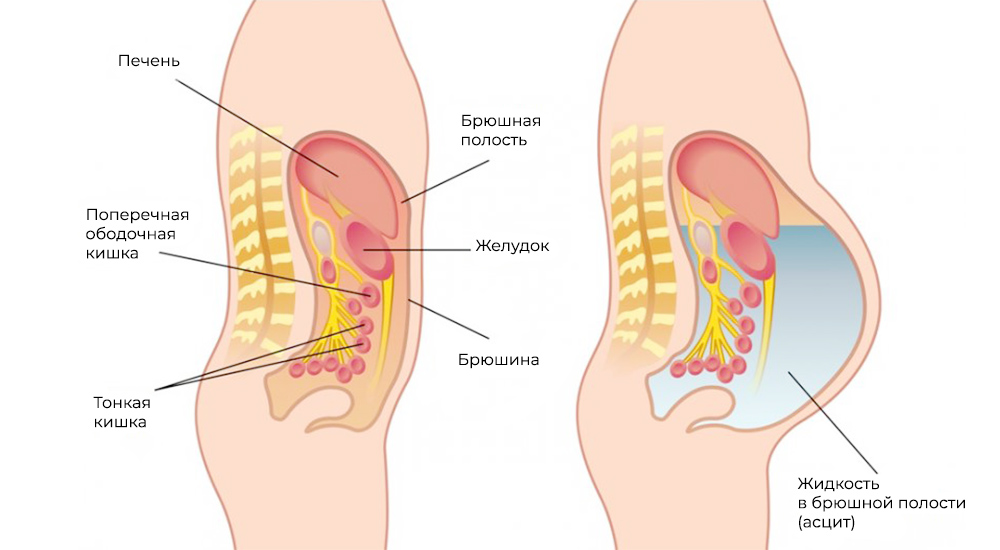
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
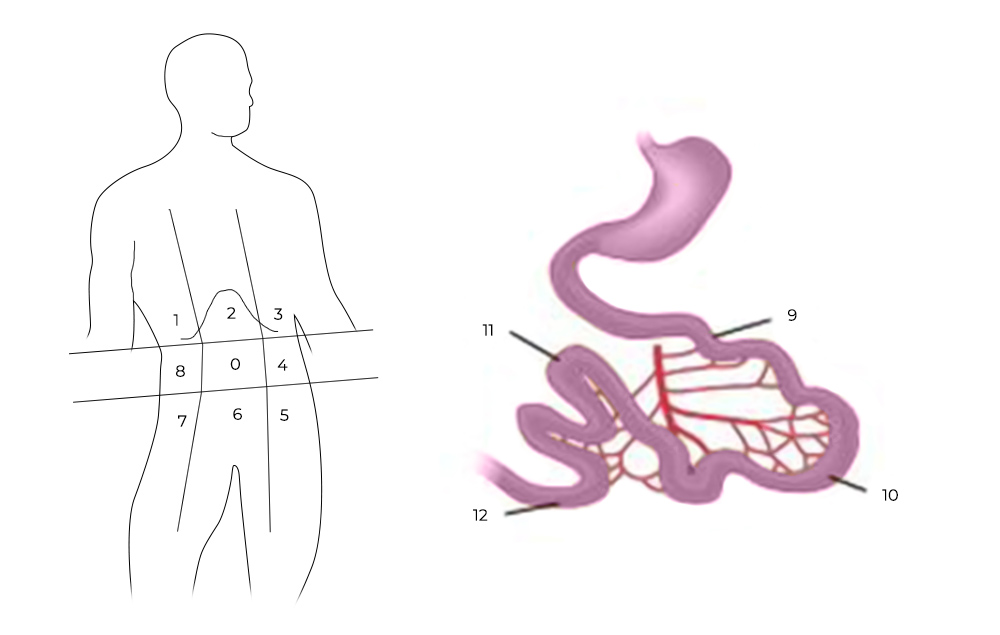
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
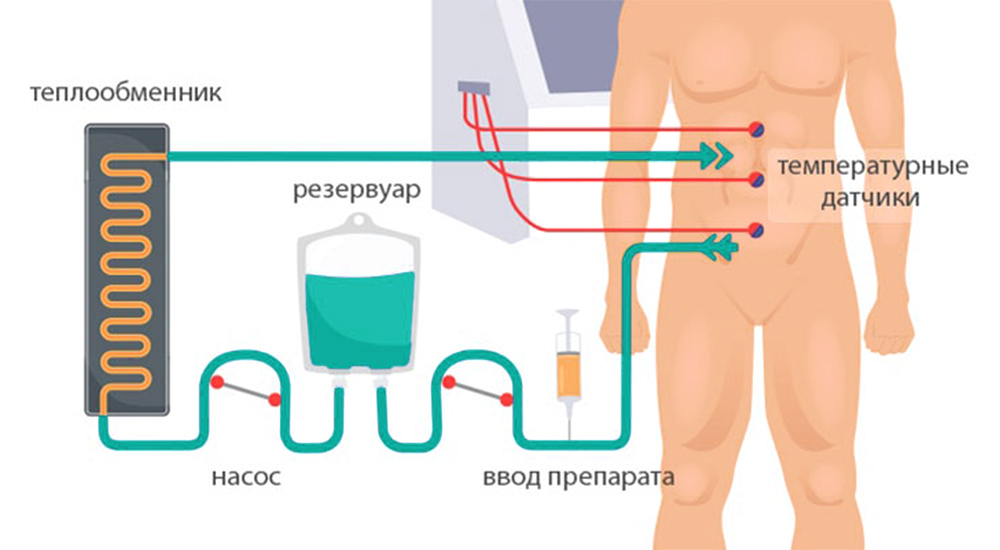
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Удаление желудка или гастрэктомия — травматичное вмешательство, трудно дающееся больному и оставляющее пожизненные осложнения, но рак желудка не имеет шансов на излечение, если операцию не делать.
До операции онкологический больной редко думает, как жить после удаления желудка, ему важно быстро избавиться от опухоли, чтобы выжить. После хирургического лечения приходит понимание, что отсутствующий орган не заменят искусственным, и проблем со здоровьем уже не избежать.
Показания для операции удаления желудка при раке
Современная онкология стремится свести к минимуму объем удаляемых тканей, чтобы минимизировать осложнения после операции и последующие страдания пациента, тем не менее полное удаление желудка одна из самых частых операций при раке.
Гастрэктомия выполняется при опухоли, как 1, так и 3 стадии, абсолютное противопоказание для хирургического вмешательства — наличие отдалённых метастазов рака.
Гастрэктомию проводят, когда операция меньшего объёма невыполнима или не гарантирует отсутствие рецидива. Гастрэктомия — это последняя возможность для спасения, иным способом карциному излечить не удается.
Только в одном случае при 4 стадии желудочной карциномы существует относительное противопоказание к хирургии — метастазирование в яичник. Относительное оттого, что при возможности удаления первичной опухоли и пораженного метастазами яичника, одномоментно выполняется сразу две операции: гастрэктомия и овариэктомия, иногда и вместе с маткой. Но если что-то удалить невозможно, хирургический этап лечения заменяется на химиотерапию.
Как удаляют желудок при раке?
Подход к желудку через брюшную стенку — оперативный доступ — зависит от состояния пациента и протяженности опухолевого процесса в пищеводе. Во время операции пищевод пересекается на 5–7 сантиметров выше опухоли, полностью удаляется желудок и сальниковые сумки с лимфатическими узлами. В брюшной полости не должно остаться ни единого опухолевого очага.
Типичные разрезы кожи и мягких тканей живота:
- Классический разрез проходит по средней линии живота — это срединная лапаротомия.
- В некоторых случаях прибегают к продлению разреза с живота на грудную стенку — это тораколапоротомия.
- При необходимости удаления значительного участка пораженного пищевода дополнительно к срединной лапаротомии делают разрез между ребрами.
- К пораженному раком пищеводу можно подобраться и изнутри — через диафрагму, что возможно и при классическом доступе.
Какой оперативный доступ при удалении лучше
Не существует стандартов, определяющих где и сколько надо разрезать брюшной стенки и как далеко продвинуться в грудной полости, всё базируется на индивидуальных особенностях конкретного пациента и опухолевого поражения.
Хирург-онколог самостоятельно выбирает хирургический доступ, при максимальном обзоре поля деятельности позволяющий минимальное повреждение здоровых тканей и оптимальную технику операции, снижающую возможность осложнений после удаления желудка.
Сегодня при раннем раке открытые операции успешно заменяются эндоскопическими технологиями, лапароскопическая гастрэктомия, несомненно, технически сложнее, но для пациента выгоднее, поскольку не увеличивает осложнения после операции, восстановление пациента проходит быстрее.
Этапы удаления желудка
Ход операции удаления всего или только части органа (резекции) протекает по одному плану, но с разным объёмом удаляемых тканей.
- Сначала проводится мобилизация — отсечение органа от фиксирующих его внутренних связок, перевязка питающих артерий и вен. Одновременно проводится тщательный осмотр органов брюшной полости и на основе увиденного в план операции вносятся коррективы.
- Второй этап — собственно удаление, с отсечением желудка от пищевода и двенадцатиперстной кишки. При вовлечении в опухолевый конгломерат близлежащих органов брюшной полости, в том числе диафрагмы или печени, поджелудочной железы или толстого кишечника, если технически возможно, выполняются сложные и объемные комбинированные операции, то есть гастрэктомия и, например, резекция поджелудочной железы или печени.
- Третий этап — восстановление пищеварительного тракта, то есть соединение пищевода с кишечником, что обеспечит в дальнейшем передвижение пищи.
Восстановление после операции
Рак желудка приводит к серьёзным внутриклеточным изменениям, нарушаются все биохимические процессы, поскольку организм не получает необходимых ему веществ из-за нарушения всасывания в желудочно-кишечном тракте. Ещё несколько десятилетий назад после гастрэктомии погибал каждый четвёртый пациент, сегодня осложнения и смертность сведены к минимальным показателям.
Главное для больного — не торопиться после удаления желудка побыстрее покинуть клинику, так как незавершенность лечебных мероприятий впоследствии откликнется проблемами со здоровьем, которые могут основательно испортить жизнь.
Осложнения после операции при раке
Ранние осложнения немногочисленны, но при несвоевременном выявлении могут быть фатальными для пациента.
Нарушение оттока панкреатических секретов из-за отечности поджелудочной железы может привести к развитию острого панкреатита. На частоте панкреатита сказывается хирургическая техника, но определяющую роль играет объем удаленных тканей и исходное состояние органов желудочно-кишечного тракта. Главное — вовремя диагностировать осложнение и проводить адекватную медикаментозную профилактику.
Несостоятельность швов и панкреатит способны инициировать воспалительные процессы внутри брюшной полости, в частности, абсцесс или перитонит, кишечную непроходимость или локальное скопление жидкости.
Процент перечисленных патологических послеоперационных состояний небольшой, а в нашей клинике значительно ниже средних статистических величин, потому что на результате отражается талант и опыт хирурга-онколога в сочетании с отличными диагностическими возможностями.
Реабилитация после удаления желудка при раке
Рана зарастёт, но восстановление нормального питательного нутритивного статуса в измененном пищеварительном тракте проходит сложно — просто протертая и на пару приготовленная еда проблему не решает. А проблема сцеплена с недостаточностью иммунитета и отсутствием полноценного всасывания необходимых для организма питательных элементов.
Для скорейшего восстановления и продолжения противоопухолевого лечения требуется индивидуальная программа реабилитационных мероприятий.
Прогноз после удаления желудка
Онкологическая статистика знает, сколько живут больные карциномой желудка в зависимости от стадии. Нет литературных данных, сокращает ли жизнь удаление важнейшей части пищеварительного тракта, но точно известно, что продолжительность жизни больного зависит от распространенности первичной карциномы и биологических характеристик раковых клеток — дифференцировки, их чувствительности к химиотерапии и сопутствующих заболеваний.
Онкологическая наука очень точна, она знает, какой алгоритм диагностических исследований необходим при заболевании, сколько процентов больных разными стадиями и сколько лет в среднем живут, может предложить целый комплекс лечебных мероприятий при определенных морфологических характеристиках карциномы.
Одного не может онкология — дать конкретному пациенту рецепт оптимального лечения с точным расписанием необходимых ему манипуляций и процедур. Но это могут сделать и делают опытные онкологи Европейской клиники.
При диагностировании у пациента онкологической патологии применяются различные методы лечения тяжёлой и опасной для жизни болезни. Первоначально проводится полная, всесторонняя диагностика патологического состояния. При формировании способа стараются применять лечение неинвазивными и малоинвазивными способами. К таковым относятся химиотерапия (остановка жизнедеятельности онкологических клеток с помощью применения фармакологических препаратов, вводимых через вену в организм больного) или радиотерапия (применение радиационных импульсов для разрушения мутировавших клеток, из которых формируется опухоль в желудке).
Если вышеприведённые методы не обеспечили необходимый результат, применяется хирургический (оперативный) метод вмешательства в лечение пациента. Удаление желудка при раке позволяет максимально сократить развитие онкологии и при благоприятных факторах полностью победить болезнь. Но подобный метод не проходит без последствий для пациента. И до конца жизни человек будет вынужден соблюдать свод строгих правил по питанию, чтобы избежать интоксикации или переедания, которые при отсутствии органа желудка грозят риском летального исхода.
В редких случаях осуществляется трансплантология (пересадка) желудка. Это тоже сложнейшая операция, способная привести к отторжению пересаженного органа.
В настоящее время проводятся исследования по созданию искусственного желудочно-кишечного тракта. Больному раком порой устанавливают искусственный желудок, полностью функциональный.
Противопоказания к применению хирургического вмешательства
В ряде случаев, применение операции не позволяет добиться желаемых результатов. Вмешательство не проводят в связи с отсутствием шансов на значительное улучшение состояния пациента.
Подобная ситуация может сложиться в результате распространения опухоли по отдалённым органам через систему метастазов. В данном случае удаление первоисточника онкологического процесса не даст требуемого улучшения в связи с тем, что заболевание будет распространяться из других очагов патологии. Операция производится только при опухоли без метастазов. В излишней травматизации организма смысла нет.
Дополнительными противопоказаниями к проведению хирургического вмешательства будут:
- пониженная свёртываемость крови;
- тяжёлая почечная недостаточность;
- тяжёлая недостаточность сердца и сосудов;
- увеличение желудка в размерах;
- злокачественный перитонит.
При подобных состояниях удаление желудка принесёт больше вреда, чем пользы либо окажется бесполезным. Для пациента подбираются иные виды лечения онкологии, не связанные с полостными видами оперативного вмешательства.
Варианты оперативного вмешательства
В зависимости от показаний возможно оперативное вмешательство в трёх вариантах:
- Резекция желудка.
- Гастрэктомия.
- Лимфодиссекция.
Операция по удалению подразумевает ампутацию повреждённой части органа. При малой распространённости по органу опухоли применяется только удаление части желудка, где происходит непосредственное развитие онкологического процесса.
При проведении частичной ампутации оставшиеся отделы сшиваются и соединяются с кишечником. Сохраняется частичная функциональность желудка, что позволяет обеспечить пациенту возможность полного восстановления нормального образа жизни после операции.
При тотальной ампутации желудка производится формирование культи из тканей кишечника, принимающей на себя функции желудка. Функционал крайне ограничен. Желудочный сок вырабатываться не будет. Поэтому система пищеварения представлена в усечённом варианте.
Существует вариант резекции с применением специального оборудования – эндоскопа. Такой вид называется эндоскопической резекцией.
Данный вид оперативного вмешательства представляет собой соединение пищевода и двенадцатиперстной кишки через тонкий кишечник. Продолжительность операции длительна по времени (не менее 5 часов) и чревата осложнениями.
После операции пациента держат в стационаре в течение 2-3 недель, после чего его допустимо выписать под диспансерное наблюдение. В течение первых 24-48 часов пациента не кормят перорально. Внутривенно вводится поддерживающий раствор.
Если место соединения пищевода и прямой кишки недостаточно хорошо закреплено, присутствует вероятность осложнений, приводящих к смерти пациента. Чтобы убедиться в крепости соединения, перед первым приёмом питьевой воды проводится рентгеновское исследование. В течение первого месяца после проведённой гастрэктомии вероятны болевые ощущения и сложности при употреблении пищевых продуктов.
К сожалению, устранить эти негативные последствия невозможно. По истечении месяца после удаления желудка организм максимально восстановит функции по перевариванию пищи с учётом новых обстоятельств.
При лимфодиссекции происходит ампутация не только части желудка, поражённого опухолью, но и ближайшие лимфатические узлы, если при визуальном осмотре в них обнаружены следы жизнедеятельности опухолевых клеток (метастазы).
Во время операции хирург определяет пострадавшие лимфатические узлы с помощью визуального осмотра. Благодаря их иссечению значительно снижается риск распространения онкологических очагов.
Подготовительный этап к проведению операции
Подготовка пациента к проведению оперативного вмешательства – залог успешного выполнения процедуры по удалению пострадавшего от рака органа. Процесс подготовки может занять до месяца.
Пациент обязан строго соблюдать предписания врачей относительно диеты в подготовительный период. Обязателен отказ от употребления алкоголя и табака. Запрещено употребление тяжёлой, острой пищи.
Больной проходит исследования с целью определить состояние здоровья, стадию развития онкологической патологии.
На анализ берут биоматериалы крови, мочи и кала. Кровь проверяется в двух анализах – общий клинический и биохимический. Дополнительно проводится проверка на наличие соответствующих онкомаркеров. Моча проходит клинический анализ, кал проверяют на присутствие скрытой крови.
Проводится электрокардиография сердечных показателей. Грудная клетка подвергается рентгенологическому исследованию в двух проекциях.
Для выявления точного места локализации новообразования производятся следующие исследования:
- Ультразвуковое исследование брюшной полости (кишечника, селезёнки, органов малого таза).
- Компьютерная томография.
- Магнитно-резонансная томография.
Пищевод и двенадцатиперстная кишка исследуются при помощи гастроскопа. Производится визуальный осмотр и сбор материала для гистологического исследования. Эта процедура носит название гастроскопия.
Производится визуальное исследование толстого кишечника с применением эндоскопа (колоноскопия).
При наличии показаний производится диагностическая операция с целью проверить наличие метастазов и иных поражений органов брюшной полости, которые являются противопоказанием к проведению оперативного вмешательства для лечения онкологии.
Для устранения риска развития инфекционных патологий назначается курс антибиотиков. Пациент проходит дополнительные консультации и исследования в соответствии с показаниями. Подбираются соответствующий режим питания и дозировка разового приёма пищи. Питание должно осуществляться 5-6 раз в течения дня небольшими порциями.
За 10 дней до оперативного вмешательства отменяется приём антикоагулянтов и противовоспалительных препаратов нестероидного вида.
Важным моментом подготовки является психологическая поддержка родных и друзей пациента. Положительные эмоции в борьбе с такой болезнью, как онкология, играют заметную роль.
Лучевая (радиотерапия) и химиотерапия назначаются до операции с целью облегчить проведение самой процедуры. В день самой операции проводится промывание желудка и внутривенное вливание плазмы крови в случае выявления анемии у пациента.
Вероятные осложнения после удаления желудка
Оперативное вмешательство такого рода, как удаление важного органа пищеварительной системы, сложно и опасно. Вероятны многочисленные осложнения после удаления желудка. К таковым относятся:
- появление внутреннего кровотечения;
- резкая потеря в весе тела;
- вероятность рецидива злокачественной опухоли;
- воспалительные процессы в брюшине;
- падение уровня железа в крови (анемия);
- воспалительный процесс на слизистой оболочке пищевода;
- ускорение процесса вывода каловых масс из организма без переваривания поступившей пищи.
Остаётся вероятность появления и других осложнений, исходя из индивидуальных особенностей организма пациента, перенёсшего операцию по удалению желудка.
Реабилитация
Реабилитация после рака займет длительный период времени. Но точный срок восстановления зависит от многих факторов, большая часть которых относится к особенностям строения организма больного. Сюда относят:
- возраст пациента;
- пол пациента;
- наличие сопутствующих патологических процессов в организме;
- психологическое состояние больного.
Непосредственное влияние оказывает и вид проведённой операции, качество оказания медицинской услуги, объём удалённого желудка.
В среднем реабилитационный период составляет не менее трёх месяцев. Но часто достигает временного интервала в 2 года. В течение этого периода необходимо строго соблюдать все предписания лечащего врача относительно приёма медикаментозных препаратов, соблюдение диеты.
Физические нагрузки под запретом, особенно тяжёлые виды спорта. Необходимо следить за температурным режимом и не допускать перегрева или переохлаждения организма.
Выживаемость
Выживаемость после проведённой операции зависит от того, насколько вовремя оперативное вмешательство было произведено. При осуществлении процедуры на первой и второй стадиях развития патологии смертность в течение 5 лет не превышает 20%.
Также выполнение операции на первых стадиях снижает риск повторного возникновения онкологии. Наличие своевременного вмешательства напрямую влияет на продолжительность жизни после проведённой операции. Упомянутый фактор гарантирует благоприятный прогноз на полное избавление от патологии. Большинство больных живут долго и пересекают рубеж 10-летней выживаемости.
Читайте также:

