Циторедуктивные операции при колоректальном раке
В практическом здравоохранении по-прежнему при обнаружении отдаленных метастазов рака толстой кишки выполняются паллиативные или симптоматические операции. Однако, число сторонников циторедуктивного подхода возрастает: удаление опухолевых очагов в сочетании с эффективными режимами лекарственной терапии позволяет улучшить отдаленные результаты.
В МНИОИ за 19852003 гг. выполнена 81 циторедуктивная операция. Средний возраст больных составил 58,3 года; мужчин было 35, женщин 46. Первичная опухоль локализовалась в прямой (33) и ободочной кишке (48). Преобладали опухоли категории T3-T4 (95,2%), у 71,4% больных имелись регионарные метастазы, у 97,5% диагностирована аденокарцинома различной степени дифференцировки. Синхронно выявленные отдаленные метастазы удалялись одномоментно с первичной опухолью (29), отсроченное удаление (3) выполнялось при тяжелой сопутствующей патологии. Метахронные отдаленные метастазы (49) удалялись у 25 больных одномоментно с первичным очагом, у остальных отсрочено. Изолированное поражение отмечено в 77,5% случаев. Интраабдоминальная локализация метастазов выявлена у 47 больных.
Метастазы в яичники (13 больных). У 11 овариоэктомия произведена одномоментно с удалением первичной опухоли; 2 оперированы отсрочено. Поражение яичников в 38,5% случаев сочеталось с поражением большого сальника, что диктует необходимость его принципиального удаления при метастазах в яичники. Послеоперационные осложнения отмечены у 15,8% больных, без летальных исходов. К сожалению, большинство больных умерли от прогрессирования опухоли в течение года после операции, но 3 живы более года на фоне системной химиотерапии.
Имплантационные метастазы в переднюю брюшную стенку (8 больных). Подавляющее большинство оперированы в сроки от 6 до 15 месяцев после первой операции. Причинами метастазов, по-видимому, стали опухолевые свищи или разгрузочные колостомы. Выполнены обширные резекции брюшной стенки, с послойной пластикой послеоперационного дефекта твердой мозговой оболочкой (? ред.) и синтетическими материалами, что обеспечивало радикализм и предотвращало после-операционные вентральные грыжи. Прослежено 5 больных. У 1 выявлен продолженный рост опухоли, что потребовало повторной операции.
Метастазы в легкие (34 больных). Солитарные метастазы выявлены у 25 больных, единичные у 5, множественные (>3) у 4, в том числе двусторонние у 5. Синхронные метастазы в печень диагностированы у 2 больных, метахронный метастаз в головной мозг у 1. Торакотомия выполнена у 31 больного, видеоторакоскопия у 3. Объемы вмешательств: сублобарная резекция (18), лобэктомия (15), пневмонэктомия (1). При билобарных метастазах операции обычно выполнялись с интервалом в 3 4 недели. Метастазы во внутригрудных лимфоузлах диагностированы у 3 больных (8,8%). Послеоперационные осложнения отмечены у 8,8%, умер 1 больной (2,9%). Отдаленные результаты прослежены у 30 больных. 135-летняя выживаемость составила 93,3;46,7;26,7% соответственно. Наилучшие результаты достигнуты при солитарном характере поражения: 5 лет пережили 30,4% больных. При множественных метастазах в легкие ни один больной не пережил 2 лет.
В послеоперационном периоде назначалась адъювантная химиотерапия. Выбор схемы лечения определялся структурой и локализацией очагов, общим состоянием организма. Больным с изолированным поражением печени интраоперационно устанавливался артериальный порт в собственную печеночную артерию для регионарной химиотерапии.
В.И. Чиссов, Л.А. Вашакмадзе, Д.В. Сидоров, В.М. Хомяков, О.В. Пикин
(МНИОИ им. П.А. Герцена)
По материалам Вестника Московского онкологического общества, № 2, февраль 2004
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
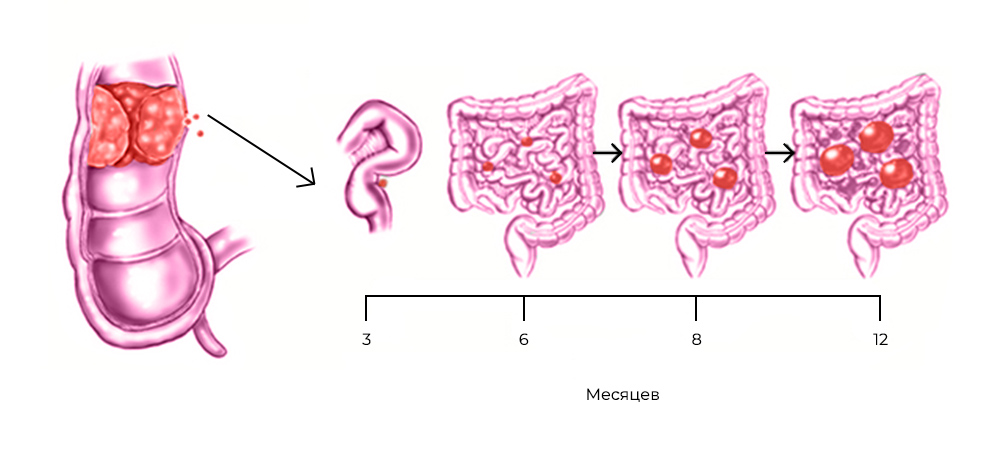
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
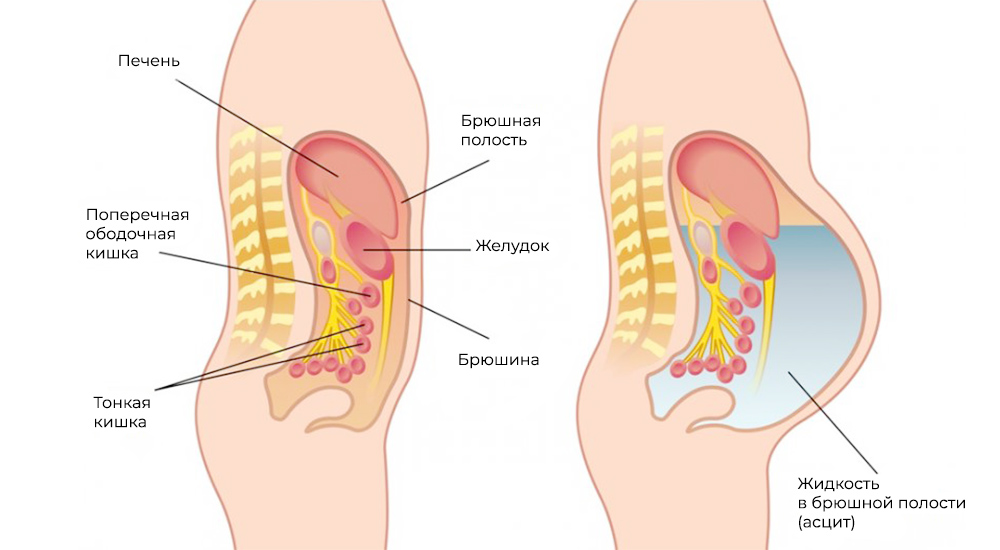
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
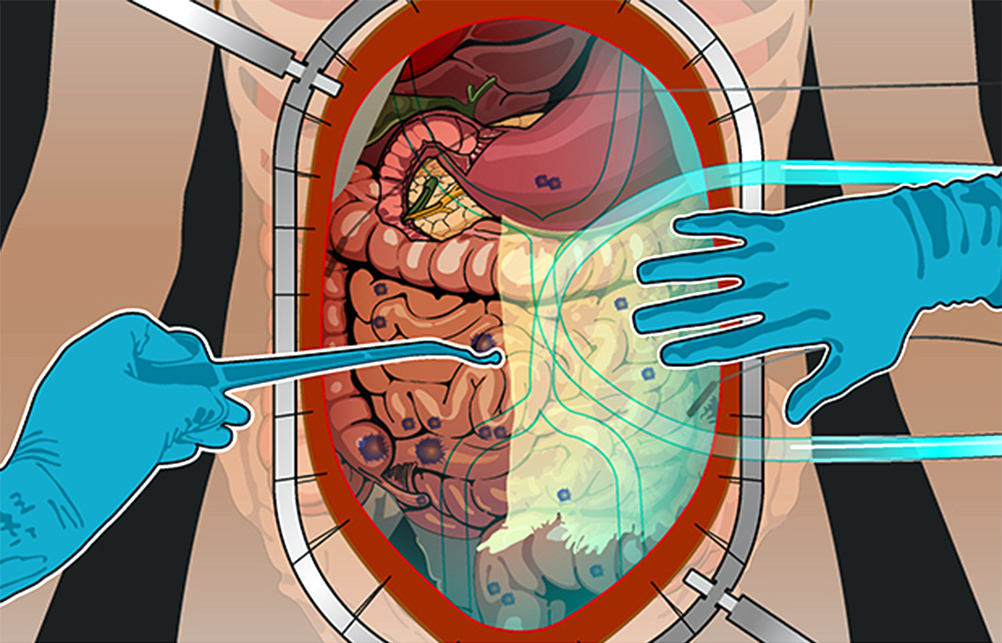
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
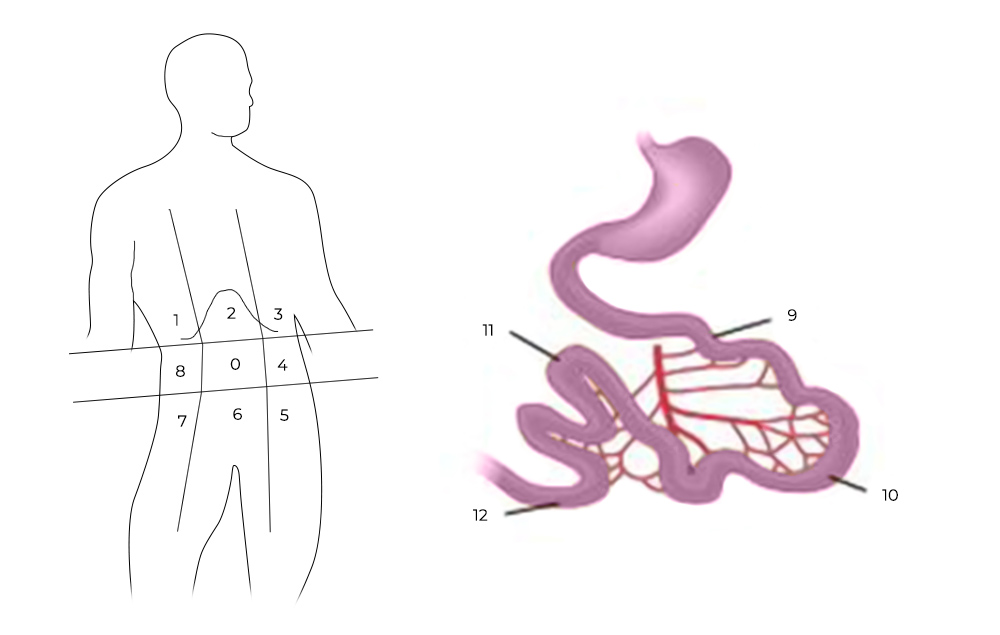
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
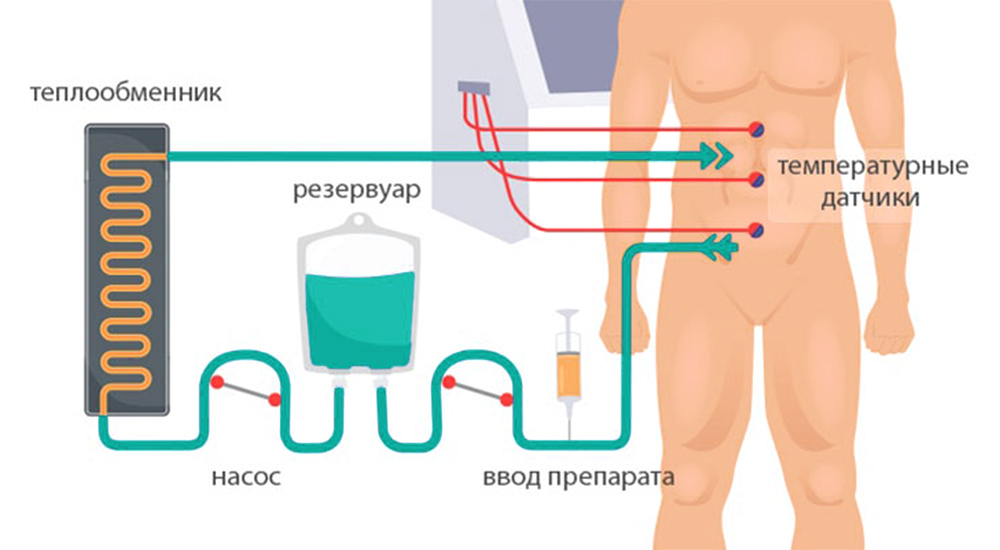
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Хирургические операции играют ключевую роль в лечении онкологических заболеваний. Радикальное удаление злокачественного новообразования в сочетании с химиотерапией, лучевой терапией способно не только продлить жизнь человека, не только остановить развитие болезни, но и победить ее.

Но что если опухоль уже невозможно удалить целиком? Если она уже дала метастазы, множественные или отдаленные. Радикальную операцию проводить поздно, и значит, человек обречен?
Долгое время так и считалось. При невозможности радикальной операции злокачественные новообразования с метастазами предпочитали не трогать. И лишь в крайних случаях, при угрозе опасных осложнений, принималось решение о вынужденном удалении части опухоли.
Что дает циторедуктивная операция?
- Уменьшение размеров опухоли снижает ее влияние на организм – интоксикацию, нагрузку на иммунную систему. Это означает уменьшение симптомов, улучшение качества жизни человека - те задачи, решением которых занимается паллиативная медицина. Циторедуктивные операции традиционно считались ее частью.
- Частичное удаление опухоли, уменьшение количества раковых клеток увеличивает возможности иммунной системы. Зачастую это приводит к замедлению развития заболевания и продлению жизни человека.
- Увеличиваясь в размерах, опухоль прорастает в соседние органы. Это называется инвазией. В процессе такого прорастания возможно прободение полых органов – желудка, кишечника. Такие осложнения угрожают жизни. Чтобы избежать этого, опухоль удаляется настолько, насколько это возможно.
- Есть и другие осложнения, когда размеры новообразования имеют критическое значение (угроза распада опухоли, кровотечения, др.). Уменьшить их – значит, избежать осложнений.
Оставьте свой номер телефона
Циторедуктивная хирургия в комплексном лечении
Успехи современной онкологии в корне изменили взгляд на циторедуктивные операции. Сегодня их возможности выходят далеко за рамки паллиативной медицины.
- Уменьшение объема опухоли способно существенно повысить результаты химио-, лучевой и таргетной терапии. Эффективность химиопрепаратов находится в обратной зависимости от размеров злокачественных новообразований. Чем они меньше, тем больший эффект может быть достигнут.
В практике комбинированного, комплексного лечения далеко не последнюю роль играют циторедуктивные операции. Как показывает опыт нашей клиники, иссечение опухоли, хотя бы и неполное, существенно влияет на общие результаты лечения:
- Циторедукция повышает чувствительность новообразования к действию химиопрепаратов, помогает им проникнуть в очаг опухоли.
- Уменьшается количество антигенов, повышается активность, увеличиваются силы и возможности иммунной системы.
- Лучевая, таргетная, гормональная и другие виды терапии зачастую дают не просто более высокие, а радикально иные результаты, которые позволяют улучшить прогноз заболевания.
- Иссечение новообразования снижает его способность видоизменяться, сопротивляться лечению. Уменьшается возможность образования клеток, не восприимчивых к терапевтическому воздействию.
- Существенно снижается возможность метастатического каскада (когда метастазы становятся центрами роста вторичных обширных очагов).
Когда применяются такие операции?
Чаще всего циторедукция применяется при раке яичников, толстой кишки, молочной железы, саркомах мягких тканей, ряде других злокачественных новообразований.
Циторедуктивная хирургия применяется в паллиативных целях, когда есть возможность продлить жизнь человека на несколько лет. Может быть, это будут дополнительные 3-5 лет или вместо нескольких месяцев человек проживет годы.
Циторедукция целесообразна, когда она дает возможность улучшить качество жизни, предотвратить опасные осложнения, облегчить боль, интоксикацию и другие симптомы.
Решение о проведении хирургического вмешательства принимается индивидуально. При этом принимаются во внимание не только ожидаемые положительные эффекты, но и возможные риски, осложнения, наличие абсолютных или относительных противопоказаний, состояние пациента.
В лечебных целях циторедуктивные операции применяются в составе комплексной терапии:
- перед проведением курса химио-, лучевой, таргетной терапии;
- после ударного курса химиотерапии;
- после нескольких курсов химио-, лучевой терапии (при рецидивах или обнаружении остаточной опухоли).
Циторедуктивная хирургия применяется, когда есть возможность удалить все видимые (визуально определяемые) очаги первичной опухоли, при одиночных, немногочисленных метастазах.
К.И. Жорданиа
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Рак яичников является частым онкогинекологическим заболеванием, занимая второе место по частоте возникновения и первое по смертности. Среди всех онкологических патологий у женщин рак яичников твердо занимает четвертое место по летальности, и в последнее десятилетие отмечается его значительное омоложение.
Как известно, основные роли в терапии рака яичников принадлежат трем методам лечения: хирургическому, лекарственному и лучевому.
Оперативному вмешательству в настоящее время придается первостепенное значение как самостоятельному методу и как важнейшему этапу в комплексе лечебных мероприятий. Лапаротомия позволяет произвести тщательную ревизию органов брюшной полости и забрюшинного пространства, способствует морфологической верификации диагноза, определению степени дифференцировки опухоли и, что самое главное, позволяет удалить опухолевую ткань целиком или частично.
При злокачественных опухолях яичников операцией выбора считается экстирпация матки с придатками, резекция большого сальника. В последние два десятилетия объем оперативного вмешательства несколько расширился. Некоторые исследователи призывают дополнительно производить аппендэктомию, спленэктомию, резекцию пораженных отделов кишки, а также забрюшинную лимфаденэктомию.
На последней хотелось бы остановиться несколько подробней в связи с важностью обнаружения метастазов этих локализации в правильном определении стадии процесса и, следовательно, адекватности терапии и оценке прогноза заболевания.
Данные литературы свидетельствуют о том, что даже у больных I-II стадиями рака яичников более чем в 30% наблюдений и только при целенаправленном исследовании диагностируются метастазы в забрюшинные лимфоузлы различных локализаций. Поэтому разработанные классификации FIGO и TNM, неоднократно модифицированные, не полностью удовлетворяют онкологов, т.к. даже несмотря на многочисленные поправки, они остаются весьма условными (1,2).
Реально подходя к пониманию данного вопроса, можно прийти к заключению, что, вероятно, существует, по крайней мере, две стадии при раке яичников: истинно первая, при которой процесс ограничен яичником, и вторая, при которой процесс приобрел уже системный характер. Правда, определить эту грань между стадиями в настоящее время практически невозможно. А если учесть еще и возможность редкого, но все же встречаемого эктопического возникновения эпителиальных злокачественных опухолей яичников, то определение стадии процесса вызывает еще большие трудности.
Сложность пальпаторной и визуальной диагностики метастазов в забрюшинные лимфоузлы объясняется тем, что даже пораженные опухолью лимфоузлы бывают не увеличенными, плотноэластической консистенции, свободно или относительно смещаемыми. Кроме того, забрюшинно только в парааортальной зоне насчитывается от 80 до 120 лимфоузлов, и практически каждый из них может быть поражен метастазами (3,4,5,6).
Учитывая вышеизложенное, становится понятным, насколько сложным является установление стадии болезни при раке яичников и насколько важную роль это играет в выработке адекватной терапии, а, следовательно, и в прогнозе заболевания.
Теоретически тотальная забрюшинная лимфаденэктомия должна приводить к лучшим результатам выживаемости, однако, те немногочисленные авторы, которые имеют достаточный опыт в проведении подобных операций, отмечают целый ряд осложнений, вплоть до летальных исходов.
Конечно же, реалистически подходя к вопросу лечебной тактики при ранних стадиях заболевания, приходится признать, что не все больные оперируются радикально. В ряде случаев, явно рискуя, хирурги вынуждены идти навстречу пожеланиям молодых женщин, которые, по тем или иным мотивам, не соглашаются на радикальное оперативное лечение. В подобных случаях необходим строгий индивидуальный подход. Органосохраняющие операции возможны, но лишь при самом тщательном исследовании контралатерального яичника, придатков, цитологическом и гистологическом исследовании операционного материала с определением степени дифференцировки опухоли, ее пролиферативного потенциала и других биологических параметров.
Значительно больше проблем возникает перед клиницистами при лечении больных с далеко зашедшими стадиями заболевания. Поэтому подавляющее число публикаций как отечественных, так и зарубежных авторов посвящено именно больным этой категории. В настоящее время ни у кого не вызывает сомнений необходимость при первичном лечении этих больных применения комбинированных или комплексных методов лечебных мероприятий. В то же время отдельные стороны и детали комбинированного лечения продолжают носить противоречивый характер в связи с большим количеством мнений различных исследователей, касающихся тактики, схем химиотерапии, этапности, длительности лечения и т.д.
1) неэффективность фармакологических препаратов снимается удалением основной массы опухоли со слабым кровотоком; 2) эффективность химиопрепаратов связана с высокой митотической активностью малых опухолей; 3) наименьшие остаточные опухоли требуют меньшего количества курсов химиотерапии, в то время как при больших массивах повышается вероятность появления резистентных форм; 4) удаление основных опухолевых масс приводит к относительной нормализации иммунной системы пациентки; 5) удаляются по возможности фенотипически резистентные опухолевые клетки.
Ниже мы постараемся коротко расшифровать перечисленные критерии возможной эффективности циторедуктивных операций.
Для солидных новообразований характерен сравнительно бедный кровоток, что снижает концентрацию фармакологического препарата в опухолевых тканях и, соответственно, эффективность проводимого лечения. Особенно это проявляется в центральных областях опухоли, где часты обширные некрозы, связанные с нарушением трофики тканей. К некротическим участкам примыкают кровоснабжающиеся из мелких сосудов многочисленные, особенно жизнеспособные участки злокачественных тканей. Такое представление подтверждается, правда косвенно, низким содержанием свободной глюкозы и высоким уровнем молочной кислоты во внутритканевой жидкости солидных опухолей. Все это приводит к временному снижению митотической активности злокачественных клеток и в результате к снижению эффективности проводимой химиотерапии, тропной к ДНК клетки только в определенную фазу.
Для максимального эффекта большинства фармакологических агентов необходима фракция клеток с быстрым ростом, поэтому при удалении основной массы малочувствительных к химиотерапии клеток остаются более чувствительные небольшие очаги (диссеминаты), обладающие высокой митотической активностью.
Кроме того, удаление большой массы опухоли приводит к восстановлению относительной иммунокомпетентности организма-опухоленосителя, в первую очередь за счет снижения иммуносупрессии, индуцированной неоплазмой, и, как следствие, отмечается повышение активности клеточного иммунитета.
Как известно, целью хирургического лечения является удаление максимально возможного объема первичной опухоли и ее метастазов. Если полное удаление опухоли невозможно, удаляют большую ее часть. Показано, что выживаемость больных в значительной степени коррелирует с размером оставшихся после операции метастазов. Так, при размерах остаточной опухоли, которые не превышала 5 мм, средняя продолжительность жизни соответствовала 40 месяцам, при размерах до 1,5 см — 18 месяцам, а в группе больных с метастазами более 1,5 см — соответствовала 6 месяцам.
В связи с этим в настоящее время рекомендуются следующие стандартные положения для оперативных вмешательств:
Первичная циторедуктивная операция предусматривает удаление максимально возможного объема опухоли и метастазов перед началом лекарственной терапии. Первичная циторедуктивная операция является стандартом помощи при распространенном раке яичников, особенно при Ш стадии заболевания. Целью циторедуктивной операции должно являться полное удаление опухоли или оставление ее минимального объема по окончании операции. Роль циторедуктивной операции при IV стадии по FIGO противоречива, но больные с наличием только плеврального выпота, метастазами в надключичные лимфоузлы или единичными кожными метастазами могут лечиться, как при III стадии заболевания. Не показан данный объём операции больным с метастазами в печень и легкие. С другой стороны, неоадьювантная химиотерапия является приемлемой альтернативой циторедуктивной операции при IV стадии заболевания или у больных, у которых заболевание не может быть оптимально уменьшено в связи с техническими трудностями.
Промежуточная циторедуктивная операция операция выполняется после короткого курса индукционной химиотерапии (обычно 2-3 курса). Выполнение операции на данном этапе является приемлемым подходом в терапии пациенток, у которых первая операция была либо пробной, либо малоуспешной.
Вторичная циторедуктивная операция. Большинство вторичных циторедуктивных операций выполняются при локализованных рецидивах, возникших после комбинированного лечения. Предварительный анализ показал, что кандидаты для выполнения подобных операций могут быть определены с учетом факторов прогноза. Чаще всего это опухоли, которые рецидивируют спустя год и более после завершения первичного лечения и адекватно отвечали на проводимую ранее химиотерапию.
Паллиативные операции в основном производятся для облегчения состояния больной, например, при кишечной непроходимости на фоне спаечного процесса или прогрессировании заболевания.
Однако, несмотря на столь весомые аргументы в пользу операций, производимых на первом этапе, существуют и их противники, которые выдвигают целый ряд критических замечаний, с которыми нельзя не считаться (10,11,12). Так, например, отмечается высокий процент послеоперационных осложнений, отсрочено начало столь необходимого лекарственного лечения и, наконец, утверждается, что комбинированная химиотерапия не менее эффективна, а подчас заменяет циторедуктивную операцию. К сожалению, соответствующие рандомизированные проспективные исследования по изучению целесообразности первичного удаления опухоли еще не проводились. Однако, доказана большая продолжительность жизни больных после отсроченного удаления опухоли (после 3-х курсов химиотерапии препаратами платины) по сравнению с больными, которым хирургическое лечение вообще не проводилось. Кроме того, во всех ретроспективных исследованиях показано, что продолжительность жизни больных обратно пропорциональна величине остаточной опухоли к моменту начала химиотерапии (10,11,12).
В заключение необходимо отметить, что к настоящему времени, методы оперативного лечения при раке яичников практически не изменились, за небольшим исключением, в то время как лекарственное лечение стало более эффективным и продолжает совершенствоваться. Появились новые перспективные методы консервативной терапии на стыке генетики, иммунологии, химиотерапии и лучевого лечения. Поэтому следует признать, что рак яичников является прерогативой консервативной медицины.
1) Berek JS, Hacher NF. Staging and second-look operations in ovarian cancer. In: Alberts DS, Sur-vit EA, eds. Ovarian cancer. Boston: Martinus Nijhoff,1985-109-27.
2) Young RC, Decker DG, Wharton JT, Piver MS, Sindelar WF, Edwards BK, et al. Staging laparot-omy in early ovarian cancer. JAMA 1983;250:3072-6.
3) Eadson DF, Ford D, Bishop DT. Breast and ovarian cancer incidence in BRCA-1-mutation car-ries. Am J Genet 1995;56:265-71.
4) Plentl FV, Friedman EA. Lymphatic system of the Female Genitalia. Philadelphia: WB Saun-ders;1971.
5) Burghard E, Hellmuth P, Lahousen M, Stettner H. Pelvic Lymphadenectomy in operative treat-ment of ovarian cancer. Am J Obstet Gynecol 1986;155:315-9.
6) Chen SS, Lee L. Incidence of paraaortic and pelvic lymph node metastasis in epithelial ovarian cancer. Gynecol Oncol 1983;16:95-100.
7) Skipper HE, Adjuvant chemotherapy. Cancer 1978;41:936-40.

Goldie JH, Coldman AJ. Cancer Trat Rep.1979;63:1727-33.
9) Bookman M, Berek JS. Biologic and immunologic therapy of ovarian cancer. Hematol Oncol Clin North Am 1992;6:941-65.
10) Hunter RW, Alexander NDE, Soutter WP. Am J Obstet Gynecol 1992;166:504-1.
11) Van der Burg MEL, van Lent M, Buyse M, Kobierska, Colombo N, Favalli G.N Engl J Med. 1995:332:629-34.
12) Berek JS. Interval debulking of epithelial ovarian cancer: an interim measure. N Engl J Med.1995;332:675-7.
Читайте также:





