Высокотепловая технология лечения онкологии
Терапевтическая гипертермия является типом лечения, при котором живые ткани подвергаются воздействию повышенной температуры. И это оказывает губительный эффект на раковые клетки, вызывающий их уничтожение, или снижает устойчивость этих клеток к воздействию радиоактивного лечения или препаратов химиотерапии. Стоит отметить, что температурное воздействие на атипичные ткани не относится к группе радиочастотной абляции, это совершенно иная методика. В сочетании с лучевой терапией метод теплового воздействия носит называние терморадиотерапия.
- Что такое гипертермия
- Локальная, регионарная и общая гипертермия
- Для каких видов рака применяется
- Абляция опухолей
- Осложнения и побочные эффекты
Гипертермия в онкологии: что это такое?
Международная онкология не выработала до сих пор общего мнения относительно того, какие показатели температуры являются самыми безопасными и одновременно самыми эффективными. Во время лечения температура тела, как правило, достигает уровня между 39,5 и 40,5 ° C. Тем не менее, другие исследователи определяют границы гипертермии между 41.8-42 ° C, что присуще для стран Европы и США. Япония и Россия принимают самые высокие показатели — 43-44 ° С.
Температура и время воздействия взаимосвязаны. Более длительная продолжительность и высокие температуры очень эффективны для уничтожения раковых клеток, но они также достаточно серьезно повышают риск токсичности. Опухолевые клетки с дезорганизованной и компактной сосудистой структурой очень тяжело отводят тепло, что способствует стимуляции апоптоза (вид физиологически запрограммированной гибели клеток) в их отношении или обычной гибели. Тогда как здоровые ткани обладают лучшей теплопроводностью, в связи с чем лучше противостоят высоким температурам.
Даже если раковые клетки не гибнут сразу, они могут стать более восприимчивы к ионизирующему излучению в противораковой терапии или химиотерапии. Тепло при локальной гипертермии расширяет кровеносные сосуды опухоли, способствуя повышению оксигенации (насыщению кислородом) новообразования, тем самым делая лучевую противораковую терапию более эффективной. Кислород является мощным радиосенсибилизатором, что значительно повышает эффективность заданной дозы излучения путем формирования ДНК-повреждений. Опухолевые клетки при недостатке кислорода могут быть в 2-3 раза более устойчивы к радиационному повреждению, чем в нормальной кислородной среде.
Гипертермия, как было доказано, весьма эффективна в сочетании с химиотерапией. Опубликованные исследования показали улучшение 10-летней выживаемости без рецидивов и метастазов у пациентов, страдавших раком мочевого пузыря, которые получали комбинированное лечение гипертермией и химиотерапией. 53 % пациентов прожили 10 последующих лет, в то время как химиотерапия в единственном варианте обеспечила выживаемость только у 15 % заболевших.
Интенсивный нагрев вызывает денатурацию и коагуляцию клеточных белков, что быстро уничтожает клетки опухоли. Более длительный умеренный нагрев до температуры всего в несколько градусов выше нормы может вызвать более тонкие структурные изменения в клетках. Мягкая термообработка в сочетании с другими способами может привести к гибели клеток по причине стимуляции биологического разрушения.
Из минусов специалисты отмечают многие биохимические последствия теплового шока в нормальных клетках, в том числе замедление роста и повышенной чувствительности к последующей ионизирующей радиоактивной терапии.
Гипертермия увеличивает приток крови к нагретой области, что может провоцировать удвоение кровотока в опухолях. Такой феномен повышает положительное воздействие химиотерапевтических средств в патологических областях.
Мягкая гипертермия, которая обеспечивает температуру, равную естественно высокой при многих инфекционных заболеваниях, может стимулировать естественные иммунологические атаки на опухоли. Однако это также индуцирует естественный физиологический ответ под названием термотолерантность, который имеет тенденцию защищать атипичные клетки.
Очень высокие температуры, выше 50 ° C, используются для абляции — прямого уничтожения некоторых опухолей. Методика использует вставки в виде металлической трубки непосредственно в опухоль, наконечник которой нагревается, это и вызывает гибель клеток по его периметру.
Стоит подчеркнуть, что методика гипертермической абляции в России пока что в стадии изучения, и в практической медицине применяется редко. Однако эффективность испытаний прогнозирует весьма неплохие перспективы этого метода, в том числе и в нашей стране.
Отличия и особенности методов локальной, регионарной и общей гипертермии
Методы терапевтической гипертермии применяются, как правило, в трех вариантах, в зависимости от показаний и лечебных возможностей.
- Локальная гипертермия
Нагревается очень маленькая площадь, как правило, в рамках самой опухоли. В некоторых случаях цель метода заключается в гибели атипичных клеток путем нагревания, не повреждая окружающие ткани. Тепло может быть стимулировано с помощью:
- ультракоротких волн;
- высоких радиочастот;
- ультразвуковой энергии;
- с использованием магнитной гипертермии.
В зависимости от локализации опухоли, тепло может быть применено к поверхности тела, внутри тканей или глубжележащих областей за счет использования игл или зондов. Одним из относительно распространенных типов является радиочастотная абляция небольших опухолей. Терапевтической цели легче всего достичь, когда опухоль находится на поверхности тела (поверхностная гипертермия), или если существует возможность ввода игл или зондов непосредственно в опухоль (интерстициальная гипертермия).
- Регионарная гипертермия
Нагревается большая площадь тела, например, целый орган или конечность. Как правило, цель метода состоит в ослаблении раковых клеток таким образом, чтобы достичь их гибели последующим радиоактивным излучением или действием химиотерапевтических препаратов. Как и в предыдущем методе, регионарная гипертермия может использовать те же поверхностные или интерстициальные методы или опираться на перфузию крови. Во время процесса перфузии кровь пациента удаляется из организма, нагревается и возвращается в кровеносные сосуды, которые ведут непосредственно в нужную часть тела. Как правило, химиотерапевтические препараты применяются одновременно.
Одним из специализированных типов такого подхода является непрерывная перитонеальная перфузия, которая используется для лечения сложных новообразований внутри брюшной полости, в том числе первичной мезотелиомы брюшной полости и рака желудка. Горячие химиотерапевтические препараты закачивают непосредственно в брюшную полость, чтобы убить раковые клетки.
- Общая гипертермия
Нагревается весь организм до температуры от 39 до 43 °С и выше. Метод, как правило, используется для лечения метастатического рака. Включает в себя использование инфракрасных гипертермических куполов, под которые помещается все тело пациента, за исключением головы. К другим способам можно отнести помещение пациента в очень горячую камеру или укутывание в нагретые влажные одеяла. Из редких методов используют специальные гидрокостюмы с постоянным подогревом или погружение в горячий воск.
Для каких видов рака может применяться гипертермия?
В одиночку гипертермия продемонстрировала уникальную способность терапии злокачественных новообразований. Также известно, что методика значительно увеличивает эффективность других методов лечения.
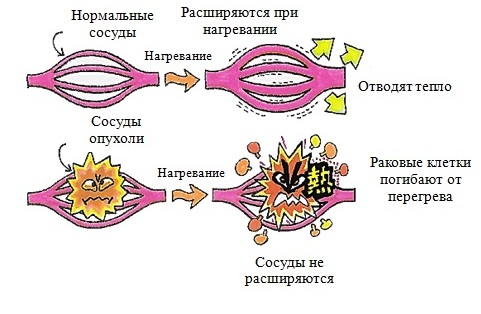
В сочетании с радиоактивным излучением гипертермия особенно эффективна в присутствии большого количества кислорода при условии одновременного воздействия не менее, чем в течение часа.
В последние десять лет гипертермия в сочетании с облучением была использована с лечебной целью у больных со следующими диагнозами:
- ранняя стадия рака молочной железы;
- при локализации рака на голове и шее;
- рак простаты.
Известные научные издания свидетельствуют об улучшении у 38 % пациентов при раке мочевого пузыря в сочетании с химиотерапией, по сравнению с применением только химиотерапии. У больных раком молочной железы результат показал улучшенную реакцию у 18 % пациентов.
Какие существуют еще типы рака, которые показывают значительное улучшение при лечении гипертермией?
- Меланома и рак кожи.
- Саркома мягких тканей.
- Рак мочевого пузыря.
- Рак шейки матки.
- Рак прямой кишки.
- Злокачественные опухоли подмышечной области и грудной стенки.
- Метастазы в лимфоузлах.
Исследования в России показали интересные результаты с высокой гипертермией в 43,5-44°C, когда метод применяли в отношении:
- рака пищевода;
- рака гортани;
- рака печени;
- при ВИЧ-инфекции и расстройствах иммунной системы.
Абляция опухолей — одна из разновидностей гипертермии
Радиочастотная абляция (РЧА), вероятно, наиболее часто используемая разновидность локальной гипертермии. Для повышения температуры применяются радиоволны высокой частоты.

- Тонкий игольчатый зонд вводится в опухоль на короткое время, как правило, от 10 до 30 минут.
- Размещение зонда регулируется с помощью ультразвука, МРТ или КТ.
- Наконечник зонда выдает высокочастотный ток, который способен создать тепло между 40 и 60°С, что вызывает гибель клеток в пределах определенной области.
- Мертвые клетки не удаляются, становятся рубцовой тканью и рассасываются с течением времени.
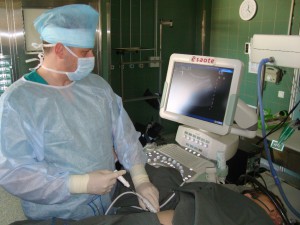
РЧА наиболее часто используется для лечения опухолей, которые не могут быть удалены хирургическим способом, или у пациентов, которые по разным причинам не операбельны. Процедура может быть выполнена амбулаторно. Повторения абляции возможно для опухолей, способных к рецидивам. Также РЧА может быть добавлена к другим лечебным мероприятиям, в том числе оперативному удалению новообразования, лучевой терапии, химиотерапии, инфузионной терапии, алкогольной абляции или химиоэмболизации.
РЧА может быть использована для лечения опухолей, достигших в диаметре вплоть до 5 см. Методика наиболее эффективна для лечения образований в печени, почках и легких. В настоящее время изучается ее применение в других областях тела. Долгосрочная эффективность после лечения гипертермической абляцией пока не известна, но первые результаты обнадеживают.
Возможные осложнения и побочные эффекты гипертермии
Применение высоких температур может привести к ожогам тканей, повреждению органа-мишени, особенно в случаях регионарного лечения. Степень поражений будет варьироваться в зависимости от времени воздействия, температуры и вида тканей. Самыми чувствительными к этому методу являются ткани головного мозга и легких.
- Отек.
- Образование тромбов.
- Внутренние кровотечения.
- Сердечно-сосудистые нарушения.
Сочетаемость с радиоактивным облучением или химиотерапией обладает достаточно сильной токсичностью, что выражается, как правило, через несколько часов после процедуры и может вызывать порой довольно тяжелые расстройства.
16 марта 2020 11:30

Мануэль Руис-Эчарри, онколог:
Еще один новый метод в онкологии — иммунная терапия. Разработке этого вида лекарственного лечения способствовало недавнее раскрытие механизма иммунного ответа при онкологических заболеваниях, за что в 2018 году американец Джеймс Эллисон и японец Тасуку Хондзе получили Нобелевскую премию. Иммунная терапия активизирует собственные защитные силы организма для борьбы со злокачественными клетками. Ее эффективность высока, переносится она удовлетворительно, а побочные эффекты легче, чем у химиотерапии. Иммунотерапевтические препараты стали важной частью противоопухолевого лечения меланомы, рака почки, рака печени, разных подтипов рака легкого, опухолей ЖКТ и других онкозаболеваний. При лимфоме Ходжкина иммунотерапия показывает высокую эффективность даже после трансплантации костного мозга. К сожалению, эффективно применять эту терапию ко всем видам рака невозможно, поскольку иммунная система человека может справиться не со всеми типами опухолей. Поэтому она изначально показана не всем пациентам.

Нидаль Салим, радиационный онколог:
Еще одна область радиационной онкологии — стереотаксическая радиохирургия. Роль скальпеля здесь выполняет пучок радиационных лучей, которые называют гамма- или киберножами. Существует и еще более новое оборудование — аппарат Varian EDGE, отличающийся максимально высокой точностью. Его можно сравнить с острейшим лезвием. Таких установок пока очень мало — единицы во всем мире. Одна из них установлена в EMC.
Дозы облучения при применении стереотаксиса в несколько десятков раз превышают дозы при лучевой терапии, но это позволяет практически избавиться от опухоли или единичных метастазов всего за один-три сеанса. При этом часть клеток может оказаться устойчивой даже к очень высоким дозам облучения, поэтому такая терапия тоже подходит не для всех случаев.

Фото: Saph Photography/Pexels

Алексей Кривошапкин, нейрохирург:
Почему с глиобластомой так трудно бороться? Потому что она развивается чрезвычайно быстро. Если выполняется лишь частичное удаление такой опухоли, операция может подстегнуть ее рост и даже сократить продолжительность жизни пациента. В настоящее время разработанные алгоритмы компьютерного зрения помогают врачам рассчитать риски математически. Благодаря этой возможности выяснилось, что если оставить опухоль после ее хирургического удаления объемом менее 2,5 кубических сантиметров, то больной достоверно проживет дольше. Остаток опухоли большего размера очень быстро перестраивается и превращается в еще более агрессивную опухоль.
Радикальное удаление опухоли — наилучший шанс для больного стать долгожителем среди людей с аналогичным диагнозом. Для максимально полного удаления новообразования нужны современные технологии. Это операционные микроскопы, оснащенные флуоресцентными блоками для определения границ злокачественной опухоли, методы нейронавигации и интраоперационной визуализации (магнитный резонанс, позитронно-эмиссионная томография).
Около двух лет назад специалисты нашей клиники запатентовали новый метод лечения пациентов с рецидивом глиобластомы. Сейчас его начинают применять нейрохирурги Европы и Америки. Суть заключается в том, что после хирургической резекции опухоли в образовавшейся полости размещают мягкий пластиковый баллон, который раздувают в соответствии с границами опухоли. Затем после контроля его позиции с помощью ультразвукового сканирования в баллон вводится источник электронного облучения. Медицинские физики могут быстро и точно рассчитать необходимую лечебную дозу. Этот метод называется баллонная электронная брахитерапия. Он не требует значительного операционного времени, безопасен для больного и медицинского персонала. Метод используется в общей онкологии. Усовершенствование технологии для нейроонкологии и внедрение методики в процесс лечения рецидива глиобластомы в рамках клинического исследования показали впечатляющие результаты, которые дают надежду пациентам на значительную прибавку в продолжительности и качестве жизни после операции.

Владимир Носов, хирург-онкогинеколог:
Среди последних достижений онкогинекологии стоит отметить прогресс онкогенетического тестирования. Большие надежды возлагаются на персонализированную медицину, а также на выявление конкретных молекулярных поломок и таргетную терапию.

Фото: Saph Photography/Pexels
Искра Даскалова, хирург-маммолог:
В последние десятилетия проблема рака молочной железы все реже решается объемным хирургическим вмешательством. Многие пациентки имеют возможность сохранить и грудь, и качество жизни без ухудшения прогноза заболевания. Уже давно доказано, что для пациенток с ранней стадией болезни щадящие (органосохраняющие) операции и последующая лучевая терапия ничем не уступают радикальной мастэктомии. Данные последних лет показывают, что онкологический прогноз у таких пациенток даже лучше.
В радикальном удалении молочной железы нуждаются около 30 процентов заболевших женщин, часто это связано с неблагоприятным соотношением размера груди к размеру опухоли, поскольку удалить новообразование нужно в пределах здоровых тканей. Даже когда речь идет об удалении груди, остаются возможности для последующей реконструкции с хорошими косметическими результатами.
Институт онкологии Европейского медицинского центра EMC — экспертная клиника международного уровня. Здесь пациенты могут получить весь комплекс услуг в одном здании: диагностику, таргетную терапию, иммуно- и химиотерапию, хирургию любой сложности, лучевую терапию, реабилитацию, психологическую поддержку пациента и его семьи. Лечение проводится по современным международным протоколам. Клиника оборудована по последнему слову техники: диагностическое оборудование экспертного уровня, 12 операционных блоков, хирургический робот последнего поколения da Vinci Si HD, отделение ПЭТ/ ОФЭКТ-диагностики с собственной лабораторией по производству радиофармпрепаратов, единственная в России сверхточная система для радиохирургии и лучевой терапии Varian EDGE, система для проведения интраоперационной лучевой терапии. Для каждого пациента разрабатывается индивидуальный план лечения, согласованный несколькими специалистами в области онкологии, радиологии, лучевой терапии, онкохирургии из США, Европы, Израиля и России.
При обращении больных с впервые выявленной опухолью 1-3 стадии любой локализации:
Начинаем не с операции, как в большинстве отечественных и зарубежных клиник, не имеющих оборудования и опыта применения общей гипертермии, а сначала проводим нагрев в сочетании с химиотерапией. Эта процедура:
- повреждает опухолевые клетки;
- предотвращает метастазирование во время последующей операции;
- уменьшает размеры опухоли и метастазов (если имеются);
- стимулирует противоопухолевый иммунитет;
- усиливает губительное воздействие химиопрепаратов.
Даже однократная химиотерапия под нагревом до операции эффективна и при малочувствительных и нечувствительных к химиопрепаратам опухолях (злокачественные образования желудка, ободочной кишки, матки, почки, поджелудочной железы, саркомы мягких тканей, тройной негативный рак молочной железы).
Вторым этапом выполняем радикальную операцию. Возможно, органосохранную. После операции с учетом стадии болезни, метастазирования, данных иммуногистохимии проводим еще общую гипертермию и химиотерапию от 2 до 4 курсов.
При обращении пациентов с 4 стадией, с неудалёнными ранее опухолями или с множественными метастазами после проводимой ранее терапии:
Выполнение курсов химиотерапии под нагревом позволяет уменьшить проявления опухолевого роста, добиться их регрессии, провести оперативное лечение и в конечном итоге контролировать болезнь, также увеличить продолжительность жизнь и ее качество. Количество курсов назначается индивидуально лечащим врачом.
Результаты метода лечения рака химиотерапией под нагревом
Данные в таблице приведены на примере самой запущенной стадии онкологии – 4. Чем менее упущено время развития заболевания, тем перспективнее лечение.
Показатель выживаемости, % | 1 год | 3 года | 5 лет |
| Злокачественные опухоли желудка, 4-я стадия | 57,0 | 26,3 | 21,5 |
| Рак ободочной кишки, 4-я стадия | 64,5 | 15,2 | 15,2 |
| Опухоли прямой кишки, 4-я стадия | 61,3 | 52,5 | 27,3 |
| Рак молочной железы (с обширными метастазами), 4-я стадия | 86,6 | 50,9 | 49,3 |
| Саркомы мягких тканей, 4-я стадия | 94,2 | 68,2 | 49,8 |
Расчет произведен с даты первого сеанса для больных, у которых в результате был получен клинический эффект (полная регрессия, частичная регрессия, стабилизация). Подсчет показателей выживаемости проводился по методу Каплана — Майера. Результаты достоверны (P Результаты лечения рака методом гипертермии:
| Диагноз | Полная регрессия | Частичная регрессия | Стабили зация |
| Рак молочной железы T3-4N0-3M0-1 в выборке – 855 чел. | 14,2 % | 38,1 % | 26,4 % |
| Местно-распространенный рак молочной железы T4N2-3M0-1 в выборке -121 чел. | — | 47,6 % | 28,6 % |
| Рак желудка T2-4N0-2M1 в выборке – 270 чел. | — | 22,9 % | 51,4 % |
| Опухоли ободочной кишки T2-4N0-2M1 в выборке – 245 чел. | — | 11,1 % | 71,1 % |
| Рак прямой кишки T2-4N0-2M1 в выборке – 245 чел. | 4,4 % | 26,7 % | 53,3 % |
| Саркомы мягких тканей T2bN0M1 в выборке – 155 чел. | 3,6 % | 36,4 % | 47,3 % |
| Рак почки T1-3aN0-2M1 в выборке – 211 чел. | — | 36,4 % | 54,5 % |
| Новообразования яичников, шейки матки, тела матки T3a-3cN1M0-1 в выборке – 140 чел. | 12,5 % | 35,0 % | 37,5 % |
| Рак гортани T3-4aN0-2M0-1 в выборке – 42 чел. | — | 41,7 % | 50,0 % |
| Рак щитовидной железы T4a-4bN1M0 в выборке – 10 чел. | 10,0 % | 30,0 % | 30,0 % |
Оценка проводилась через месяц после процедуры. Учитывались пациенты с запущенной онкологией и обширными метастазами, у которых на фоне проведенного в других больницах лечения отмечалось прогрессирование. Ранее больные получали до 17 курсов химиотерапии.
ПОЛНАЯ РЕГРЕССИЯ — полное исчезновение всех поражений.
ЧАСТИЧНАЯ РЕГРЕССИЯ — уменьшение размеров всех или отдельных очагов более чем на 50 %.
СТАБИЛИЗАЦИЯ — уменьшение очагов менее чем на 50 % при отсутствии новых поражений или увеличение не более чем на 25 %.
Контрольные исследования, принимаемые во внимание для оценки результатов: рентгенография и рентгеноскопия; компьютерная томография или магнитно-резонансная томография; ПЭТ КТ; ультразвуковое исследование и др.
Подробнее о методе лечения рака:
Краеугольный вопрос, почему еще этот метод не распространен повсеместно: как прогреть тело человека до таких температур, чтобы опухоль погибла, а больной нет?
Противопоказания к процедуре лечения онкологии гипертермией:
- опухоли головного и спинного мозга, а также метастазы в головной мозг;
- тяжелое общее состояние: выраженная раковая интоксикация, кахексия, дыхательная недостаточность III–IV степени, печеночная недостаточность, почечная недостаточность, сердечно-сосудистая недостаточность, тяжелые нарушения сердечного ритма;
- анемия, лейкопения, тромбоцитопения III–IV степени тяжести.
Научные публикации:
Локальная ВЧ-гипертермия с токопроводящей жидкостью в комбинированном лечении рака молочной железы / И.Г.Терентьев, И.С.Шумская, В.И.Кирилин, С.С.Кузнецов, С.П.Петяшина /Нижегородская государственная медицинская академия;Областной онкологический диспансер, Нижний Новгород
Локальная высокочастотная гипертермия в комплексном лечении рака шейки матки II – III стадии./ Румянцев Т.В. / Автореферат диссертации на соискание ученой степени к. м. н. Нижний Новгород, 2007. Работа выполнена на кафедре онкологии ЦПК и ППС НижГМА и на базе ГУЗНООД
Преимущество применения гипертермии и гипергликемии как модифицирующей метод в комплексном лечении местнораспространенной формы рака молочной железы/ Абдуллаев Х.Н., Турдиев М.Р., Абдулхакимов Ш.А./ Бухарский государственный медицинский институт. Узбекистан/ Материалы республиканской научно-практической конференции, Минск, 2014.
СВЧ гипертермия в медицине: реализация и применение/ Директоренко, А.А. Димитрюк, А.А. Директоренко / 2011 / Вестник Саратовского государственного технического университета.
Температурные зоны в лечении опухолей и метастазов:
1) когда опухоль разогревается до 38–40 °С, возможно усиление ее роста;
2) при достижении 40–42 °С происходит чувствительность опухоли к химиопрепаратам и ионизирующему излучению;
3) при разогреве свыше 42,5 °С наблюдается гибель опухолевых клеток – самый важный эффект.
Температурные режимы для нормальных тканей вдвое больше из-за их большей термоустойчивости. Поэтому нагрев губителен только для больных, неправильно функционирующих раковых клеток.
Существует несколько подходов к проведению сеансов общего нагрева. Они различаются способом разогрева тела человека: водоструйная, воздушная, инфракрасная и электромагнитная. В первом случае больного греют в ванне с горячей водой. Но какой же должна быть температура воды, чтобы внутренние органы прогрелись до температур свыше 42,5 °С? При воздушной и инфракрасной – также нагрев идет снаружи внутрь, поглощаясь на всем пути здоровыми тканями.
Электромагнитная гипертермия – контролируемый и эффективный способ нагрева .

Поглощение энергии тепла происходит глубоко расположенными тканями.
Рост температуры в облучаемых тканях происходит не за счет передачи тепла от поверхности внутрь, а вследствие преобразования электромагнитных волн в тепло в каждой точке тела.
Это позволяет снять проблему тепловой перегрузки кожного покрова, получить максимальный перегрев тканей и уменьшить число осложнений. Электромагнитный нагрев является наиболее управляемым.
Ход процедуры:
Больной размещается на электромагнитной установке на водяной подушке в положении лежа на спине. Процедура проводится под общей анестезией с искусственной вентиляцией легких. Контроль температуры осуществляется с помощью датчиков, установленных в прямой кишке, в пищеводе, на коже, в наружном слуховом проходе.
Температуру тела больного повышается до 42,5–43 °С и поддерживаем в течение 80 минут; этот температурный интервал является базовым лечебным режимом. Температурный режим выбирается с учетом исходного состояния больного, оценки риска осложнений, оценки результатов ранее проведенного лечения.
Во время сеанса контролируется уровень разогрева сердца, печени, глубинных структур головного мозга. Если во время проведения сеанса разогрев тела пациента возможен до 43 °С, то температура головного мозга может быть повышена только до 41 °С.
Рис. 2. Температурный режим сеанса
На фоне максимального разогрева вводим химиопрепараты, причем возможно снижение дозы лекарств на 50 % с одновременным усилением эффекта.
За время процедуры проводится постоянная корректировка водно-электролитного баланса.
По окончании сеанса установка отключается, и остывание больного происходит течение 40–80 минут в зависимости от массы тела. Выведение из наркоза проводится на уровне температуры 39 °С.
В первые часы после окончания сеанса больной переводится в палату интенсивной терапии, где проводится инфузионная терапия, направленная на восполнение потери воды и электролитов. Температура тела пациента нормализуется в течение нескольких часов после процедуры.
В последующие 1–7 суток пациентам проводится дезинтоксикационная инфузионная терапия, лабораторный контроль показателей крови. При проведении нескольких сеансов общей гипертермии интервал между курсами лечения составляет три недели.
Оптимальным числом курсов химиотерапии под нагревом являются 4 процедуры в режиме 42,5–43 °С. Этого достаточно, чтобы добиться регрессии большинства опухолей, получая субъективный эффект и улучшая качество жизни пациентов.
Оценка качества жизни и самочувствия после гипертермии:
- исчезновение или уменьшение интенсивности болевого синдрома;
- увеличение двигательной активности;
- уменьшение одышки и т. п.
Больные ощущают выраженное снижение интенсивности болей уже на вторые сутки после процедуры. Уменьшение слабости, одышки, прибавление массы тела обычно отмечается спустя 7–14 суток после курса. При диссеминированном раке молочной железы субъективный эффект химиотерапии под нагревом до 42,5–43 °С – улучшение качества жизни отмечено более чем у 95 % женщин.
Лечение злокачественных новообразований общей гипертермией дает половине пациентов возможность вести активный образ жизни, вернуться к труду. Стойкий субъективный эффект достигнут у 66,1 % больных.
Результаты оцениваются в соответствии с рекомендациями ВОЗ.
Читайте также:

