В качестве таргетной терапии хронического миелолейкоза применяются
Заболеваемость
Заболеваемость в Соединенных Штатах Америки составляет 1-2 случая на 100 тыс. человек в год при отсутствии существенных географических различий.
Возрастная медиана на момент диагноза составляет около 60 лет.
Диагноз
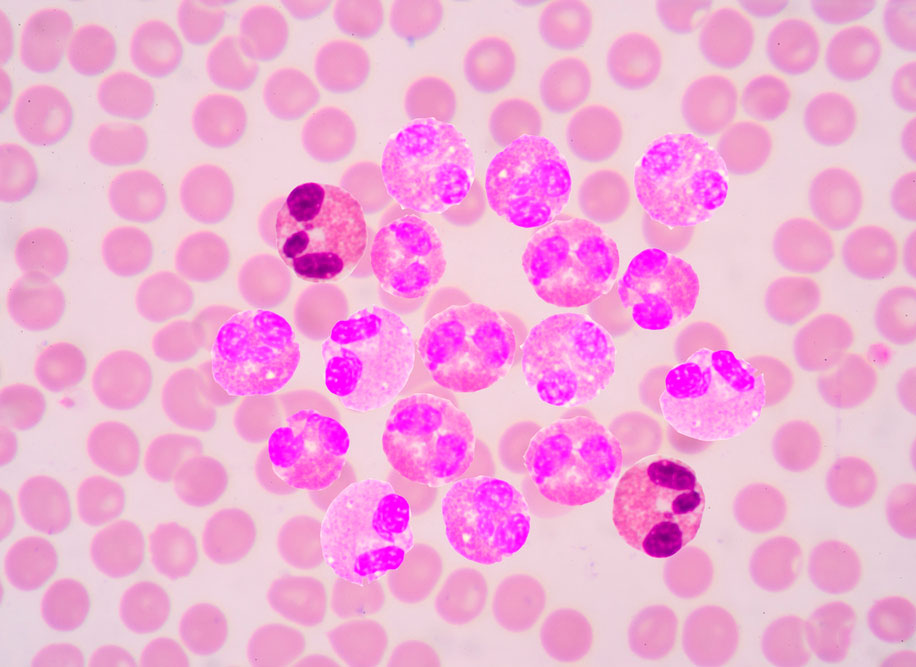
В большинстве случаев в основе диагноза лежит обнаружение типичной картины крови ― лейкоцитоз, часто сочетанный с тромбоцитозом и базофилией и расширение формулы с наличием элементов незрелого лейкопоэза (до метамиелоцитов и миелобластов).
Спленомегалия обычно обнаруживается в >50% случаев пациентов хронической фазы ХМЛ, однако 50% пациентов имеют бессимптомное течение.
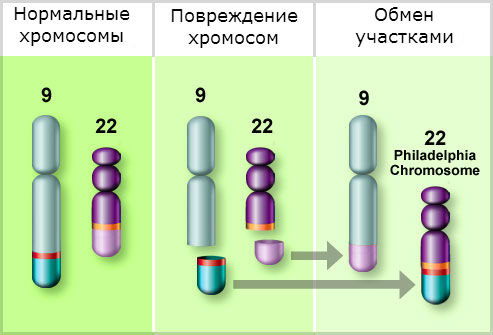
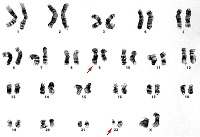
Для потверждения диагноза требуется определение Филадельфийской хромосомы (22q-), являющейся результатом сбалансированной транслокации (19;22) (q34;q11), и/или выявление реаранжировки BCR-ABL в клетках костного мозга или крови. Примерно в 5% случаев Ph хромосома может не определяться и для подтверждения/исключения диагноза ХМЛ необходимо применение молекулярно- биологические методов таких, как флуоресцентная гибридизация in situ (FISH) или полимеразная цепная реакция с обратной транскрипцией (RT-PCR).
Стадирование и факторы риска
Более чем в 90% случаев диагноз устанавливается в хронической фазе (ХФ). Типичное течение заболевание является трехфазным: ХФ, фаза акселерации (ФА), бластная фаза (БФ) и бластный криз (БК).
В фазу акселерации, в соответствии с общепринятым ее определением в периферической крови или костном мозге должно определяется около 10-29% бластов, >20% базофилов, независящие от лечения тромбоцитопения, тромбоцитоз, а также клональная цитогенетическая эволюция Ph+ клона.
БФ/БК характеризуются присутствием в крови/костном мозге . 30% бластов или наличием экстрамедуллярной бластной инфильтрации.
Прогностические системы, основанные на показателях возраста, размера селезенки, показателей формулы крови, были утверждены в эру до иматиниба и позволяют прогнозировать вероятность ответа на терапию, продолжительность времени до прогрессирования (progression-free survival) и общей выживаемости также для пациентов получающих терапию иматинибом.
Время достижения и выраженность гематологического, цитогенетического и молекулярного ответов также представляют собой важные факторы прогноза. (таблица №1). Особенной прогностической ценностью обладает получение полного цитогенетического ответа (CHR).
Лечение
Лекарственная терапия превосходит трасплантацию аллогенных стволовых клеток в первой линии, по причине трансплантант ассоциированной смертности. На основании рандомизированного исследования эффективности иматиниба против интерферона IFN-альфа (протокол IRIS), селективный киназный ABL-ингибитор иматиниб в дозе 400мг ежедневно был утвержден в качестве стандартной терапии хронической фазы ХМЛ. В соответствии с последними данными исследования IRIS после 6 лет время до прогрессирования (progression-free survival) составило 84% и общая выживаемость ― 88%.
Начальная доза иматиниба составляет 400 мг/день. По данным двух проспективных рандомизированных исследований применение более высоких доз иматиниба (800 мг/день) не показало преимуществ при сравнении со стандартной дозой 400 мг, поэтому применение иматиниба в дозе 600 или 800 мг/ день за рамками протоколов клинических исследований не рекомендуется.
Монотерапия IFN-альфа больше не рекомендуется к использованию, однако комбинация IFN-альфа в иматинибом в настоящее время проходит исследование в проспективных исследованиях III фазы.
Применение гидроксимочевины возможно только с целью исходной циторедукции или в качестве паллиативной терапии ― иматиниб доказал свое преимущество, в том числе в группе пожилых пациентов.
Оценка эффективности терапии
Существуют три основные критерия ответа в процессе терапии иматинибом в стандартной дозе 400 мг в день: оптимальный, субоптимальный и отсутствие ответа/неудача лечения (таблица №1).
При наличии оптимального ответа должен быть продолжен постоянный прием иматиниба. Пациенты, достигшие большого молекулярного ответа (BCR-ABL не определяется методами количественной real-time ПЦР (RT-Q-PCR)), с целью элиминирования минимальной остаточной болезни, могут быть включены в исследования, посвященные отмене терапии, терапии интерферонами или вакцинации.
В случае неудачи лечения во второй линии применяются ингибиторы тирозин киназ (TKI) второго поколения (дасатиниб и нилотиниб) выбор которых осуществляется на основании типа мутации BCR–ABL. Указанные препараты позволяют получать полную цитогенетическую ремиссию (CCgR) примерно у 50% пациентов в ХФ, исходно резистентных или имеющих непереносимость иматиниба; однако оба препарата неэффективны в случае наличия мутации T315I киназного домена (KD) BCR–ABL.
TKI второго поколения обычно проявляют эффективность достаточно быстро и уже через 6 месяцев терапии может быть рассмотрен вопрос о применении трансплантации стволовых клеток (TСКК) при отсутствии противопоказаний, или продолжении терапии TKI второго поколения. Благодаря использованию немиелоаблативных или режимов кондиционирования сниженной токсичности, а также альтернативных источников стволовых клеток (пуповинная кровь) показания для проведения TСКК в настоящее время пересмотрены и расширены.
В случае субоптимального ответа на иматиниб, который представляет переходное состояние, терапия выбора все еще является предметом изучения. Возможно продолжение терапии иматинибом в стандартной или увеличенной дозе или переход на ингибиторы тирозин-киназ второго поколения. В любом случае, подобные пациенты должны быть направлены для дальнейшего лечения и наблюдения в клинические центры с большим опытом ведения ХМЛ.
При прогрессировании заболевания с переходом в фазу акселерации или БФ/ БК, терапия выбора зависит от исходного лечения и может включать другие типы TKI, экспериментальные таргетные препараты, гомоцетаксин или цитотоксическую терапию всегда с основной целью консолидации посредством проведения аллогенной трансплантации СК.
Наблюдение
В течение первых трех месяцев терапии проведение клинического, биохимического и гематологического мониторинга показано каждые 2 недели. По прошествии 3-х месяцев цитогенетический анализ (хромосомная исчерченность в метафазных клетках костного мозга) следует проводить как минимум каждые 6 месяцев до момента достижения и подтверждения полной цитогенетической ремиссии (CCgR).
Количественную полимеразную цепную реакцию (RT-Q-PCR) на предмет определения процента BCR-ABL:ABL транскрипта в клетках крови следует повторять каждые три месяца до момента констатации большого молекулярного ответа (MMolR).
После достижения большого цитогенетического и молекулярного ответов, цитогенетического исследование должно проводиться 1 раз в 12 месяцев, RT-Q- PCR- каждые 6 месяцев.
Скрининг на предмет наличия BCR-ABL KD мутаций рекомендуется только в случае отсутствия (неудачи лечения) или субоптимального ответа.
Определение концентрации иматиниба в периферической крови рекомендуется только в случае субоптимального ответа, неудачи лечения, доза-ассоциированной токсичности или при наличии побочных эффектов.












Новые горизонты в таргетной терапии хронического миелоидного лейкоза
— Валерий Григорьевич, что такое хронический миелолейкоз?
— Какая существует статистика ХМЛ в России и Европе?
— В РФ и Европе заболеваемость ХМЛ составляет от 1—1,5 случая на 100 тыс. населения, а средний возраст больных — 60—65 лет. В апреле 2012 года зарегистрировано 6510 пациентов с ХМЛ, ежегодно с 2004 по 2011 год диагностировалось от 610 до 842 первичных пациентов. Еще недавно средняя продолжительность жизни больных ХМЛ составляла 4—5 лет. Современные препараты таргетной терапии продлевают жизнь у 80—90% больных до 10—12 лет, их качество жизни остается на хорошем уровне.
— Какие существуют современные методы лечения ХМЛ?
— В большинстве случаев для лечения пациентов с ХМЛ используется лекарственная терапия, а трансплантации костного мозга в настоящее время применяются все реже в связи ростом эффективности лекарственной терапии. Первая линия терапии ХМЛ включает три возможные схемы: применение синтезированного еще 20 лет назад ИТК 1-го поколения (ИТК1) иматиниба или одного из двух ИТК 2-го поколения (ИТК2): нилотиниба или дазатиниба. Вторая линия терапии включает: при непереносимости иматиниба или развитии резистентности — перевод на нилотиниб или дазатиниб, принимая во внимания наличие и тип мутации киназного домена BCR-ABL, а при неудаче терапии нилотинибом или дазатинибом рекомендуется перевод на другой препарат — соответственно на дазатиниб или нилотиниб.
— Обеспечивает ли наше государство больных ХМЛ современными лекарствами бесплатно?
— Существуют ли в нашей стране недостатки в оказании медицинской помощи пациентам с ХМЛ в сравнении со стандартами, принятыми в Европе и США?
— Стандарты оказания медицинской помощи существуют только в нашей стране. В Европе и США есть только рекомендации. Если говорить о государствах с наиболее развитым здравоохранением и относительно высоким уровнем жизни, то там среднеобеспеченному пациенту доступна такая страховая программа, которая позволяет не доплачивать из своего кармана за данные препараты. Европейские коллеги анализируют статистику и думают, как получить наилучший эффект при фиксированных затратах. Нам тоже необходимо четко контролировать процесс лечения и оценку результатов. Я убежден, что наша страна, где существует и научная школа онкогематологии, и клиническая практика борьбы с данными патологиями, не отстает от развитых стран и способна в кратчайший срок преодолеть отставание от Запада в вопросах обеспечения больных ХМЛ инновационными лекарствами как 1-й, так и 2-й линий терапии.

— Профессор Хельманн, как развивалась терапия ХМЛ в Европе?
— Первым препаратом, который использовался в Европе для лечения ХМЛ, был бусульфан. На втором этапе эволюции терапии ХМЛ стала применяться гидроксимочевина, а затем и интерферон-?. С 1998 года после получения положительных результатов в клинических исследованиях ингибитор тирозинкиназы (ИТК) первого поколения — иматиниб начал использоваться в реальной лечебной практике. В настоящее время применение ИТК является основным подходом к лечению ХМЛ во всем мире. Второе поколение ИТК (дазатиниб и нилотиниб) впоследствии были одобрены для применения при непереносимости или резистентности к терапии иматинибом (2-я линия терапии). Два года назад эти препараты получили регистрацию и в 1-й линии терапии ХМЛ в Европе.
— Расскажите, пожалуйста, про Европейскую сеть по изучению лейкозов (ELN).
— Европейская организация European Leukemia Net была основана в 2002 году исследователями в области ХМЛ и финансируется Европейским союзом с 2004 года. Данная организация объединяет более 1000 врачей и исследователей из 180 учреждений, разбросанных по всему миру.
Первостепенной задачей является проведение исследований, направленных на излечение заболевания. Второстепенные задачи: возможность делиться накопленным опытом, публикация рекомендаций и контроль их исполнения. Под эгидой Европейского общества было опубликовано 35 рекомендаций.
— Как человек, стоявший у истоков создания ЕLN, расскажите о прогрессе в лечении ХМЛ.
— Эволюция терапии ХМЛ в эпоху ИТК находит свое отражение в европейских рекомендациях. Первое издание появилось в 2006 году, а третье запланировано к выходу в 2013 году. В рекомендациях ELN на 2013 год прописаны все три ИТК: иматиниб, дазатиниб и нилотиниб при применении в 1-й линии терапии ХМЛ. При выборе препарата следует учитывать эффективность и безопасность препарата, а также наличие сопутствующих заболеваний у пациента. К сожалению, до сих пор некоторые пациенты (1—2% в год) переходят из хронической фазы в фазу бластного криза, при которой ИТК эффективны, но ремиссия достаточно коротка. Я надеюсь, что раннее назначение эффективной терапии пациентам с ХМЛ даст возможность предотвратить развитие бластного криза.

— Развитие здравоохранения в России — как далеко мы ушли?
— Рынок ХМЛ — что сейчас в приоритете, насколько пациенты чувствуют себя защищенными?
— Это стабильно развивающийся рынок — примерно 6—10% прироста каждый год. Причем этот прирост в значительной степени определяется все более широким использованием для лечения ХМЛ препаратов ИТК 1-го и 2-го поколений. Дальнейший прогресс будет зависеть от принимаемых сегодня стандартов лечения.
Хочется верить в компетентность российских специалистов, ответственных за создание таких стандартов. Я надеюсь, что на благо отечественным пациентам в обновленные российские стандарты по лечению ХМЛ будут включены также и препараты, хорошо зарекомендовавшие себя во всем мире. Все же терапия одним из препаратов ни в одной стране мира не оправдывает ожиданий, есть определенные проблемы с резистентностью или ее непереносимостью, поэтому разнообразие выбора для врача — это польза для пациента.
— Каковы прогнозы на улучшение состояния в обеспечении таких пациентов?
Участники дискуссии отметили, что подходы европейских специалистов в терапии ХМЛ заслуживают пристального внимания. Важно и то, что европейские специалисты рекомендуют применение ИТК 1-го и 2-го поколений для терапии впервые выявленного в хронической фазе ХМЛ в равной степени. Выбор между препаратами 1-й и 2-й линий зависит от их эффективности и переносимости.
Как подчеркнул, исходя из реальной клинической практики, профессор Хельманн, своевременный перевод на препараты 2-й линии, в случае неэффективности препаратов 1-й линии, значительно увеличивает выживаемость пациентов.
В Европе около 40% пациентов с ХМЛ уже получают лечение ИТК 2-го поколения, и назначаются они приблизительно в равных соотношениях. Данную информацию озвучил в рамках своего выступления на панельной дискуссии Д.В. Мелик-Гусейнов.
При неудаче терапии нилотинибом или дазатинибом из-за развития резистентности или непереносимости российские гематологи должны иметь возможность переключить пациента на другой препарат соответственно на дазатиниб или нилотиниб. Именно такая практика существует в Европе, США и России.
Клинический опыт использования ИТК 2-го поколения показал, что в Европе они назначаются приблизительно с одинаковой частотой и с учетом индивидуальных особенностей пациентов, страдающих ХМЛ. Данная ситуация прежде всего отражает подходы к выбору препаратов, рекомендованные ELN.
Основными задачами, которые ставит перед собой на современном этапе онкогематология (и онкология, в общем), являются увеличение продолжительности жизни и улучшение её качества у онкобольных. Решения этого вопроса, возможно, удастся добиться благодаря разработке направления, именуемого таргетной терапией (от англ. target - мишень). Данный подход представляет собой системное воздействие, направленное против злокачественного новообразования и его отдалённых метастазов (микрометастазов).Это одна из разновидностей биологической терапии.
В основе таргетной терапии лежит действие моноклональных антител, избирательно связывающихся с особыми рецепторами, расположенными на поверхности раковых клеток, не затрагивая при этом здоровые ткани. Такие антитела аналогичны тем, которые продуцируют элементы иммунной системы - B-лимфоциты. Однако B-лимфоциты против молекулярных рецепторов, локализующихся на раковых клетках, антитела не вырабатывают.
Первая попытка использования антител в онкологии была предпринята ещё в 1895 г. Однако тогда, несмотря на полученные весьма перспективные результаты, оставалась серьёзная проблема побочных реакций, нестандартизируемости применяемых сывороток, слабого и непродолжительного эффекта терапии. Дальнейшее развитие лечение антителами получило в 1970-х годах. К этому времени учёные уже доказали, что образующиеся сывороточные антитоксины - это иммуноглобулины и продуцентом антител выступают плазматические клетки.
На сегодняшний день моноклональные антитела получают с помощью генно-инженерных технологий, причём ключевой является именно одинаковость этих антител, а не только лишь моноклональность вырабатывающих их В-клеток. Сейчас используются два типа антител: простые (неконъюгированные), которые не связаны ни с какими цитотоксическими веществами, и конъюгированные с присоединёнными цитостатиками, радиоактивными частицами либо токсинами. В основном в онкологии и в частности для лечения острых и хронических лейкозов, эффективно применяются именно первые.
Целый ряд различных фармацевтических и биотехнологических компаний работает над созданием технологий нового поколения, сочетающих в себе преимущества моноклональных антител и низкомолекулярных препаратов с высокой специфичностью и низким уровнем токсичности, возможностью воздействия на объекты, нераспознаваемые современными моноклональными антителами (в том числе и на активные центры рецепторов и ферментов). Такие препараты должны иметь более высокую стабильность для обеспечения различных путей их применения, включая и пероральный.
В последнее время на стадии клинических испытаний находится достаточно много различных моноклональных антител, на которые возлагаются очень большие надежды. К примеру, моноклональные антитела против антигена CD33 (антигена клеток миелоидного ряда) - озогамицин, гемтузумаб, ингибиторы фарнезилтрансферазы, блокирующие присоединение к клеточной мембране белков Ras - зарнестра, ингибиторы протеосом - бортезомиб, гипометилирующих агентов - зебулярин, децитабин, ингибиторы гистондеацетилазы - вальпроевая кислота, и др.
+7 (495) 50 254 50 - ГДЕ ЛУЧШЕ ЛЕЧИТЬ РАК КРОВИ
Основными задачами, которые ставит перед собой на современном этапе онкогематология (и онкология, в общем), являются увеличение продолжительности жизни и улучшение её качества у онкобольных. Решения этого вопроса, возможно, удастся добиться благодаря разработке направления, именуемого таргетной терапией (от англ. target - мишень). Данный подход представляет собой системное воздействие, направленное против злокачественного новообразования и его отдалённых метастазов (микрометастазов).Это одна из разновидностей биологической терапии.
В основе таргетной терапии лежит действие моноклональных антител, избирательно связывающихся с особыми рецепторами, расположенными на поверхности раковых клеток, не затрагивая при этом здоровые ткани. Такие антитела аналогичны тем, которые продуцируют элементы иммунной системы - B-лимфоциты. Однако B-лимфоциты против молекулярных рецепторов, локализующихся на раковых клетках, антитела не вырабатывают.

Первая попытка использования антител в онкологии была предпринята ещё в 1895 г. Однако тогда, несмотря на полученные весьма перспективные результаты, оставалась серьёзная проблема побочных реакций, нестандартизируемости применяемых сывороток, слабого и непродолжительного эффекта терапии. Дальнейшее развитие лечение антителами получило в 1970-х годах. К этому времени учёные уже доказали, что образующиеся сывороточные антитоксины - это иммуноглобулины и продуцентом антител выступают плазматические клетки.
На сегодняшний день моноклональные антитела получают с помощью генно-инженерных технологий, причём ключевой является именно одинаковость этих антител, а не только лишь моноклональность вырабатывающих их В-клеток. Сейчас используются два типа антител: простые (неконъюгированные), которые не связаны ни с какими цитотоксическими веществами, и конъюгированные с присоединёнными цитостатиками, радиоактивными частицами либо токсинами. В основном в онкологии и в частности для лечения острых и хронических лейкозов, эффективно применяются именно первые.
Целый ряд различных фармацевтических и биотехнологических компаний работает над созданием технологий нового поколения, сочетающих в себе преимущества моноклональных антител и низкомолекулярных препаратов с высокой специфичностью и низким уровнем токсичности, возможностью воздействия на объекты, нераспознаваемые современными моноклональными антителами (в том числе и на активные центры рецепторов и ферментов). Такие препараты должны иметь более высокую стабильность для обеспечения различных путей их применения, включая и пероральный.
В последнее время на стадии клинических испытаний находится достаточно много различных моноклональных антител, на которые возлагаются очень большие надежды. К примеру, моноклональные антитела против антигена CD33 (антигена клеток миелоидного ряда) - озогамицин, гемтузумаб, ингибиторы фарнезилтрансферазы, блокирующие присоединение к клеточной мембране белков Ras - зарнестра, ингибиторы протеосом - бортезомиб, гипометилирующих агентов - зебулярин, децитабин, ингибиторы гистондеацетилазы - вальпроевая кислота, и др.
+7 (495) 50 254 50 - ГДЕ ЛУЧШЕ ЛЕЧИТЬ РАК КРОВИ
Хронический миелолейкоз - опухолевое заболевание крови. Характеризуется бесконтрольным ростом и размножением всех ростковых клеток крови, при этом молодые злокачественные клетки способны созревать до зрелых форм.
Во время хронического миелолейкоза в крови повышается содержание особой разновидности лейкоцитов – гранулоцитов. Они образуются в красном костном мозге в огромном количестве и выходят в кровь, не успевая до конца созреть. Одновременно содержание всех остальных видов лейкоцитов снижается.
Причины хронического миелолейкоза
Причины хромосомного нарушения, приводящего к хроническому миелолейкозу, до сих пор изучены недостаточно.
Считается, что имеют значение следующие факторы:
![]()
Слабые дозы радиации. Их роль доказана только у 5% больных.- Электромагнитные излучения, вирусы и некоторые химические вещества – их влияние не доказано окончательно.
- Применение некоторых лекарственных препаратов. Известны случаи возникновения хронического миелолейкоза при лечении цитостатиками (противоопухолевые препараты) в сочетании с лучевой терапией.
- Наследственные причины. Люди с хромосомными нарушениями (синдром Клайнфелтера, синдром Дауна) имеют повышенный риск хронического миелоидного лейкоза.
- Клетки размножаются неконтролируемо, как раковые.
- Для этих клеток перестают работать естественные механизмы гибели.
Фазы хронического миелолейкоза
- Хроническая фаза. В этой фазе находится большинство пациентов, которые обращаются к врачу (около 85%). Средняя продолжительность – 3 – 4 года (зависит от того, насколько своевременно и правильно начато лечение). Это стадия относительной стабильности. Пациента беспокоят минимальные симптомы, на которые он может не обращать внимания. Иногда врачи выявляют хроническую фазу миелолейкоза случайно, при проведении общего анализа крови.
- Фаза акселерации. Во время этой фазы патологический процесс активируется. Количество незрелых белых кровяных телец в крови начинает быстро нарастать. Фаза акселерации является как бы переходной от хронической к последней, третьей.
- Терминальная фаза. Финальная стадия болезни. Возникает при нарастании изменений в хромосомах. Красный костный мозг практически полностью замещается злокачественными клетками. Во время терминальной стадии пациент погибает.
Проявления хронического миелолейкоза
![]()
Вначале симптомы могут полностью отсутствовать, либо они выражены настолько слабо, что больной не придает им особого значения, списывает на постоянное переутомление. Заболевание выявляется случайно, во время очередной сдачи общего анализа крови.- Нарушение общего состояния: слабость и недомогание, постепенная потеря веса, снижение аппетита, повышенная потливость по ночам.
- Признаки, обусловленные увеличением размеров селезенки: во время приема пищи больной быстро наедается, боли в левой части живота, наличие опухолевидного образования, которое можно прощупать.
- Признаки, связанные с нарушением функции тромбоцитов и белых кровяных телец: различные кровотечения либо, напротив, образование тромбов.
- Признаки, связанные с повышением количества тромбоцитов и, как следствие, повышением свертываемости крови: нарушение кровообращения в головном мозге (головные боли, головокружения, снижение памяти, внимания и пр.), инфаркт миокарда, нарушение зрения, одышка.
- Резкая слабость, значительное ухудшение общего самочувствия.
- Длительные ноющие боли в суставах и костях. Иногда они могут быть очень сильными. Это связано с разрастанием злокачественной ткани в красном костном мозге.
- Проливные поты.
- Периодическое беспричинное повышение температуры до 38 - 39⁰C, во время которого возникает сильный озноб.
- Снижение массы тела.
- Повышенная кровоточивость, появление кровоизлияний под кожей. Эти симптомы возникают в результате уменьшения количества тромбоцитов и снижением свертываемости крови.
- Быстрое увеличение размеров селезенки: живот увеличивается в размерах, появляется чувство тяжести, боли. Это происходит за счет роста опухолевой ткани в селезенке.
Диагностика заболевания
| Название исследования | Описание | Что выявляет? |
| Общий анализ крови | Рутинное клиническое исследование, выполняется при подозрении на любые заболевания. Общий анализ крови помогает определить общее содержание лейкоцитов, их отдельных разновидностей, незрелых форм. Кровь для анализа берут из пальца или вены в утренние часы. |
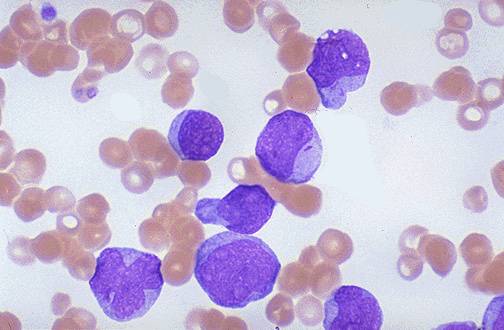
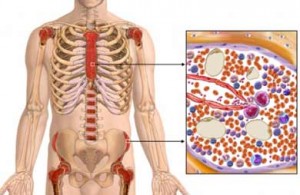
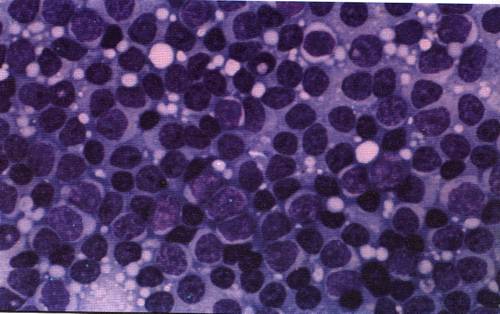
Симптомы
- Приапизм – болезненная, чрезмерно длительная эрекция.
Данные симптомы это предвестники тяжелого состояния (бластного криза), появляются за 6- 12 месяцев до его начала.
- Снижается эффективность лекарств (цитостатиков)
- Развивается анемия
- Увеличивается процент бластных клеток в крови
- Ухудшается общее состояние
- Увеличивается селезенка
- Симптомы соответствую клинической картине при остром лейкозе (см. Острый лимфолейоз).
Как лечат миелолейкоз?
Цель лечения снизить рост опухолевых клеток и уменьшить размеры селезенки.
Лечение заболевания должно быть начато сразу после того, как установлен диагноз. От качества и своевременности терапии во многом зависит прогноз.
Лечение включает различные методы: химиотерапия, лучевая терапия, удаление селезенки, пересадка костного мозга.
Химиотерапия
- Классические препараты: Миелосан (Милеран, Бусульфан), Гидроксиуреа (Гидреа, Литалир), Цитозар, 6-меркаптопурни, альфа-интерферон.
- Новые препараты: Гливек, Спрайсел.
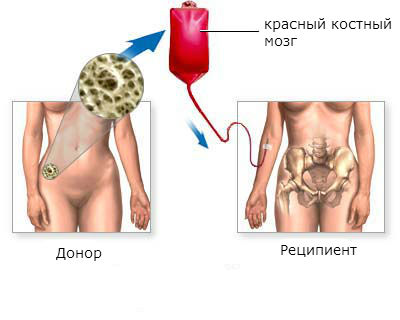
Пересадка костного мозга даёт возможность полностью выздороветь больным хроническим миелолейкозом. Эффективность пересадки выше в хронической фазе заболевания, в остальных фазах гораздо ниже.
Трансплантация красного костного мозга является наиболее эффективным методом лечения хронического миелоидного лейкоза. Более чем у половины пациентов, которым была произведена пересадка, наступает стойкое улучшение в течение 5 лет и дольше.
Чаще всего выздоровление происходит в том случае, когда красный костный мозг пересаживают больному моложе 50 лет в хроническую фазу заболевания.
Этапы трансплантации красного костного мозга:
- Поиск и подготовка донора. Лучшим донором стволовых клеток красного костного мозга является близкий родственник больного: близнец, брат, сестра. Если близких родственников нет, или они не подходят, ищут донора. Проводят ряд тестов для того, чтобы убедиться, что донорский материал приживется в теле пациента. Сегодня в развитых странах созданы большие банки доноров, в которых находятся десятки тысяч донорских образцов. Это дает шанс быстрее найти подходящие стволовые клетки.
- Подготовка пациента. Обычно этот этап продолжается от недели до 10 дней. Проводят лучевую терапию и химиотерапию для уничтожения как можно большего количества опухолевых клеток, предотвращения отторжения донорских клеток.
- Собственно пересадка красного костного мозга. Процедура похожа на переливание крови. В вену пациента заводят катетер, через который в кровь вводят стволовые клетки. Они какое-то время циркулируют в кровотоке, а потом оседают в костном мозге, приживаются там и начинают работать. Для предотвращения отторжения донорского материала врач назначает противовоспалительные и противоаллергические средства.
- Снижение иммунитета. Донорские клетки красного костного мозга не могут прижиться и начать функционировать сиюминутно. Для этого нужно время, обычно 2 – 4 недели. В течение этого срока у больного сильно снижен иммунитет. Его помещают в стационар, полностью ограждают от контакта с инфекциями, назначают антибиотики и противогрибковые средства. Этот период является одним из самых сложных. Сильно повышается температура тела, в организме могут активироваться хронические инфекции.
- Приживление донорских стволовых клеток. Самочувствие пациента начинает улучшаться.
- Восстановление. В течение нескольких месяцев или лет функция красного костного мозга продолжает восстанавливаться. Постепенно пациент выздоравливает, восстанавливается его работоспособность. Но он все еще должен находиться под наблюдением врача. Иногда новый иммунитет не может справиться с некоторыми инфекциями, в этом случае примерно через год после пересадки костного мозга делают прививки.
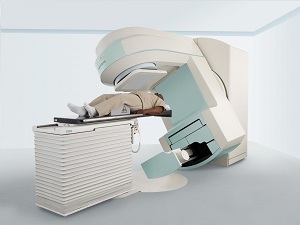
Проводится в случаи отсутствия эффекта от химиотерапии и при увеличенной селезенке после приема медикаментов (цитостатиков). Метод выбора при развитии локальной опухоли (гранулоцитарная саркома).
В какой фазе заболевания применяется лучевая терапия?
Лучевая терапия используется в развернутой стадии хронического миелолейкоза, которая характеризуется признаками:
- Значительное разрастание опухолевой ткани в красном костном мозге.
- Рост опухолевых клеток в трубчатых костях 2.
- Сильное увеличение печени и селезенки.
Применяется гамма-терапия – облучение области селезенки гамма-лучами. Основная задача – уничтожить или прекратить рост злокачественных опухолевых клеток. Лучевую дозу и режим облучения определяет лечащий врач.
| К длинным трубчатым костям относят кости плеча, предплечья, пальцев, голени, бедра. В детстве эти кости целиком заполнены красным костным мозгом. У взрослого человека красный костный мозг сохраняется только в головках костей, а в теле кости он замещается на желтый костный мозг (жир). При хроническом миелоидном лейкозе желтый костный мозг может быть вытеснен опухолевой тканью. |
Удаление селезенки используется редко по ограниченным показаниям (инфаркт селезенки, тромбоцитопения, выраженный дискомфорт в животе).
Операцию обычно проводят в терминальную фазу заболевания. Вместе с селезенкой из организма удаляют большое количество опухолевых клеток, тем самым облегчая течение заболевания. После операции обычно увеличивается эффективность медикаментозной терапии.
Каковы основные показания к операции?
- Разрыв селезенки.
- Угроза разрыва селезенки.
- Значительное увеличение органа в размерах, что приводит к сильному дискомфорту.
При высоких уровнях лейкоцитов (500,0 · 10 9 /л и выше), могут использовать лейкаферез для предотвращения осложнений (отек сетчатки, приапизм, микротромбозы ).
При развитии бластного криза, лечение будет таким же, как при острых лейкозах (см. острый лимфолейкоз).
Лейкоцитаферез – лечебная процедура, напоминающая плазмаферез (очищение крови). У пациента берут определенное количество крови и пропускают через центрифугу, в которой она очищается от опухолевых клеток.
В какой фазе заболевания проводят лейкоцитаферез?
Так же, как и лучевую терапию, лейкоцитаферез проводят во время развернутой стадии миелолейкоза. Нередко его применяют в тех случаях, когда отсутствует эффект от применения лекарственных средств. Иногда лейкоцитаферез дополняет медикаментозную терапию.
Читайте также: