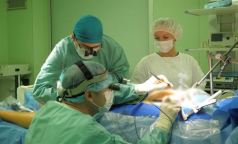
Стереотаксическая лучевая терапия рака поджелудочной железы романов
![]()
НМИЦ онкологии им. Петрова: Из-за рака пациенты теряют лицо![]()
Петербургский врач: Польза МРТ с контрастом превышает вред от возможных осложнений![]()
Пороки клапанов сердца: классические подходы и новые альтернативы
В комплексной терапии онкологических заболеваний используются 4 метода лечения: хирургия, химиотерапия, лучевая терапия, иммунотерапия. Сейчас самое большое финансирование и все внимание брошены на лекарственную терапию. Но со следующего года грядут изменения и в лучевой. А это для Петербурга – самое больное место.
Как говорит профессор Сергей Новиков, заведующий отделением лучевой терапии НМИЦ онкологии им Петрова, за последнее десятилетие лучевая терапия сделала большой рывок и ее стремительное развитие не останавливается. Появились новые аппараты, новые технологии, а с ними — новая идеология лучевой терапии.
- Сергей Николаевич, правда ли, что новые технологии в лучевой терапии когда-то заменят хирургию?
- Во многих случаях это уже происходит. Например, только что мы составляли план лечения пациента с ранним немелкоклеточным раком легкого. У него нет изменений в лимфоузлах, нет метастазирования. Но его невозможно прооперировать из-за сопутствующих заболеваний (перенес инфаркт, инсульт), так что операция угрожает жизни. В этой фактически патовой ситуации лучевая терапия позволяет провести радикальное лечение - мы можем подвести чрезвычайно высокую дозу излучения на очень маленький объем тканей. И это приведет не к продлению жизни, а именно к излечению. Опухоли объемом 1-5 см мы можем облучить, избежав при этом серьезного повреждения окружающих тканей. Это называется стереотаксическая лучевая терапия или радиохирургия.
- Вы имеете в виду лечение с помощью гамма-ножа и кибер-ножа?
- Эти технологии тоже относятся к стереотаксической лучевой терапии — гамма-нож применяют для лечения новообразований на головном мозге, а кибер-нож - для направленного радиотерапевтического воздействия на экстракраниальные опухоли (расположенные вне головного мозга). Но сейчас активно развиваются технологии радиохирургии и стереотаксической лучевой терапии на линейных ускорителях. Их преимущество в том, что это универсальные приборы: на одном аппарате может выполняться - стерео-, радио- или классическая лучевая терапия с избирательным воздействием на опухоль (обычная или 3D-конформная). У нас уже три таких аппарата, каждый из них имеет свои преимущества, а в целом умеют все.
- Для лечения какого вида рака они предназначаются, что умеют?
- Легче перечислить, что не умеют — не умеют облучать очень много очагов в головном мозге одномоментно, в отличие от гамма ножа. Но такая ситуация — редкость, а главное, пока нет доказательств целесообразности такой агрессивной терапии, она не продлевает жизнь.
С другой стороны, эти аппараты могут делать все в области высокотехнологичного облучения, когда требуется радиохирургия: используются в комплексном лечении новообразований в головном мозге, локализованных процессах в легких (немелкоклеточный рак), метастатических поражений легких, печени, надпочечников, костей, мягких тканей и т. д. Благодаря высокой точности направления воздействия, они незаменимы в лечении злокачественных новообразований головы и шеи. Например, опухоль языка — очень тяжелая патология, лечить ее хирургически или невозможно, или очень сложно. После операции пациента берем мы. Активно используем методы брахитерапии и стереотаксической лучевой терапии при раке предстательной железы.
Онкологи сегодня говорят, что иммунотерапия перевернула наше сознание в лечении некоторых видов рака. Но забывают упомянуть, что сочетание иммунотерапии с некоторыми видами лучевой терапии увеличивает эффективность практически в два раза. Поэтому трудно встретить протоколы лечения, в которых рекомендована иммунотерапия без лучевой терапии.
— Да, но для ослабленных и пожилых пациентов мы используем стереотаксис, потому что это неинвазивное - щадящее лечение. С моей точки зрения, пациенты с этим диагнозом должны получать прежде всего лучевую терапию, хотя на протяжении многих лет считалось, что главный способ лечения рака предстательной железы – хирургия. Но простатэктомия сопряжена с риском для жизни, с осложнениями — каждый пятый после хирургического вмешательства страдает недержанием мочи, у 70% перенесших операцию возникает нарушение эректильной функции. Эффективность хирургии, брахитерапии и стереотаксической лучевой терапии с точки зрения борьбы с опухолью одинаковая, в некоторых случаях лучевое лечение даже более результативно. Но недержание мочи после него – редкость, всего 1-2% случаев в сравнении с 20% после хирургического удаления предстательной железы и тут даже использование роботизированных хирургических методов не помогает улучшить результаты. Эректильная дисфункция, к сожалению, может возникнуть и после проведения лучевого лечения - у 30-40% пациентов мы отмечаем снижение эректильной функции. Но, к счастью, это существенно меньше 70-80% после хирургического лечения.
- Однако по-прежнему распространен миф о том, что лучевая терапия опасна, потому что может спровоцировать развитие лучевой болезни.
- Если под лучевой болезнью мы подразумеваем то, что происходит с организмом человека, оказавшегося в эпицентре взрыва ядерной бомбы, то даже в 1970 годы лучевая терапия ее не провоцировала. Другое дело, что когда использовали большие поля для облучения, это вызывало разного рода токсичность — развивались осложнения со стороны органов дыхательной или кроветворной системы, например. Я начал работать в 1980-е, и уже тогда были разработаны методы, которые позволяли избегать фатальной или очень серьезной токсичности. Хотя какие-то неприятности от лучевой терапии были, есть и будут. Например, если мы подводим очень высокие дозы в область опухоли предстательной железы, мы можем вызвать повреждения прямой кишки, если облучаем опухоль в легких, — повреждения легких, в мозге — здоровые ткани мозга. И иногда вынуждены рисковать, потому что понимаем: другой возможности спасти человека нет. Да, бывает, лучевая терапия балансирует между добром и злом, но зачастую альтернативы нет. Например, при метастазах в головном мозге — это пациенты, которым часто нейрохирурги уже помочь не могут, возможности химиотерапии, нередко, исчерпаны. А лучевая терапия у таких пациентов ассоциируется с 20-30% риском возникновения лучевого некроза. Но в оставшихся 70-80% случаев есть шанс, что мы поможем пациенту преодолеть на определенное время его проблемы.
- Стереотаксическая лучевая терапия – не самая распространенная технология в Петербурге, возможности для ее применения есть только у двух федеральных специализированных клиник и у одной негосударственной. Часто ли она востребована?
- Когда у нас только появился первый аппарат для стереотаксиса, мы пролечили всего 12 пациентов. Это была, можно сказать, эксклюзивная методика - все отделение собиралось смотреть. А в этом году стереотаксическую лучевую терапию получили уже 350 пациентов, то есть около 20% получивших лучевое лечение в НМИЦ онкологии им. Н.Н. Петрова.
- Парадокс: при том, что в Петербурге можно получить самые современные виды лучевой терапии, петербуржцев направляют на лучевое лечение в клиники, в которых их нет. Более того, на 2020 год из средств петербургского фонда ОМС выделяется 1 млрд рублей на 3D-конформную терапию, выполнять которую в городских специализированных клиниках, можно сказать, не на чем.
- Только кто и на каком оборудовании будет ее проводить? В городских медицинских учреждениях нет современных ускорителей. Да и старые регулярно выходят из строя.
- Мы сражаемся за то, чтобы петербуржцы могли получать современное эффективное лучевое лечение. Но НМИЦ им. Петрова не может принять всех, хотя пока мы никому не отказывали.
Что касается стереотаксической лучевой терапии, которая есть в единичных клиниках Петербурга, мы примерно на 30% увеличиваем объемы ежегодно. И готовы взять на себя столько пациентов, сколько нужно. Поскольку у нас стереотаксическая лучевая терапия проводится на тех же аппаратах, на которых проводится и классическая, чтобы освободить их от загрузки стандартной 3D-конформной лучевой терапией, мы приобрели еще один линейный ускоритель, на котором и будем ее выполнять.
- В Городском онкологическом центре в Песочном и в Городском онкологическом диспансере недостаточно современных линейных ускорителей, на которых можно проводить 3D-конформную лучевую терапию. И мне кажется, что на аппаратах, которые там есть, невозможно использовать сложные технологии, например, радиохирургическое лечение и стереотаксическую лучевую терапию. Поэтому важно, чтобы руководители городской онкологической службы наладили сотрудничество с федеральными учреждениями, частными клиниками, которые готовы и могут помочь петербуржцам.
Конечно, нужно обновлять парк оборудования. Потому что на аппаратах 2001-2005 года, которые морально устарели, а многие уже сняты с производства, можно выполнять паллиативную лучевую терапию, использовать простые методики облучения, но современные достижения радиационной онкологии на них недоступны.
У городских клиник есть рентген-терапия, которой, кстати, у нас нет, в онкодиспансере есть интраоперационный ускоритель, которого больше нет ни у кого в нашем городе.
Задача - дать пациентам возможность получать все существующие на сегодня виды лучевой терапии по показаниям: простую, когда ее достаточно, сложную, когда она необходима. Понимаете, если у мужчины выявили рак предстательной железы, и он попадает в учреждение, где нет аппаратов для проведения стереотаксической лучевой терапии, нет брахитерапии, то, на мой взгляд, он адекватной помощи в этих учреждениях получить не сможет. Потому что если будут подведены достаточно большие дозы на устаревших линейных ускорителях, серьезно вырастут осложнения, если дозы будут меньше, чем необходимы для борьбы с опухолью, то лечение не будет эффективным. Да, часть пациентов выздоровеет, но меньше, чем тот процент, который мог бы и должен был выздороветь. А пациенты, которым можно провести более простую лучевую терапию, должны лечиться там, где она есть, - нет смысла направлять их в НМИЦ онкологии.
То есть Петербургу нужна грамотная маршрутизация. Но это очень болезненный вопрос для городских властей. Тут все должны понимать, что его нужно решать, и мы к этому готовы.
- До сих пор федеральные клиники лечили, конечно, петербуржцев, но – по федеральным квотам. И объясняли это тем, что тарифы ОМС на лучевую терапию слишком малы. А количество квот всегда ограничено.
- Те тарифы, что действуют в системе ОМС сейчас, рассчитаны на ту простую лучевую терапию, что есть в городских клиниках. Мы работаем в рамках программы ВМП, потому что используем технологии, которых нет в городских медучреждениях. Программа ВМП рассчитана на то, что люди могут получить помощь там, где ее могут оказать. И ее финансирование было достаточным, чтобы применять в лечении сложные технологии: закупать дорогие расходники, заниматься техническим обслуживанием оборудования. Теперь, насколько я знаю, запланированные на 2020 год тарифы петербургского фонда ОМС эквивалентны тарифам, действующим в программе ВМП.
- На 1 миллиард рублей запланировано 4 тысячи курсов 3Д-конформной терапии. 4 тысячи пациентов ее получат – это много или мало?
- Немало, но 4 тысячи курсов это не 4 тысячи пациентов. Потому что некоторым приходится проводить их повторно. Например, прошла женщина курс терапии по поводу опухоли в молочной железе, но обнаружился метастаз в лимфоузле или в другом месте, его тоже нужно облучать. Я думаю, что это 3-3,5 тысячи пациентов.
Для сравнения: в НМИЦ онкологии в год лучевую терапию получают 2 тысячи пациентов. Приблизительно столько же - РНЦРХТ им. Гранова. Эту помощь могут оказывать в частных клиниках МИБС и есть один современный ускоритель и аппараты для брахитерапии в ПСПбГМУ им. Павлова. То есть в городе можно выполнять лучевую терапию любой сложности. Важно, чтобы средства были потрачены на ее эффективные методы.
- Люди по-прежнему едут за рубеж, чтобы получить лечение радиоактивным йодом. Почему в России оно до сих пор дефицитное, а в Петербурге его и вовсе нет?
- Это не сложная технология, но для ее применения у нас действуют очень строгие требования, вплоть до строительства специальных очистных сооружений. Чтобы выполнить все, что нужно по нормативам, надо выиграть большое сражение, но сначала вложить в его подготовку огромные деньги. Сейчас предпринимаются усилия, чтобы сделать наше законодательство более демократичным — смягчить требования для применения этой технологии. А мы уже фактически готовы к тому, чтобы использовать ее, даже обсуждаем возможность открытия коек для пациентов, нуждающихся в терапии радиоактивными источниками. Эта терапия — это огромная перспектива на будущее.
Сегодня это, в первую очередь, радиойодотерапия или паллиативная терапия при метастазах в кости - она позволяет сделать комфортной жизнь человека, страдающего от болевого синдрома. Это то, к чему мы уже сегодня готовы. Но есть еще много методик использования радиоактивных источников. Например, лечение препаратами, мечеными лютецием, — это широкий круг препаратов, которые избирательно накапливаются в опухоли и уничтожают ее. То есть это один из вариантов целенаправленной терапии.
- Магической пули, которая бьет только в цель пока нет. И при таргетной терапии избирательность условная, и при стереотаксическом — какая-то доза облучения все же приходится на здоровые ткани и они могут пострадать. Но все же воздействие современных лучей и химиотерапии, действительно, выигрывает в эффективности и точности направленного действия.
- Что нужно сделать, чтобы в лучевой терапии новые технологии появлялись не только в федеральных клиниках? Закупать новые аппараты?
- Я счастлив, что лучевая терапия в нашей стране начала осознано развиваться. Но это огромная машина, она не сдвинется с места мгновенно. Чтобы ее раскрутить, нужно потратить много сил и времени, грамотно использовать финансовые вложения.
То есть миллиарды сначала должны вкладываться не в оборудование, а в людей. Их нужно учить, в том числе за границей, нужно обеспечить их достойным заработком. А когда будут люди, способные работать на современном оборудовании, тогда и нужно его покупать.
- Сколько всего аппаратов для лучевой терапии работают у вас?
- Четыре ускорителя - от самого простого до самого сложного, и еще два аппарата – для брахитерапии. Плюс много компьютерных планирующих систем, задача которых сделать лучевую терапию максимально точной.
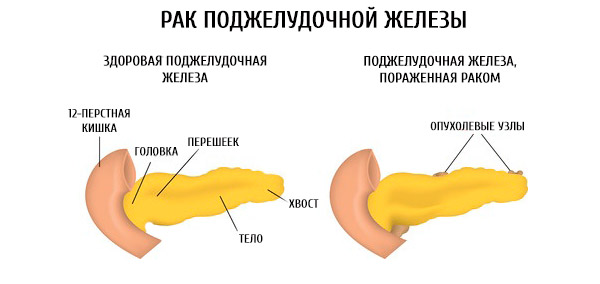
Рак поджелудочной железы встречается сравнительно редко, составляя чуть более 3% от всех злокачественных опухолей, регистрируемых в нашей стране. При этом смертность от него практически вдвое выше. Опухоль занимает пятое место в структуре смертности от онкозаболеваний и чаще встречается у мужчин, чем у женщин. Средний возраст пациентов составляет 64 и 70 лет соответственно. Сегодня в мире регистрируется рост заболеваемости раком поджелудочной железы, при этом тенденции к снижению смертности от него не отмечается.
Подавляющее большинство злокачественных опухолей поджелудочной железы (более 95%) являются протоковыми аденокарциномами — опухолями из железистого эпителия протоков органа. Рак может сформироваться в любом его отделе, но наиболее часто возникает в головке — в 60-80% случаев.
Факторы риска
По мнению отечественных специалистов, до 10% случаев рака поджелудочной железы связаны с генетическим фактором, а именно с наследуемыми синдромами, в том числе:
- синдром Линча — наследственное заболевание, связанное с мутацией в генах, отвечающих за исправление ошибок при делении ДНК. Заболевание обусловливает рак толстой кишки, яичников, мочевого пузыря и других органов;
- синдром Пейтца-Егерса — патология, которая сопровождается полипозом желудка, кожными проявлениями и связана с раком матки и яичников;
- синдром наследуемого рака молочной железы, вызванный мутацией гена BRCA, который участвует в поддержании генома, обеспечивая нормальное деление ДНК.
Все остальные факторы риска носят случайный характер, и выделить из них сколь-либо лидирующий достаточно сложно. Обычно к ним причисляют: дефицит холекальциферола, хронический панкреатит, сахарный диабет, табакокурение, чрезмерную массу тела. Алкоголь не относится к факторам риска, однако следует помнить, что злоупотребление крепкими спиртными напитками ведет к хроническому панкреатиту, то есть косвенно влияет на развития рака.
Симптомы
Симптомы заболевания появляются лишь на его поздней стадии, поэтому 9 из 10 пациентов попадают к врачу с распространенным раком или отдаленными метастазами.
Клиника заболевания складывается из общих симптомов интоксикации, обструкции панкреатических и билиарных протоков, а также функциональных нарушений органа:
- опоясывающие боли в верхних отделах живота с иррадиацией в спину;
- прогрессирующая потеря веса;
- обструктивная желтуха (до 90% пациентов);
- увеличение селезенки при нарушении кровообращения в селезеночной вене;
- варикозное расширение вен пищевода и желудка;
- сахарный диабет;
- мальабсорбция (нарушение всасывания пищи).
По мере роста опухоли нарастают признаки интоксикации: слабость, снижение аппетита, умеренное повышение температуры тела, головная боль, недомогание.
Стадирование
Стадирование проводится по системе ТNМ, где
Т — инвазивный рост первичного очага;
N — распространение в лимфатические узлы;
М — отдаленные метастазы;
0 — отсутствие признака.
Диагностика
Диагностические мероприятия при раке поджелудочной железы проводятся в объеме, который даст достаточный объем информации для определения тактики лечения. Обычно с этой целью применяются:
- Биопсия с целью получения материала для гистологического исследования. Если при оперативном лечении эта процедура в некоторых случаях может не применяться, то при планировании консервативных процедур биопсия обязательна.
- ФГДС — эндоскопическое исследование, обязательное при подозрении на рак поджелудочной железы. С его помощью врач может визуализировать опухоль, ее локализацию и степень инвазивности.
- Компьютерная томография грудной клетки и брюшной полости незаменима в поиске отдаленных метастазов, для чего наиболее эффективна КТ с внутривенным контрастированием. Кроме того, исследование помогает определить размеры новообразования и его связь с соседними органами.
- Рентгенография грудной клетки показана в сочетании с УЗИ брюшной полости, если недоступна КТ.
- Ангиография — исследование сосудов, которое помогает оценить резектабельность опухоли, если КТ не дает для этого достаточной информации.
- Эндосонография — ультразвуковое исследование, которое используется для навигации при проведении биопсии и дополнительной оценки инвазивности процесса.
- Магнитно-резонансная терапия с контрастированием применяется при подозрении на метастазы в печень и головной мозг, которые не удается обнаружить иными методами.
При соответствующем оснащении клиники могут применяться также ПЭТ/КТ, остеосцинтиграфия и другие методы диагностики.
Принципы лечения
В подавляющем большинстве случаев (до 80- 90%, по мнению некоторых специалистов) к моменту постановки диагноза опухоль уже является неоперабельной либо вследствие прорастания в крупные сосуды, либо наличия отдаленных метастазов.
При операбельном раке железы рекомендовано оперативное лечение. Объем операции связан с локализацией и распространением новообразования.
Химиотерапия
Системная терапия применяется самостоятельно или в комбинации с хирургическим лечением:
- Погранично операбельный рак, например Т3N1М0, требует предоперационной (неоадъювантной) химиотерапии, при положительном результате которой проводится операция.
- При неоперабельных опухолях назначается индукционная (то есть направленная на достижение ремиссии) химиотерапия, по результатам которой судят о возможности хирургического лечения.
- Адъювантная (послеоперационная) химиотерапия показана всем пациентам после операции.
- Метастатические опухоли требуют назначения системной химиотерапии.
Пациентам с резектабельным раком рекомендована адъювантная терапия с гемцитабином или капецитабином. Эта же комбинация может применяться при местнораспространенном, но неоперабельном раке, обеспечивая среднюю продолжительность жизни около 1 года. Пациентам с метастазами может быть предложена химиотерапия, однако прогноз, несмотря на проводимое лечение, остается неблагоприятным.
Роль лучевой терапии на сегодняшний день окончательно неясна. В классическом варианте, она входит в состав неоадъювантной химиолучевой терапии. Проведенные исследования не выявили преимуществ адъювантной химиолучевой терапии перед самостоятельной хирургической операцией.
Некоторые иностранные эксперты рекомендуют проведение дистанционного радиологического лечения в комбинации с 5-фторурацилом в составе адъювантной терапии при местнораспространенных неоперабельных новообразованиях.
Стоимость лечения рака поджелудочной железы
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | 0 | шт. |
| Консультация врача детского онколога | 0 | шт. |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
TomoTherapy и рак поджелудочной железы
Применение лучевой терапии при использовании обычных доз и режимов ограничено ее токсическим влиянием на организм в целом и на прилежащие критические органы и структуры. Поэтому взгляды специалистов со всего мира сегодня прикованы к принципиально новым методам лучевой терапии, которые позволяют сфокусировать ионизирующее излучение строго на опухоли, не затрагивая остальные ткани. Один из таких методов — лучевая терапия под визуальным контролем с модулированной интенсивностью излучения (IG\IMRT), который реализуется в частности в уникальной системе TomoTherapy.
Исследований, посвященных лечению рака поджелудочной железы с применением TomoTherapy пока не очень много, но те, что уже проведены, показывают высокую эффективность этого метода и достоверное снижение токсического действия на организм. В результате удается добиться снижения продолжительности лечения и его лучшей переносимости. TomoTherapy избирательно может применяться у пациентов, которые уже проходили курсы лучевой терапии, при наличии медицинских показаний.
В каждом из трех Центров Лечения Рака в США используются аппараты TomoTherapy, которые по признанию многих специалистов можно считать будущим радиотерапии. В России имеется 2 таких аппарата. Один из них установлен в клинике СакНур, где проходят лечение пациенты из республики Татарстан и других регионов России.
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Процедура представляет собой воздействие высоких доз радиационного излучения непосредственно на злокачественный очаг. Важность лучевой терапии обусловлена высокой чувствительностью аномальных клеток, зародившихся в эпителиальном слое панкреаса, к радиации.
Раковое новообразование панкреаса имеет высокую радиочувствительность, что делает облучение рака поджелудочной железы достаточно эффективным. Но, несмотря на резистентность аномальных структур к ионизирующим лучам, применяется этот метод не во всех клиниках и только при наличии у пациента определённых медицинских показаний.
Ограниченное использование для уничтожения генно модифицированных клеточных структур радиационного излучения связано с анатомическими особенностями секреторно-пищеварительного органа:
- В непосредственной близости от панкреаса расположено большое количество внутренних органов, имеющих определённый порог чувствительности, поэтому облучение может проводиться только ограниченными дозами.
- Без специальных аппаратов достигнуть точного попадания пучка лучей на злокачественный очаг невозможно, что связано с подвижностью секреторно-пищеварительного органа, провоцируемой дыханием человека.
- Из-за удалённого анатомическое расположение панкреаса в большинстве случаев самая эффективная внутренняя радиотерапия (бархитерапия) становится невозможной.
Но, несмотря на трудности проведения процедуры, данная терапевтическая методика, имеющая высокую эффективность при лечении онкопатологий, широко применяется в клиниках, имеющих специальное оборудование. С помощью этой процедуры достигается разрушение максимального количества аномальных клеток, значительное уменьшение размеров злокачественного новообразования и предупреждение возможных рецидивов после радикального удаления опухоли.
Высокая эффективность лучевой терапии при раке поджелудочной даёт возможность использовать данную процедуру как самостоятельный метод лечения на самых ранних стадиях развития патологического состояния. Но это в клинической практике отмечается очень редко, что обусловлено бессимптомным развитием злокачественных структур и поздним их выявлением, когда без хирургического вмешательства обойтись невозможно.
Чтобы специалист более адекватно поставил задачу облучения при раковом поражении панкреаса, необходима точная диагностика рака поджелудочной железы. Только после получения достоверных результатов радиолог сможет определить цели предстоящей процедуры и подобрать наиболее оптимальную схему радиационного воздействия.
Виды облучений при раке поджелудочной железы
Радиохирургия при раке поджелудочной железы проводится несколькими хорошо себя зарекомендовавшими способами.
Чаще всего для разрушения аномальной структуры, локализованной в панкреасе, применяются следующие виды радиационного облучения:
- Дистанционная или наружная радиотерапия. Пучок лучей направляется с расстояния 10-15 см в поражённую область. Благодаря применению современных технологий радиологи могут добиться высокой точности облучения онкоопухоли, позволяющей не задевать радиационными лучами здоровых тканей.
- Интраоперационная гамма-терапия. Процедура проводится одномоментно с оперативным вмешательством, что позволяет разрушать злокачественные клетки прямо на открытом операционном поле. Такой прямой способ воздействия на злокачественное новообразование показывает наиболее высокую результативность.
Стереотаксическая радиотерапия, высокоточная техника разрушения аномального новообразования, для проведения которой используется кибер-нож (CyberKnife). Данная техника облучения аномальных структур является самой современной и позволяет добиться высоких результатов. Радиохирургия рака поджелудочной железы, при проведении которой применяют кибер-нож, считается самой безопасной для больного, так как даёт специалисту возможность отследить меняющееся при дыхании положение органа.
Паллиативная лучевая терапия при раке поджелудочной также имеет широкое применение. Её используют на финальном этапе развития процесса малигнизации. Целью такого лечения считается не достижение выздоровления неоперабельного пациента, а облегчение его состояния. Симптоматическая лучевая терапия при раке поджелудочной позволяет купировать большинство мучительных проявлений, сопровождающих последнюю стадию развития злокачественной структуры.
Показания и противопоказания к проведению лучевой терапии
Облучение при раковых новообразованиях секреторно-пищеварительного органа необходимо в большинстве клинических случаев. Как показывает статистика, 65-70% пациентов, у которых выявлена онкология панкреаса, нуждаются в таком лечении. Лучевая терапия при раке поджелудочной железы помогает в большинстве клинических случаев. Основными показаниями к её проведению считаются крупные размеры опухоли, наличие в брюшной полости и регионарных лимфоузлах метастазов, выявление злокачественных клеток на операционном поле после проведения хирургического вмешательства. Также лучевую терапию рекомендуется проводить после того, как выполнена операция при раке поджелудочной железы, в целях профилактики. Облучение в этом случае снижает риски возникновения послеоперационного рецидива болезни. Но у этой процедуры имеется и ряд противопоказаний, делающих её проведение недопустимым.
К ним относятся:
- Начало распада злокачественного новообразования, сопровождающееся внутренним кровотечением или образованием на поверхности секреторно-пищеварительного органа нагноений.
- Начало обширного процесса метастазирования с поражением вторичными очагами отдалённых участков организма.
- Активное прорастание аномальных клеток в находящиеся поблизости полые органы, желудок и кишечник.
- Наличие в анамнезе патологий крови, недавно перенесённого инфаркта миокарда, острого туберкулёза лёгких.
- Кахексия и выраженная интоксикация, провоцирующие общее тяжёлое состояние пациента.
- Гнойные поражения и аллергические высыпания на кожном покрове.
Подготовка и проведение облучения
Для достижения высокой результативности процедуры, позволяющей эффективно разрушить рак поджелудочной железы, пациент должен быть к ней подготовлен.
С этой целью в предлучевом периоде проводят:
- Детальное исследование характера опухолевого новообразования и общего состояния человека, позволяющее выявить все показания и возможные противопоказания к проведению процедуры.
- Составление индивидуального лечебного плана с расчётом ритма облучения и величины суммарной дозы радиации.
- Выявление топографии новообразования и уточнение её границ относительно к кожному покрову.
Благодаря проведённой предоперационной подготовке радиолог с наибольшей точностью проведёт процедуру радиационного разрушения опухоли. Непосредственно перед сеансом пациента, переодетого в больничную рубашку, размещают на столе линейного ускорителя в соответствии с метками на коже. Сделанными во время предлучевой подготовки. После того, как точность расположения онкобольного подтверждена КТ, врач выходит из кабинета и включает аппаратуру. Все нюансы процедуры специалист будет отслеживать удалённо, через монитор, а вести переговоры с пациентом через специальное переговорное устройство.
Схемы и курсы
Наружное облучение при раке поджелудочной железы проводится циклами. Обычно процедуры, при которых пациент получает фиксированную дозу радиации, выполняются ежедневно (кроме выходных) на протяжении 6 недель. Но эти сроки у каждого конкретного пациента могут значительно колебаться, так как подход к лучевой терапии строго индивидуален.
Стандартом при злокачественной опухоли в поджелудочной железе считаются следующие схемы воздействия радиации:
- Конвенциональное 2D-облучение РОД (разовая очаговая доза) составляет 2Гр, а СОД, суммарное воздействие, 60Гр.
- Конформное 3D-облучение разнится в суммарной дозе. При наличии остаточной микроскопической аномальной структуры бывает достаточно 60ГР, а макроскопический очаг, оставшийся на операционном поле, требует увеличения дозировки радиации до 70ГР.
Стоит знать! Правильно подобранные и проведённые курсы радиационного облучения позволяют на 2 и 3 стадии рака поджелудочной железы значительно продлить период ремиссии, а на заключительном этапе улучшить качество жизни.
Дополняющее лечение
Радиотерапия, эффективно разрушающая рак поджелудочной железы, показывает более высокие результаты, когда применяется в одном протоколе с другими методами терапии. Обычно лучевая терапия рака поджелудочной железы дополняет хирургическое вмешательство. Благодаря воздействию радиационного облучения онкологи-хирурги добиваются более высоких результатов операции. Нередко радиохирургическое лечение рака поджелудочной железы проводится в комбинации с химиотерапией. Противоопухолевые препараты в этом случае способствуют усилению эффекта лучевого воздействия. Такие совместные протоколы лечения позволяют добиться более длительного периода ремиссии и сокращают риск развития осложнений и побочных эффектов.
Реабилитация
Продолжительность восстановительного периода после проведения курса лучевой терапии индивидуальна для каждого конкретного пациента. Реабилитация, следующая за процедурой облучения, разрушившей в большей степени рак поджелудочной железы, является при этом опасном заболевании важнейшим этапом терапии.
Чтобы восстановление органов, функционирование которых нарушило облучение рака поджелудочной железы, необходимо выполнять следующие реабилитационные мероприятия:
- правильно питаться (рацион должен быть достаточно калорийным и в то же время щадящим);
- распланировать распорядок дня таким образом, чтобы на отдых оставалось максимальное количество времени;
- вести активный образ жизни с частыми прогулками на свежем воздухе, желательно у водоёмов или в лесополосе, где воздух более чистый и влажный.
Особенности питания до, во время и после проведения лучевой терапии
Правильный и сбалансированный рацион питания при проведении курсов облучения и после них направлен на максимальное уменьшение их последствий. В связи с тем, что лучевая терапия при раке поджелудочной железы зачастую приводит к значительной потере веса, радиологам нередко приходится кардинально менять лечебные курсы. Такие изменения оказывают плохое влияние на качество жизни онкобольного и результаты проводимой терапии. Именно поэтому необходимо кардинально корректировать пищевой рацион.
Диетологи рекомендуют при облучении панкреаса (как до проведения курса, так и во время или после него) специальную бесшлаковую диету. Соблюдение такой диеты при лучевой терапии позволяет достигнуть максимального щажения пищеварительных органов и устранение развивающихся в них бродильных и воспалительных процессов.
Общие её рекомендации заключаются в следующем:
- запрет на солёную, острую, кислую пищу;
- устранение из рациона всех видов молочных продуктов;
- снижение до минимума содержание в блюдах растительной клетчатки.
Стоит знать! Чаще всего при прохождении процедур облучения у пациентов происходит значительное снижение аппетита, поэтому питание при лучевой терапии должно быть обогащено продуктами, содержащими максимальное количество калорий и питательных веществ: шоколадом, взбитыми сливками, мёдом, яйцами, орехами.
Осложнения и последствия лучевого лечения рака поджелудочной железы
Воздействие на организм при ликвидации онкологических поражений радиационным излучением всегда приводит к развитию неприятных, а в некоторых случаях и достаточно серьёзных последствий. Облучение при раке поджелудочной железы не обходится без осложнений. Особенно подвержены их появлению пациенты, проходящие длительные курсы радиотерапии с большими суммарными дозами радиации. Тем не менее, стоит отметить, что последствия лучевой терапии при раке поджелудочной чаще всего имеют лёгкую степень выраженности и не препятствуют доведению до конца лечебного курса.
Основными побочными эффектами, провоцируемыми радиационным излучением, являются:
- разрушение волосяных луковиц, провоцирующее развитие аллопеции (быстрой потере волос, приводящей к облысению);
- появление сухости, шелушения и отёчности на кожных покровах в местах соприкосновения с высокочастотными лучами;
- диспепсические явления со стороны органов пищеварения;
- развитие нервозности и проблем с дыханием.
Некоторые осложнения лучевой терапии при раке поджелудочной могут развиваться уже после прохождения пациентом терапевтического курса. Специалисты называют поздно появляющуюся негативную симптоматику остаточным явлением и связывают её возникновение с длительной реализацией в тканевых структурах радиационного эффекта.
Читайте также: