Провера лечение рака матки
Первое место по заболеваемости среди онкогинекологических заболеваний занимает рак тела матки, или рак эндометрия. В России каждый год выявляют до 16 тысяч новых случаев болезни, и количество заболевших постоянно увеличивается.
Патология поражает в основном женщин после 60 лет, но может возникать и в более молодом возрасте. Около 40% пациенток заболевают до наступления менопаузы. В последнее десятилетие наибольшими темпами растет заболеваемость женщин моложе 29 лет.
Опухоль сопровождается быстрым появлением симптомов, которые заставляют женщину обращаться к врачу. Это приводит к тому, что до 90% случаев рака матки диагностируются в ранней стадии, что значительно улучшает прогноз.
Причины и факторы риска

Факторы, предрасполагающие к раку матки:
- поздние первые месячные;
- менопауза только после 55 лет;
- длительная ановуляция;
- эндокринное бесплодие;
- поликистоз яичников и гормонально-активная опухоль этих органов (рак Бреннера);
- ожирение;
- сахарный диабет;
- длительный прием эстрогенных гормонов без сочетания с гестагенами;
- лечение антиэстрогенными препаратами (Тамоксифен);
- отсутствие половой жизни или беременности;
- случаи болезни у близких родственниц.
Рак эндометрия матки возникает на фоне комплекса нарушений гормонального баланса, обмена жиров и углеводов.
Основные патогенетические виды заболевания:
- гормонально-зависимый (у 70% пациенток);
- автономный.
При первом варианте нарушения овуляции в сочетании с ожирением или диабетом приводят к повышенной выработке эстрогенов. Действуя на внутренний маточный слой – эндометрий, эстрогены вызывают усиленное размножение его клеток и их гиперплазию – увеличение в размерах и изменение свойств. Постепенно гиперплазия приобретает злокачественный характер, перерастая в предрак и рак матки.
Гормонально-зависимый рак матки часто сочетается с опухолью кишечника, молочной железы или яичника, а также со склерокистозом яичников (синдром Штейна-Левенталя). Такая опухоль растет медленно. Она чувствительна к прогестагенам и имеет относительно благоприятное течение.
Признаки, увеличивающие риск гормонально-зависимого рака:
- бесплодие, поздняя менопауза, ановуляторные кровотечения;
- фолликулярные кисты яичников и гиперпластические процессы в них (текоматоз);
- ожирение;
- неправильное лечение эстрогенами, аденома надпочечников или цирроз печени, вызывающие гормональные сдвиги.
Автономный вариант чаще развивается у женщин в постменопаузе на фоне атрофии яичников и эндометрия. Гормональная зависимость отсутствует. Опухоль характеризуется злокачественным течением, быстро распространяется вглубь тканей и по лимфатическим сосудам.
Существует генетическая теория рака, согласно которой мутации клеток запрограммированы в ДНК.
Основные этапы формирования злокачественной опухоли матки:
- отсутствие овуляции и повышение уровня эстрогенов под действием провоцирующих факторов;
- развитие фоновых процессов – полипов и гиперплазии эндометрия;
- предраковые нарушения – атипия с гиперплазией эпителиальных клеток;
- преинвазивный рак, не проникающий за пределы слизистой оболочки;
- минимальное проникновение в миометрий;
- выраженная форма.
Классификация
Рак тела матки классифицируется в зависимости от размера опухоли, ее проникновения в мышечный слой, разрастания в окружающих органах, поражения лимфоузлов и наличия отдаленных метастазов. Используется как определение стадии по системе TNM, так и по классификации международной Федерации акушеров-гинекологов (FIGO).
Опухоль, не выходящая за пределы эндометрия, называется преинвазивной. Она обозначается как карцинома in situ, Тis или стадия 0.
Различают 4 стадии рака матки
1. Опухоль поражает только тело матки:
- эндометрий (Т1а или IA);
- миометрий до половины глубины (Т1b или IB);
- более половины глубины миометрия (T1c или IС).
2. Злокачественные клетки обнаруживаются в шейке:
- только в железистом слое (Т2а или IIА);
- опухоль проникает в глубокие слои шейки (Т2b или IIВ).
3. Опухоль переходит на влагалище, придатки или лимфоузлы:
- поражение наружного серозного слоя матки и/или придатков (Т3а или IIIA);
- распространение на влагалище (Т3b или IIIB);
- есть метастазы в тазовые или околоаортальные лимфоузлы (N1 или IIIC).
4. Рак матки 4 степени с метастазами:
- в мочевой пузырь или прямую кишку (Т4 или IVA);
- в легкие, печень, кости, отдаленные лимфоузлы (М1 или IVB).
Кроме этого, различают разные степени дифференцировки клеток опухоли: от G1 (высокая степень зрелости клеток) до 3 (низкодифференцированная опухоль). Чем более выражена дифференцировка, тем медленнее растет новообразование и тем меньше вероятность его метастазирования. При низкодифференцированном раке прогноз ухудшается.
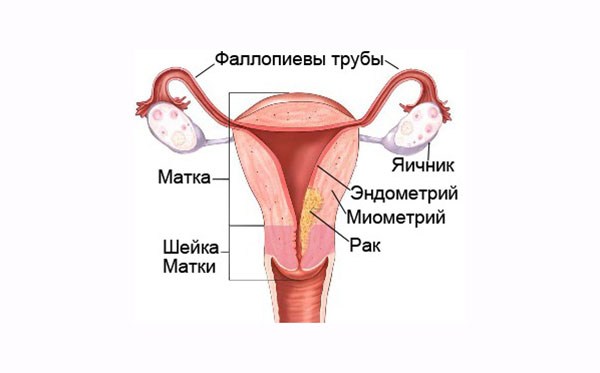
В зависимости от микроскопического строения различают такие морфологические типы рака:
- аденокарцинома;
- светоклеточный;
- плоскоклеточный;
- железистоплоскоклеточный;
- серозный;
- музинозный;
- недифференцированный.
Морфологический тип во многом определяет злокачественность. Так, течение недифференцированного рака неблагоприятное, а при плоскоклеточной опухоли вероятность выздоровления довольно высока.
Новообразование может расти экзофитно (в просвет матки), эндофитно (в толщу мышечной стенки) или иметь смешанный характер.
Локализуется рак в области дна и тела матки, в её нижнем сегменте опухоль находят реже.
Симптомы
Нередко пациентка обращается к врачу, когда у нее появляются первые признаки рака матки на ранних стадиях. Прежде всего, это нерегулярные кровянистые выделения у молодых женщин, не совпадающие с менструальным циклом. У женщин в постменопаузе появляются маточные кровотечения. У молодых больных возникают светлые бели.
Кровотечения встречаются не только при раке эндометрия, но и при многих других заболеваниях. С этим бывают связаны трудности в ранней диагностике болезни, особенно у молодых женщин. Они могут долго наблюдаться по поводу дисфункционального маточного кровотечения.
Другие симптомы рака матки появляются на более поздних стадиях. При скоплении крови в полости органа появляются боли в нижнем отделе живота. Длительный болевой синдром возникает при разрастании новообразования на придатки и распространении по брюшине.
Обильные водянистые или слизистые выделения при раке матки характерны для пожилых женщин.
При поражении мочевого пузыря возможно учащенное болезненное мочеиспускание. Если вовлекается прямая кишка, появляются запоры, боль при дефекации, примесь крови в кале.
Общие признаки онкопатологии – слабость, ухудшение работоспособности, тошнота, отсутствие аппетита, снижение веса.
Как быстро развивается рак матки?
При высокой степени дифференцировки опухоль растет медленно, в течение нескольких лет. Низкодифференцированные формы обладают высокой скоростью размножения злокачественных клеток. При этом клинически выраженная опухоль может развиться в течение нескольких месяцев.
Метастазирование
Распространение раковых клеток возможно по лимфатическим путям, кровеносным сосудам и по брюшине.
Лимфогенное метастазирование осуществляется в ближайшие (регионарные) лимфоузлы таза. При ранней стадии и высокой дифференцировке (G1-G2) вероятность поражения лимфоузлов не превышает 1%. Если раковые клетки проникают в миометрий, риск метастазирования увеличивается до 6%. Если опухоль поражает большую площадь, проникает глубоко в маточную стенку или распространяется на шейку – метастазы в лимфоузлах обнаруживаются у 25% больных.
Гематогенное метастазирование возникает позднее. По кровеносным сосудам опухолевые клетки попадают в легкие, кости и печень.
Имплантационные метастазы возникают на брюшине и сальнике при прорастании наружного слоя матки и поражении маточных труб.
Диагностика
Скрининговые исследования для раннего выявления образования не проводятся. Считается, что для своевременного распознавания нужно лишь ежегодно наблюдаться у гинеколога.
Анализ на онкомаркеры, самым распространенным из которых считается СА-125, обычно не проводится. Он считается дополнительным методом для оценки эффективности лечения и раннего выявления рецидивов.
Самый простой метод диагностики – аспирация содержимого матки специальным шприцом и гистологическое исследование (аспирационная биопсия). На ранней стадии информативность такого способа не превышает 36%, при распространенной опухоли ее признаки можно обнаружить у 90% пациенток. Для увеличения точности исследования его могут проводить неоднократно. Аспирационная биопсия не требует расширения цервикального канала и выполняется амбулаторно.
Инструментальная диагностика рака матки:
- УЗИ органов малого таза: толщина эндометрия у женщин в постменопаузе не должна превышать 4 мм.
- Гистероскопия с биопсией подозрительного участка эндометрия и его микроскопическим исследованием.
Для определения распространенности опухоли и поражения лимфоузлов проводится МРТ малого таза. В отличие от УЗИ, метод помогает уточнить состояние лимфатических узлов у 82% больных.
Обязательно выполняется рентгенография легких для исключения метастазов в них.
Виден ли рак матки на УЗИ?
Насторожить врача должны данные УЗИ матки, если регистрируется увеличение М-эхо (толщина эндометрия) более 4 мм у пожилых женщин или 10-16 мм у пациенток до менопаузы.
При величине М-эхо более 12 мм у молодых женщин назначают аспирационную биопсию. Если эта величина составляет 5-12 мм – выполняют гистероскопию и прицельную биопсию (взятие материала из подозрительного участка).
При обнаружении опухоли на УЗИ можно определить:
- размеры и контуры матки;
- структуру миометрия;
- расположение опухоли;
- глубину прорастания в миометрий;
- поражение внутреннего зева, яичников и лимфоузлов.
Дополнительную информацию дает цветное допплеровское картирование – ультразвуковое исследование сосудов, позволяющее оценить скорость и интенсивность кровотока в сосудах матки и опухолевом очаге.
Гистероскопия – важнейший метод диагностики, позволяющий оценить выраженность и распространенность опухоли и взять материал для гистологического анализа.
При подозрении на рак матки необходимо выполнить раздельное диагностическое выскабливание стенок цервикального канала и эндометрия.
Как определить рак матки при минимальном размере поражения?
Современный метод выявления ранних стадий рака эндометрия – флуоресцентная диагностика. В организм вводят специальные вещества, избирательно накапливающиеся в раковых клетках. При облучении внутренней поверхности матки лазером эти вещества начинают светиться. Это позволяет увидеть очаги опухоли до 1 мм и взять прицельную биопсию. На ранней стадии чувствительность такой диагностики достигает 80%.
Окончательно диагноз подтверждают по данным выскабливания матки. Если опухоль расположена в верхней части органа, ее распознают в 78% случаев, а при распространенном поражении – в 100% случаев.
Рак матки нужно дифференцировать с такими заболеваниями:
Лечение
Если у женщины диагностирована злокачественная опухоль половой системы, пациентка должна наблюдаться у онкогинеколога.
Лечение рака матки основано на различных сочетаниях трех методов:
- Операция.
- Облучение.
- Терапия лекарственными веществами.
Основной способ лечения, выполняемый при любой стадии заболевания, — удаление матки с придатками. Если имеется низкодифференцированная опухоль или она глубоко проникает в мышечный слой органа, дополнительно удаляют тазовые лимфоузлы, в которых могут находиться метастазы.
Операция проводится у 90% женщин с ранней стадией болезни. У остальных она противопоказана из-за тяжелых сопутствующих заболеваний. Разработка новых способов оперативного вмешательства позволяет расширить возможности хирургического лечения.
Лучевая терапия при раке матки как самостоятельный метод лечения используется редко, только при невозможности удалить орган. Чаще всего облучение проводится после операции (адъювантная радиотерапия) с целью уничтожить оставшиеся раковые клетки.
Такая комбинация показана в следующих случаях:
- глубокое прорастание новообазования в миометрий;
- распространение на цервикальный канал и шейку;
- метастазы в лимфоузлы;
- низкодифференцированная или неэндометриоидная опухоль.
Современные методы лечения: радиотерапия – IMRT и брахитерапия. IMRT-метод включает прицельное облучение опухоли с минимальным повреждением окружающих тканей. Брахитерапия – введение в очаг новообразования специальных радиоактивных веществ, действующих непосредственно на раковые клетки.
При предраке эндометрия у молодых женщин возможна гормональная терапия прогестинами. Эти гормоны блокируют активирующее действие на опухоль эстрогенов, предотвращая ее дальнейший рост. Гормоны используются при распространенном (диссеминированном) раке, а также при его рецидиве. Их эффективность не превышает 25%.
На ранней стадии прием гормонов по определенной схеме длится около года. Эффективность терапии контролируют с помощью биопсии. При благоприятном результате в течение следующих 6 месяцев проводят восстановление нормального менструального цикла. В последующем возможна нормальная беременность.
Химиотерапия назначается при низкодифференцированном раке матки и неэндометриоидных опухолях, диссеминированном и рецидивирующем раке, если новообразование не отвечает на влияние гестагенов. Она носит паллиативный характер, то есть, направлена на уменьшение тяжелых симптомов, вызванных опухолью, но не излечивает заболевание. Применяются препараты из групп антрациклинов, таксанов, производные платины. Послеоперационная (адъювантная) химиотерапия не назначается.
В домашних условиях женщине необходимо больше отдыхать. Окружающие должны оградить ее от эмоциональных стрессов. Питание при раке матки полноценное, разнообразное, с исключением рафинированных углеводов (сахара), ограничением животных жиров, жареных и консервированных блюд, пряностей, шоколада и других раздражающих продуктов. Очень полезны молочные продукты и растительная пища.
Считается, что некоторые растения помогают справиться с опухолью или улучшить самочувствие пациентки:
- зеленый чай;
- куркума;
- свекла;
- помидоры;
- соя.
Вопрос о том, как вылечить рак матки, решается врачом после тщательного анализа всей полученной диагностической информации. Во многом это зависит от стадии опухоли.
При раке 1 степени (стадии) применяется полное удаление матки и придатков (тотальная гистерэктомия и аднексэктомия).
Такая операция проводится при выполнении всех перечисленных ниже условий:
- умеренная и высокая дифференцировка опухоли;
- образование занимает меньше половины полости органа;
- глубина прорастания миометрия менее 50%;
- нет признаков распространения опухоли по брюшине (в перитонеальных смывах раковые клетки не найдены).
Если глубина проникновения в мышечный слой составляет более половины его толщины, после операции назначают внутривлагалищную лучевую терапию.
Во всех остальных случаях удаление половых органов дополняется иссечение тазовых, а в некоторых случаях и парааортальных лимфоузлов. Узлы, расположенные около аорты, пунктируют во время операции и проводят срочное гистологическое исследование. По его результатам принимают решение об удалении этих образований.
После операции используется облучение. Если хирургическое вмешательство невозможно, применяют только лучевую терапию, но эффективность такого лечения ниже.
Гормональная терапия на 1 стадии не используется.
При раке 2 степени больным показано удаление матки, придатков, тазовых (иногда и парааортальных) лимфоузлов и послеоперационная лучевая терапия. Облучение проводится по комбинированной схеме: внутривлагалищно и дистанционно.
При раке 3 степени проводится комбинированное хирургическое и лучевое лечение. Если опухоль проросла в стенки таза, ее полное удаление невозможно. В этом случае назначают лучевую терапию через влагалище и дистанционно.
Если радиотерапия и операция противопоказаны, лечение зависит от гормональной чувствительности опухоли: назначаются либо прогестины, либо химиопрепараты.
При опухоли 4 степени используется паллиативная химиотерапия в сочетании с гормонами. Эти вещества помогают уничтожить отдаленные метастазы рака в других органах.
Рецидив новообразования также лечится с применением гормонов и химиопрепаратов. При повторном очаге, расположенном в малом тазу, проводится паллиативная радиотерапия. Рецидивы чаще всего возникают в течение первых 3 лет после лечения. Они локализуются преимущественно во влагалище, лимфоузлах и отдаленных органах.
Рак матки и беременность
Во время беременности патологические изменения распознать практически невозможно. Рост опухоли в течение вынашивания плода чаще всего не наблюдается. Однако рак матки при беременности может сопровождаться выкидышем, отслойкой плаценты, гибелью плода и сильным кровотечением. В этих случаях проводят экстренное родоразрешение с последующей экстирпацией матки.
В том случае, если молодая женщина прошла полный курс лечения с хорошим эффектом, в дальнейшем у нее возможна беременность. Для восстановления детородной способности врачи назначают курсы гормональной терапии, восстанавливающие нормальную репродуктивную функцию.
Сколько живут с раком матки?
Это зависит от стадии выявления болезни и чувствительности к гормонам. При гормонозависимом варианте в течение 5 лет и более живут 85-90% пациенток. При автономной форме у пожилых женщин этот показатель составляет 60-70%. Однако при 3-й стадии любой формы продолжительность жизни больше 5 лет регистрируется у трети больных, а при 4-й – только в 5% случаев.
Международное наименование. Medroxyprogesterone
Состав и форма выпуска. Таблетки: в упаковке 100 штук. 1 таблетка содержит медроксипрогестерона ацетат 100 мг. Таблетки: в упаковке 30 штук, 1 таблетка содержит медроксипрогестерона ацетат 500 мг. Гранулят для приема внутрь: в пакетиках, по 10 штук в упаковке. Пакеты по 4 г, 10г, 10г с содержанием медроксипрогестерона ацетат 200 мг, 500 мг, 1 г соответственно.
- Фармакологическое действие
- Фармакокинетика
- Показания к применению
- Противопоказания к применению
- Побочные эффекты
- Передозировка
Фармакокинетика Связывание с белками плазмы составляет 90-95%. Препарат метаболизируется в печени. Период полувыведения составляет около 30 ч. Основной метаболит выводится почками. Препарат проникает в материнское молоко и через гематоэнцефалический барьер.
Показания к приему провера. Гормонально зависимые формы рака молочной железы у женщин в менопаузе в качестве паллиативного лечения; рецидивы и/или метастазы рака эндометрия в качестве дополнительного и/или паллиативного лечения; рецидивы и/или метастазы рака почки в качестве дополнительного и/или паллиативного лечения.
Режим дозирования. При раке эндометрия и раке почки Провера назначают в дозе 200-600 мг в сут. При раке молочной железы препарат назначают в дозе 400-1200 мг в сут. Во всех случаях лечение проводят до тех пор, пока пациент реагирует на проводимую терапию.
Побочные эффекты. Аллергические реакции: крапивница, сыпь, случаи анафилактоидных реакций. Со стороны свертывающей системы крови: тромбоэмболии, тромбофлебит. Со стороны ЦНС: нервозность, расстройства сна, сонливость, слабость, депрессия, головокружение, головная боль. Со стороны ЖКТ: тошнота. Со стороны половых органов: изменения характера выделений из половых путей, чувствительность молочных желез и галакторея. Прочие: пирогенные реакции. При длительном приеме высоких доз Провера возможно развитие симптомокомплекса Иценко-Кушинга.
Противопоказания при применении провера. Повышенная чувствительность к медроксипрогестерону; беременность.
Особые указания. Применительно к любой пациентке, у которой возникают признаки и/или симптомы, соответствующие тромбоэмболическому процессу, перед продолжением терапии Провера необходимо повторно оценить ситуацию. Пациентки, в анамнезе которых имеются указания на терапию по поводу депрессивных состояний, в период лечения препаратом нуждаются в тщательном наблюдении. При появлении симптомокомплекса Иценко-Кушинга необходимо тщательно наблюдать за больным и по возможности снизить дозу. При назначении Провера в высоких дозах может наблюдаться задержка жидкости, поэтому при наличии эпилепсии, мигрени, астмы, признаков хронической сердечной или почечной недостаточности больной нуждается в особом контроле. У некоторых больных, получающих Провера, возможно снижение толерантности к глюкозе. Это учитывают при назначении препарата диабетикам. При гормональном лечении рака эндометрия, почки или рака молочной железы результаты лечения могут появиться даже через 8-10 недель от начала терапии. В случае наличия эрозии шейки матки перед началом применения Провера желательно проведение терапии эрозии. При сохраняющейся эрозии показан тщательный врачебный контроль. Если на фоне лечения препаратом проводят цитологическое или гистологическое исследование эндометрия или шейки матки, необходимо предупредить гистолога о проводимой терапии. Применение Провера может оказывать влияние на результаты следующих лабораторных исследований: определение уровней гонадотропинов; определение уровней в плазме крови прогестерона, кортизола, эстрогенов; определение уровня прегнандиола в моче; определение уровня тестостерона в плазме крови (у мужчин); проведение теста с сахарной нагрузкой (тест толерантности к глюкозе); метапироновый тест. Применение Провера в качестве диагностического теста для определения беременности не рекомендуется.
Передозировка. Явления острой передозировки препарата не отмечались.
Производитель. Pharmacia & Upjohn
Применение препарата провера только по назначению врача, инструкция дана для справки!
Несмотря на то что смертность от рака эндометрия (РЭ) ниже, чем при злокачественных опухолях шейки матки и яичников, она все же остается высокой, особенно если принять во внимание подавляющее число больных с первично диагностированной I стадией. Некоторые рецидивы, например, в культе влагалища можно успешно лечить с помощью хирургического вмешательства, ЛТ или комбинированным методом.
Прогноз для многих больных благоприятный, и они живут достаточно долго. К сожалению, во многих случаях рецидивы возникают за пределами верхней части влагалища и поэтому не подлежат ни хирургическому лечению, ни ЛТ. У некоторых пациенток ЛТ имеет ограниченное значение, особенно если ее применяли как этап первичного лечения. Следовательно, для многих пациенток с рецидивом рака эндометрия (РЭ) терапией выбора остается гормональная или химиотерапия.
Прогестины назначают в качестве адъювантной терапии, направленной на профилактику рецидива заболевания. В рамках рандомизированного исследования Lewis и соавт. при раке эндометрия (РЭ) применяли медроксипрогестерона ацетат (МПА) или плацебо в послеоперационный период. В обеих группах 4-летняя выживаемость была одинаковой.
Kauppila и соавт., описав более 1100 больных раком эндометрия (РЭ), получавших адъювантную терапию прогестинами в течение 2 лет после операции и ЛТ, обнаружили, что рецидивы возникали даже при высокодифференцированных аденокарциномах I стадии; по их мнению, профилактическое применение прогестинов у этих пациенток было неэффективным.
В проспективном исследовании DePalo и соавт. не обнаружили разницы в выживаемости 363 больных раком эндометрия (РЭ) I стадии, получавших МПА в течение 12 мес, и 383 пациенток с той же стадией, которые не получали этот препарат. По данным британского исследования, в котором 429 пациенток с I и II стадиями рака эндометрия (РЭ) были рандомизированы для послеоперационной терапии МПА или наблюдения, разницы в показателях выживаемости через 5 лет выявлено не было.

Прогестины применяют более 30 лет; чувствительность рецидивных опухолей рака эндометрия (РЭ) к этим гормонам доказана. Имеющиеся данные свидетельствуют о том, что приблизительно 1/3 всех больных с рецидивами рака эндометрия (РЭ) реагирует на гормональную терапию, причем частота ответов при высокодифференцированных аденокарциномах значительно выше, чем при умеренно и низкодифференцированных.
Эксперты GOG назначали МПА по 50 мг 3 раза в сутки 420 больным с выраженными стадиями или рецидивами рака эндометрия (РЭ). Из 219 пациенток с объективно измеряемыми опухолями было всего 17 (8%) с полным ответом на терапию и 13 (6 %) — с частичным. Более чем у 1/2 пациенток заболевание оставалось стабильным, а у 1/3 — прогрессировало. Медиана выживаемости составила 10,5 мес.
При высокодифференцированных аденокарциномах частота ответов на терапию прогестинами выше, чем при низкодифференцированных. GOG в рамках рандомизированного клинического исследования III фазы провела сравнительную оценку эффективности МПА в дозе 1000 и 200 мг/сут у 300 пациенток. Различий между показателями ответа на лечение и выживаемостью между двумя терапевтическими группами не отмечено. Lentz сообщил о другом клиническом исследовании GOG, в котором больным с распространенным или рецидивным раком эндометрия (РЭ) назначали высокие дозы (800 мг/сут) мегестрола ацетата.
Из 58 пациенток прореагировали на лечение 13 (24%); у 6 (11 %) пациенток ответ был частичным, причем в 4 случаях он длился более 18 мес. и наблюдался при умеренно и высокодифференцированных аденокарциномах.
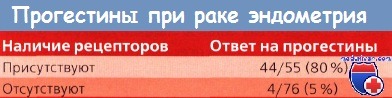
Позднее стали определять специфические ЭР и ПР в клетках злокачественных опухолей матки. Нет сомнений в наличии этих рецепторов, но их концентрация варьирует в различных опухолях. В высокодифференцированных опухолях по сравнению с низкодифференцированными содержится больше как ЭР, так и ПР.
В небольшой группе пациенток было установлено, что примерно в 1/3 рецидивных опухолей содержались ЭР и ПР. Следовательно, рецепторный статус опухоли может коррелировать с клиническими данными чувствительности к прогестерону у больных с рецидивным раком эндометрия (РЭ). Предварительные результаты весьма убедительно свидетельствуют об этом.
Очевидно, что для подтверждения этих данных необходимо получить дополнительную информацию; во всяком случае, перспективы в этом направлении весьма обнадеживающие. Если подтвердится прямая корреляция, то анализ рецепторного статуса опухоли позволит подбирать ту или иную схему гормональной или химиотерапии при рецидивах рака эндометрия (РЭ). Если результат анализа на наличие ЭР и ПР положительный, то у пациентки хорошие шансы на достижение ремиссии при лечении прогестинами, даже если у нее низкодифференцированная опухоль.
С другой стороны, при отрицательных результатах ответ на терапию прогестинами может оказаться настолько низким, что проведение XT сэкономит время и будет более эффективным. Kauppila, анализируя данные 5 исследований, описанных в литературе, подсчитал, что 89% опухолей с ПР проявили чувствительность к гормональной терапии по сравнению с чувствительностью всего лишь 17 % у опухолей, не содержащих эти рецепторы. По данным GOG, 4 (40%) из 10 опухолей, имеющих ЭР и ПР, реагировали на проводившуюся терапию прогестинами по сравнению с 5 (12%) из 41 опухоли без ПР.
Терапию прогестинами можно проводить несколькими способами. Мы предпочитаем использовать МПА (Депо-Провера) по 400 мг в/м с недельным интервалом. Другие рекомендуемые прогестины: пероральный МПА (Провера) 150 мг/сут и мегестрола ацетат (Мегейс) 160 мг/сут. Если достигнут объективный ответ, терапию прогестинами продолжают неопределенно долго. При прогрессировании заболевания прогестины отменяют и назначают XT.
Занимая первое место в структуре онкологической заболеваемости среди злокачественных опухолей женских половых органов, рак эндометрия (РЭ) и сегодня остается одной из самых актуальных проблем в онкогинекологии. За последнее десятилетие в России, как и в большинстве стран мира, отмечается отчетливая тенденция к росту заболеваемости РЭ - с 14,3 в 1991 г. до 19,7 в 2004 г. При этом преобладают начальные (I-II) стадии процесса (74%), что на сегодняшний день является хорошим и перспективным показателем. Сегодня под начальным РЭ принято понимать атипическую гиперплазию с дисплазией эпителия III степени, карциному in situ и РЭ 1а стадии. В настоящее время экстирпация матки с придатками и самостоятельная гормонотерапия гестагенами являются наиболее широко применяющимися методами лечения начального РЭ. Однако в последние годы в практической деятельности начинают использоваться другие хирургические методы лечения, альтернативные классическим, такие как экстирпация матки без придатков и аблация эндометрия.рак матки
Однако какой из перечисленных методов будет применяться в лечении начального РЭ не так важно, как то, насколько информативны результаты диагностического поиска, позволяющие точно установить наличие и истинную распространенность опухолевого процесса. Клиницист в каждом конкретном случае составляет индивидуальный план лечебных мероприятий, ориентируясь на возраст больной, морфологическую структуру опухоли, степень дифференцировки опухолевых клеток, потенциальную чувствительность данного вида опухоли к гормонотерапии, выраженность экстрагенитальной патологии, являющейся противопоказанием к проведению того или иного метода лечения.рак матки
Сегодня в диагностике начального РЭ реализуется стандартный алгоритм уточняющей диагностики, включающий в себя высокоинформативные методы исследования: ультразвуковое сканирование в режиме цветового допплеровского картирования (ЦДК), гистероскопию, желательно с флюоресцентной диагностикой (ФД) и прицельной биопсией эндометрия, морфологическое исследование полученного материала.
Использование при гистероскопии флюоресцентного исследования с опухолевотропными фотосенсибилизаторами и их метаболитами (фотосенс, 5-аминолевулиновой кислотой - 5-АЛК) оказывает существенную помощь в диагностике заболевания и оценке его распространненности. Принцип действия метода основан на выявлении злокачественных новообразований малых размеров (до 1 мм) за счет избирательного накопления в них заранее вводимого в организм больной фотосенсибилизатора (5-АЛК) с последующей регистрацией флюоресценции (собственной и индуцированной) на экране видиосистемы при воздействии лазерного излучения в ультрафиолетовом спектре. ФД с 5-АЛК позволяет визуализировать невидимые глазом микроскопические опухолевые очаги на, казалось бы, неизмененной слизистой, уточнять их топографию и получать прицельную биопсию с этих мест. Информативность метода при начальном РЭ достигает 80%.
Несомненно, заключительным и решающим методом диагностики начального РЭ является гистологическое подтверждение гистероскопического заключения, позволяющее определить характер морфоструктурных изменений.
В настоящее время от каждой женщины получают информированное согласие о планируемом лечении, что очень важно, так как пациентка непосредственно и осознанно участвует в процессе выбора лечения.
Лечение рака эндометрия у женщин репродуктивного периода принято начинать с гормонотерапии. Применение высокоактивных прогестино-вых препаратов позволяет не только излечить молодых женщин от онкологического заболевания, но и сохранить им менструальную и детородную функции. Морфологические изменения, происходящие в опухоли под воздействием гормонотерапии, заключаются в постепенном усилении структурной и функциональной дифференцировки клеток с признаками секреторной трансформации с последующим достижением атрофических изменений в эндометрии.
За период с 1975-2003 гг. в МНИОИ гормонотерапия как самостоятельный метод лечения применялась у 125 женщин репродуктивного периода: у 56 с атипической гиперплазией эндометрия - АГЭ (дисплазия III степени) и у 69 по поводу начального РЭ (Ia стадии). Средний возраст больных составил 30,5 года. Многолетний клинический опыт лечения молодых больных позволил выработать эффективную двухэтапную схему гормонального лечения.
Первый этап преследует цель достичь излечения онкологического заболевания, второй предусматривает коррекцию нарушенного гормонального гомеостаза для восстановления нормального овуляторного менструального цикла.
На первом этапе больным молодого возраста с АГЭ вводят 12,5% раствор 17-ОПК по 500 мг в/м 3 раза в неделю в течение 2 мес (так называемая доза достижения эффекта - ДДЭ) - 14-15 г препарата. Затем производят забор материала эндометрия во время гистероскопии для оценки чувствительности опухоли по степени гормонального патоморфоза (полученный биоптат сравнивают с исходным до лечения). Если степень патоморфоза достаточно выражена, считается, что опухоль гормоночувствительна и лечение прогностически эффективно. Следующие 2 мес больная получает по 500 мг 12,5% раствора 17-ОПК в/м 2 раза в неделю. Данный этап лечения завершается последующим еще 2-месячным введением 12,5% раствора 17-ОПК по 500 мг в/м уже 1 раз в неделю. Всего на курс лечения больная получает 23-28 г ОПК (с учетом ДДЭ).
В качестве лекарственных препаратов могут быть использованы не только 12,5% раствор 17-ОПК, но и провера и депо-провера, Наиболее удобны в применении таблетирован-ные формы типа проверы. Одна таблетка этого препарата содержит 500 мг медроксипрогесте-рона ацетата, таким образом дозы в схемах лечения остаются теми же.
Схема лечения больных начальными формами РЭ отличается большей интенсивностью. 1-й этап лечения длится приблизительно около года.
Больные ежедневно в течение 2 мес получают по 500 мг 12,5% раствора 17-ОПК в/м (ДДЭ 25-30 г), после чего оценивают чувствительность опухоли по морфологическим критериям и определяют прогноз гормонального лечения. Затем лечение ОПК продолжают по 500 мг в/м через день в течение 2 мес до достижения суммарной дозы 40-45 г (с учетом ранее полученной ДДЭ). После этого интенсивность гормонотерапии постепенно снижается таким образом, чтобы курсовая доза за год лечения составила 60-70 г ОПК.
1-й этап лечения заканчивается излечением онкологического заболевания, что должно быть подтверждено проведением гистероскопии и наличием атрофии эндометрия в соскобе матки по морфологическому заключению. Но гормональные расстройства, вызвавшие развитие опухоли, еще не устранены.
Следующий этап направлен на восстановление нормальных овуляторных менструальных циклов. В течение 6 мес искусственно создается менструальный цикл при помощи комбинированных гормональных препаратов 1-го и 2-го поколения (типа нон-овлон, овидон, ригевидон и т.д.). Это позволяет восстановить функциональную активность эндометрия. В дальнейшем возможно осуществление реабилитации яичниковой функции по индивидуальной программе.
У ряда больных овуляторные менструальные циклы восстанавливаются без медикаментозной терапии, иногда требуется индукция овуляции. При наличии синдрома склерокистозных яичников, подтвержденного эндоскопически, выполняют оперативное лечение в объеме клиновидной резекции яичников (лапаротомическим или лапароскопическим доступом).
Органосохраняющее лечение следует проводить под строгим динамическим наблюдением. Эндоскопический контроль с прицельной биопсией эндометрия показан после введения ДДЭ 17-ОПК, при достижении половинных курсовых доз, а также по завершении 1-го онкологического этапа, поскольку суждение о достижении атрофии эндометрия, т.е. излеченности, является чрезвычайно ответственным моментом.
Полноценная гормональная реабилитация подтверждается восстановлением фертильности пациенток. За время наблюдения у 35 женщин из 125 отмечено 40 беременностей, 24 из них закончились рождением здоровых детей, 6 - искусственными абортами, 9 - самопроизвольными выкидышами и 1 женщина находится во II триместре беременности. Сроки наблюдения за представленной группой больных колеблются от 2 до 25 лет. Более половины из них прослежены свыше 10 лет.
Им предлагается хирургическое лечение. Дискуссионным остается вопрос о необходимом объеме оперативного вмешательства. В настоящее время выполнение экстирпации матки с придатками является стандартом, однако удаление у молодых пациенток эндокриннозависимых органов (матки и яичников) неизбежно приводит к развитию кастрационного синдрома, требующего проведения длительной заместительной гормональной терапии для восполнения функции яичников. Благоприятное клиническое течение начального РЭ (G1, отсутствие инвазии в миометрий) позволяет у ряда женщин молодого возраста в плане функционально щадящего лечения сократить объем хирургического вмешательства до экстирпации матки без яичников.
За период с 1993 по 2003 г. операция выполнена 50 молодым женщинам: 31 по поводу начального РЭ (!а стадия) и 19 с АГЭ, соответствующей дисплазии эпителия III степени. Средний возраст больных 36,2 года. Сроки наблюдения за пациентками составляют от 1 до 10 лет. При комплексном обследовании данных за поражение гонад и про-грессирование заболевания за время наблюдения не получено. Таким образом, с одной стороны, из организма женщины удаляется орган-мишень - опухолевоизмененный эндометрий, с другой, пациентка избегает кастрационного синдрома, что значительно улучшает ее послеоперационную реабилитацию и качество жизни.
В отличие от электрической основным недостатком лазерной аблации является отсутствие материала для последующего морфологического исследования, что существенно ограничивает ее применение в онкологии. К настоящему моменту известны следующие электрохирургические техники деструкции слизистой оболочки матки: резекция, коагуляция и вапоризация. Каждая из этих методик имеет свои преимущества и недостатки, что позволяет хирургу выбрать наиболее оптимальный и приемлемый способ деструкции в каждом индивидуальном случае.
Существуют разные модификации электродов, различающиеся по форме, каждая из которых имеет свое предназначение.
За период с 1999 по 2003 г. в МНИОИ абла-ция эндометрия выполнена 59 больным, находящимся в пре- и постменопаузе: 34 с АГЭ с диспла-зией эпителия III степени и 25 по поводу начального РЭ (Ia стадия).
Деструкцию эндометрия осуществляли без предварительной гормональной подготовки, при этом резекцию эндометрия провели 14 пациенткам, коагуляцию - 29, а вапоризацию слизистой матки - 16.
После проведенного лечения у 42 пациенток зафиксирована аменорея, у 17 - гипоменструаль-ный синдром. Сроки наблюдения за больными составили от 1 мес до 5 лет. На сегодняшний день в процессе динамического наблюдения при комплексном обследовании (УЗИ, гистероскопия, морфологическая верификация аспиратов и биопта-тов из полости матки) рецидив заболевания выявлен у двух пациенток, им выполнена экстирпация матки с придатками.
По истечении 6 мес с момента проведения аблации эндометрия всем пациенткам с целью определения состояния внутренней поверхности матки выполняли контрольную гистероскопию с прицельной биопсией эндометрия, при которой отмечали выраженные грубые внутриматочные синехии, устья маточных труб, как правило, не определялись, были облитерированы.
Морфологическое заключение, свидетельствующее о сохранившейся патологической трансформации, т.е. об отсутствии эффекта от проведенного гистерорезектоскопического лечения, являлось основанием для осуществления повторной аблации, необходимость в которой возникла у двух пациенток. На различных сроках после абла-ции эндометрия 10 пациенткам из 59 выполнена экстирпация матки с придатками. У двух из них показанием к операции стал выявленный рецидив заболевания, у трех - прогрессирующий аденоми-оз, у двух - продолженный рост миомы, у трех - психологический фактор (мнительность пациенток в связи с возможным развитием рецидива заболевания именно у них).
При гистологическом исследовании удаленных маток пациенток, ранее подвергшихся деструкции эндометрия, у двух больных выявлены микроочаги высокодифференцированной аденокар-циномы в пределах эндометрия, у остальных восьми отмечены микроучастки атрофичного эндометрия без признаков дисплазии на фоне выраженного фиброзного компонента.
Оставаясь до некоторой степени спорной операцией, аблация эндометрия как метод лечения начального РЭ завоевывает все большую популярность как среди врачей, так и среди больных. С точки зрения пациенток операция благоприятна в психоэмоциональном плане, так как позволяет им излечиться от онкологического заболевания, сохранив при этом матку - орган, олицетворяющий для многих женское начало. С точки зрения врачей основными преимуществами операции являются высокая эффективность, хорошая переносимость, значительно меньшее количество осложнений по сравнению с гистерэктомией, минимальная травматичность, быстрое восстановление трудоспособности, более высокая экономичность (в частности, благодаря значительному уменьшению числа послеоперационных койко-дней) и уменьшение длительности операции (длительность аблации эндометрия варьирует в пределах 20-40 мин).
В заключение хотелось бы еще раз отметить, что эффективность проведенного лечения зависит не от того, какой из перечисленных методов будет применяться в лечении начального РЭ, а от того, насколько информативны будут результаты диагностического поиска, позволяющие точно установить наличие и истинную распространенность опухолевого процесса.
Ввиду высокой ответственности за жизнь и здоровье пациентки органосохраняющее и функционально щадящее лечение больных с начальным РЭ должно выполняться в специализированных онкологических учреждениях под строгим динамическим наблюдением.
О.В. Чулкова, Е.Г. Новикова, С.М. Пронин
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Берштейн Л.М. Гормональный канцерогенез. С.-Пб., Наука; 2000.
2. Бохман Я.В., Волкова А.Т., Чепик Щ.Ф. и др. Возможно ли излечение рака эндометрия I стадии без операции и лучевой терапии? В кн.: Гормонотерапия рака эндометрия. Под ред. Я.В. Бохмана, Я. Бонтэ, А.С. Вишневского и др. НИИ онкологии им. Н.Н. Петрова РАМН. С.-Пб., Гиппократ; 1992. с. 119-27.
3. Востров А.Н. Комплексная ультразвуковая диагностика рака эндометрия. Ав-тореф. дис. . канд. мед. наук. М.; 2002.
4. Морфологические особенности предрака и начальных форм рака тела матки. Методические рекомендации. Под ред. проф. Г.А. Франка, докт. мед. наук Т.А. Белоус, канд. мед. наук Н.В. Соколовой. М., 1991.
5. Новикова Е.Г., Чулкова О.В. Роль гистероскопии в диагностике и мониторинге за больными раком эндометрия. В сб.: Эндоскопия в диагностике и лечении патологии матки. Ч. 2. М.; 1997. с. 114-5.
6. Новикова Е.Г., Чиссов В.И., Чулкова О.В. и др. Органосохраняющее лечение в онкогинекологии. М., ВИ-ДАР-М; 2000.
7. Саркисов С.Э. Гистероскопическая эндохирургия матки. Автореф. дис. . докт. мед. наук. М.; 1999.
8. Чекалова М.А. Ультразвуковая диагностика злокачественных опухолей тела матки. Автореф. дис. . докт. мед. наук. М.; 1998.
9. Новикова Е.Г., Чулкова О.В., Пронин С.М. Предрак и начальный рак эндометрия у женщин репродуктивного возраста. М., МИА; 2005.
10. Benshushan A. Endometrial adenocarcinoma in young patients: evaluation and fertility-preserving treatment. Eur J Obstet Gynecol Reprod Biol 2004;117(2):132-7.
11. Mazzon I., Corrado G., Morricone D., Scambia G. Reproductive preservation for treatment of stage IA endometrial cancer in young women: hysteroscopic resection. Int J Gynecol Cancer 2005;15(5):974-8.
12. Lee T.S., Jung J.Y., Kim J.W. et al. Feasibility of ovarian preservation in patients with early stage endometrial carcinoma. Gynecol Oncol 2007;104(1):52-7. Epub 2006 Aug 2.
13. Kaku T., Yoshikawa H., Tsuda H. et al. Conservative therapy for adenocarcinoma and atypical endometrial hyperplasia of the endometrium in young women: central pathologic review and treatment outcome. Cancer Lett 2001;167(1):39-48.
Читайте также:

