Оценка эффективности лучевой терапии рака шейки

Рак шейки матки (РШМ) остается одной из наиболее распространенных форм новообразований, занимая 7-е место среди всех злокачественных опухолей и 3-е место среди раков у женщин. [9]. Несмотря на визуальную локализацию, РШМ III - IV стадий выявляется у 38,9% больных, что свидетельствует о трудностях в диагностике и проведении адекватного лечения [2, 10]. Проблема лечения РШМ в течение многих десятилетий продолжает оставаться в центре внимания ведущих отечественных и зарубежных онкологов, т.к. выбор эффективного метода лечения заболеваний этой локализации был и остается одним из актуальных вопросов [8, 7, 3]. К сожалению, несмотря на высокую информативность современных методов диагностики, при выявлении онкологической патологии и определении стадии заболевания при РШМ отмечается высокий процент диагностических ошибок [5, 6]. В связи с этим, важной задачей остается поиск путей кардинального улучшения диагностики ранних стадий заболевания, а также рецидивов опухоли или осложнений, развившихся в процессе лечения [7]. Это диктует необходимость использования технически сложных диагностических методов исследований, высококвалифицированной трактовки полученных результатов [4]. Широкое внедрение в клиническую онкологию трансвагинальной сонографии, с применением новых технологий визуализации: использование цветового и энергетического доплеровского картирования, трехмерной реконструкции и тканевых гармонических изображений открыло новые возможности эхографии в онкогинекологии. [3]. Однако это направление требует дальнейших разработок и уточнения данных о современных возможностях метода при первичной диагностике, а также определения четких допплерографических критериев эффективности противоопухолевого лечения РШМ на этапах мониторинга [1].
Цель исследования - выявление объективных сонографических признаков оценки эффективности лучевого лечения РШМ на этапах ультразвукового мониторинга.
Материалы и методы исследования
Методика исследования заключалась в том, что у больных РШМ до начала лечения определяли размеры шейки матки в стандартных проекциях, объем шейки матки, размеры и объем очага поражения, показатели кровотока в маточных артериях и качественную картину опухолевой ангиоархитектоники, затем эти данные дополняли количественными характеристиками внутриопухолевого кровотока - артериальная максимальная систолическая скорость - Vmax, в цветовом и энергетическом допплеровском режимах. Ультразвуковое исследование повторяли по окончанию курса противоопухолевой терапии в динамике.
Результаты исследования и их обсуждение.
Нами определены четкие, динамические допплерографические критерии оценки эффективности противоопухолевого лечения при раке шейки матки [4]. Полученные ультразвуковые показатели сравнивали и установили, что достоверными сонодопплерографическими признаками положительной динамики РШМ, на этапах лучевого лечении, были уменьшение размеров и объема шейки матки и опухолевого субстрата, изменение центральной гемодинамики в нисходящих ветвях маточных артерий до пределов возрастных нормативов, отсутствие или уменьшение визуализации количества сосудистых структур в опухоли, снижение количественных показателей внутриопухолевого артериального кровотока Vmaх. Уменьшение максимальной систолической скорости внутриопухолевого кровотока (Vmax) на 35% и более констатировали эффективность лечения, при уменьшении Vmax менее чем на 35% от исходной констатировали стабилизацию процесса, при увеличении Vmax более чем на 35% от исходных значений определяли прогрессирование процесса. Увеличение количества сосудистых локусов в контрольном объеме, наличие патологических низкорезистентных сосудистых спектров в шейке матки, с образованием артерио-венозных, артерио-артериальных анастомозов, увеличение показателей гемодинамики в нисходящих ветвях маточных артерий от возрастных нормативов, также свидетельствовали о прогрессировании заболевания.
Пример клинического применения: Больная Е., 1960 года рождения. Диагноз: рак шейки матки T3NxMo. Диагноз верифицирован цитологически (инфильтрирующий плоскоклеточный рак). УЗИ проводилось до начала лечения и после окончания курса противоопухолевой терапии. Пациентка получила суммарную дозу облучения на точку А 24 Гр. И на точку В 40 Гр. Шейка матки до начала лечения увеличена, размерами 4,13х4,49х5,62 см, объемом – 54,57 см3, на всем протяжении определяется объемное новообразование инфильтративного типа, пониженной эхогенности, неоднородной эхо-структуры с неровными контурами, размерами 3,74х4,3х5,22 см3, объемом 43,96 см3. При ТВ ЦДК и ЭДК сосудов шейки матки определяется гиперинтенсивный патологический артерио-венозный кровоток, при ДМ опухолевого кровотока шейки матки в режимах ТВ ЦДК и ЭДК составила MAC 50,98 см/с.
После окончания курса противоопухолевой терапии при УЗИ органов малого таза – отмечается уменьшение размеров шейки матки до 2,97х3,03х4,06 см, объем – 19,1 см3, в верхней и средней трети шейки матки определяется объемное новообразование инфильтративного типа, пониженной эхогенности, неоднородной эхо-структуры с неровными контурами, размерами 1,77х2,28х2,06 см, объемом 6,04 см3. При ТВ ЦДК и ЭДК сосудов шейки матки определяется значительное уменьшение сосудистых локусов, при ДМ опухолевого кровотока шейки матки в режимах ТВ ЦДК и ЭДК составила MAC 18,75 см/с.
На рисунках 1-5 представлены эхограммы пациентки Е. до лечения и после противоопухолевой терапии
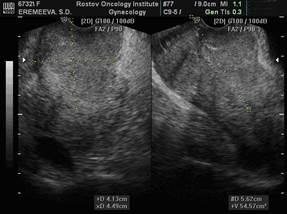
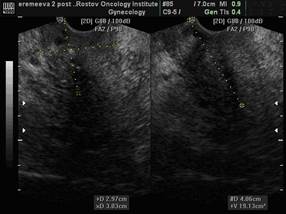
Рис. 1. Размеры шейки матки до и после лечения. ТВ-сканирование.
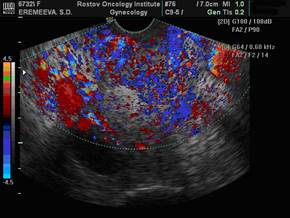
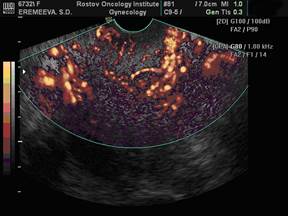
Рис. 2. Эхографическое изображение шейки матки в режимах ЦДК и ЭДК до лечения. ТВ-сканирование. Гиперинтенсивный патологический кровоток.
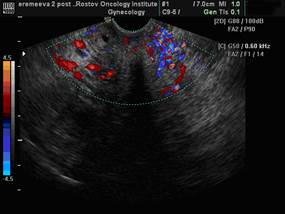
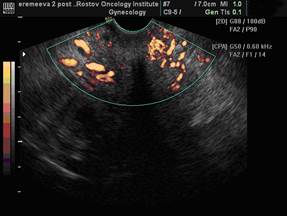
Рис. 3. Эхографическое изображение шейки матки в режимах ЦДК и ЭДК после лечения. ТВ-сканирование. Гипоинтенсивный патологический кровоток.
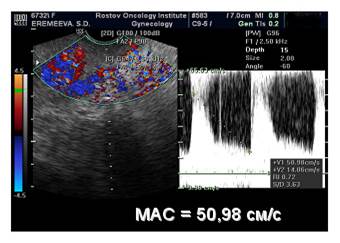
Рис. 4. Допплерометрия опухолевого кровотока шейки матки в режимах ТВ ЦДК и ЭДК до лечения 
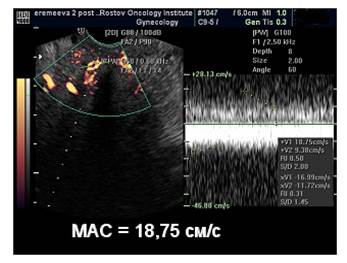
Рис. 5. Допплерометрия опухолевого кровотока шейки матки в режимах ТВ ЦДК и ЭДК после противоопухолевого лечения.
Нами установлено, уменьшение размеров и объема шейки матки, изменение центральной гемодинамики в нисходящих ветвях маточных артерий до пределов возрастных нормативов, уменьшение визуализации количества сосудистых структур в опухоли, уменьшение скорости внутриопухолевого кровотока более чем на 35% (Vmax - с 50,98 см/с до 18,75 см/с). Ввиду выраженного клинического эффекта у данной пациентки решено перейти к следующему этапу лечения - оперативному. Было выявлено, что первоначально при плоскоклеточном раке, скоростные показатели внутриопухолевой гемодинамики имели менее высокие значения по сравнению с низкодифференцированным раком. У 136 (85%) больных отмечалась инфильтрации параметральной и (или) паравезикальной, клетчатки в виде зон повышенной васкуляризации с асимметричными, множественными сосудистыми локусами, неправильной формы.
Нами установлено, что в результате разработанной и внедренной нами методике допплерографической оценки эффективности противоопухолевой терапии, регрессия опухоли подтверждена у 70% (112 больных), что в дальнейшем позволило провести радикальное хирургическое вмешательство, стабилизация процесса отмечалась у 25% (40 больных), резистентность к проведенному лечению составила 5% (8 человек).
Выводы
Таким образом, трансвагинальная сонодопплерография является высокоточным методом в уточняющей диагностике рака шейки матки, в процессе мониторинга на этапах лучевого лечения, а используемые нами методики дают объективную оценку эффективности лечения рака шейки матки и позволяют своевременно определить правильную тактику дальнейшего лечения. Чувствительность метода составила 87%.
Рецензенты:
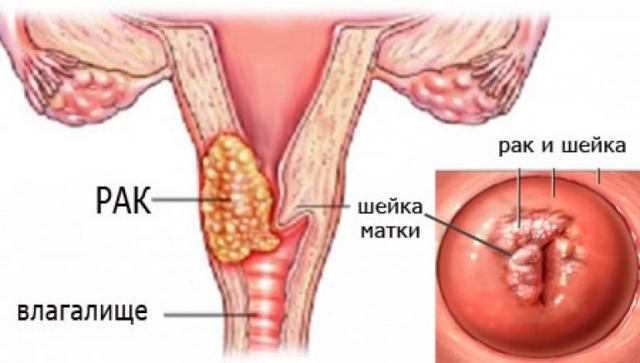
Рак шейки матки является одним из наиболее часто встречаемых злокачественных новообразований у женщин. Он возникает из плоского многослойного эпителия, покрывающего шейку матки. По типу опухоли рак шейки матки делится на:
- плоскоклеточный рак (70-80 % случаев);
- аденокарциному (10-20 % случаев);
- низкодифференцированный рак (примерно 10% случаев).
Факторы риска возникновения рака шейки матки:
- Вирус папилломы человека
- Раннее начало половой жизни (до 16 лет)
- Ранние роды
- Частая смена половых партнеров
- Курение
- Аборты
- Воспалительные заболевания половых органов
- Длительный прием гормональных контрацептивов
- Нарушение иммунитета
- Возраст от 40 до 50 лет (однако, рак шейки матки в мире молодеет и встречается у женщин в возрасте от 25 до 29 лет).
В настоящее время доказана прямая связь между раком шейки матки и вирусом папилломы человека (ВПЧ). Он выявляется более чем у 95% больных. ВПЧ типов 16, 18, 31, 33, 35 или 39, вызывают рак шейки матки. Передается ВПЧ преимущественно половым путем.
Профилактика:
- Предупреждение ранней половой жизни
- Отказ от курения
- Использование презервативов
- Исключение частой смены половых партнеров
- Вакцинация от ВПЧ (желательный возраст 10 – 25 лет, до начала половой жизни)
- Регулярные медосмотры у гинеколога с забором мазка на цитологию, а также кольпоскопия для выявления предраковых заболеваний шейки матки и ранних стадий рака шейки матки, которые могут быть полностью излечены.
Симптомы рака шейки матки. Что должно Вас насторожить?
Ранние стадии рака шейки матки протекают без проявления каких-либо симптомов, но если вы наблюдаете следующие изменения, необходимо обратиться к врачу:
- Выделения из влагалища беловатые с примесью крови
- Кровеносные выделения после полового акта или подъема тяжестей, возможно с неприятным запахом
- Кровотечение между менструациями
- Боли в нижней части живота, области крестца, поясницы
- Нарушение мочеиспускания, дефекации, боли в ногах, отек ног (при прогрессировании опухоли).
Каждый из вышеописанных симптомов может быть вызван другой причиной. Но для исключения возможности возникновения рака шейки матки, нужно пройти обследование у гинеколога.
Диагностика
Диагностика начинается с визита к гинекологу, который проведет осмотр шейки матки на предмет наличия изменений, возьмет мазок на цитологическое исследование (тест Папаниколау) и проведет кольпоскопию с помощью специального оптического прибора (кольпоскопа), увеличивающего в разы исследуемую область, для выявления видимых патологических очагов. При этом может браться небольшой кусочек ткани – биопсия – для гистологического анализа.
В случае подтверждения рака – проведение дополнительных исследований (КТ, МРТ, УЗИ органов малого таза) для определения стадии опухолевого процесса, т.е. уточнение размеров, локализации и распространенности заболевания.
Лечение
Что влияет на выбор типа лечения, подходящий именно ВАМ?
- Стадия опухолевого процесса.
- Наличие или отсутствие других заболеваний. Будьте честны с доктором. Некоторые заболевания являются противопоказанием для проведения того или иного вида лечения.
- Ваш возраст.
- Риск осложнений от того или иного вида лечения.
Хирургический метод лечения
Как правило, хирургическое лечение применяется на ранних стадиях заболевания, когда процесс максимально локализован и не требует дополнительной терапии. Но, в случае наличия сопутствующих заболеваний, являющихся противопоказанием к операции, очень успешно используют лучевую терапию.
Во время операции может быть удалена часть шейки матки вместе с опухолью, а при более распространенных заболеваниях целиком шейка матки и сама матка.
Лучевая терапия
При лечении рака шейки матки используется два вида лучевой терапии: дистанционная и внутриполостная. Часто эти два вида терапии применяются в сочетании. В этом случае, дистанционная лучевая терапия направлена на область тазовых лимфатических узлов, а внутриполостная – а первичный опухолевый очаг.
В 75% случаев рака шейки матки лучевая терапия является основным или единственным методом лечения.
Стандартом дистанционной радиотерапии является конформная лучевая терапия, которая подразумевает облучение опухоли в пределах ее границ. Перед лечением пациент проходит топометрическую подготовку, в ходе которой с помощью КТ, МРТ или ПЭТ определяют конфигурацию и точную локализацию новообразования, вовлечение соседних анатомических структур, метастазирование в лимфатические узлы.
Дистанционно облучают не только первичную опухоль, если она не была удалена хирургически, но и окружающие ее ткани — параметрий, крестцово-маточные связки региональные лимфатические узлы.
Внутриполостное облучение, или брахитерапия рекомендована как обязательный этап лечения. Суть метода заключается в имплантации радиоактивного препарата непосредственно в ткани, например, в культю влагалища. При этом локальный объем облучения, который обеспечивается одной процедурой, практически эквивалентен общей дозе, полученной при дистанционной терапии.
Современные аппараты лучевой терапии позволяют облучить пораженную зону, не затрагивая близ расположенные здоровые органы и ткани. Это дает возможность избежать поздних лучевых реакций и сохранить качество жизни после перенесенного лечения. Во время облучения происходит постепенное воздействие на пораженную область определенной дозы радиации, в результате чего раковые клетки гибнут.
Одним из таких современных аппаратов является аппарат томотерапии TomoTherapy серии TomoHD, который благодаря своим конструктивным особенностям и заложенным в него физическим характеристикам позволяет максимально конформно подвести лечебную дозу радиации и минимизировать лучевое воздействие на мочевой пузырь, прямую кишку, яичники, сохраняя их функции. Отсутствие лучевых повреждений ведет к лучшей переносимости лечения, быстрому восстановлению организма и сохранению качества жизни.
Стоимость лечения рака шейки матки
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | 0 | шт. |
| Консультация врача детского онколога | 0 | шт. |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
Химиотерапия
Химиотерапия для лечения рака шейки матки, как правило, применяется при распространенных метастатических процессах. Чаще она используется в сочетании с лучевой терапией для усиления радиочувствительности опухоли.
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Лучевая терапия — наиболее важный терапевтический метод лечения карциномы шейки матки. Этим методом вылечивается много пациенток, включая даже тех, у кого болезнь находится на более поздних стадиях, а также больных с рецидивами опухоли. Применяется как внутреннее (внутриполостное), так и внешнее облучение. Разработка метода внутриполостно-го облучения радием представляет собой важный исторический этап на пути развития техники радиотерапии. Однако с появлением современного оборудования основная роль перешла к внешнему облучению.
Вообще говоря, внутриполостное облучение чаще применяется на ранних стадиях развития опухоли, а облучение внешним пучком в основном на более поздних стадиях. Для некоторых пациенток с симптоматикой, характерной для ранних стадий заболевания, метод внутрипо-лостного облучения может оказаться неприемлемым, особенно вследствие местных анатомических особенностей, по причине узости свода влагалища или облитерации устья шейки матки опухолью.
При внутриполостном облучении в матку вводится аппликатор с источником излучения, содержащим радиоактивный элемент (обычно радиоактивный цезий, более подходящий по своим характеристикам, чем радий). В области бокового свода влагалища источник примыкает к шейке. В большинстве клиник аппликатор вводится под общей анестезией, хотя в некоторых случаях достаточной оказывается местная или эпидуральная анестезия. В настоящее время широко используется технология дистанционной автоматической загрузки источника (техника after-loading).
Вначале вводятся пластиковые аппликаторы, поддерживающие контейнеры для внутриматочного облучения и облучения свода влагалища. Радиоактивные источники помещаются на свои места только после того, как пространственное расположение аппликаторов полностью отрегулировано. Эта техника обеспечивает типично грушевидную форму распределения изодоз. При такой форме распределения матка шейка и верхняя часть влагалища получают максимальную дозу облучения. Парацервикальные и параметральные области, а также некоторые регионарные лимфоузлы получают меньшую, хотя довольно значительную, дозу радиации. Обычно при дозиметрических расчетах используются две точки, обозначаемые А и В.
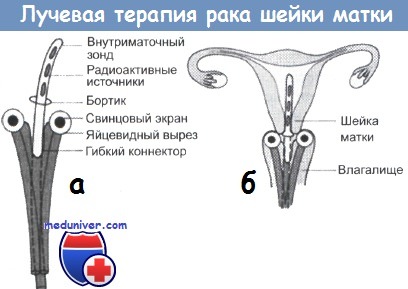
Схематическое изображение типичного аппликатора, применяющегося при внутри полостном облучении карциномы шейки матки с использованием техники after-loading:
(а) составные части;
(б) положение в органе.
Хотя особенности анатомического строения внутренних половых органов часто затрудняют расчет доз по этим стандартным точкам, они широко используются в качестве так называемых точек учета. Точка А находится на расстоянии 2 см от средней линии цервикального канала, и в 2 см выше по отношению к боковому своду влагалища. Точка В смещена на 3 см вбок от точки А (т. е. располагается на расстоянии 5 см от средней линии вдоль той же основной оси).
Существует большое количество аппликаторов, некоторые из которых предназначены для одноразового применения. В большинстве случаев, при облучении с малой мощностью дозы аппликатор остается на месте в течение 2-3 дней, хотя чаще используется облучение с высокой мощностью дозы. Для этого облучения используются такие приспособления как Катетерон или Микро Селектрон. Эта техника позволяет проводить автоматический дистанционный контроль процедуры загрузки источника (Со60 или Ir192) после установки аппликатора. При этом процедура проводится быстрее, пациентка чувствует себя комфортнее, а риск облучения персонала сводится к минимуму.
При совместном облучении внешним пучком и внутриполостном облучении доза, приходящаяся на область таза, составляет обычно 40-50 Гр (полученные за 4-5 недель или за эквивалентный промежуток времени). Может быть также показано дополнительное облучение параметральной области. В ряде медицинских центров проводится облучение в больших дозах. Схема облучения, предусматривающая использование нескольких полей, обычно лучше переносится больными. Типичный размер поля составляет 15 х 15 см. Он вполне достаточен для облучения первичной опухоли и локальных лимфатических узлов. Хотя можно применять экранирование, облучение больших участков тонкого и толстого кишечника, включая прямую кишку, часто оказывается неизбежным.
Вообще говоря, облучение тазовой области ограничивается возможностью радиационного поражения этих органов. Особенно целесообразно применять внешнее облучение на поздних стадиях заболевания (стадии III и IV). После этого у пациенток часто снимаются болевые ощущения, прекращаются кровотечения и выделения. Иногда в результате уменьшения размера опухоли удается провести дополнительное внутриполостное облучение.
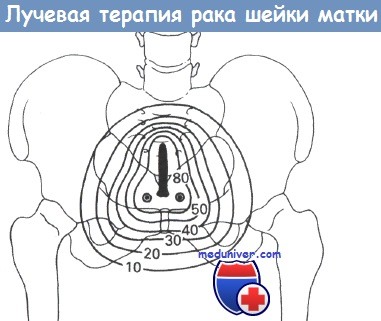
Типичное распределение изодоз от внутриполостного цезиевого источника при проведении курса лучевой терапии по поводу цервикальной карциномы.
Поглощенные дозы в Гр обозначены цифрами.
Хотя комбинированная терапия с применением внутриполостного и внешнего облучения используется часто, ее эффективность, судя по оценкам разных центров, различна. Наиболее эффективно внутриполостное облучение на ранних стадиях заболевания. В случаях более поздних стадий, особенно при распространении опухоли на боковую тазовую стенку, внешнее облучение области таза с большей вероятностью может привести к излечению. При совместном применении внешнего и внутреннего облучения, как это имеет место в большинстве случаев, некоторые радиологи предпочитают традиционный подход, при котором вначале проводится внутриполостное облучение.
В то же время растет число сторонников первоочередного применения облучения внешним пучком. Известны случаи, для которых попытка введения радиоактивного источника оказывается безуспешной. Это происходит в случае, если опухоль достигла больших размеров. В какой-то степени такое препятствие можно удалить при внешнем облучении.
Хотя по мере развития радиационной биологии и совершенствования техники последствия облучения могут быть существенно ослаблены, избежать их полностью невозможно. К числу ранних последствий лучевой терапии относится диарея, анорексия, тошнота, развитие в основном влажных, а также сухих эритем, и шелушения кожи. Эти последствия поддаются контролю с помощью симптоматической терапии. После внутриполостного облучения могут наблюдаться случаи проктита и/или цистита.
Более существенными являются поздние осложнения, такие как хронический проктосигмоидит, повреждения тонкой кишки и образование ректовагинальных или везикуловлагалищных фистул, которые требуют проведения дополнительных операций на кишке или на мочепроводящих путях. Часто наблюдаются хронические поражения кожных покровов (гиперфиброз, депигментация, телеангиэктазия), хотя они редко вызывают серьезные последствия. После сеанса радиотерапии верхний участок влагалища обычно становится сухим и сужается. Половая жизнь при этом возможна, но необходимо пользоваться смазывающими кремами. С другой стороны, после радикальной хирургической операции влагалище укорачивается без нарушения секреторной функции. Частота сеансов облучения определяется необходимой дозой радиации и используемой техникой.
Последствия радиотерапии проявляются даже в тех случаях, когда лечение проводит опытный радиолог. Дело в том, что радиочувствительность злокачественных опухолей мало отличается от чувствительности здоровых тканей к облучению. Поэтому величина дозы облучения при лучевой терапии определяется радиочувствительностью окружающих органов, таких как мочевой пузырь, кишечник, почки и кожа. К счастью, поскольку методы дозиметрии и техника облучения совершенствуются, тяжелые осложнения, такие как фистулы и некрозы, сейчас наблюдаются гораздо реже, чем раньше.
В последнее время прогнозируемость исхода заболевания локальной формой рака значительно улучшилась благодаря широкому применению химиотерапии и лучевого метода лечения. По схеме лечения, наиболее широко распространенной в Великобритании, пациенткам, находящимся в стационаре, ежедневно назначается цисплатин в умеренной дозе, которая хорошо переносится большинством из них. Проведено несколько рандомизированных исследований, которые выявили очевидные преимущества такой схемы лечения, несмотря на некоторое ухудшение переносимости препарата.
Лечение рецидивов рака шейки матки. Для пациенток с рецидивами локальной опухоли, которые наблюдаются после лучевой терапии и не осложнены метастазами, единственной возможностью вылечиться может быть экзентерация тазовой области. Это сложная операция, при которой полностью удаляется все содержимое области таза, обычно включающее прямую кишку и мочевой пузырь, с последующей колостомией и илеостомией. Для выполнения столь сложной операции подготавливается лишь несколько хирургов, и проводится она только на тщательно отобранном контингенте больных.
С.А.Тюляндин, май 1999
Несмотря на возможности ранней диагностики и профилактики предопухолевых состояний эпителия шейки матки ежегодно в России диагностируется около 12000 новых случаев плоскоклеточного рака шейки матки. Более того, у 40% больных заболевание диагностируются в поздних (III-IV) стадиях.(1)
Лучевая терапия всегда считалась наиболее эффективным методом лечения больных с распространенным процессом (IB-IVA).(2) С ее помощью 5-летняя выживаемость больных достигала 65% и варьировала от 15 до 80% в зависимости от степени распространения опухолевого процесса. Прогрессирование процесса в области малого таза является наиболее частой причиной смерти больных с распространенным раком шейки матки. Хотя проведение лучевой терапии с использованием повышенных доз облучения ведет к уменьшению частоты местного прогрессирования, лучевое повреждение тканей и органов малого таза лимитируют возможности дальнейшего увеличения дозы.
Другим перспективным подходом к повышению эффективности лечения больных раком шейки матки является совместное использование лучевой терапии и химиотерапии. Такой подход имеет ряд теоретических обоснований.(3) Противоопухолевые препараты усиливают лучевое повреждение опухолевых клеток за счет нарушения механизма репарация поврежденной ДНК, синхронизации вступления опухолевых клеток в фазы клеточного цикла, наиболее чувствительные к лучевому повреждению, уменьшения числа опухолевых клеток, находящихся в фазе покоя, и способности убивать резистентные к облучению опухолевые клетки находящиеся в гипоксиии. Кроме того, сами противоопухолевые препараты обладают цитостатическим эффектом не только в отношении первичной опухоли и региональных метастазов, но и способны контролировать имеющиеся отдаленные метастазы. Таким образом, совместное применение лучевой терапии и химиотерапии должно повысить противоопухолевый эффект лечения больных раком шейки матки.
В исследовании Keys и соавт. больные раком шейки матки IB стадии (при наличии подозрения на увеличенные региональные лимфоузлы по данным компьютерной томографии требовалась пункционная биопсия) на первом этапе получали либо лучевую терапию, либо лучевую терапии совместно с цисплатином.(4) Суммарная доза облучения на параметрий составляла 75 Гр и на стенки таза 55 Гр. Цисплатин в дозе 40 мг/м2 вводили еженедельно в течение 6 недель, в течение которых проводилась лучевая терапия. В последующем всем больным выполняли гистерэктомию. В исследование было включено 183 больных, которые получали химиолучевое лечение и 186 пациенток, которым проводили только облучение. Совместное назначение лучевой терапии и цитостатиков обладало хорошей переносимостью и не привело к увеличению продолжительности лечения, которое составило 50 дней в обеих группах. Однако, химиолучевое лечение значительно уменьшило частоту местного прогрессирования (16% по сравнению с 39% в группе лучевой терапии), что привело к значительному увеличению продолжительности жизни. Показатели 3-летней выживаемости составили 84% и 74% в группе химиолучевого лечения и лучевой терапии соответственно (р.=0.008). Совместное применение облучения и цитостатиков уменьшили риск смерти от рака шейки матки на 46% ( Таблица 1 ).
Второе исследование посвящено лечению рака шейки матки в более поздних стадиях (IIB, III, IVA) у 526 больных, которым проводилась лучевая терапия с одновременным назначением гидроксимочевины (Гидреа) 3 г/м2 2 раза в неделю внутрь 6 недель (1 группа), либо цисплатина в дозе 40 мг/м2 еженедельно 6 недель (2 группа), либо комбинации цисплатина 50 мг/м2 1 и 29 дни, 5-фторурацила 4г/м2 в/в инфузия в течение 96 часов 1 и 29 дни и гидроксимочевины 2 г/м2 внутрь 2 раза в неделю 6 недель(3 группа).(5) Дистанционная лучевая терапия проводилась до суммарной дозы 40,8 Гр (24 фракции) или 51 Гр (30 фракций) с последующим проведением через 3 недели брахитерапии в дозе 40 Гр при стадии IIВ или 30 Гр при стадии III-IVA. Таким образом суммарная очаговая доза на шейку матки и параметрий составила 80,8 Гр (стадия IIB) или 81 Гр (стадия III-IVA) и на стенки таза 55 Гр и 60 Гр соответственно при общей продолжительности лечения 63 дня. Двухлетняя безрецидивная выживаемость была значительно выше в группах больных, получавших цисплатин (67% и 64%), по сравнению с группой, получавшей гидроксимочевину (47%). Относительный риск смерти больных, получавших цисплатин только или в комбинации составил 0,61 и 0,58 соответственно ( риск смерти в группе гидроксимочевина был принят за 1), т.е. был уменьшен на 39% и 42% (Таблица 1). Принимая во внимание меньшую токсичность и простоту введения цисплатина по сравнению с комбинацией цисплатина, 5-фторурацила и гидроксимочевины, следует считать предпочтительным назначение цисплатина совместно с облучением.
В третье исследование было включено 388 больных раком шейки матки в стадии IB-IV, которым проводилась дистанционная лучевая терапия на область малого таза до суммарной очаговой дозы 45 Гр (разовая 1,8 Гр) и через 2 недели после ее окончания брахитерапия радиоактивным цезием или радием так, что общая доза облучения на шейку матки составила 85 Гр.(6) Лучевая терапия была проведена 193 больным, а 195 пациенток одновременно получали химиотерапию цисплатином в дозе 75 мг/м2 1 день и 5-фторурацилом в дозе 4000 г/м2 постоянная в/в инфузия с 1- по 5 дни, подобный курс повторяли на 22 день и затем еще один одновременно с проведением брахитерапии. 5-летняя безрецидивная выживаемость составила 40% и 67% в группе лучевой и комбинированной терапии соответственно, 5-ти летняя общая выживаемость 58% и 73% соответственно (р.=0.004). Проведение химиотерапии значительно уменьшило частоту развития отдаленных метастазов ( 13% по сравнению с 33% в группе лучевой терапии) и риск смерти больных раком шейки матки на 48% по сравнению с лучевой терапией только (Таблица 1). Токсичность сочетания двух лечебных методов была умеренной.
Таким образом, представленные данные свидетельствуют о целесообразности совместного назначения лучевой терапии и химиотерапии у больных местнораспространенным раком шейки матки. Трудно сказать, какой режим химиотерапии должен быть рекомендован. Независимо от использованных цитостатиков добавление химиотерапии к лучевой терапии уменьшало риск смерти на 40% и более по сравнению с контрольной группой (Таблица 1). Очевидно, что гидроксимочевина значительно уступает цисплатину и комбинациям на его основе в потенциировании эффекта облучения. В отсутствии рандомизированных исследований о преимуществе какой-либо комбинации у этой группы больных может быть рекомендовано еженедельное введение цисплатина в дозе 40-50 мг/м2 как наименее токсичный режим. Следует продолжить поиск хорошо сочетающихся с лучевой терапией эффективных и малотоксичных комбинаций цитостатиков, в том числе с включением таким препаратов как ифосфамид, блеомицин, таксаны и т.д. Вероятно при разных стадиях заболевания добавление химиотерапии должно преследовать различные цели. Если на ранних стадиях химиотерапия в первую очередь должна потенциировать местный эффект лучевой терапии, то в более поздних стадиях заболевания назначение химиотерапии должно преследовать и подавление отдаленного метастазирования. Отсюда разница как в выборе цитостатиков, так и в интенсивности проведения химиотерапии.
Следует отметить, что улучшение результатов лечения больных раком шейки матки в трех приведенных исследованиях было достигнуто при одновременном сочетании облучения и химиотерапии. У больных раком шейки матки до недавнего времени пользовалось популярностью проведение неоадъювантной химиотерапии с последующим облучением или хирургическим лечением. В восьми из девяти опубликованных рандомизированных исследований применение неоадъювантной химиотерапии у больных раком шейки матки не улучшило результаты лучевого или хирургического лечения.(7) Поэтому сегодня назначение только химиотерапии больным местнораспространенным раком шейки матки на первом этапе лечения противоречит результатам проведенных научных исследований.
Похоже, что длительный период ‘застоя’ в лечении больных раком шейки матки закончился. Определена перспективная стратегия лечения этого заболевания, предполагающая одновременное проведение химиотерапии и лучевой терапии. Предстоит еще много сделать, чтобы оптимизировать комбинацию этих двух лечебных подходов как с точки зрения эффективности при различных стадиях заболевания, так и переносимости лечения.
1. Трапезников Н.Н., Аксель Е.М., Бармина Н.М. Состояние онкологической помощи населению стран СНГ в 1996 году. Москва, ОНЦ РАМН, 1997, 192 с.
2. Thipgen T, Vance RB, Khansur T. Carcinoma of the uterine cervix: current status and future directions. Semin Oncol 1994; v.21(2) (suppl 2): 43-54.
3. Rose PG. Locally advanced cervical carcinoma: the role of chemoradiation. Semin Oncol 1994, v.21(1): 47-53.
4. Keys HM, Bundy BN, Stehman FB et al. Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Engl J Med 1999; 340:1154-1161.
5. Rose PG, Bundy BN, Watkins EB et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. N Engl J Med 1999; 340:1144-1153.
6. Morris M, Eifel PJ, Lu J et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer. N Engl J Med 1999; 340:1175-1178.
7. Thomas GM. Improved treatment for cervical cancer -concurrent chemotherapy and radiotherapy. N Engl J Med 1999;340:1175-1178
Таблица 1.
Результаты рандомизированных исследований по совместному применению химиотерапии и лучевой терапии у больных раком шейки матки.
Читайте также:

