Новые подходы в лечении меланомы
2019. Наночастицы для доставки РНК-вакцин помогли остановить меланому

Перепрограммирование иммунных клеток с помощью РНК-вакцин - это очень перспективное направление в лечении рака. Но главной проблемой этого метода является сложность доставки РНК-молекулы в нужные клетки внутри организма. Профессор Дэниэл Андерсон из MIT придумал как создать наночастицы для доставки РНК. Он синтезировал тысячи наночастиц из липидов (жирных кислот) и выбрал наиболее те, которые имеют желаемые химические свойства, в частности, циклическую структуру на кончике наночастиц, которая, по-видимому, активирует стимулятор пути передачи сигналов генов интерферона (STING). Когда он активен, STING заставляет иммунные клетки вырабатывать цитокины, которые заставляют Т-клетки разрушать раковые клетки. Дэниэл протестировал свою систему доставки на мышах с меланомой, и ему удалось остановить рост опухоли.
2019. В Израиле разработали нановакцину против меланомы

Обычно меланому лечат с помощью химиотерапии, лучевой и иммунотерапии. А вот технологию вакцинации (которая хорошо зарекомендовала себя для лечения вирусных инфекций) - пока не научились использовать для этой задачи. Команда врачей из Медицинской Школы Саклера (Тель-Авив) под руководством профессорши Ронит Сачи-Файнаро (на фото) - решила устранить этот пробел. Они обнаружили 2 пептида, которые выделяются клетками меланомы, и которые могут служить целью для иммунных клеток. Запаковали эти пептиды в наночастицы и дали попробовать мышкам с меланомой. Говорят, если использовать эту вакцину в комбинации с иммунотерапией, иммунная реакция организма и результат лечения значительно улучшаются.
2018. Вакцина против меланомы продемонстрировала 100%-ную эффективность

Учёные из Научно-исследовательского института Скриппс в Сан-Диего (под руководством Дэйла Богера - на фото) разработали новую вакцину, которая - в сочетании с уже известным препаратом от меланомы (ингибитором PD-L1) - может не только вылечить агрессивную меланому, но и защитить пациента от рецидивов. По крайней мере, такой фокус удалось провести на мышах со 100% эффективностью. Секретом успеха оказалось вещество Дипровоцим, которое добавили в препарат PD-L1. Оказалось, что дипровоцим способствует выработке специализированных лейкоцитов, способных атаковать опухоли и уничтожать их. Учёные также подчёркивают, что применение вакцины с дипровоцимом не сопряжено с особыми сложностями. Чтобы добиться эффекта, лекарство не обязательно вводить непосредственно в первичную опухоль, достаточно двух внутримышечных инъекций с интервалом 7 дней.
2018. Фармагигант Bristol-Myers Squibb инвестировал $3.6 млрд в TIL-иммунотерапию рака
Американская фармакомпания Bristol-Myers Squibb инвестировала $3.6 млрд в совместный проект со стартапом Nektar Therapeutics, целью которого является вывод на рынок технологии иммунотерапии рака NKTR-214. Эта технология использует метод TIL (Tumor Infiltrating Lymphocytes) и нацелена на 9 типов рака, включающих меланому, рак почек, рак легких, мочевого пузыря и трижды-негативного рака груди. На видео показано, как TIL клетки (включающие в себя T-лимфоциты и NK-лимфоциты) способствуют развитию воспаления опухоли и, соответственно, развитию иммунной реакции организма против рака. Препарат NKTR-214 способствует размножению этих TIL-клеток.
2017. Персонализированная вакцина от рака прошла первую фазу клинических испытаний
Вакцина - это препарат, содержащий чужеродный агент, который вводится в организм и тренирует имунную систему организма на его уничтожение. Оказывается, с помощью вакцин можно бороться и против рака. Т.е. пациенту вводят взятые у него же раковые клетки с веществами, которые усиливают иммунный ответ. В 2013 году немецкая компания BioNTech начала клинические исследования пептидной вакцины от рака на пациентах с прогрессирующей меланомой. Результаты оказались обнадеживающими: у части больных после прививки опухоли исчезли. Однако в испытаниях принимало участие всего 19 человек, поэтому о высокой эффективности вакцины от рака говорить пока рано.
2017. Нанолекарство CelePlum-777 дает надежду на излечение меланомы

Новый препарат CelePlum-777, разработанный учеными Университета штата Пенсильвания - это комбинация молекул противовоспалительного лекарства Celecoxib и токсина Plumbagin, которые скрепляются при помощи наночастицы. Нагружать наночастицы несколькими препаратами сразу - новаторский подход в доставке лекарства к раковым клеткам, объясняет профессор Рагхавендра Говда, один из разработчиков препарата. Сниженная концентрация активных препаратов оказывается более эффективной и менее опасной для пациента. В ходе испытаний CelePlum-777 успешно уничтожал раковые клетки в пробирке и опухоли у подопытных мышей. Побочных эффектов замечено не было. Но прежде чем начать клинические испытания на людях, препарат должен будет пройти еще серию тестов.
2015. Впервые вирус сертифицировали для лечения рака
Раковые клетки (как ни странно) беззащитны против вирусов. Поэтому вирусотерапия (лечение рака вирусами) считается одним из наиболее перспективных методов лечения рака. Однако, до сих пор не удавалось создать вирус, который убивал бы только раковые клетки, а не все подряд. До сих пор, потому что на днях американские и европейский регуляторы впервые сертифицировали метод вирусотерапии, основанный на модифицированном вирусе герпеса T-VEC для лечения меланомы (рака кожи). Генетические изменения кода этого вируса сделали его неспособным к нападению на обычные здоровые клетки, таким образом, заражение таким вирусом не приводит к появлению герпеса. Более того, в код вируса внедрен код для производства белка GM-CSF, наличие которого стимулирует естественную иммунную систему организма. Проведенные клинические испытания показали, что применение этого вируса позволиляет существенно уменьшить размеры злокачественных опухолей и удлинить срок жизни тяжелых больных на достаточно значимое время.
2014. Искусственный интеллект IBM диагностирует рак кожи за 1 секунду с точностью выше 95%
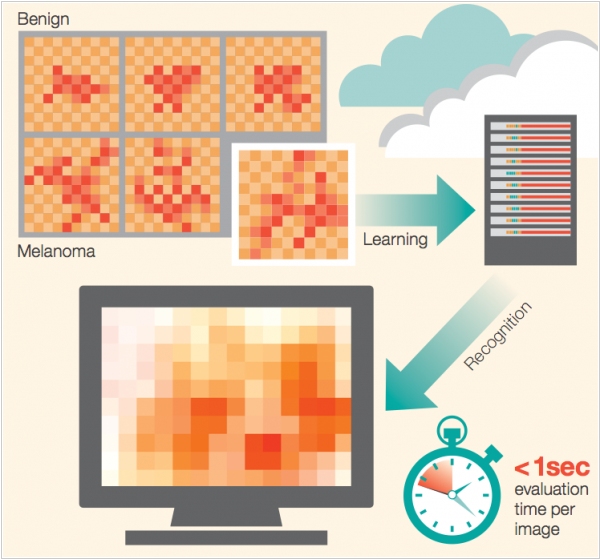
Даже с использованием всех современных компьютерных технологий уровень точности диагностирования рака кожи на данный момент составляет где-то 75-84%. IBM разработала самообучаемую систему, которая (пройдя обучение на 3000 примерах случаев меланомы) научилась это делать с точностью как минимум 95%. Причем на обработку одного снимка кожи уходит около 1 секунды. И это уже не просто научные испытания. Крупнейший в США (и в мире) Онкологический центр Memorial Sloan-Kettering отныне будет использовать эту систему IBM. Известный суперкомпьютер IBM Watson (который тоже занимается диагностикой рака) в этом проекте не используется.
2014. Лекарство Keytruda меняет правила игры в лечении рака кожи
Новые эффективные лекарства появляются не так уж часто. Но за последние несколько дней произошло сразу два лекарственных прорыва. Недавно мы рассказывали о препарате LCZ696 для лечения сердечной недостаточности, а сегодня в США был сертифицирован препарат Keytruda, который называют революцией в лекарственном лечении меланомы (рака кожи). Разработала этот препарат американская фармацевтическая компания Merck. Принцип действия лекарства основан на блокировании белка иммунных клеток, который не дает им атаковать раковые клетки. Потенциально Keytruda может использоваться в лечении и других видов рака, при которых иммунная система способна распознавать раковые клетки, – рака легких, мочевого пузыря, головы и шеи.
2014. Флуоресцентная камера позволяет хирургу видеть раковую опухоль во время операции
Ткани с раковыми клетками визуально и тактильно ничем не отличаются от здоровых, поэтому при их хирургическом удалении врач может ориентироваться только на результаты томограммы. Поэтому ему приходится либо перестраховываться и вырезать "излишки", либо рисковать тем, что некоторые раковые клетки останутся в организме. В американском Мемориальном онкологическом центре им. Слоуна-Кеттеринга придумали (и успешно применяют для лечения меланомы) специальную систему подсветки раковых тканей. Перед операцией пациент принимает специальный биомаркер, который проникает в раковые клетки. Затем, во время операции, подсвечивают необходимый участок флуоресцентным фонариком с камерой, которая улавливает излучение маркера. При этом хирург видит на мониторе оперируемый участок, на котором раковые ткани отображаются зелененьким цветом.
2013. Esteya - новый аппарат для брахитерапии рака кожи
Шведская компания Elekta, известная своими линейными ускорителями и аппаратами Гамма-нож, получила сертификацию FDA на свою новую систему электронной брахитерапии для лечения рака кожи Esteya. Как известно, брахитерапия - это контактная лучевая терапия, обычно применяемая для лечения рака простаты. В случае с раком кожи обеспечить контакт излучателя с опухолью еще проще и для этого не нужно хирургическое вмешательство. Электронная брахитерапия использует компьютерные технологии для того, чтобы уменьшить излучение на здоровые части тела, а также сократить время воздействия лучевой терапии, направляя ее целенаправленно на опухолевые клетки. Представители компании говорят, что данная технология обеспечивает 95% вероятность выздоровления обработанной области кожи. При этом скорость лечения увеличивается в разы за счет того, что за одну процедуру можно обработать несколько участков кожи.
2011. MelaFind - прибор для точной диагностики рака кожи
Недавно мы рассказывали о мобильном приложении MelApp, которое позволяет (с помощью смартфона) заметить появление рака кожи на самой ранней стадии (чтобы превратить его лечение в косметическую процедуру). Но прибор MelaFind, который сегодня получил европейскую сертификацию - это кое-что покруче айфона. Это мощный сканер для спектрального анализа кожи плюс мощное программное обеспечение для интерпретации результатов сканирования. Когда вы приходите к врачу и у вас действительно ранняя стадия меланомы, врач может ее не заметить. Или может сказать "да, может быть, надо понаблюдать за динамикой роста". Но имея такой прибор, дерматолог сможет точно поставить диагноз и вы начнете лечение значительно раньше (либо перестанете волноваться).


— Заболеваемость и смертность, ассоциированные с меланомой кожи, в России, как и в мире в целом, растут из года в год. В нашей стране ежегодно диагностируется 11 тыс. новых случаев меланомы кожи. Этот рост в большей степени связан с изменением образа жизни людей. К сожалению, в настоящее время наблюдается высокий показатель запущенности меланомы кожи – 19% всех случаев меланомы выявляются на поздних (III–IV) стадиях. Более того, среди всех онкологических заболеваний именно метастатическая форма меланомы имеет наибольший риск распространения в центральную нервную систему. Частота метастазирования в головной мозг для данной нозологии достигает 43% по объединенным данным клинических исследований.
— Зачастую люди не знают, что у них развивается меланома. Из-за дефицита информации общество не осознает важность данной проблемы. Сейчас наша главная задача – добиться ранней диагностики меланомы кожи: заболевание на первой стадии хорошо поддается терапии, при второй стадии вероятность излечиться преобладает над вероятностью хронической болезни. Однако говорить о полном излечении при второй стадии нельзя.
При этом нужно понимать, что массовый скрининг в данном случае малоприменим: показатель заболеваемости – 7 человек на 100 000, именно поэтому на первую роль выходит информирование людей о заболевании и активная работа с врачами первичного звена – дерматологами, хирургами и терапевтами.
— Существует ассоциация специалистов по проблемам меланомы, которая имеет интернет-ресурсы, где представлена важная медицинская информации и для пациентов, и для их родственников. Главное – достоверность источника: информация о меланоме или другом онкологическом заболевании не должна искажаться. Иногда читаешь какую-нибудь статью в интернете, и волосы просто дыбом встают. Там совершенно не то, что на самом деле в жизни. Поэтому я призываю обращать внимание на достоверные источники информации.
В 2020 году планируется продолжение проекта после стабилизации эпидемиологической ситуации.
— Что сейчас нового в лечении метастастической меланомы кожи, удается онкологам повысить выживаемость в этой группе пациентов?
— Важным этапом в лечении онкологических заболеваний стало развитие иммуноонкологии. Меланома кожи – одна из тех локализаций, которая тяжелее всего поддается другим методам лечения: стандартная химиотерапия дает короткий ответ в 20% случаев, а пятилетняя выживаемость пациента при этом не превышает 5%. При использовании современных иммунотерапевтических препаратов этот показатель выше в разы. Это очень хороший результат в сравнении с результатами химиотерапии.
В апреле этого года Минздрав РФ одобрил применение первого российского противоопухолевого препарата Фортека® (МНН – пролголимаб), который предназначен для лечения пациентов с неоперабельной метастатической меланомой. Препарат стал первым российским оригинальным PD-1 ингибитором, представляющим собой моноклональное антитело изотипа IgG1 с Fc-фрагментом, модифицированным методом генной инженерии.
Механизм действия пролголимаба направлен на восстановление способности Т-лимфоцитов распознавать и уничтожать злокачественные клетки, в результате чего иммунная система человека может снова начать бороться с опухолью.
На протяжении десятилетий вера онкологов, да и простых людей, кто косвенно или напрямую коснулся проблемы рака, часто от безысходности сводилась к вере в таинственную силу самой иммунной системы. И вот наступило время, когда эта вера перестала быть слепой. Но для этого мысли человека пришлось пройти огромный путь от самой веры до создания препаратов, способных помочь иммунной системе осуществить наяву это чудо.
— Результаты были представлены компанией BIOCAD в прошлом году. В исследование MIRACULUM было включено 126 пациентов с нерезектабельной метастатической меланомой из России и Белоруссии. Полный или частичный ответ на терапию наблюдался у 48% пациентов с меланомой кожи, которые получали пролголимаб в режиме дозирования 1 мг/кг 1 раз в 2 недели в качестве первой линии терапии. У большинства ответивших на терапию ответ сохранялся на протяжении всего срока наблюдения. 12-месячная выживаемость без прогрессирования в данной группе пациентов составила 44,6%, а общая выживаемость достигла 71,8% Также исследование показало, что новый препарат обладает благоприятным профилем безопасности с низкой частотой отмены терапии из-за нежелательных явлений (3,2%).
— Достаточно высокая эффективность и благоприятный профиль безопасности. Этот метод может помочь больным, для которых химиотерапия и другие методы лечения не были эффективны.
— Разработка и создание новых молекул, клинические исследования и производство оригинального препарата в нашей стране является важным приоритетом. При этом терапия онкологических больных не будет зависеть от курса доллара и ввоза препаратов из-за рубежа. Вывод на рынок российских оригинальных продуктов говорит о том, что отечественные производители, научно-исследовательские институты, биотехнологические компании, как в случае с BIOCAD, способны сделать эту область более конкурентоспособной, а также развивать экспортный потенциал.
Ученые уверяют, что открыли принципиально новый способ справиться с меланомой, одним из самых агрессивных и смертоносных видов рака. Вдохновением для открытия, по их словам, послужила морская бактерия, которая способна стать мощным оружием в борьбе с этой опасной формой онкологии. Они надеются, что уже в ближайшем будущем смогут предложить пациентам с раком кожи эффективный препарат для лечения.
- Морская бактерия поможет бороться с меланомой
- Новые возможности
- Новое лекарство – в ближайшей перспективе
Морская бактерия поможет бороться с меланомой
По последним оценкам, в одних только Соединенных Штатах Америки в нынешнем году будут выявлены порядка 100 тысяч новых случаев заболевания меланомой, свыше семи тысяч человек станут жертвами этой разновидности рака. Чаще всего меланому диагностируют у пожилых людей, однако в последнее время она приобретает широкое распространение и среди молодых.
Ведущие клиники в Израиле



Новые возможности
Относительно недавно появился новый класс препаратов, которые показали свою эффективность в лечении меланомы. Речь идет об ингибиторах BRAF – гена, мутации которого чаще всего сопровождают опухоли кожи меланомного типа. Однако проблема в том, что почти половина пациентов не отвечают на терапию этими препаратами, а у тех, кто все же реагируют, в течение нескольких месяцев развивается устойчивость к ним, что делает лечение неэффективным.
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную цену на лечение.
Их работа стала своеобразным продолжением исследования, проведенного и обнародованного в 2014 году. В этом исследовании их коллеги изучали химическое вещество под названием серинихинон, которое они выделили из морской бактерии вида Serinicoccus. В ходе эксперимента, проведенного в лабораторных условиях, было доказано, что серинихинон способен избирательно разрушать клетки меланомы, стимулируя процесс клеточной гибели. Этой цели он достигает, атакуя белок дермицидин, который помогает опухоли защищаться от иммунной системы. В этом исследовании ученые впервые идентифицировали крошечную молекулу, способную поражать злокачественные клетки.
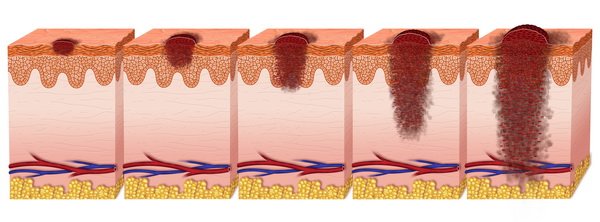
Стадии Меланомы
Разумеется, обнаружить химическое вещество, которое сражается со свободно плавающими в пробирке раковыми клетками, совсем не одно и то же, что изобрести лекарство, способное успешно бороться с раком у живого человека. Как отмечают сами ученые, преобразовать серинихинон в химиотерапевтический агент непросто. Это требует огромных усилий от людей, занятых в области медицинской химии, по созданию большого числа производных этого вещества, необходимых, чтобы усилить его лекарственные свойства.
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную смету на лечение.
Новое лекарство – в ближайшей перспективе
Недавнее исследование ученых приблизило их к созданию клинически применимого препарата. Им, в частности, удалось, определить структурные элементы молекулы серинихинона, которые и определяют его противораковую активность. Затем они видоизменили другие компоненты молекулы, чтобы сделать водорастворимой и облегчить процесс ее очищения. Оба этих свойства важны для превращения морской бактерии в эффективный лекарственный препарат.
И хотя нынешние усилия приблизили авторов к созданию пригодного для клинического применения препарата, впереди им предстоит еще много работы. Исследователи намерены продолжать идти к своей цели и уже работают над способами очищения и усиления действия производных серинихинона. Они надеются, что в конце концов смогут создать и вывести на рынок новое мощное лекарство против меланомы.
Невзирая на масштабы предстоящей работы, тот факт, что ученым удалось наметить новый эффективный способ борьбы с агрессивной формой рака кожи, сам по себе является значимым достижением.

Российские онкологи предостерегают граждан от чрезмерного пребывания на солнце и в солярии, особенно в летний период. Ультрафиолетовое излучение является одним из главных факторов, вызывающих рак кожи, а за последние 10 лет прирост пациентов с этим диагнозом в мире составил 30%.
— Светлана Анатольевна, специальная сессия, посвящённая меланоме кожи, стала одним из центральных событий IV международного онкологического форума.
— Еще несколько лет назад считалось, что рак кожи — это смертельное заболевание. Что-то изменилось с тех пор?
— Много ли больных меланомой в России и в мире, если есть статистика?
— В мире на протяжении последних десятилетий отмечается неуклонный рост заболеваемости меланомой кожи, в год выявляется более 200 тысяч новых случаев.
В России ежегодно регистрируются около 10 000 новых случаев меланомы кожи. Причём большинство заболевших — это люди трудоспособного возраста. К сожалению, в нашей стране около четверти всех пациентов на момент постановки диагноза имеют местно-распространённую или метастатическую форму заболевания (III-IV стадию), при которой прогнозы обычно неблагоприятны.
Результаты лечения и показатели выживаемости напрямую зависят от того, на какой стадии заболевания был диагностирован опухолевый процесс. Если на раннем этапе 5-летняя выживаемость превышает 90%, при второй стадии составляет около 65%, то при локально-регионарной, третьей стадии снижается до 45%, а при метастатической (четвертой стадии) составляет не более 20%.

— Кто, прежде всего, находится в зоне риска?
— Один из главных факторов риска развития меланомы кожи, по мнению исследователей, связан с избыточным воздействием ультрафиолетовых лучей, как на открытом солнце, так и в солярии. Шансы развития меланомы увеличиваются у людей с первым и вторым фототипом кожи (белокожий/рыжий, светлокожий), при котором образуется меньше всего защитного пигмента. Поэтому хочу призвать всех читателей: при малейшем подозрении немедленно обращайтесь к врачу. Выявление меланомы на ранней стадии — как правило, залог полного излечения. И, конечно, по-прежнему актуальная рекомендация: не злоупотребляйте естественным или искусственным ультрафиолетом!

— Насколько эффективно сегодня борются с меланомой в России? У нас свои препараты, методики лечения и химиотерапии или в основном зарубежные?
— В России сейчас зарегистрированы и применяются в клинической практике все современные противоопухолевые препараты для лечения меланомы кожи (таргетные, иммуноонкологические). Они могут использоваться как при монотерапии, так и в комбинации. Эффективность комбинированной терапии выше, но и частота побочных эффектов значительно увеличивается. Поэтому применение противоопухолевой терапии должно осуществляться строго по показаниям и только в специализированных онкологических учреждениях. Благодаря использованию современных препаратов удалось добиться увеличения выживаемости пациентов, как общей, так и без прогрессирования заболевания.
Конечно, в основном сегодня мы пользуемся импортными противоопухолевыми препаратами, однако в настоящее время есть и отечественные разработки. Сейчас проводятся клинические исследования двух лекарственных образцов. Мы с нетерпением ждём результатов!

Комбинация ингибитора иммунной контрольной точки и двух препаратов таргетной терапии блокирующих BRAF и MEK показывает многообещающую эффективность при меланоме, вызванной мутацией гена BRAF.
Таргетная терапия ингибиторами BRAF и MEK дает высокий уровень ответа у пациентов с меланомой, вызванной BRAF V600 , со средней продолжительностью лечебного эффекта приблизительно в один год. Блокирование же контрольной иммунной точки PD-1 дает более низкие показатели ответа, но с большой продолжительностью сохранения эффекта.
Выводы были сделаны на основании трех исследований, проведенных в различных онкологических центрах Европы и США.
Первое из трех проведенных исследований показало, что терапия, сочетающая ингибиторы BRAF и MEK с блокадой иммунной контрольной точки, может помочь группе пациентов с метастатической меланомой, вызванной BRAF V600 .
Второе рандомизированное исследование фазы II, описывает тестирование тройной комбинации ингибирования BRAF, MEK и PD-1 в качестве терапии первой линии у пациентов с меланомой с BRAF- мутацией. В нем демонстрируются длительные ответы и хорошая средняя выживаемость без прогрессирования заболевания (PFS).
Третье исследование доказывает, что лечение ингибиторами BRAF и/или MEK с последующим добавлением анти-PD-L1 иммунотерапии у пациентов с BRAF+ меланомой безопасно и обладает многообещающей противоопухолевой активностью.

Тестирование дабрафениба и траметиниба в комплексе с пембролизумабом при BRAF+ меланоме
Антони Рибас из Калифорнийского университета в Лос-Анджелесе, США и его коллеги в фоновом исследовании выявили, что доклинические модели демонстрируют улучшение противоопухолевой активности комплекса ингибиторов BRAF и MEK при сочетании с блокадой PD-1.
Это позволило предположить, что комплексное воздействие обеспечит дополнительную выгоду для пациентов, которые недостаточно полно или стойко реагируют только на один из режимов терапии. Такое предположение побудило ученых начать первое клиническое исследование дабрафениба, траметиниба и пембролизумаба на людях (NCT02130466).
Исследовательская группа зарегистрировала 15 пациентов с метастатической меланомой BRAF+, из которых у 11 пациентов (73%) наблюдались неблагоприятные явления, связанные с лечением 3-4 степени. Наиболее распространенным осложнением становилось повышение температуры и рост активности печеночных ферментов (АЛТ/АСТ).
Девять пациентов(60%) в результате показали объективный полный ответ, а шесть (40%) пациентов имели частичный ответ. Средний период наблюдений составил 27 месяцев для всех пациентов.
Подтверждение результатов первого исследования
Второе исследование, а по сути рандомизированная фаза II предыдущего прошла под руководством Паоло Антонио Асьерто из Национального Института Опухолей IRCCS имени Г. Паскаля в Неаполье. Кроме того в нем принимали участие группы Пьера Франческо Ферруччи из Европейского института онкологии IRCCS, Милан, Италия и группа Антони Рибаса из Университета Калифорнии.
В ходе рандомизированной фазы II пациенты с прогрессирующей BRAF V600E / K меланомой получали дабрафениб и траметиниб вместе с пембролизумабом (триплетная терапия; n = 60) или плацебо (дублетная терапия; n = 60).

Первичная конечная точка PFS была статистически значимо улучшена в триплетной группе — 16,0 месяцев по сравнению с 10,3 месяцами в дублетной группе (отношение рисков 0,66; p = 0,043). Однако, общий период наблюдений был слишком мал, чтобы говорить об улучшении общей выживаемости.
Медиана продолжительности объективного ответа опухоли на терапию составила 18,7 месяца в триплетной группе и 12,5 месяца в дуплетной. По оценкам, 59,8% и 27,8% объективных улучшений длились более 18 месяцев при триплетном и дублетном лечении соответственно.
Безопасность нового лечения и перспективы
Неблагоприятные явления, связанные с лечением 3–5 степени отмечались у 58,3% и 26,7% пациентов, получавших триплетную и дублетную терапию соответственно. Чаще всего лечение сопровождалось повышением температуры, повышением уровня трансаминаз и сыпью. Один пациент, получивший триплетную терапию, умер от пневмонита. Ни в одном случае лечение не требовалось прервать вследствие непереносимой токсичности.
Таким образом новая комплексная схема лечения может быть представлена к апробированию на широком круге пациентов в ходе клинического исследования фазы III, после которого она может быть рекомендована к повсеместному применению.
Читайте также:


