Новейшие методы в лечении лейкозов
2020. Tafasitamab - новый препарат от рака крови - на подходе

Американская фармакомпания Incyte выкупает у немецкого биотек-стартапа MorphoSys права на препарат Tafasitamab почти за $2 млрд. Это препарат на основе антител для лечения B-клеточной лимфомы, хронического лимфоцитарного лейкоза (ХЛЛ) и В-клеточной неходжкинской лимфомы. Препарат усиливает работу иммунных B-клеток, которые цепляются к раковым клеткам и привлекают макрофаги для их уничтожения. На данный момент Tafasitamab проходит последнюю стадию клинических испытаний и его эффективность сравнима с более дорогой CAR-T терапией. Incyte надеется выпустить препарат в продажу уже в этом году.
2019. В России создали нейропроцессор для диагностики рака крови

Российский научно-технический центр Модуль разработал нейросетевое устройство, которое умеет анализировать микроснимки анализа крови и выявлять атипичные клетки, которые могут быть связаны со злокачественным заболеванием кроветворной системы. Нейросеть обучалась на массиве данных лаборатории патологической анатомии одной из малазийских клиник. Разработчики говорят, что точность диагноза от нейросети составляет 98%, а анализ проводится всего за несколько секунд. В перспективе нейросеть Модуля сможет определять раковые клетки по результатам биопсии других видов рака. Сейчас устройство готовят к сертификации FDA в США.
2017. В США одобрили вторую генную терапию для лечения рака крови

Американский регулятор FDA одобрил вторую генную терапию для борьбы с раком крови: препарат Yescarta (компании Kite Pharma). Он предназначен для лечения агрессивной лимфомы у взрослых. Первым одобренным антираковым генотерапевтическим препаратом стал Kymriah (компании Novartis). В Yescarta применяется та же технология (CAR-T), что и в первой генной терапии. Она редактирует иммунные Т-клетки так что они начинают атаковать раковые клетки. Стоит Yescarta немного дешевле - 373 тыс. долларов для одного пациента. Причем есть потенциал к снижению этой стоимости, т.к. в США - более 7 тысяч пациентов в год, которым подходит эта технология. А чем больше пациентом покупают препарат, тем дешевле он становится.
2017. Антираковая генотерапия CAR-T сертифицирована в США
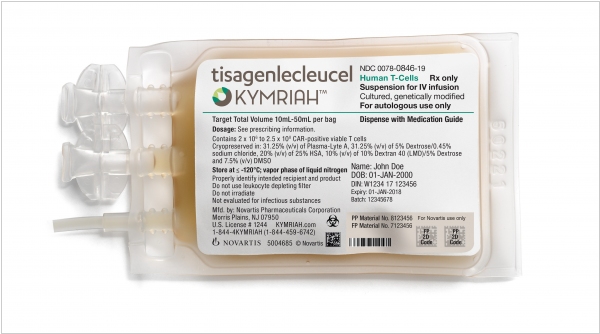
Технология CAR-T и препарат Kymriah (Кимрия) швейцарской компании Novartis, которая уже доказала свою эффективность в лечении острого лимфобластного лейкоза, была сертифицирована американским регулятором FDA (что еще раз подтверждает ее действенность). Суть технологии в том, что врачи берут образец белых кровяных телец пациента, а потом в лаборатории перепрограммируют их в убийц опухолей. Затем клетки возвращают в тело, где они быстро группируются и уничтожают раковые клетки. Конечно, стоимость такого лечения - не всем по карману - $475,000. Правда, Novartis обещает вернуть деньги, если организм пациента не отвечает на лечение.
2017. Наночастицы перепрограммируют Т-клетки прямо в организме для борьбы с лейкемией
2017. Лекарство Гливек показывает отличные результаты в лечении лейкоза
2016. Персонализированная вакцина остановила рак крови

Медицинский центр Beth Israel Deaconess, расположенный в Бостоне, провел успешные клинические испытания новой вакцины, изготавливаемой из собственных клеток пациента, которая предназначена для лечения острого миелоидного лейкоза. Вакцина использует технологию иммунотерапии, т.е. стимулирует собственные имунные Т-клетки для уничтожения опухоли. Испытания начались 4 года назад, когда 17 пациентам со средним возрастом 63 года начали вводить вакцину после сеансов химиотерапии. В результате 12 из них до сих пор показывают ремиссию. На фото - руководитель проекта - Дэвид Авиган.
2016. Технология Cellectis вылечила уже второго ребенка от лейкемии

Франко-американская компания Cellectis, похоже, заняла лидирующую позицию на многообещающем рынке иммунотерапии рака. В конце прошлого года ее технология TALEN (основанная на методе CAR-T) помогла вылечить годовалую девочку от лейкемии, а недавно они объявили о второй успешной операции, проведенной в том же лондонском госпитале. Смысл технологии в том, что ДНК иммунных клеток (Т-лимфоцитов) модифицируется в пробирке, а затем они вводятся в организм, где уничтожают поврежденные при лейкемии кровяные клетки. Есть еще три перспективных стартапа, разрабатывающих подобные технологии (Novartis, Juno Therapeutics и Kite Pharma). Но отличие технологии Cellectis в том, что она использует донорские Т-клетки, т.е. потенциально может создать универсальный и дешевый препарат, который можно быстро ввести любому пациенту.
2015. Генная инженерия и иммунотрапия спасли девочку от лейкемии
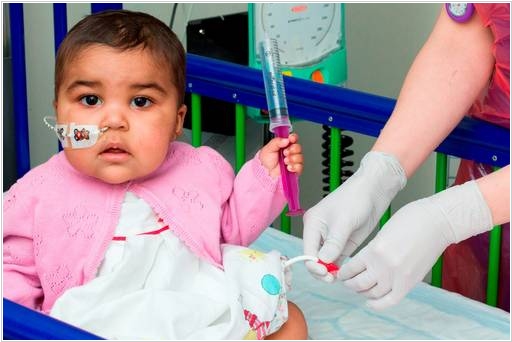
В Лондонской больнице Грейт-Ормонд-Стрит врачи использовали уникальный метод CAR-T для лечения лейкемии (рака крови) у маленькой девочки Лейлы (1 год). Химиотерапия и пересадка костного мозга ей не помогли, поэтому медики решились испробовать новый вид иммунотерапии. Они взяли иммунные клетки донора, генетически-модицифировали их так чтобы они распознавали и уничтожали раковые клетки и при этом сами не воспринимались иммунной системой, как чужеродные, и ввели их в организм девочки. Через три месяца Лейле снова пересадили костный мозг: здоровые иммунные клетки распознали генно-модифицированные клетки как чужеродные и уничтожили их. Таким образом, сейчас в организме девочки не осталось генетически модифицированных клеток. Пока о полном излечении Лейлы говорить рано, но она жива и хорошо себя чувствует. Полноценные клинические испытания этой технологии начнутся в 2016 году. Технология разработана французской биотехнологической компанией Cellectis.
2014. Создан искусственный костный мозг для выращивания стволовых клеток крови
Все клетки крови (эритроциты, лейкоциты. ) формируются из так называемых гемопоэтических стволовых клеток, которые, содержатся в костном мозге человека. И иногда человеку требуется замена этих стволовых клеток. Например, при лейкемии, когда собственные стволовые клетки превращаются в раковые. Или после лучевой терапии, когда собственные стволовые клетки погибают. В таких случаях проводят трансплантацию костного мозга, и это очень-очень дорогая операция, в основном из-за сложности поиска совместимого донора. В России с этим делом - вообще комедия. Вот было бы здорово, если б можно было взять у человека чуть-чуть стволовых клеток крови, размножить их в лаборатории, а потом ввести обратно в костный мозг. Именно над такой идеей работают ученые из нескольких ведущих научных центров Германии. И у них уже кое-что получилось. Они создали искусственную пористую структуру, имитирующую губчатое вещество кости в области кроветворного костного мозга. ***
2013. В Ханты-Мансийске проводят трансплантацию стволовых клеток при лечении рака крови
Югорский научно-исследовательский институт клеточных технологий, созданный четыре года назад, вроде-как успешно применяет свою технологию лечения рака крови с помощью стволовых клеток. На базе Сургутской ОКБ они провели уже 34 трансплантации стволовых клеток, и говорят, что все пациенты до сих пор живы. Кроветворные стволовые клетки НИИ получает от доноров (из костного мозга и пуповинной крови), проводят ДНК анализ (для определения совместимости) и хранит этот материал в своем криобанке. Затем стволовые клетки добавляют в кровь пациента каким-то уникальным методом. По словам Сергея Щукина, заместителя директора Департамента здравоохранения Югры, стоимость пересадки стволовых клеток на западе - порядка 420 тысяч долларов. А у нас по стране, хотя такие операции - редкость, но делаются они бесплатно, за счет средств бюджета.
Лейкоз – это общее название для целой группы злокачественных заболеваний системы кроветворения,
причины возникновения и симптоматика которых могут существенно различаться.
Лечение лейкоза подбирается в зависимости от обнаруженной формы и типа заболевания.
Диагностика
Диагноз может быть поставлен только после получения результатов анализа крови. Вначале у пациента берут кровь на общий анализ, который помогает определить характер заболевания.
Уточнить диагноз можно при помощи пункции костного мозга. Пункция проводится посредством прокола толстой иглой кости в области грудины или таза.
Таким образом, специалисты изымают нужное для анализа количество костного мозга, который цитолог исследует под микроскопом.
Исследование помогает определить тип опухоли, насколько она агрессивна и насколько разрослась область поражения.
В более сложных случаях используют иммуногистохимию. Это метод биохимической диагностики, который позволяет определить природу опухоли на основании количества определенного вида белка, содержащегося в опухолевом образовании.
Традиционное лечение
Лечение подбирают на основании данных о типе заболевания, стадии его развития, состоянии здоровья и возраста больного. Острый лейкоз требует немедленного начала терапии с целью замедлить рост лейкозных клеток.
В этом случае зачастую можно добиться состояния стойкой ремиссии. О полном излечении лейкоза обычно не говорят, так как данная болезнь склонна рецидивировать.
Хроническая форма лейкемии очень редко переходит в стадию ремиссии. Однако при проведении грамотной терапии развитие заболевания можно контролировать.
Хроническую лейкемию обычно начинают лечить с момента появления ее симптомов, а вот для терапии хронического миелоидного лейкоза иногда необходимо дождаться результатов диагностирования.
В качестве основных методов лечения лейкемии используют следующие:
- Химиотерапия, при которой применяются препараты для уничтожения раковых клеток.
- Радиотерапия (лучевая терапия) – действует разрушающе на лейкозные клетки, воздействуя на них рентгеновским и прочими видами излучения. При этом увеличенные органы (селезенка, лимфоузлы) приобретают прежние очертания.
- Операция по пересадке стволовых клеток помогает возобновить продуцирование здоровых кровяных клеток. Иммунная система также восстанавливается.
Перед тем как приступать к оперативному вмешательству, обычно проводят радио- или химиотерапию с целью уничтожения некоторого количества клеток костного мозга, чтобы появилось место для стволовых клеток.
Другой целью проведения предварительной терапии является ослабление иммунной системы, так как из-за своей активности она может отторгнуть пересаженные клетки.
Народная медицина против лейкоза
В нетрадиционной медицине используют множество рецептов из растительных компонентов для лечения белокровия. Одним из них является рецепт с конским каштаном. Соцветия срезают, удаляют столбик, а цветы сушат. Берут 1 столовую ложку, заливают ее 200 мл кипящей воды и оставляют на 6 часов настаиваться. Принимать настойку следует по половине стакана. В течение суток выпивают до литра такого настоя.
Лечение лейкемии народными средствами не обходится без сока алоэ. Для этого берут 0,5 сока алоэ, 200 г корня аира, 0,5 красного вина и 0,5 кг меда.
Корень измельчают и смешивают с остальными компонентами. Смесь оставляют настаиваться в течение 14 дней в темном месте. Принимают средство ежедневно по столовой ложке за час до еды, запивая настоем из душицы.
Можно использовать другой похожий рецепт. Для него берут 0,5 л коньяка, 200 г корня аира и 0,5 кг меда. Настойку применяют аналогично.
Уменьшить содержание в крови лейкоцитов позволяет употребление следующего напитка. В стакан чистой воды добавляют чайную ложку яблочного уксуса и меда. Принимают средство без ограничений.
Очень эффективным при лейкемии может быть золотой ус. Его используют совместно с гречишным медом, смешивая в равных частях. Далее в смесь добавляют кагор в количестве, в 2 раза превышающем количество меда. Настаивать средство нужно не менее 40 дней.
Лекарство принимают по ложке перед каждым приемом пищи. Запивать средство можно отваром из цветков конского каштана. Отвар готовится из столовой ложки сухих цветов и литра кипятка.
Голодание

Еще одним методом народной медицины в борьбе с лейкозом является голодание на воде или на соках. Оно способствует очистке кроветворной системы от токсинов и повышает сопротивляемость иммунной системы.
Но, к сожалению, нет научно подтвержденных данных о том, что такие методы способны излечить больного от лейкемии.
В любом случае, прежде чем менять свой привычный режим питания, нужно проконсультироваться с лечащим врачом. Ведь в особых случаях голодание может, наоборот, ухудшить состояние больного.
Грамотно сочетая методы традиционной и народной медицины, можно добиться существенных результатов, и прогноз в отношении больного будет благоприятным.
Использование модифицированных иммунных клеток самих пациентов позволило победить разновидность рака, ранее бывшую практически неизлечимой на поздних стадиях.

Специалисты из Центра изучения рака в Сиэтле (США) добились того, что 27 из 29 пациентов с запущенной лейкемией после курса иммунотерапии оказались в долговременной ремиссии. Ранее излечение таких больных на поздних стадиях заболевания практически не удавалось. Новая методика борьбы с раком использует модифицированные иммунные клетки, взятые у самого больного, что делает её значительно эффективнее всех других существующих аналогов. Соответствующее исследование опубликовано в Journal of Clinical Investigation.
При обычном течении острого лимфобластного лейкоза быстро делящиеся незрелые белые кровяные клетки окружают спинной мозг и не дают ему продуцировать здоровые кровяные клетки, без которых организм погибает. Собственные иммунные клетки человека, о бычно борющиеся с раковыми, при таком заболевании неэффективны. Дело в том, что опухолевые кл е тки исходно являются частью того же организма, отчего их поверхность покрыта в основном теми же белками, что и поверхность обычных клеток. Иммунные Т-лимфоциты, потенциально способные убить раковую клетку, п росто не могут от личить ее от нераковой и поэтому не атакуют .
Ч тобы справиться с проблемой, несколько лет назад был предложен принципиально новый способ антираковой иммунотерапи и с использованием специально "обученных" Т-лимфоцит ов. Для этого у пациента заб и ра е т ся образец этой разновидности иммунных клеток. В лаборатории его подвергают небольшой генетической модификации. В её ходе в геном встраивается участок, который отвечает за появление на поверхност и Т-лимфоцит а искусственн ого Т-лимфоцитн ого рецептор а, способн ого распознавать те белки раковой клетки, которые отличают её от здоровой. Такой участок называется химерным антигенным рецептором.

Микропрепарат костного мозга больного острой В-лимфоцитарной лейколастной лейкемией. Фото: Wikipedia
Для проверки эффективности этого метода с 2013 года в Центре изучения рака в Сиэтле (США) проводились клинические испытания, окончившееся в начале 2016 года. В них приняли участие 29 больных острым лимфобластным лейкозом на поздних стадиях. На них уже испытывались другие виды антираков о й терапии , однако они не дали никаких устойчивых результатов. Затем учёные взяли образцы Т-лимфоцит ов у всех пациентов и оснастили их искусственными рецепторами для распознавания мутировавших клеток.
Посл е этого модифицированные Т-лимфоцит ы ввели в кровоток каждого из пациентов , где они нач али размножаться делением . Модифицированные клетки с новыми распознающими рецепторами интенсивно самовоспроизводились внутри человеческого организма и быстро росли в числе . В силу многочисленности, их атаки на раковые клетки были систематическими и непрекращающимися. В итоге все мутировавшие клетки погибали за считаные недели после однократного ввода новых Т-лимфоцитов.
Из 29 пациентов на поздних стадиях острого лимфобластного лейкоза у 27 произошла устойчивая ремиссия — врачи не выявили признаков наличия раковых клеток в их спинно м мозге . Это необычный результат, поскольку такой вид рака на поздних стадиях считается практически неизлечимым. П рогноз для всех пациентов, подвергшихся новой иммунотерапии, предсказывал им считаные месяцы жизни.
Создатели новой методики иммунотерапии, полагают, что результат ы её клинического испытания станут важным шагом на пути внедрения модифицированных Т- лимфоцитов в о врачебную практику. Они отмечают, ч то такой метод является во многом более эффективным, чем радио- или химиотерапия. М одифицированные клетки иммунной системы самовоспроизводятся (их не надо вводить многократно), не имеют побочных последствий (токсических или радиационных) , свободно разносятся по всему организму и способны атаковать раковые клетки самостоятельно, без дальнейшего врачебного вмешательства. Всё это с н ижает вероятность рецидива. В перспективе новый метод может быть распространен и на другие разновидности рака, о сторожно полагают врач и .
Современная стратегия химиотерапии острого лейкоза, разработанная 20—25 лет назад и претерпевшая за это время определенные изменения в плане интенсификации, к сожалению, уже не может принципиально изменить результаты лечения: ни частоты достижения ремиссий, ни долгосрочной выживаемости.
Эффективность стандартной химиотерапии, по-видимому, еще может быть повышена, но в основном благодаря усовершенствованию тактики выхаживания пациентов после цитостатического воздействия. Собственно антилейкемический потенциал самой стратегии химиотерапии уже исчерпан, поэтому все современные исследования в лейкозологии направлены на поиск и внедрение новых, порой не связанных с цитостатическими эффектами способов воздействия на лейкемические клетки. Основные направления этой работы отражены в таблице.
Данные, представленные в таблице, отражают лишь те новые подходы, которые были испытаны в клинических исследованиях I—II и даже III фаз. Безусловно, не перечислены еще многие исследовательские работы, в основном те, которые не вышли из рамок поисковых. К ним относится, например, так называемая вакцинация:
1) введение в организм больного собственных лейкемических клеток (аутологичная клеточная вакцина), в которые с помощью ретровирусов были введены гены определенных молекул (например, В7-1), являющихся мощными костимуляторами Т-клеточного ответа;
2) коммитирование и культивирование, а затем введение в организм больного собственных дендритных (антигенпрезентирующих) клеток, полученных из лейкемических, с целью усиления иммунного ответа на опухолевые антигены.
Традиционным направлением многих исследований является разработка новых противоопухолевых препаратов. Особого внимания заслуживают ингибиторы тирозинкиназ, в частности c-ABL-тирозинкиназа (Гливек). Этот препарат полностью изменил терапевтические подходы в лечении ХМЛ. В программах терапии острого лейкоза его используют в случае обнаружения химерного транскрипта BCR-ABL или t(9;22).
У 30 % больных острым миелоидным лейкозом выявляют мутации гена FLT3, продуктом которого является FLT3-тирозинкиназа. Проведены первые клинические испытания II фазы по применению ингибиторов FLT3 тирозинкиназы.
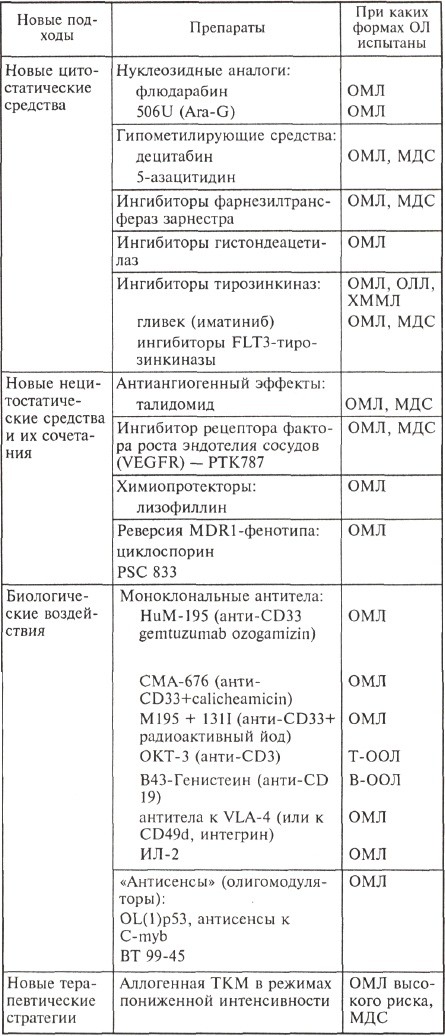
При использовании молекулы РКС412 были зафиксированы выраженные эффекты у больных с рефрактерным острым миелоидным лейкозом. Так, из 20 больных у одного достигнута полная ремиссия, у 6 отмечено значительное (более чем в 100 раз) уменьшение числа властных клеток в крови, у 7 больных оно составило на 50 % от исходного. Аналогичные эффекты наблюдались и при использовании другого ингибитора FLT3-тирозинкиназы - СЕР-701.
Ингибиторы гистондеацетилаз — это препараты, которые влияют на процесс транскрипции. Создано несколько молекул различных классов: производные бутировой кислоты — ВА (пивалоилоксиметил бутират, бутироилоксиалкиловые эфиры глутаровой и никотиновой кислот, бутироилоксиметиловые эфиры); диэтиловый эфир фосфорной кислоты; субероиланилидгидроксаминовая кислота (SAHA); циннамил гидроксамат LAQ824 и др.
Большинство из этих молекул демонстрирует высокую активность в лабораторных условиях на клеточных линиях острого лейкоза. Клинические исследования проводят лишь с единичными препаратами. Так, применение SAHA у больных с периферическими Т-клеточными лимфомами позволило у 5 из них получить частичную ремиссию, у 5 — стабилизацию. У 25 больных рефрактерным острым миелоидным лейкозом исследование I фазы по применению ингибитора гистондеацитилаз МС-275 было не столь эффективным — получены лишь незначительные гематологические эффекты.
Создается впечатление, что в скором времени из огромного числа синтезируемых ингибиторов гистондеацетилаз будут отобраны наиболее эффективные препараты.
В настоящее время проходят клинические испытания препараты из новой группы лекарственных средств — ингибиторы фарнезилтрансферазы. Основой для разработки использования этих препаратов стали исследования, свидетельствующие об увеличении частоты мутаций онкогена RAS у больных острым миелоидным лейкозом. RAS-протеины являются важным звеном в цепи передачи сигналов внутри клетки и становятся функционально активными после присоединения фарнезильтных остатков с помощью фарнезилтрансферазы.
Результаты первых клинических испытаний препарата типифарниба (R115 777, Зарнестра) свидетельствуют об его определенной активности: общий гематологический эффект отмечен у 37 % больных острым миелоидным лейкозом старше 60 лет.
Нуклеозидные аналоги завоевывают место в программах лечения не только острый миелоидный лейкоз и хронических лимфопролиферативных заболеваний, определенный оптимизм внушает эффективность некоторых из них при остром лимфобластном лейкозе. Так, арабинозилметоксигуанин (Ara-G или 506U), вводимый в дозе 40—50 мг/кг внутривенно 1 раз в день в течение 5 дней, позволил добиться полной ремиссии у 44 % и частичной ремиссии у 32 % больных с рецидивами Т-клеточного острого лимфобластного лейкоза.
Анализ работ по применению гипометилирующих агентов — 5-азацитидина и 5-аза-деоксицитидина (децитабина) — позволяет сделать заключение о более высокой эффективности децитабина. Его применение в дозе 50—75 мг/м2 в виде постоянной инфузии в 1—3-й день позволяет получить полную ремиссию у 30—37 % больных ОМЛ или МДС из группы высокого риска. При использовании децитабина в сочетании с антрациклинами или амсакрином полный ответ отмечен у 35 % больных ОМЛ из группы высокого риска. Следует подчеркнуть, что клинических исследований по изучению этих препаратов еще очень мало, и требуется время, чтобы реально оценить эффективность каждого из них.
Бесспорным является лишь тот факт, что эти средства обладают уникальным механизмом действия: помимо гипометилирующих эффектов (а гиперметилирование ДНК является признаком опухолевой устойчивости и прогрессии), они вызывают клеточную дифференцировку, активируют супрессорные гены и могут in vitro ингибировать пролиферацию клоногенных лейкемических клеток.
Очень интересным направлением в разработке новых противоопухолевых препаратов является создание средств, влияющих на ангиогенез. Талидомид как антиангиогенный препарат давно занял прочное место в лечении множественной миеломы, однако его эффективность при ОЛ и миелодисплазиях незначительна. К новым средствам относятся молекулы, ингибирующие рецепторы ростового фактора эндотелия сосудов (VEGFR). Показано, что ОЛ, при которых бластные клетки экспрессируют VEGFR в больших количествах, отличаются неблагоприятным прогнозом. В испытаниях I фазы исследователи отметили незначительную эффективность ингибитора VEGFR — PTK787 при минимальной токсичности.
Лейкоз. Инновации и терапевтические прорывы.
За последнее десятилетие достигнут значительный прогресс в лечении различных видов рака крови и лимфы. В нашей новой статье все о лечении рака крови в рамках месяца осведомленности о раке. Сегодня для вас только хорошие новости.
Наряду с традиционной химиотерапией, дающей хорошие результаты для лечения большинства видов рака, в том числе и для лечения лейкоза, в последние годы одобрено множество передовых биологических препаратов, которые показали высокую степень излечения у пациентов с лейкозом. Данные лекарства не только увеличивают продолжительность жизни пациентов, но и обеспечивают перспективы лечения многих раковых заболеваний, в том числе лимфолейкоза.
Инновационные биологические методы лечения основаны на использовании двух основных механизмов:

Новые препараты для лечения рака крови.
CML – хронический миелолейкоз.
Первый прорыв в биологическом лечении хронического миелолейкоза зафиксирован в начале 2000-х годов. До этого времени у всех пациентов наблюдался переход хронической формы в острую, после чего следовала смерть пациента.
Заболевание фиксируется как правило у людей 50-60 лет, но встречается и у молодых людей. По всему миру диагноз ставится у порядка 100 тыс.человек в год. В больницах Израиля под наблюдением находится несколько сотен пациентов с диагнозом рака крови.
Рак крови вызывается генетической мутацией клеток в костном мозге, которая вызывает активацию белка тирозинкиназы в клетке, что приводит к ее поражению и быстрому делению.
Десять лет назад впервые успешно был применен препарат иматиниб Гливек, который ингибировал активность белковых тирозинкиназ, что привело к излечению 90% пациентов, а также исключил генетическую мутацию у 80% пациентов.
С 2004 г. иматиниб добавлен в корзину препаратов для лечения рака крови, а позже разработаны и более совершенные поколения ингибиторов семейства тирозинкиназы, такие как Nilotinib (Tsignh), Dstinib (Sfriisl) и Fontinib (Aiklosig).
Эти препараты более эффективно борются с раковыми клетками, даже в тех случаях, когда у пациентов развивается резистентность к лечению иматинибом. Именно благодаря им продолжительность жизни пациентов с раком крови практически сравнялась с жизнью здоровых людей.

ХЛЛ – хронический лимфолейкоз и НХЛ — неходжикинская лимфома.
Хронический лимфолейкоз является наиболее распространенным видом лейкоза у взрослых В-лимфоцитов, клеток, принадлежащих к иммунной системе и защищающих организм от вредных клеток.
Заболевание встречается у 2-4 человек на 100 тыс. пациентов, причем его распространенность значительно выше среди людей старше 70 лет. Болезнь имеет тенденцию к медленному развитию и повторяемости после диагностики и лечения. Т.к. традиционная химиотерапия не дает хороших показателей для излечения, то в какой-то степени именно это и подтолкнуло ученых для разработки новых биологических препаратов.
Неходжкинская лимфома – рак лимфатических узлов, также наносит вред другим органам организма. В большинстве случаев источником заболевания становятся В-лимфоциты, которые угрожают жизни, особенно в случае агрессивной лимфомы и умеренной формы болезни, еще называемой Ленивой лимфомой.
Начало прорыва в лечении ХЛЛ и НХЛ положено более десяти лет назад с запуском препарата Мабтера (Ritoksimb). Сочетание препарата с химиотерапией значительно улучшило ответ пациентов на лечение. Более того, такое сочетание в значительной мере способствует излечению пациента.
Мабтера представляет собой моноклональное антитело, направленное против белка, называемого CD-20. Антитело связывается с раковыми клетками и вызывает их гибель путем прямого попадания в клеточную мембрану и активации лимфоцитов иммунной системы против рака.
В последствии было разработано еще несколько антител, которые работают против CD-20, в том числе Aofatomomb (Arzrh) для лечения пациентов с ХЛЛ. В сочетании с химиотерапией применение препарата привело к значительному улучшению ответа на лечение.
Второе поколение препаратов, Бельведер, показало высокую эффективность у пациентов, которые по тем или иным причинам не могут получать химиотерапию. На сегодняшний день доказана эффективность и при лечении других типов лимфомы, поэтому ожидается рост его применения, особенно у взрослых пациентов с ХЛЛ.
Научные достижения в понимании структуры раковых клеток и функций раковой опухоли позволили осуществить огромный прорыв в онкологической медицине и внесли большой вклад в развитие ряда новаторских интеллектуальных препаратов лечения ХЛЛ. Один из таких препаратов, это Aibrotinib.
Данный препарат блокирует белок БТК (Брутона тирозинкиназы), имеющий важное значение для выживания и пролиферации В-клеток. Соответственно благодаря препарату белок ингибируется, что вызывает нейтрализацию и уничтожение раковых клеток. При этом существенного вреда другим клеткам организма не наносится.
В начале 2014 года препарат был одобрен FDA для лечения ХЛЛ у пациентов с рецидивирующей или резистентной болезнью, которые уже получили по меньшей мере одну линию лечения. Результаты медицинского обследования показали, что болезнь вернулась у 60% пациентов, хорошо отреагировавших на препарат.
При этом пациенты, которые, как правило, не отвечают на лечение, хорошо реагировали на лекарственную терапию. В итоге, препарат был введен в схему лечения с 2014 г пациентам, страдающим раком крови при мутации в 17 хромосоме.
В 2015 году применение препарата стало доступно для всех пациентов с рецидивом ХЛЛ, а также для тех пациентов, которым не подошли стандартные схемы лечения. На сегодняшний день большинство случаев лечения успешны, а сам препарат эффективен и одобрен для использования в корзине пациентов с лимфомой клеток мантии – агрессивной формой лимфомы с рецидивирующими вспышками.
Notoklast – еще один новый препарат, который ингибирует белок под названием BCL2 и приводит к гибели раковых клеток. Препарат одобрен FDA для лечения ХЛЛ и признан эффективным при лечении других видов лимфом.

Множественная миелома.
Множественная миелома – это рак крови, при котором злокачественными становятся клетки плазмы костного мозга. По сути, это клетки, производящие антитела, помогающие организму бороться с различными инфекциями. При таком раке крови клетки начинают не только бесконтрольно делиться и образовывать опухоли, но и поражают другие органы за счет распространения потоком крови.
Множественная миелома достаточно болезненное заболевание, вызывающее сопутствующие патологии. Это и почечная недостаточность, и повторные инфекции, и переломы костей, а также анемия. Средняя продолжительность жизни пациентов с множественной миеломой раньше составляла всего 2-3 года. Сейчас же, благодаря развитию биологических препаратов, которые на сегодня являются неотъемлемой частью лечения множественное миеломы, продолжительность жизни пациентов увеличилась до 7-9 лет.
Биологическое лечение множественной миеломы принято разделять на две группы, каждая из которых представляет собой дополнение к передовым биологическим терапиям.
Lnlidomid предоставляется пациентам пожилого возраста при проведении лечения первой линии. Fomlidomid входит в корзину здоровья всех пациентов с множественной миеломой. Особую важность препараты предоставляют для пациентов с плохими показателями диагностики.
Стоит отметить, что множественная миелома остается неизлечимым заболеванием. Более того, это заболевание с неизбежным рецидивом, и каждый раз болезнь становится более агрессивной и труднее поддается лечению. Однако применение биологических препаратов не только позволяет заменить химиотерапию, имеющую множество побочных эффектов, но и существенно продлевает жизнь пациентов. Особенно в случаях, когда пациенты получили другие виды лечения множественной миеломы.
В 2015 году был утвержден список пищевых продуктов и медикаментов, возможных для применения в лечении множественной миеломы.
Daratomomab – препарат иммунотерапии, представляющий собой моноклональное антитело, являющееся активным по отношению к белку CD-38 в мембране клеток миеломы. Лекарство запускает несколько механизмов, и, в том числе, активизирует иммунную систему, а также блокирует сигналы раковых клеток на бесконтрольное их деление. Препарат убивает раковые клетки и белок, который ориентирован на экспрессию раковых клеток миеломы.
Клинические исследования данных препаратов проводятся по всему миру, в том числе в медицинских центрах Израиля. Результаты публикуются в престижных журналах, а совсем недавно были представлены на медицинских конференциях по всему миру, что определило основные исследования на ближайшее будущее, как имеющие наибольшее значение для лечения раковых заболеваний и множественной миеломы в том числе.

Лимфома Ходжкина.
На сегодняшний день лимфома Ходжкина имеет высокую степень отверждения, благодаря комбинации химиотерапии и радиации. Однако не менее 10-30% пациентов не реагируют на химиотерапию или имеют рецидив заболевания после лечения.
Новые биологические методы лечения показывают лучшие результаты, а поэтому их применение набирает все большую популярность в передовых клиниках, в том числе и в клиниках Израиля.
Среди них Brntoksimb ( Adtztris), препарат, представляющий собой антитело против CD-30 белка, содержащегося в опухолевых клетках пациентов с лимфомой Ходжкина. Препарат показал свою эффективность в 75% случаев пациентов, у которых болезнь вернулась после пересадки костного мозга. При этом продолжительность ремиссии увеличилась в 2 раза.
В настоящее время препарат используется при лечении пациентов, у которых болезнь вернулась после трансплантации костного мозга и у пациентов с рецидивом заболевания, не являющихся кандидатами для пересадки костного мозга.
Антиингибитор PD-1 (Aofdibo / Nibolomab, Kitrodh / Fmbrolizomab) – еще одна группа препаратов, вызывающих активацию Т-клеток в иммунной системе организма, подавленных раком. Лечение вызывает 78% положительных реакций у пациентов с лимфомой Ходжкина, перенесших пересадку костного мозга.
Как видите, медицина находится на грани революции в лечении раковых заболеваний. Мы стали свидетелями значительного прогресса в биологической очистке большинства видов рака крови и лимфы, что существенно повышает шансы на выживание и восстановление с этими заболеваниями. Думаем, уже в ближайшее время мы объявим о значительных улучшениях препаратов, о их большей эффективности и безопасности лечения.
Читайте также:

