Новейшие методы лечения мелкоклеточного рака легкого

Симптомы мелкоклеточного рака легкого
Мелкоклеточный рак почки на ранних стадиях протекает бессимптомно. Наиболее распространенные признаки данного заболевания появляются на более поздней стадии. К ним относится:
- гематурия,
- боли в поясничной области,
- прощупывание опухоли,
- повышение артериального давления.
Диагностика мелкоклеточного рака легкого
К наиболее эффективным методам диагностики данного заболевания относится:
- рентгенологическое исследование,
- флюорография,
- микроскопия мокроты,
- компьютерная томография,
- бронхоскопия.
Лечение мелкоклеточного рака
Как и для других видов рака, для лечения мелкоклеточного рака используются три основных метода:
- оперативное вмешательство,
- лучевая терапия,
- химиотерапия.
Как правило, оперативное вмешательство показано больным МРЛ на ранних этапах.
Лучевая терапия может обеспечить существенный регресс опухоли в 70 % случаев, но, как и в случае с оперативным лечением, облучение не эффективно при использовании в монорежиме, так как это не препятствует образованию отдаленных метастазов.
Химиотерапия представляет наиболее действенный метод лечения мелкоклеточного рака легкого. Наилучшие результаты достигаются от одновременного применения нескольких - 2-3-х, реже – 4-х и более активных препаратов. Подобные комбинации препаратов называются полихимиотерапией.
На выбор терапевтического лечения мелкоклеточного рака легкого влияет в первую очередь распространенность ракового процесса. Существует две формы заболевания - локализованная и распространенная.
Локализованная форма мелкоклеточного рака легкого хорошо поддается лечению. Статистика результатов ее лечения данной формы МРЛ имеет следующие показатели:
- эффективность лечения – в 65-90 % случаев,
- регресс опухоли - в 45-75 % случаев,
- двухлетняя выживаемость составляет 40-50 %;
- пятилетняя выживаемость составляет около 10%.
Проведение химиотерапии в 2-4 курса является основой в лечении локализованной формы МРЛ. Лучевую терапию следует начинать на фоне химиотерапии: либо во время, либо после 1-2 курсов. Если у больного наблюдается полная ремиссия, целесообразно проведение облучения головного мозга. Это необходимо и потому, что МРЛ отличается высокой вероятностью, порядка 70%, метастазирования в головной мозг.
Больным распространенным МЛР предписано лечение посредством комбинированной химиотерапии. В данном случае облучение целесообразно производить только при наличии таких показаний, как при метастатическом поражении:
- костей,
- головного мозга,
- надпочечников,
- лимфатических узлов,
- средостения наряду со сдавливанием верхней половой вены.
МРЛ довольно хорошо поддается лечению лучевой терапией и химиотерапией, но чувствительность к лечению нередко нивелируется высоким уровнем возникающих рецидивов. Поэтому пациентам, которым по медицинским показаниям отказано в проведении хирургической операции, назначается классическая лучевая терапия, которая, в свою очередь, не позволяет провести эскалацию дозы из-за побочных эффектов.
Гипофракционированная стереотаксическая лучевая терапия, представленная на российском рынке новейшей высокотехнологичной разработкой — радиохирургической роботизированной системой КиберНож. Она позволяет увеличить суммарную дозу на патологический очаг и, как следствие, увеличить вероятность локального контроля опухоли и выживаемость пациентов.
КиберНож позволяет проводить стереотаксическую радиохирургию опухолевых образований без ограничения дыхания пациента. Система слежения за дыханием Synchrony синхронизирует движение робота с дыханием пациента, и, соответственно, с движением мишени. Погрешность позиционирования мишени при такой работе системы снижается до 1 (!) мм.
В каждом отдельном случае стоимость определяется на основании показаний к лечению, необходимого количества фракций и плана лечения разработанного врачом радиационным онкологом и медицинским физиком.
| Стоимость лечения | |
| Рак легкого (от 370 000) |
Точная стоимость лечения определяется только после консультации с врачом
- О центре
- Специалисты
- Новости
- Партнеры
- Отзывы
- Запись на приём
- Стоимость лечения
- Консультация
- Диагностика
- FAQ
- Статьи
- Аппарат Кибернож
- Уникальность системы
- Показания к лечению
- Противопоказания
- Как происходит лечение
- Сравнение методов
- Дистанционная
- Комбинированное лечение
- Лечение
- Опухоли головного мозга
- Рак легкого
- Рак печени
- Рак почки
- Рак предстательной железы
- Рак носоглотки
- Опухоль спинного мозга
- Опухоль ЦНС у детей
- Рак поджелудочной железы
- Опухолевое поражение костей
- Метастазы
- Невралгия тройничного нерва
- Пяточная шпора
…должно стать новым стандартом терапии второй линии вместо топотекана.
Мелкоклеточный рак легких почти неизлечим ввиду отсутствия подходящих молекулярных мишеней, на которые могли бы таргетироваться лекарственные препараты. Но поскольку это заболевание является зависимым от регуляторов онкогенной транскрипции, имеет смысл их блокировать.
Лурбинектедин подавляет активную транскрипцию в опухолевых клетках путем избирательного ковалентного связывания с CG-насыщенными ДНК-последовательностями, необратимого торможения и деградации элонгирующей РНК-полимеразы II на матрице ДНК, генерации XPF-зависимых одно- и двухцепочечных разрывов ДНК. Итогом становится апоптоз раковых клеток. Молекула не затрагивает РНК-полимеразу I или митохондриальную РНК-полимеразу и не влияет на базальную транскрипцию. Лурбинектедин оказывает селективный апоптоз-индуцирующий эффект на мононуклеарные фагоциты и ингибирует выработку воспалительных цитокинов.
Путем сдерживания активной транскрипции в опухолеассоциированных макрофагах (TAM) лурбинектедин оказывает влияние на опухолевое микроокружение, сдерживая экспрессию:
- интерлейкина 6 (IL-6) и интерлейкина 8 (IL-8), индуцирующих пролиферацию опухолевых клеток;
- хемокина ССL2 и IL-6, ингибирующих иммунный ответ и активирующих иммунные контрольные точки;
- фактора роста эндотелия сосудов (VEGF) и IL-8, способствующих ангиогенезу.
Клинические исследования NCT02454972 фазы II (нерандомизированные, открытые, мультикогортные, многоцентровые, международные) оценили мононазначение лурбинектедина при различных распространенных солидных опухолях. В случае мелкоклеточного рака легких, рецидивировавшего после первоочередной платиносодержащей химиотерапии, когорта включила 105 взрослых пациентов.
Медиана возраста участников составила 60 лет (40–83), 60% мужчин, все получили как минимум один курс платиносодержащей химиотерапии (1–2), облучение прошли 71% испытуемых, 8% ранее назначали иммунотерапию поверх химиотерапии.
- Частота общего ответа (ORR) составила 35% во всей популяции участников, притом что среди пациентов с платиночувствительным МРЛ этот показатель вышел к 45%, тогда как среди испытуемых с платинорезистентным МРЛ он оказался вдвое хуже, достигнув 22%. Все ответы были частичными — полной ремиссии не добился никто.
- Медиана длительности ответа (DoR) получилась равной 5,3; 6,2 и 4,7 месяца соответственно.
- Медиана выживаемости без прогрессирования (PFS) — 3,5; 4,6 и 2,6 месяца. 6-месячный показатель PFS установлен для 33% пациентов.
- Медиана общей выживаемости (OS) — 9,3; 11,9 и 5,0 месяца. Скончались 63%, 48% и 82% пациентов. 12-месячная общая выживаемость зафиксирована для 34%, 48% и 16% больных.
Среди наиболее частых побочных реакций в ходе назначения лурбинектедина: усталость (77% пациентов), тошнота (37%), снижение аппетита (33%), мышечно-скелетная боль (33%), запор (31%), диспноэ (31%), рвота (22%), диарея (20%), кашель (20%). Кроме того, применение лурбинектедина отразилось на существенном изменении лабораторных и биохимических показателей.
С серьезными отрицательными явлениями столкнулись 34% больных. Из-за этого два человека (1,9%) были вынуждены отказаться от лечения, а временно прервать его — 30,5%. Дозу препарата пришлось снизить для 25% участников.
Если сравнивать эффективность и безопасность лурбинектедина со стандартным топотеканом, результаты будут совсем не в пользу последнего. Так, второлинейное назначение топотекана при мелкоклеточном раке легких выдает следующие показатели результативности лечения: ORR 24%, медиану PFS 3,1 месяца, медиану OS 5,8 месяца. Кроме того, применение топотекана, весьма токсичного, сопровождается существенно более частыми побочными реакциями в тяжелой форме.
Более того, клинические исходы лурбинектедина опережают получаемые в ходе терапии мелкоклеточного рака легких иными, менее распространенными схемами, включающими циклофосфамид, доксорубицин и винкристин, а также повторное использование платиносодержащего курса.
Тем временем в клинических исследованиях NCT02611024 фазы Ib/II было изучено сочетание лурбинектедина с иринотеканом в ходе терапии распространенных солидных опухолей. В когорте пациентов с мелкоклеточным раком легких (n=13) показатель ORR составил 62% (все ответы частичные), а 6-месячная PFS вышла к 36%.
Фармотрасль не сдается перед несокрушимым бастионом мелкоклеточного рака, продолжая активные попытки хоть как-то пробиться через его серьезную защиту. И главный упор здесь сделан на иммуноонкологическое лечение. Первые проблески надежды уже появились, хотя, впрочем, пока весьма сдержанные:
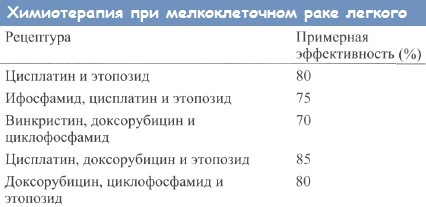
В течение последних 30 лет химиотерапия является основным методом в комплексном лечении мелкоклеточного рака легкого (МРЛ). За это время она прошла путь от монохимиотерапии эмбихином и циклофосфаном до современных схем химиотерапии, включающих такие препараты как цисплатин (карбоплатин), этопозид, таксол, таксотер, иринотекан, топотекан, доксорубицин, винкристин и др. Использование новых химиотерапевтических режимов позволило увеличить длительность жизни больных МРЛ в 4-5 раз по сравнению с не леченными пациентами.
В табл. 1 приведены препараты различного класса, используемые при МРЛ. Эти данные, опубликованные 5 лет назад, требуют комментария. Так, большинство препаратов, указанных в III колонке, в настоящее время исследованы, и далее будет показана их активность в моно- и комбинированной химиотерапии МРЛ. Интересно отметить, что среди оставленных препаратов оказались производные нитрозомочевины, винкаалкалоиды (винбластин и виндезин), а также широко использовавшийся ранее метотрексат. С нашей точки зрения, возможности производных нитрозомочевины еще не исчерпаны, что будет представлено ниже [1].
В табл. 2 показана активность препаратов, применяемых в настоящее время при МРЛ, в том числе новых цитостатиков, которые вошли в практику в 90-х годах ХХ века. Среди них паклитаксел (Таксол), доцетаксел (Таксотер), гемцитабин (Гемзар), топотекан (Гикамтин), иринотекан (Кампто), навельбин (Винорельбин). Как видно из этой далеко несовершенной таблицы, активность новых цитостатиков значительно превышает эффективность таких препаратов как циклофосфан, доксорубицин, ифосфамид.
Современные платиносодержащие схемы комбинированной химиотерапии приведены в табл. 3, а бесплатиновые схемы – в табл. 4. Эффективность бесплатиновых схем колеблется в пределах 45-70%, а платиносодержащих – 60-90%.
В табл. 5 представлены сводные данные о схемах современной химиотерапии, которые могут быть использованы для лечения больных МРЛ как для 1-ой, так и для 2-ой линий. Следует отметить, что применение платиносодержащих схем в качестве 2-ой линии лечения может быть полезно у больных, ранее получавших антрациклинсодержащие схемы. Так же как и использование антрациклинсодержащих схем для 2-ой линии у пациентов, ранее получавших платиносодержащие схемы.
МРЛ – опухоль высокочувствительная к химиотерапии и лучевой терапии. Эффективность сочетанного лечения при локализованном МРЛ колеблется от 80 до 100% с полной регрессией опухоли у 50-60% пациентов, а иногда до 70% и выше. Эти больные имеют шансы на полное излечение (15-20%).
Однако у большинства больных после проведения индукционной химиолучевой терапии возникают рецидивы заболевания. В этих случаях, а также у больных с распространенным процессом после стандартного лечения возникает вопрос о проведении 2-ой линии лечения.
Murray N. [2] на конгрессе ASCO 2003 поставил четыре вопроса о роли 2-ой линии химиотерапии МРЛ:
существуют ли данные о пользе 2-й линии химиотерапии?
каким больным показана 2-я линия?
есть ли преимущества комбинированной химиотерапии над монотерапией?
какой режим лечения нужно рекомендовать больным.
При ответе на первый вопрос Murray отмечает, что, к сожалению, в литературе нет данных по изучению 2-ой линии химиотерапии МРЛ в сравнении с поддерживающей терапией при рецидивах заболевания после индукционной химиотерапии (цисплатин + этопозид) с оценкой выживаемости и качества жизни. Поэтому, учитывая чувствительность МРЛ, можно предположить, что 2-ая линия может быть полезна и имеет смысл, как это было показано для 2-ой линии химиотерапии при НМРЛ.
Вероятность эффекта должна базироваться на чувствительности к препаратам 1-ой линии, времени до рецидива и состояния больного к началу 2-ой линии лечения. У больных, которые получали стандартное лечение, и рецидив возник ранее 3 мес. от начала терапии, все режимы 2-ой линии химиотерапии являются малоэффективными (частота объективных эффектов (ОЭ) не превышает 10%). Этим больным лучше проводить активную симптоматическую терапию и лучевую терапию по показаниям. В случаях, когда время до прогрессирования >3 мес., эффективность 2-й линии более вероятна, особенно у больных, леченных циклофосфансодержащими схемами (CAV, CAE и др.). Однако ремиссии, в основном, остаются короткими (табл. 7) [19].
В отделении химиотерапии РОНЦ им. Н.Н. Блохина РАМН были разработаны и изучены два новых режима для лечения больных с МРЛ с включением производных нитрозомочевины:
Комбинация AVP (ACNU 3-2 мг/кг в 1 день, этопозид 100 мг/м2 4, 5, 6 дни, цисплатин 40 мг/м2 2 и 8 дни с повторением цикла каждые 6 недель) была применена для лечения 68 больных МРЛ. Эффективность комбинации составила 66,7% с полными регрессиями опухоли у 11,8% пациентов и медианой выживаемости 10,6 мес. При этом была отмечена высокая эффективность при метастазах МРЛ в головной мозг (полная регрессия (ПР) - у 55,6%) и печень (ОЭ – 75%, ПР – 43,8%). Эффект был отмечен также у 50% с метастазами в надпочечники и легкие (табл. 8).
Схема ArDV (араноза 1,0 г в/в 1 и 2 дни, доксорубицин 40 мг/м2 в 1 день, винкристин 2 мг) была использована как 2-ая линия химиотерапии у 15 больных МРЛ (13 с распространенным и 2 с локализованным процессом). Полная ремиссия отмечена у 1 и частичная – у 3 больных. ОЭ составил 26,7%, при этом у 3 из 6 больных с метастазами в мозг достигнута полная ремиссия.
Eckardt J.R. с соавт. [17] на конгрессе ASCO 2003 представил результаты большого международного исследования (III фаза) по сравнительному изучению эффективности внутривенного и орального введения топотекана при МРЛ. Внутривенно топотекан вводили в дозе 1,5 мг/м2 1-5 дни, а per os – по 2,3 мг/м2 1-5 дни 1 раз в 3 недели. Всего в исследование были включены 304 пациента (151 и 153 больных в сравниваемых группах соответственно). Объективное улучшение, медиана выживаемости и 1-летняя выживаемость оказались одинаковыми, однако токсичность IV ст. была разной: нейтропения чаще развивалась при внутривенном введении (64% и 47%), а тромбоцитопения – при приеме per os (29% и 18%). Авторы делают вывод об удобстве орального введения топотекана (табл. 9).
При МРЛ до сих пор обсуждается вопрос о роли трехкомпонентных комбинаций. Neil H.B. с соавт. [18] на конгрессе ASCO 2002 опубликовали результаты большого рандомизированного исследования III фазы, в котором 287 больных МРЛ получали схему РЕ, а 285 – ту же схему с добавлением таксола (табл. 10). ОЭ и ПР регистрировались чаще 2-ой группе (63% и 8%, 72% и 17% соответственно). Однако медиана выживаемости и 1-летняя выживаемость были одинаковыми в обеих группах, а токсичность V степени (смертельные случаи) была выше во 2-й группе (2,3% и 6,5% соответственно).
Использование новых химиотерапевтических режимов при МРЛ с включением Таксола, Таксотера, топотекана, иринотекана, а также гемцитабина и навельбина, позволило увеличить цифры объективного улучшения до 60-90% с полной регрессией опухоли до 50% при локализованном процессе и у 10-20% больных при распространенном. При этом 1-летняя выживаемость у больных с распространенным процессом достигла 36%, а медиана выживаемости – 10,3 мес. Использование новых схем комбинированной химиотерапии позволило увеличить длительность жизни больных МРЛ в 4-5 раз по сравнению с не леченными пациентами.
Применение новых режимов лечения позволило увеличить медиану выживаемости при локализованном процессе до 20 мес., а при распространенном – до 10 мес. Больше 2 лет живут 40% больных с локализованным процессом и 17% с распространенным, а больше 4 лет - соответственно 24% и 10% пациентов. Эти данные свидетельствуют о прогрессе в лечении МРЛ за последние 10 лет.
Вторая линия химиотерапии при МРЛ также может быть эффективна у 50-70% больных и должна применяться в зависимости от чувствительности опухоли.
Среди препаратов, обладающих активностью, в качестве 2-ой линии химиотерапии могут быть использованы топотекан и этопозид, а также различные схемы комбинированной химиотерапии.
При обследовании у большинства больных (две трети) обнаруживаются признаки обширного опухолевого процесса: поражение одной или обеих сторон грудной клетки или распространение метастазов. Облучение таких больных проводят только с паллиативными целями, и при назначении им даже современных химиотерапевтических препаратов прогноз оказывается крайне неблагоприятным.
Для больных с более ограниченным характером заболевания (поражение одной стороны грудной клетки) основным методом лечения является химиотерапия.
Давно известно, что мелкоклеточная карцинома легкого является быстрорастущей опухолью, которая к моменту постановки диагноза уже дает метастазы. Поэтому при лечении таких больных используется системный подход. Опухоль довольно чувствительна (по крайней мере вначале) к цитотоксическим препаратам, и основным методом лечения стала химиотерапия.
Крайне редко при мелкоклеточном раке легкого обнаруживают лишь небольшую опухоль, не затрагивающую лимфатические узлы средостения. В таких случаях опухоль можно удалить и после операции назначить больному курс химиотерапии. По данным клинических исследований, проведение операции после назначения больным курса химиотерапии для снижения размеров опухоли не дает преимуществ. Поэтому обычно хирургический метод играет лишь незначительную роль в лечении мелкоклеточного рака легкого.
В одном из ранних рандомизированных исследований сравнивали эффективность лучевой терапии и ее совместного применения с химиотерапией. При этом было показано увеличение кратковременной выживаемости в группе больных, леченных двумя методами, по сравнению с группой, получавшей только курс лучевой терапии.

Некоторые химиотерапевтические препараты эффективны при изолированном применении. К числу наиболее часто используемых алкилирующих агентов относятся циклофосфамид и ифосфамид. Среди других эффективных препаратов можно отметить этопозид, таксаны, иринотекан, алкалоиды винки, цисплатин и антрациклины.
От изолированного применения препаратов в основном отказались, за исключением некоторых специальных случаев (рассматриваются ниже). В многочисленных исследованиях с использованием различных режимов и схем назначения препаратов показана их полная (25-50%) или частичная (30-50%) эффективность.
В нескольких крупных исследованиях оценивалась оптимальная продолжительность курса химиотерапии. В соответствии с общепринятой точкой зрения, оптимальным считается проведение шести курсов химиотерапии. Основным ограничивающим обстоятельством является развитие у больных нейтропении, которую частично можно предотвратить назначением гемопоэтических факторов. По данным рандомизированных исследований, при увеличении дозы препаратов выживаемость больных увеличивается.
Это достигается за счет снижения интервала между курсами или при назначении более высоких доз препаратов совместно с факторами гемопоэза. В общем, исследования не продемонстрировали настолько значимого увеличения выживаемости больных, которое оправдывало бы проявления у них токсических реакций и высокую стоимость лечения. Попытки увеличить интенсивность химиотерапии при еженедельном назначении препаратов также не привели к увеличению выживаемости больных.
Аналогичным образом, назначение в качестве средства первичного лечения больших доз препаратов с поддержкой аутологичных стволовых клеток не выявило каких-либо преимуществ, хотя большинство больных реагировало на лечение.
Химиотерапевтические препараты обладают высокой токсичностью и лишь незначительно увеличивают выживаемость больных. В настоящее время удается на 2 года продлить жизнь 15-20% больных с ограниченным опухолевым процессом. Анализ выживаемости среди больных с мелкоклеточным раком легкого показал, что 8% больных с ограниченным процессом и 2,2% с распространенной опухолью живут не менее 2 лет.
Через 6 лет наблюдается рецидивирование опухоли; к этому моменту времени выживают лишь 2,6% всех больных. Даже если химиотерапия дает какой-то шанс продлить больному жизнь и, возможно, излечиться, последствия лекарственного лечения, развивающиеся особенно у ослабленных или пожилых людей, заставляют прибегать к паллиативным методам терапии. Всегда необходимо иметь в виду, что болезненная симптоматика является основной причиной плохого качества жизни.
Например, в качестве простого паллиативного средства широко практиковалось пероральное назначение этопозида. Однако, по данным двух рандомизированных исследований, оказалось, что при этом у больных развиваются признаки сильного токсикоза, резко ухудшается качество жизни, и в результате их жизнь укорачивается. При проявлении благоприятного эффекта препарата, который компенсирует развитие тяжелой побочной симптоматики, лечение отменять не следует.
Неблагоприятный прогноз мелкоклеточного рака легкого определяется рядом факторов. К числу наиболее существенных относятся: обширное заболевание, плохое физическое состояние больного, низкий уровень альбумина и ионов натрия в плазме крови, а также нарушение функции печени. Больным пожилого возраста, для которых часто характерно наличие неблагоприятных прогностических факторов, нецелесообразно назначать продолжительное лечение химиотерапевтическими препаратами.
Если опухоль не реагирует на препарат и улучшения состояния не происходит, то можно ограничиться проведением лишь 2-3 начальных циклов. Интенсивная комбинированная химиотерапия часто позволяет продлить жизнь людям молодого возраста, с опухолью в начальной стадии развития и с относительно благоприятным прогнозом. Многие больные занимают промежуточное положение между двумя этими крайними категориями, и в каждом отдельном случае врач должен выбирать наиболее подходящий метод лечения.
Неблагоприятные прогностические факторы при мелкоклеточном раке легкого:
- Плохое общее состояние больного
- Обширный опухолевый процесс
- Низкое содержание альбумина и ионов натрия в плазме крови
- Повышенный уровень щелочной фосфатазы или лактатдегидрогеназы
- Наличие метастазов в головном мозге
- Инфильтрация костного мозга опухолью или анемия
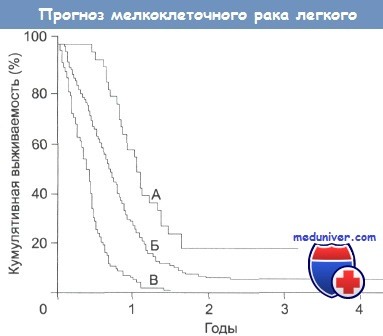
Значение прогностических факторов при мелкоклеточном раке легкого:
А — Больные характеризуются хорошим общим состоянием; результаты биохимических анализов в норме.
В — Больные с плохим общим состоянием; результаты более двух биохимических анализов отличаются от уровня нормы.
Б — Построено по данным разницы между первой и второй группой.
В мировой статистике среди всех злокачественных опухолей рак легкого занимает первое месте по показателям смертности. Пятилетняя выживаемость больных составляет 20%, то есть четверо из пяти пациентов умирают в течение нескольких лет после установления диагноза.
Сложность заключается в том, что начальные стадии бронхогенного рака трудно диагностировать (его не всегда можно увидеть на обычной флюорографии), опухоль быстро формирует метастазы, вследствие чего становится нерезектабельной. Около 75% случаев впервые установленного диагноза – это уже рак с метастатическими очагами (местными или отдаленными).
Лечение рака легких – актуальная проблема во всем мире. Именно неудовлетворенность специалистов результатами лечения мотивирует к поиску новых методов воздействия.
Основные направления
Выбор тактики напрямую зависит от гистологического строения опухоли. Принципиально выделяют 2 основных типа: мелкоклеточный рак легкого (МРЛ) и немелкоклеточный (НМРЛ), куда входят аденокарцинома, плоскоклеточный и крупноклеточный рак. Первая форма является наиболее агрессивной, рано образует метастатические очаги. Поэтому в 80% случаев применяют медикаментозное лечение. При втором гистологическом варианте — основной метод — хирургический.
Операция. В настоящее время, является единственным радикальным вариантом воздействия.

Таргетная и иммунотерапия. Относительно новые методы лечения. Основаны на целенаправленном точном воздейвлиянии на клетки опухоли. Не все случаи рака легкого подходят для такого лечения, только некоторые типы НМРЛ с определенными генетическими мутациями.
Лучевая терапия. Назначается пациентам, которым не показана операция, а также в составе комбинированного метода (предоперационное, послеоперационное облучение, химиолучевая терапия).
Симптоматическое лечение — направлено на облегчение проявлений болезни – кашля, одышки, боли и других. Применяется на любом этапе, является основным в терминальной стадии.
Хирургическое вмешательство
Оперативное лечение показано всем больным с немелкоклеточным раком легкого с 1 по 3 стадию. При МРЛ с 1 по 2 ст. Но, учитывая тот факт, что выявляемость на раннем этапе развития выявляемость новообразований крайне низкая, то хирургическое вмешательство проводится не более чем в 20% случаев.
Основные виды операций при раке легкого:
- Пульмонэктомия – удаление всего органа. Наиболее частый вариант хирургического лечения, выполняемый при центральном расположении (с поражением главных бронхов) опухоли.
- Лобэктомия – удаление доли, показанием является наличие периферического образования, исходящего из мелких воздухоносных путей.
- Клиновидная резекция – удаление одного или нескольких сегментов. Проводится редко, чаще у ослабленных больных и при доброкачественных новообразованиях.
Противопоказания для операции:
- Наличие отдаленных метастазов.
- Тяжелое общее состояние, декомпенсированные сопутствующие заболевания.
- Хронические патологии легких с имеющейся дыхательной недостаточностью.
- Близкое расположение опухоли к органам средостения (сердцу, аорте, пищеводу, трахее).
- Возраст старше 75 лет.
Перед операцией проводится подготовка больного: противовоспалительное, общеукрепляющее лечение, коррекция нарушений основных функций организма.
Операция чаще выполняется открытым методом (торакотомия), но возможно удаление доли органа и торакоскопическим доступом, что менее травматично. Вместе с тканью легкого удаляются и регионарные лимфоузлы.
После операции обычно проводится адъювантная химиотерапия. Возможно также проведение хирургического лечения после предоперационной (неоадъювантной) химиолучевой терапии.
Химиотерапия
По данным ВОЗ, химиотерапия при раке легких показана 80% больным. Химиопрепараты – это лекарства, которые либо блокируют метаболизм опухолевых клеток (цитостатики), либо напрямую отравляющие опухоль (цитотоксическое вохдействие) в результате чего деление их нарушается, карцинома замедляет свой рост и регрессирует.
Для лечения злокачественных опухолей легкого в качестве первой линии применяются препараты платины (цисплатин, карбоплатин), таксаны (паклитаксел, доцетаксел), гемцитабин, этопозид, иринотекан, циклофосфамид и другие.
Для второй линии — пеметрексед (алимта), доцетаксел (таксотер).
Применяют обычно комбинации из двух препаратов. Курсы проводятся с интервалом в 3 недели, количество — от 4-х до 6. При неэффективности 4-х курсов лечения первой линии применяются схемы второй линии.
Лечение химиопрепаратами более 6-ти циклов нецелесообразно, так как их побочные эффекты будут превалировать над пользой.
Цели химиотерапии при раке легких:
- Лечение больных с распространенным процессом (3-4 стадии).
- Неоадъювантная предоперационная терапия для уменьшения размеров первичного очага, воздействия на регионарные метастазы.
- Адъювантная послеоперационная терапия для профилактики рецидивов и прогрессии.
- В составе химиолучевого лечения при неоперабельной опухоли.
Различные гистологические типы опухолей обладают неодинаковым ответом на лекарственное воздействие. При НМРЛ эффективность химиотерапии колеблется от 30 до 60%. При МРЛ ее результативность достигает 60-78%, причем у 10-20% больных достигается полный регресс новообразования.
Химиотерапевтические препараты действуют не только на опухолевые клетки, но и на здоровые. Побочных эффектов от такого лечения обычно не избежать. Это выпадение волос, тошнота, рвота, диарея, угнетение кроветворения, токсические воспаления печени, почек.
Такое лечение не назначаются при острых инфекционных заболеваниях, декомпенсированных заболеваниях сердца, печени, почек, заболеваниях крови.
Таргетная терапия
Это относительно новый и перспективный метод лечения опухолей с метастазами. Если стандартная химиотерапия убивает все быстроделящиеся клетки, то таргетные препараты избирательно действуют на конкретные целевые молекулы, способствующие размножению раковых клеток. Соответственно они лишены тех побочных действий, которые мы наблюдаем в случае с обычными схемами.
Однако таргетная терапия подходит не всем, а только пациентам с НМРЛ при наличии определенных генетических мутаций в опухоли (не более 15% от общего числа больных).
Применяется такое лечение у пациентов с 3-4 стадиями рака чаще в комбинации с химиотерапией, но может выступать и как самостоятельный метод в случаях, когда химиопрепараты противопоказаны.
Широко применяются в настоящее время тирозинкиназные ингибиторы EGFR гефинитиб (иресса), эрлотиниб (тарцева), афатиниб, цетуксимаб. Второй класс таких препаратов – это ингибиторы ангиогенеза в опухолевой ткани (авастин).
Иммунотерапия
Это наиболее перспективный метод в онкологии. Основная его задача – усилить иммунный ответ организма и заставить его побороть опухоль. Дело в том, что раковые клетки подвержены различным мутациям. Они образуют на своей поверхности защитные рецепторы, которые препятствуют распознаванию их иммунными клетками.
Ученые разработали и продолжают разрабатывать препараты, блокирующие эти рецепторы. Это моноклональные антитела, которые помогают иммунной системе победить чужеродные опухолевые клетки.
Лучевая терапия
Лечение ионизирующим излучением направлено на повреждение ДНК раковых клеток, в результате чего они перестают делиться. Для такого лечения применяются современные линейные ускорители. При раке легкого проводится в основном дистанционная лучевая терапия, когда источник излучения не соприкасается с телом.
Лучевое лечение применяется у пациентов как с локализованным, так и с распространенным раком легкого. При 1-2 стадии выполняется пациентам с противопоказаниями к операции, а также у неоперабельных больных. Чаще проводится в комбинации с химиотерапией (одновременно или последовательно). Химиолучевой метод — основной в лечении локализованной формы мелкоклеточного рака легкого.
При метастазах в головной мозг МРЛ лучевая терапия является также основным методом лечения. Облучение применяется и как способ облегчить симптомы при сдавлении органов средостения (паллиативное облучение).
Предварительно опухоль визуализируется с помощью КТ, ПЭТ-КТ, на коже пациента наносятся метки для направления лучей.
В специальную компьютерную программу загружаются изображения опухоли, формируются критерии вохдействия. Во время процедуры важно не двигаться и задерживать дыхание по команде врача. Проводятся сеансы ежедневно. Существет гиперфракционная интенсивня методика, когда сеансы проводят каждые 6 часов.
Основные отрицательные последствия лучевой терапии: развитие эзофагита, плеврита, кашель, слабость, затруднение дыхания, редко – поражение кожи.

Воздействие происходит из нескольких положений, потоки излучения сходятся в ткани опухоли с точностью до миллиметра, не затрагивая здоровые структуры. Эффективность метода при некоторых опухолях достигает 100%.
Основные показания для системы Кибер-нож – это НМРЛ 1-2 стадии с четкими границами размером до 5 см, а также единичные метастазы. Избавиться от таких опухолей можно за один или несколько сеансов. Процедура безболезненная, бескровная, выполняется амбулаторно без наркоза. При этом не требуется строгая фиксация и задержка дыхания, как при других методах облучения.
Принципы лечения немелкоклеточного рака легкого
Стадия 0 (интраэпителиальная карцинома) – эндобронхиальное иссечение или открытая клиновидная резекция.
- I ст. — хирургическое лечение или лучевая терапия. Применяется сегментарная резекция или лобэктомия с иссечением медиастинальных лимфатических узлов. Лучевое лечение проводится пациентам с противопоказаниями к операции или отказавшимся от нее. Наилучшие результаты дает стереотаксическая радиотерапия.
- II ст. НМРЛ – хирургическое лечение (лобэктомия, пульмонэктомия с лимфаденэктомией), неоадъювантная и адъювантная химиотерапия, лучевая терапия (при неоперабельности опухоли).
- III ст. – хирургическое удаление резектабельных опухолей, радикальная и паллиативная химиолучевая терапия, таргетная терапия.
- IV ст. – комбинированная химиотерапия, таргетная, иммунотерапия, симптоматическое облучение.
Принципы лечения мелкоклеточного рака легких по стадиям
Для лучшего определения подходов к лечению онкологи делят МРЛ на локализованную стадию (в пределах одной половины грудной клетки) и обширную стадию (распространившуюся за пределы локализованной формы).
При локализованной стадии применяется:
- Комплексная химиолучевая терапия с последующим профилактическим облучением головного мозга.
Наиболее часто для химиотерапии используют препараты платины в комбинации с этопозидом (схема ЕР). Проводится 4-6 курсов с интервалом 3 недели. - Лучевое лечение, проводимое одновременно с химиолечением, считается предпочтительнее их последовательного применения. Оно назначается с первым или вторым курсом ХТ.
- Стандартный режим облучения – это ежедневно, 5 дней в неделю по 2 Гр на сеанс в течение 30-40 дней. Облучается сама опухоль, пораженные лимфоузлы, а также весь объем средостения.
- Гиперфракционный режим – это два и более сеанса облучения в сутки в течение 2-3 недель.
- Хирургическая резекция с адъювантной химиотерапией для пациентов с 1-й стадией.
При правильном и полном лечении локализованной формы МРЛ в 50% случаев достигается стойкая ремиссия.
При обширной стадии МРЛ основным методом является комбинированная химиотерапия. Наиболее эффективная схема – это EP (этопозид и препараты платины), могут быть использованы и другие комбинации.
- Облучение применяется при метастазах в головной мозг, кости, надпочечники, а также как метод паллиативного лечения при сдавлении трахеи, верхней полой вены.
- При положительном эффекте от химиотерапии проводится профилактическое краниальное облучение, оно снижает частоту метастазов в головной мозг на 70%. Суммарная доза – 25 Гр (10 сеансов по 2,5 Гр).
- Если после одного-двух курсов химиотерапии опухоль продолжает прогрессировать, продолжать ее нецелесообразно, пациенту рекомендуется только симптоматическое лечение.
Антибиотики при раке легкого
У больных раком легкого отмечается снижение местного и общего иммунитета, вследствие чего на измененной легочной ткани довольно легко может возникнуть бактериальное воспаление – пневмония, которая осложняет течение заболевания. На этапе лечения цитостатиками и облучением также возможна активация любой инфекции, даже условно-патогенная флора может вызвать тяжелое осложнение.
Поэтому антибиотики при раке легкого применяются довольно широко. Назначать их желательно с учетом бактериологического исследования микрофлоры.
Симптоматическое лечение
Симптоматическое лечение применяется на любых стадиях рака легкого, но на терминальном этапе оно становится основным и называется паллиативным. Такое лечение направлено на облегчение симптомов заболевания, улучшения качества жизни пациента.
- Облегчение кашля. Кашель при раке легкого может быть сухим надсадным (он обусловлен раздражением бронхов растущей опухолью) и влажным (при сопутствующем воспалении бронхов или легочной ткани). При сухом кашле применяются противокашлевые средства (кодеин), при влажном – отхаркивающие. Облегчают кашель также теплое питье и ингаляции с минеральной водой и бронхолитическими средствами через небулайзер.
- Уменьшение одышки. С этой целью применяются препараты эуфиллина, ингаляции бронхолитиков (сальбутамола, беродуала), кортикостероидные гормоны (беклометазон, дексаметазон, преднизолон и другие).
- Оксигенотерапия (ингаляция дыхательной смеси, обогащенной кислородом). Уменьшает одышку и симптомы гипоксии (слабость, головокружение, сонливость). С помощью концентраторов кислорода оксигенотерапию можно осуществлять и дома.
- Эффективное обезболивание. Пациент не должен испытывать боль. Анальгетики назначаются по схеме усиления препарата и увеличения дозы, в зависимости от их эффекта. Начинают с нестероидных противовоспалительных средств и ненаркотических анальгетиков, затем возможно применение слабых опиатов (трамадол), и постепенно переходят к наркотическим препаратам (промедол, омнопон, морфин). Обезболивающие группы морфина обладают также противокашлевым эффектом.
- Удаление жидкости из плевральной полости. Рак легкого часто сопровождается выпотным плевритом. Это утяжеляет состояние больного, усугубляет одышку. Жидкость удаляют путем торакоцентеза – прокола грудной стенки. Для уменьшения скорости повторного накопления жидкости применяют мочегонные препараты.
- Дезинтоксикационная терапия. Для уменьшения выраженности интоксикации (тошноты, слабости, лихорадки) проводят инфузионную поддержку солевыми растворами, глюкозы, метаболических и сосудистых препаратов.
Кровоостанавливающие средства при кровотечении и кровохарканье. - Противорвотные лекарства.
- Транквилизаторы и нейролептики. Они усиливают действие анальгетиков, уменьшают субъективное ощущение одышки, снимают тревогу, улучшают сон.
Заключение
Рак легкого – заболевание в большинстве случаев с неблагоприятным прогнозом. Однако лечить его можно на любой стадии. Целью может быть как полное выздоровление, так и замедление прогрессирования процесса, облегчение симптомов и улучшение качества жизни, как при любом хроническом заболевании.
Читайте также:

