Лучевая терапия при раке печени последствия
Среди первичных злокачественных новообразований печени наиболее часто встречается гепатоцеллюлярная карцинома, или печеночно-клеточный рак, который, как видно из названия, берет свой рост в гепатоцитах — клетках печени. Значительно реже регистрируют злокачественные опухоли, растущие из эпителия внутрипеченочных желчных протоков — холангиокарциномы, а также смешанные новообразования — гепатохолангиокарциномы.
Рак печени занимает третье место в структуре смертности от онкологических заболеваний в мире, и каждый год уносит жизни около миллиона человек. Наиболее часто патология регистрируется в возрасте 40-50 лет, при этом мужчины страдают от заболевания в 4-9 раз чаще, чем женщины.
Факторы риска
Менее 10% рака развивается в исходно здоровой печени. В остальных случаях ему предшествуют различные патологические состояния:
- цирроз печени;
- вирусные гепатиты В и С;
- алкогольная болезнь печени;
- аутоиммунное воспаление;
- токсическое повреждение, в частности афлатоксинами и винилхлоридом;
- наследственная патология, сопровождающаяся дефицитом α1- антитрипсина.
Показательно, что наиболее высока заболеваемость раком печени в регионах с высоким уровнем вирусных гепатитов. Установлено, что у носителей гепатита В гепатоцеллюлярная карцинома встречается почти в 100 раз чаще, чем у остальных пациентов.
Знание факторов риска позволяет определить группы риска для проведения скрининговых исследований. Пациентам с циррозом печени, носителям вируса гепатита В, людям с семейным анамнезом по раку печени рекомендовано регулярная ультразвуковая томография печени с определением уровня альфа-фетопротеина (АФП) в крови, повышенное содержание которого является основанием для более глубокого исследования.
Клиническая картина
Симптомы заболевания и жалобы пациента, как правило, не отличаются специфичностью, поэтому на ранних стадиях выявить рак печени можно практически исключительно в ходе скрининга. На более поздних стадиях у еще достаточно стабильных пациентов появляются:
- неопределенные боли в животе;
- потеря веса;
- ухудшение общего состояния;
- лихорадка (не всегда);
- пальпируемое образование в правом подреберье;
- асцит;
- перитонит (при кровотечении).
Следует заметить, что и в этом случае, симптомы рака практически не отличаются от симптомов тяжелого поражения печени, например, вследствие цирроза, поэтому также не могут служить основанием для постановки диагноза.
Помимо этого, у части пациентов могут развиваться различные метаболические нарушения, в частности: повышение уровня глюкозы, жиров и кальция в крови, что также иногда сопровождается соответствующими клиническими проявлениями.
Стадирование рака печени
Первичный гепатоцеллюлярный рак стадируется согласно международной системе ТNМ, где:
Т — размеры опухоли и степень ее инвазии;
N — метастазы в лимфоузлы;
М — отдаленные метастазы;
0 — отсутствие признака.
Т1 — новообразование до 2 см без инвазии в сосуды.
Т2 — опухоль менее 2 см с инвазией в сосуд, или множественные опухоли в одной доле менее 2 см без инвазии, или новообразование более 2 см без инвазии.
Т3 — более 2 см с инвазией, или множественные в одной доле менее 2 см с инвазией, или множественные одной доле размером более 2 см.
N1— метастазы в регионарных лимфоузлах.
Т4 — множественные новообразования в обеих долях, или опухоль, распространяющаяся на соседние органы или прорастающая в брюшину.
М1 — имеются отдаленные метастазы
Поскольку рак печени очень часто развивается на фоне ее цирроза, для объективной оценки состояния пациента и предполагаемой эффективности лечения применяется также BCLC, или Барселонская система стадирования, в которой присутствует 5 стадий от 0 (очень ранняя) до D (терминальная).
Диагностика рака печени
Диагностические процедуры при раке печени могут носить скрининговый и уточняющий характер. К их числу относятся:
- Исследование крови на АФП, который считается опухолевым маркером, хотя его уровень может быть повышен и при некоторых других заболеваниях печени, а также при опухолях другой локализации.
- Ультразвуковая КТ применяется как метод скрининга, а также в качестве средства навигации при проведении чрезкожной биопсии и некоторых интервенционных вмешательствах. При всех достоинствах, метод недостаточно чувствителен в отношении мелких новообразований.
- КТ и МРТ с контрастированием позволяют обнаружить типичные для гепатокарциномы изменения локального кровообращения.
Биопсия печени — надежный метод диагностики, требующий интервенционного вмешательства, которое, впрочем, при должном опыте врача достаточно безопасно. Биопсия просто необходима при небольших опухолях, в ситуациях, когда заключения, полученные иными методами, расходятся, а также при обнаружении любой опухоли в нецирротической печени. Вместе с тем биопсия может быть и не показана. Так, например, в следующих ситуациях проведение исследования нецелесообразно:
- декомпенсированный цирроз или другие тяжелые заболевания, которые делают лечение заведомо неэффективным;
- при запланированной резекции печени;
- наличие специфичной картины при проведении мультифазной КТ или МРТ.
С учетом того, что рак печени чаще всего появляется на фоне цирроза и другой патологии, требующей собственных диагностических мероприятий, в каждом случае необходима оценка выраженности фонового процесса.
Методы лечения
Лечение гепатоцеллюлярного рака — сложная задача, требующая индивидуального подхода, который учитывает наличие и степень цирроза, функциональные возможности печени, распространение опухоли. В разработке плана лечебных мероприятий принимает участие целая команда специалистов, в том числе онколога, радиолога, химиотерапевта, трансплантолога и других.
Удаление части печени
Резекция (удаление части) печени является методом выбора при раннем гепатоцеллюлярном раке. Операцию возможно провести при сохраненных функциях органа и в отсутствие портальной гипертензии. Наилучшие результаты лечения были получены у пациентов с новообразованием размерами менее 5 см.
Трансплантация
Пересадка печени показана в ситуациях, когда резекция не рекомендована, например, при множественных узлах или выраженном циррозе. При отборе пациентов для трансплантации печени используют так называемые “миланские” критерии, следуя которым удается обеспечить 5-летнюю выживаемость на уровне 70%.
Радиочастотная аблация
Метод термодеструкции, который предпочтительно применять на ранних стадиях новообразования, если невозможно выполнить резекцию и трансплантацию. Такой вариант лечения не оправдан при множественных опухолях, при большом размере узлов (более 3 см), а также у пациентов с декомпенсированным циррозом.
Трансартериальная химиоэмболизация
Введение цитостатиков в артерию, которая питает опухоль. Метод используется в паллиативном лечении неоперабельных пациентов, но не применяется при выраженном циррозе.
Лучевая терапия
Дистанционная лучевая терапия в классическом виде применяется редко, поскольку наносит существенный ущерб неповрежденным тканям печени. Хорошие перспективы имеет стереотаксическая лучевая терапия, которая позволяет минимизировать воздействие на интактные ткани.
Химиотерапия
Назначается с целью увеличить продолжительность жизни пациента. Показаниями к ней являются отдаленные метастазы и прогрессирование заболевания после лечения другими методами, а также наличие противопоказаний к другим вариантам терапии.
Какой бы способ лечения не применялся, прогноз жизни пациента зачастую определяется не только новообразованием, но и циррозом печени.
Томотерапия в лечении рака печени
В лечении рака печени, а также других опухолей, хирургическое лечение которых подчас затруднительно, а химиолучевая терапия недостаточно эффективна и безопасна, популярность приобретают стереотаксические радиологические методы, позволяющие обеспечить подачу высокой дозы радиации в границах новообразования.
Именно такой системой является TomoTherapy HD, которая представляет собой
КТ-сканер, совмещенный с устройством для облучения, что позволяет добиться точного позиционирования пациента во время каждого сеанса лечения. Основные преимущества томотерапии:
- лечение опухолей разных форм и размеров;
- одновременное лечение сразу нескольких новообразований;
- избирательное излучение, не затрагивающее здоровые ткани;
- минимум побочных эффектов;
- возможность повторного применения.
Использование TomoTherapy HD открывает новые возможности в лечении пациентов с неоперабельным раком печени, позволяя значительно улучшить их прогноз выживаемости.
Стоимость лечения рака печени лучевой терапией
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | 0 | шт. |
| Консультация врача детского онколога | 0 | шт. |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Облучение печени для разрушения развивающейся в ней первичной опухолевой структуры использовалось достаточно редко, так как крупнейший секреторный орган не способен эффективно справляться с повышенными дозами радиации. Но в современной онкологической практике появляются инновационные, практически полностью безопасные методики лучевой терапии, дающие возможность расширить область применения радиационного облучения.
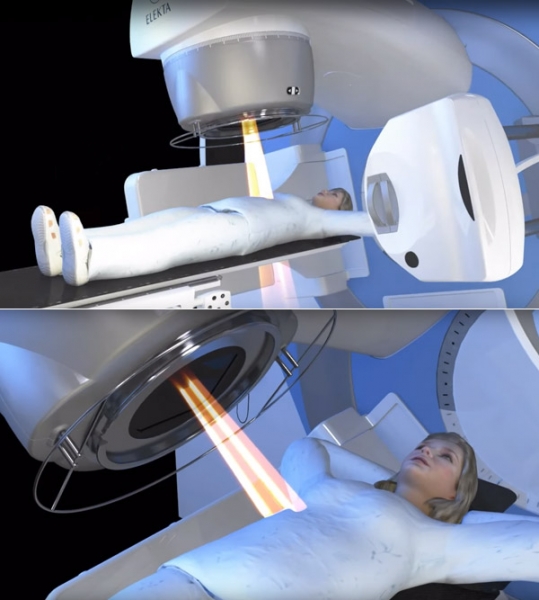
Лечение лучевой терапией рака печени 4 стадии
Более полувека назад в онкологической практике для разрушения аномальных клеток при большинстве злокачественных процессов стали применять радиотерапию, но в список опасных заболеваний не входил рак печени. Специалисты не применяли доказавшее свою эффективность облучение на секреторном органе, так как его здоровые клетки (гепатоциты) оказались очень восприимчивы к этой терапевтической процедуре – под действием радиационных лучей они сразу же погибали, усугубляя и без того тяжёлое состояние больного человека. Но, благодаря стремительному развитию онкологического направления в медицине, на сегодняшний день лучевая терапия при раке печени, основной целью которой является разрушение мутировавших печёночных клеток, стала максимально безопасной.
Она назначается в следующих случаях:
- Предоперационная лучевая терапия. В задачи этого метода облучения входит уничтожение непосредственно перед проведением хирургического вмешательства наиболее измененных клеток, что приводит к уменьшению размеров опухолевой структуры, уменьшению степени её злокачественности и облегчению процедуры оперативного воздействия. Операция назначается на 2-3 день после того, как закончен курс неоадъювантной ЛТ.
- Послеоперационная лучевая терапия. Её целью является разрушение оставшихся после хирургического лечения злокачественных микроскопических частиц, способных в кратчайшие сроки привести к рецидиву опасного заболевания. Адъювантное облучение назначают через 2- 6 недель после оперативного вмешательства, сразу же после того, как зарубцуется послеоперационная рана.
Хорошие терапевтические результаты даёт и облучение при метастазах печени. Для уничтожения вторичных злокачественных очагов применяется современная методика РЧА (радиочастотная чрезкожная абляция), которая проводится направленно и контролируемо, провоцируя активное развитие на поражённых участках асептического некроза. Здоровые клетки печёночной паренхимы и окружающие секреторный орган ткани при этой процедуре не повреждаются. Это способствует наступлению длительного периода ремиссии.
Инновационные методы лечения рака печени облучением
Хотя лекарство от злокачественных новообразований до сих пор не придумано, учёные смогли разработать множество приборов, помогающих разрушать различные типы опухолевых структур, поражающих печёночные ткани и желчные протоки. Они отлично зарекомендовали себя в онкологической практике, так как действуют быстро, максимально эффективно, и при этом практически не вызывают развития негативных реакций.
Самое большое количество положительных отзывов специалистов имеют 2 инновационных линейных ускорителя:
- TrueBeam. Данная система является настоящей революцией в терапии онкоопухолей печени и желчных протоков. Главным преимуществом линейного ускорителя считается увеличение эффективности лечения и снижение проявлений сопутствующих лучевой терапией побочных эффектов за счёт уменьшения количества сеансов и их продолжительности. Инновационный прибор имеет настолько высокую точность, что позволяет воздействовать исключительно на злокачественное новообразование, не задевая при этом здоровые печёночные клетки.
- Triology. Этот линейный ускоритель, как и TrueBeam, предназначен для использования широкого спектра как внутренних, так и внешних лучевых методик. Его применение в онкологической практике позволяет значительно расширить возможности терапии онкозаболеваний и сделать доступным излечение рака печени с помощью облучения. Воздействие ионизирующих лучей при использовании этой системы может происходить с любого угла, так как их источник вращается вокруг закреплённого на специальном столе пациента.
Стоит знать! Данные линейные ускорители при проведении радиохирургии имеют неоспоримое преимущество перед кибер- и гамма- ножом, которое обусловлено возможностью радиационного воздействия на онкоопухоли большого размера. С их помощью проводится высокоточное (точность попадания рассчитывается до долей миллиметра) попадание в злокачественное новообразование, поразившее любой участок секреторного органа.
Виды лучевой терапии
Облучение при раке печени в современной клинической практике применяется всё ещё не так часто. Причиной тому служит отсутствие в большинстве медицинских учреждений оборудования, позволяющего сделать процедуру лечения ионизирующими лучами печёночной паренхимы полностью безопасной. Инновационные линейные ускорители имеют очень высокую стоимость, поэтому на данный момент рак печени с их помощью лечат только в некоторых ведущих онкоклиниках. С помощью этих приборов возможно проведение достаточно большого количества разновидностей облучения.
При онкологическом поражении печени назначаются следующие современные методики внешнего облучения:
- IGRT. Метод высокоточного радиационного воздействия, проводимый при непосредственном визуальном контроле. Это позволяет максимально снизить риски повреждения окружающих тканей и повысить эффективность процедуры.
- IMRT. Лучевя терапия с модулированной (преобразуемой, меняемой, по мере необходимости) интенсивностью. Такой вид облучения онкоопухоли позволяет с наибольшей точностью подбирать дозы ионизирующего излучения во всех специфических зонах опухолевой структуры, учитывая при этом трёхмерную объёмную форму новообразования.
- SBRT. Стереотактическое экстракраниальное лучевое воздействие. Метод подразумевает в ходе выполнения процедуры фиксирование онкоопухоли и одномоментное использование достаточно высокой дозы облучения, за счёт чего чаще всего бывает достаточно 1-5 сеансов радиационной терапии.
Противопоказания к проведению лучевой терапии при раке печени
Процедура облучения переносится достаточно легко и практически не имеет абсолютных противопоказаний к своему проведению, поэтому назначается большинству пациентам с раком печени. Недопустимо её проведение только в единичных случаях, имеющих непосредственную связь со следующими негативными состояниями, которыми может сопровождаться онкология в печени:
- наличие в анамнезе печёночной, почечной, сердечнососудистой недостаточности, а также активного туберкулёза и септических патологий;
- кожный диатез, открытые язвенные и гнойные очаги, расположенные на коже в местах, подпадающих под облучение;
- снижение в кровяном русле тромбоцитов (тромбоцитопения) и красных кровяных телец (анемия);
- ухудшение общего состояния вследствие наступившей после распада опухоли интоксикации;
- значительное (до критических отметок) повышение температуры и лихорадка;
- кахексия (полное истощение).
Помимо перечисленных патологических состояний, препятствующих проведению курса лучевой терапии, существует ряд относительных противопоказаний, которые имеет лучевая терапия при раке печени. Они связаны с не так давно проведённым курсом радиотерапии на другой внутренний орган, повышенной концентрацией в сыворотке крови билирубина, а также минимальным объёмом не повреждённой злокачественным процессом печени.
Показания к проведению лучевой терапии при раке печени
В настоящее время, с появлением новых инновационных методик, облучающее лечение при раке печени стало проводиться достаточно часто. Практически 70% пациентов, имеющих в анамнезе, как операбельную, так и неоперабельную опухоль печёночной паренхимы, подлежат воздействию радиационных лучей.
Как отмечают радиологи, лучевая терапия при раке печени может быть показана в следующих случаях:
- Первичный нерезектабельный рак печени, имеющий множественные очаги или очень большие размеры. В этом случае облучение позволяет уменьшить объём новообразования и сделать его операбельным.
- Метастатический рак печени. Радиочастотная абляция или эмболизация приводят к некрозу и полному разрушению проросших в печёночные ткани метастазов.
- Профилактика патологического состояния.
Но, несмотря на наличие одного или нескольких показаний к радиационному лечению, проводить его категорически не рекомендуется в том случае, если у пациента выявлены отдалённые метастазы. При раке печени прорастания аномальных клеток в самые дальние участки организма отмечается достаточно часто, поэтому специалисты перед назначением лучевой терапии проводят курс специальных диагностических исследований, способствующих их выявлению.
Подготовка к проведению лучевой терапии при раке печени
Перед началом курса облучения необходимо тщательное продумывание его плана, что обеспечит максимальный эффект процедуры с минимальными побочными эффектами, оказывающими влияние на другие части тела. В первую очередь специалист проводит разметку кожных покровов в том месте, откуда будет облучаться опухоль печени. Эта процедура достаточно кропотлива и может занимать по времени больше часа. В подготовительный период необходимо и выполнение дополнительных исследований, позволяющих оценить состояние окружающих опухоль здоровых тканей, а также уточнить место её локализации.
Также перед тем, как будет назначена и проведена лучевая терапия при раке печени, выполняются следующие расчёты:
- подбирается наиболее оптимальный способ воздействия радиации;
- рассчитываются единичная и суммарная её дозы;
- вычисляется необходимое количество сеансов.
Помощь в проведении сложных расчётов оказывает дополнительная группа высококвалифицированных специалистов, в которую входят – дозиметристы, математики и физики. Окончательное решение при процедуре планирования радиотерапии может приниматься в течение нескольких дней.
Тактика проведения процедуры облучения при раке печени
Каждый сеанс лучевой терапии занимает несколько минут. Для выполнения данной процедуры предусмотрен специальный кабинет, в котором кроме онкобольного во время проведения радиоактивных манипуляций никто не будет находиться. Перед тем, как будет начато облучение при раке печени, медицинский персонал удобно размещает пациента на процедурном столе и переходит в соседнюю комнату. Связь с облучаемым человеком во время работы линейного ускорителя будет поддерживаться по специальному переговорному устройству.
Важно! Проведение лучевой терапии не вызывает каких-либо негативных ощущений и не сопровождается болями. Всё, что требуется от больного, это соблюдение в течение нескольких минут, пока работает оборудование, максимальной неподвижности.
Курсы, схемы
Лучевая терапия при раке печени сходна с обычным рентгеном, но предполагает применение в ходе процедуры более мощного излучения. Лечение проводится в течение нескольких недель пятидневными курсами с двухдневными перерывами. Схемы, курсы и дозы подбираются на основании результатов, которые показала диагностика рака печени.
Они в каждом конкретном случае индивидуальны и могут иметь следующие показатели:
- для устранения болевых ощущений, спровоцированных давлением опухолевой структуры на окружающие ткани, на протяжении 6 недель проводится 15 фракций с суммарной дозой 20-30 Гр.;
- при поражении околопечёночных лимфоузлов в течение 5 недель выполняется 10 процедур, суммарная доза которых равняется 20-25 Гр.;
- локальное лечение рака печени, находящегося на начальном этапе развития, предусматривает проведение в течение 6 недель 30 сеансов с суммарной дозой в 60 Гр.
Лучевая терапия при раке печени, проведённая с превышением спрогнозированных специалистами порогов облучения, чревата возникновением у онкобольных острой фазы гепатита и других серьёзных осложнений. Чтобы не допустить развития опасных побочных эффектов одним из условий адекватного лечения ионизирующими лучами является неукоснительное соблюдение дозировки воздействующей на новообразование радиации.
Дополняющее лечение
Попытки удалить опухоль печени при помощи только радиационного излучения полностью безрезультативны. Онкоопухоль печени поддаётся активному разрушению только в том случае, когда в лечебных целях используется целый комплекс терапевтических процедур. Лучевое лечение рака печени, направленное на продление жизни пациента или его полное выздоровление, в обязательном порядке должно сопровождаться оперативным вмешательством и химиотерапией. Также некоторым онкобольным может быть назначен курс иммунотерапии.
Реабилитация: питание, возможные диеты
После того, как проведена радиотерапия, у многих пациентов появляются некоторые негативные проявления, связанные с воздействием радиации. В первую очередь это чувство усталости и потеря аппетита. В реабилитационных целях пациентам, проходящим курсы лучевой терапии, рекомендуется как можно больше отдыхать, не пренебрегать дополнительным сном и прогулками на свежем воздухе.
Помимо этого радиационная терапия требует от онкобольных соблюдения некоторых правил по питанию:
- в случае полного отсутствия аппетита рекомендуется отдавать предпочтение высокоэнергетическим напиткам в виде супов и молочных коктейлей;
- диета в соотношении углеводов жиров и белков должна быть полностью сбалансированной, а также включать все витаминные группы;
- в обязательном порядке следует усилить питьевой режим – в сутки необходимо выпивать не менее 2-2,5 л жидкости, включая чаи и соки;
- на столе больного, проходящего облучение, должны присутствовать молочные продукты, яйца, рыба и мясо.
Важно! Если возникают какие-либо проблемы с питанием, следует вместо основных приёмов пищи делать маленькие перекусы. Полностью отказываться от еды, ссылаясь на отсутствие аппетита, ни в коем случае нельзя, так как это ослабит и так минимальные силы онкобольного.
Осложнения и последствия лучевого лечения рака печени
Использование лучевой терапии для разрушения онкоопухоли в печени обросло большим количеством мифов. Какие только осложнения ему не приписывают. Но на самом деле всё не так уж и страшно. Последствия лучевой терапии рака печени носят исключительно индивидуальный характер, поэтому трудно предсказуемы.
Чаще всего отмечается появление следующей симптоматики:
- регулярная тошнота, временами сменяющаяся рвотными позывами;
- нарушения стула протекающие с постоянной диареей;
- повышенная слабость и ухудшение аппетита;
- проблемы с кожей в зоне облучения.
Количество побочных эффектов, сопровождающих курс облучения, разрушающего опухоль печени, минимально по сравнению с медикаментозным противоопухолевым лечением. К тому же они не долговечны – спустя короткое время после окончания процедур все показатели вернутся к норме, поэтому ни в коем случае не стоит отказываться от курса радиоактивного лечения из-за мифических побочных эффектов.
Информативное видео: SIRT — селективная внутренняя радиационная терапия

Лучевая терапия — это один из ведущих методов противоопухолевого лечения, основанный на использовании ионизирующего излучения. Может применяться как самостоятельный вид терапии, так и в рамках комбинированного/комплексного лечения (совместно с другими методами), в качестве радикальной, нео- и адъювантной, консолидирующей, профилактической и паллиативной терапии.
- Виды лучевой терапии
- Этапы лучевой терапии
- Побочные эффекты лучевой терапии
- Химиолучевая терапия

Виды лучевой терапии
Уже несколько десятилетий человечество изучает воздействие ионизирующего излучение на организм человека. При этом акцентируется внимание как на положительном, так и отрицательном эффекте, возникающем при его применении. Разрабатываются новые методы, которые позволяют добиваться максимального лечебного эффекта при снижении отрицательного действия на организм. Улучшается оборудование для проведения лучевой терапии, появляются новые технологии облучения.
Сейчас классификация методов лучевой терапии довольно обширна. Мы остановимся только на самых распространенных методиках.
При контактной лучевой терапии источник излучения вводится непосредственно в опухоль или прилегает к ее поверхности. Это позволяет прицельно облучать новообразование с минимумом воздействия на окружающие его ткани.
К контактным видам лучевой терапии относятся:
- Аппликационная лучевая терапия. Применяется при лечении поверхностно расположенных опухолей, например, новообразований кожи, слизистых оболочек гениталий. В этом случае используются индивидуально изготовленные аппликаторы, которые накладываются непосредственно на поверхность новообразования.
- Внутриполостная лучевая терапия. Источник ионизирующего излучения вводится в просвет полого органа, например, в пищевод, мочевой пузырь, прямую кишку, полость матки или влагалища. Для облучения используются специальные аппликаторы (их называют эндостатами), которые заполняются радионуклидами.
- Внутритканевое облучение. Источник ионизирующего излучения вводится непосредственно в ткань опухоли. Для этого используются интростаты, которые могут иметь вид игл, шариков, трубочек, заполненных источником излучения.
Кроме того, существует такой вид лечения, как радионуклидная терапия. В этом случае используются открытые источники излучения в виде растворов радионуклидов (радиофармацевтический препарат — РФП), которые при попадании в организм прицельно накапливаются в опухолевых очагах и уничтожают их. Чаще всего РФП вводится внутривенно. Наибольшее распространение получили следующие виды радионуклидной терапии:
- Терапия радиоактивным йодом. Используется для лечения ряда видов рака щитовидной железы, поскольку йод избирательно накапливается в тиреоидной ткани.
- Применение остеотропных РФП используется для лечения метастазов в костях или костных опухолей.
- Радиоиммунотерапия — радионуклиды присоединяют на моноклональные антитела, чтобы добиться прицельного воздействия на опухолевую ткань.
При дистанционной лучевой терапии источник излучения находится на расстоянии от тела пациента, при этом на пути его прохождения могут лежать здоровые ткани, которые в процессе проведения терапии также подвергаются облучению, что приводит к развитию осложнений разной степени выраженности. Чтобы их минимизировать, разрабатываются различные технологии, позволяющие сконцентрировать максимальную дозу ионизирующего излучения непосредственно на в мишени (опухоли). С данной целью используются:
- Короткофокусная рентгенотерапия. При облучении используется рентгеновское излучение малой и средней мощности, которое способно проникать в ткани на глубину до 12 мм. Метод назван так из-за того, что источник располагается на коротком расстоянии от облучаемой поверхности. Таким способом лечат неглубокие опухоли кожи, вульвы, конъюнктивы и век, ротовой полости.
- Гамма-терапия. Этот вид излучения имеет большую проникающую способность, поэтому может использоваться для лечения более глубоко расположенных опухолей, нежели рентген-терапия. Однако сохраняющаяся большая нагрузка на окружающие органы и ткани приводят к ограничению возможности использования данного метода в современной онкологии.
- Фотонная терапия. Именно этим видом излучения проводится лучевое лечение большинства онкологических пациентов в современном мире. Достаточно высокая проникающая способность в сочетании с высокотехнологичными способами подведения дозы (IMRT и VMAT), достаточно совершенные системы планирования позволяют очень эффективно использовать этот вид излучения для лечения пациентов с приемлемыми показателями токсичности.
- Применение корпускулярного излучения (электроны, протоны, нейтроны). Эти элементарные ядерные частицы получают на циклотронах или линейных ускорителях. Электронное излучение используют для лечения неглубоких опухолей. Большие надежды возлагаются на протонную терапию, с помощью которой можно максимально прицельно подводить высокие дозы излучения к глубоко расположенным опухолям при минимальном повреждении здоровых тканей за счет выделения радиационной дозы на определённом отрезке пробега частиц, однако пока эти виды излучения играют сравнительно небольшую роль в лечении онкологических заболевания из-за своей высокой стоимости и ряда не до конца решённых технологических аспектов реализации метода.
Этапы лучевой терапии
Весь процесс проведения лучевой терапии делят на три этапа:
- Предлучевая подготовка (КТ-симуляция), этап выбора объёмов облучения и критических структур, этап дозиметрического планирования, верификации плана лучевой терапии.
- Этап облучения.
- Постлучевой этап.
Как правило, этап планирования занимает несколько дней. В это время проводятся дополнительные исследования, которые призваны дать возможность врачу более точно оценить границы опухоли, а также состояние окружающих ее тканей. Это может повлиять на выбор вида лучевой терапии, режима фракционирования, разовой и суммарной очаговых доз. Основой же данного этапа является выполнение так называемой КТ-симуляции, то есть компьютерной томографии необходимого объёма с определёнными параметрами и в определённом положении тела пациента. Во время КТ-симуляции на кожу пациента и/или его индивидуальные фиксирующие устройства наносятся специальные метки, призванные помочь правильно укладывать пациента в дальнейшем, а также облегчить задачу навигации по время проведения сеансов облучения.
Затем врач-радиотерапевт рисует объёмы облучения и критических структур (тех, на которые будет предписано ограничение дозы) на полученных срезах КТ с учётом данных других диагностических модальностей (МРТ, ПЭТ). Далее формируется задача для медицинского физика, включающая определение доз, которые должны быть подведены к мишени, мишеням или отдельным её частям, а также тех, которые не должны быть превышены в объёмах здоровых органов и тканей. Медицинский физик разрабатывает дозиметрический план в соответствии с заданными параметрами, при соблюдении которых и успешной верификации данного плана на фантоме, можно считать пациента готовым к лучевой терапии.
На этапе подготовки к лучевой терапии пациенту рекомендуется придерживаться нескольких правил:
- Отказаться от средств, раздражающих кожу.
- Если на коже в месте воздействия имеются повреждения или элементы сыпи, следует проконсультироваться с врачом.
- Если предполагается лучевая терапия в челюстно-лицевой области, требуется санация полости рта.
- Воздержаться от загара.
- Главное правило на любом этапе: обсудить все нюансы предстоящих подготовки и лечения с лечащим врачом-радиотерапевтом и строго придерживаться полученных рекомендаций!
Проведение этапа облучения будет зависеть от выбранного метода лучевой терапии.
Проведение дистанционной лучевой терапии
Продолжительность курса дистанционной лучевой терапии зависит от выбранного режима фракционирования, а также цели лечения. Паллиативные курсы, как правило, короче неоадъювантных и адъювантных, а те, в свою очередь, менее продолжительны, чем радикальные. Однако подведение радикальной дозы возможно и за один-несколько сеансов в зависимости от клинической ситуации. В таком случае курс дистанционной лучевой терапии называется стереотаксической радиотерапией или радиохирургией. Варьирует и кратность сеансов в день и в неделю: чаще всего используются схемы с пятью сеансами в неделю, однако могут быть предложены и 2-3 сеанса в день (гиперфракционирование) и схемы с 1-4 и 6 сеансами в неделю.
Во время облучения пациент в подавляющем большинстве случаев располагается лежа на столе специальной установки. Крайне необходимо соблюдать полную неподвижность во время сеанса облучения. Для достижения этого могут использоваться специальные фиксирующие устройства и системы иммобилизации.
Перед тем как включить установку, медперсонал покидает помещение, и дальнейшее наблюдение осуществляется через мониторы или окно. Общение с пациентом осуществляется по громкой связи. Во время выполнения сеанса, части аппарата и стол с пациентом совершают движения по заданной траектории. Это может создавать шум и беспокойство у больного. Однако бояться этого не стоит, поскольку вся процедура контролируется.
Сам сеанс лучевой терапии может длиться как 5-10, так и 60-120 минут, чаще — 15-30 минут. Само воздействие ионизирующего излучения не вызывает никаких физических ощущений. Однако в случае ухудшения самочувствия пациента во время сеанса (выраженной боли, судороги, приступа тошноты, паники), следует позвать медицинский персонал заранее оговоренным способом; установку сразу отключат и окажут необходимую помощь.
Контактная лучевая терапия (брахитерапия)
Брахитерапия проводится в несколько этапов:
- Введение в облучаемую зону неактивных проводников — устройств, в которые затем имплантируют источник ионизирующего излучения. При внутриполостной лучевой терапии используются приспособления, называемые эндостатами. Их устанавливают непосредственно в полость облучаемого органа и рядом с ним. При внутритканевой лучевой терапии используются интростаты, которые устанавливаются непосредственно в ткань опухоли по заранее просчитанной схеме. Для контроля их установки, как правило, используются рентгенологические снимки.
- Перемещение источника излучения из хранилища в интро- и эндостаты, которые будут облучать опухолевую ткань. Время облучения и особенности поведения пациента будут зависеть от вида брахитерапии и используемого оборудования. Например, при внутритканевой терапии, после установки источника ионизирующего излучения пациент может покинуть клинику и прийти на повторную процедуру через рекомендуемый промежуток времени. Весь этот период в его организме будет находиться интростат с радионуклидами, которые будут облучать опухоль.
Проведение внутриполостной брахитерапии будет зависеть от используемых установок, которые бывают двух типов:
- Установки низкой мощности дозы. В этом случае один сеанс облучения длится около 2-х суток. Под наркозом имплантируются эндостаты. После контроля правильности их установки и введения радионуклидов, пациент переводится в специальное помещение, где должен будет находиться все время, пока длится процедура, соблюдая строгий постельный режим. Разрешается только немного поворачиваться на бок. Вставать категорически запрещено.
- Установки высокой мощности дозы. Время облучения составляет несколько минут. Для установки эндостатов наркоза не требуется. Но во время процедуры все равно необходимо лежать абсолютно неподвижно. Внутриполостная лучевая терапия установкой высокой мощности проводится несколькими сеансами с интервалами от одного дня до одной недели.
При радионуклидной терапии пациент принимает радиофармпрепараты внутрь в виде жидкого раствора, капсул или инъекций. После этого он помещается в специальную палату, имеющую изолированную канализацию и вентиляцию. По истечении определенного срока, когда мощность дозы снизится до приемлемого уровня, проводится радиологический контроль, пациент принимает душ и переодевается в чистую одежду. Для контроля результатов лечения проводится сцинтиграфия, после чего можно покинуть клинику.
Лучевая терапия является серьезным стрессом для организма. У многих пациентов в этот период ухудшается самочувствие. Чтобы его минимизировать рекомендуется придерживаться следующих правил:
- Больше отдыхать. Минимизируйте физическую и интеллектуальную нагрузку. Ложитесь спать, когда почувствуете в этом необходимость, даже если она возникла в течение дня.
- Постарайтесь сбалансировано и полноценно питаться.
- Откажитесь на время проведения терапии от вредных привычек.
- Избегайте плотной обтягивающей одежды, которая бы могла травмировать кожу.
- Следите за состоянием кожи в месте облучения. Не трите и не расчесывайте ее, используйте средства гигиены, которые вам порекомендует врач.
- Защищайте кожу от воздействия солнечных лучей — используйте одежду и головные уборы с широкими полями.

Побочные эффекты лучевой терапии
Лучевая терапия, как и другие методы противоопухолевого лечения, вызывает ряд осложнений. Они могут быть общими или местными, острыми или хроническими.
Острые (ранние) побочные эффекты развиваются во время проведения радиотерапии и в ближайшие недели после неё, а поздние (хронические) лучевые повреждения — через несколько месяцев и даже лет после ее окончания.
Угнетенное эмоциональное состояние
Подавляющее большинство пациентов, проходящих лечение по поводу злокачественного новообразования, испытывают тревожность, страх, эмоциональное напряжение, тоску и даже депрессию. По мере улучшения общего состояния, эти симптомы стихают. Чтобы облегчить их, рекомендуется чаще общаться с близкими людьми, принимать участие в жизни окружающих. При необходимости рекомендуется обратиться к психологу.
Чувство усталости
Чувство усталости начинает нарастать через 2-3 недели от начала терапии. На это время рекомендуется оптимизировать свой режим дня, чтобы не подвергаться ненужным нагрузкам. В то же время нельзя полностью отстраняться от дел, чтобы не впасть в депрессию.
Изменение крови
При необходимости облучения больших зон, под воздействие радиации попадает костный мозг. Это в свою очередь приводит к снижению уровня форменных элементов крови и развитию анемии, повышению риска кровотечения и развития инфекций. Если изменения выражены сильно, может потребоваться перерыв в облучении. В ряде случаев могут назначать препараты, стимулирующие гемопоэз (кроветворение).
Снижение аппетита
Обычно лучевая терапия не приводит к развитию тошноты или рвоты, но снижение аппетита наблюдается довольно часто. Вместе с тем, для скорейшего выздоровления требуется полноценное высококалорийное питание с высоким содержанием белка.
Побочные реакции со стороны кожи
Вероятность развития кожных реакций и их интенсивность зависят от индивидуальных особенностей пациента. В большинстве случаев через 2-3 недели в области воздействия возникает покраснение. После окончания лечения оно сменяется пигментированием, напоминающим загар. Чтобы предотвратить чрезмерные реакции, могут назначаться специальные кремы и мази, которые наносятся после окончания сеанса. Перед началом следующего их необходимо смыть теплой водой. Если реакция выражена сильно, делают перерыв в лечении.
Реакции со стороны полости рта и горла
Если облучают область головы и шеи, могут развиться лучевой стоматит, который сопровождается болью, сухостью во рту, воспалением слизистых, а также ксеростомия вследствие нарушения функции слюнных желез. В норме эти реакции проходят самостоятельно в течение месяца после окончания лучевой терапии. Ксеростомия может беспокоить пациента в течение года и более.
Осложнения со стороны молочной железы
При прохождении лучевой терапии по поводу рака молочной железы могут возникать следующие реакции и осложнения:
- Покраснение кожи груди.
- Отек груди.
- Боль.
- Изменение размера и формы железы из-за фиброза (в некоторых случаях эти изменения остаются на всю жизнь).
- Уменьшение объема движения в плечевом суставе.
- Отек руки на стороне поражения (лимфедема).
Побочное действие на органы грудной клетки
- Воспаление слизистой пищевода, которое приводит к нарушению глотания.
- Кашель.
- Образование мокроты.
- Одышка.
Последние симптомы могут свидетельствовать о развитии лучевого пневмонита, поэтому при их возникновении следует немедленно обратиться к вашему врачу.
Побочные реакции со стороны прямой кишки/петель кишечника
- Расстройство стула — диарея или наоборот, запоры.
- Боли.
- Кровянистые выделения из заднего прохода.
Побочные действия со стороны мочевого пузыря
- Учащенное болезненное мочеиспускание.
- Наличие примеси крови в моче иногда может быть настолько выраженным, что моча приобретает кроваво-красный цвет.
- Наличие патологических примесей в моче — кристаллы, хлопья, гнойное отделяемое, слизь.
- Уменьшение емкости мочевого пузыря.
- Недержание мочи.
- Развитие везиковагинальных или везикоректальных свищей.
Побочные эффекты при облучении опухолей забрюшинного пространства, печени, поджелудочной железы
- Тошнота и рвота.
- Ознобы после сеансов.
- Боли в эпигастрии.
Химиолучевая терапия
Лучевая терапия довольно редко проводится в качестве самостоятельного лечения. Чаще всего она сочетается с каким-либо другим видом лечения: хирургическим, а чаще всего — с лекарственным. Это может быть как вариант одновременной химиолучевой терапии, так и последовательной, а также варианты сочетания лучевой терапии с иммунотерапией, таргетной и гормональной терапии. Такие виды лечения могут иметь ощутимо более высокую противоопухолевую эффективность, однако необходимо тщательно оценить риски совместных побочных эффектов, поэтому принятие решения о любом объёме лечения с онкологической патологией должен принимать мультидисциплинарный онкологический консилиум.
Читайте также:

