Лучевая терапия при плоскоклеточном раке легкого
Лучевая терапия – это группа лечебных курсов. Лечение рака представляет собой облучение раковых новообразований и повреждённых клеточных тканей рентгеновскими лучами. Воздействие лучей уничтожает патологические клетки. Однако во время проведения терапии затрагиваются и здоровые ткани, что приводит к появлению неприятных для организма пациента последствий.
Лучевая терапия характеризуется целенаправленным влиянием электромагнитных волн на злокачественные наросты. Излучение успешно разрушает структуру молекул повреждённых тканей, из-за чего клетки погибают. Повышенная действенность терапии замечена при лечении клеток, предрасположенных к повышенному размножению. Поэтому процедура направлена на борьбу именно с раковыми опухолями. Патологические ткани разрушаются первоочередно.
Показания и противопоказания
При раке лёгких лучевая терапия проводится согласно результатам диагностических процедур. Перед проведением терапии пациент проходит УЗИ и компьютерную или магнитно-резонансную томографию.
Лечение назначается, если:
- метастазные клетки попали в лимфоузлы;
- опухоль с метастазами размножилась по лимфоузлам средостения;
- нарост давит на близрасположенные структуры;
- развился рецидив;
- раковые клетки распространились по диафрагме и грудной клетке;
- опухоль с метастазами перешла на стенки груди или в часть сердца;
- опухолевые ткани проникли в надключичные участки;
- как профилактика размножения поражённых клеток после торакотомии.
Также показаниями к лучевой терапии являются:
- противопоказание к проведению оперативного вмешательства;
- отказ пациента от операции;
- как вспомогательная процедура для предупреждения вторичного появления болезни.
Врачи отмечают такие противопоказания к лечению:
- ателектаз;
- разрыв опухоли;
- существование полостей;
- кровотечение;
- повышенная температура;
- огромные размеры и территории поражения лёгких;
- кумуляция жидкости в плевре;
- воспалительный процесс в лимфатических сосудах;
- отравление организма;
- активное развитие туберкулёза открытой формы;
- перенесенный инфаркт меньше 6 месяцев назад;
- диабет на стадии декомпенсации;
- сердечная недостаточность;
- осложнённые патологии почек и печени;
- нарушение психического здоровья, нестабильность эмоционального фона.
Виды лучевой терапии
Диагностирование мелкоклеточного рака лёгких характерно для редких случаев. Данная разновидность характерна для курильщиков со стажем, отличается агрессивным характером и регулярно метастазирует. Для лечения рака прибегают к химиотерапии. Процедура выступает в качестве самостоятельного мероприятия или проводится совместно с лучевой терапией. Лучевая терапия эффективна, если злокачественное образование не начало процесс активного распространения, и не наблюдается рецидива.
Данный тип онкологии требует использования терапии превентивно. Облучают жизненно важные органы, в частности головной мозг, пока не сформировались отдалённые метастазные клетки. Процедура осуществляется методом стереотаксической радиотерапии. Направление лучей рассчитывается через компьютерную 3D-модель.
Вылечить немелкоклеточный и плоскоклеточный рак поможет радиотерапия совместно с хирургическим вмешательством. Иногда операция заменяется радиотерапией. Начало лечения приходится на момент диагностирования опухоли лёгких. Процедура при онкологии на 3 этапе применяется после окончания хирургического лечения. Это позволяет снизить вероятность рецидивирования злокачественного нароста.
Лучевая терапия, независимо от типа рака лёгкого, выступает способом локального и целенаправленного использования. Благодаря изучению пределов терапии удалось создать новейшие методики. В основу одних легло применение агрессивных мероприятий, а другие направлены на подведение лучей напрямую к опухолевым клеткам. Для достижения наибольшего эффекта процедуры комбинируют с химиотерапией или хирургическим лечением.
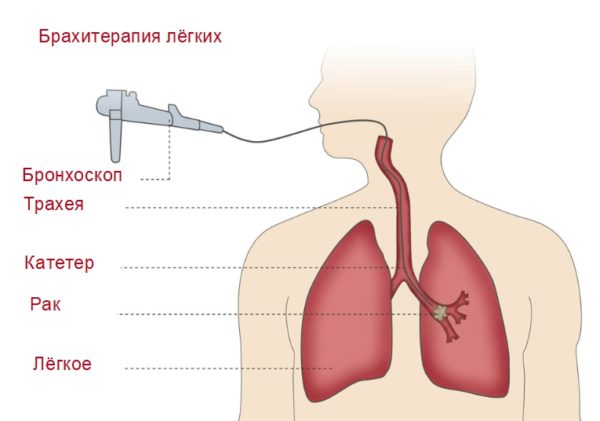
Эндобронхиальная брахитерапия назначается для нормализации путей проходимости, если новообразование подобралось близко к бронхам либо проросло в бронхиальную область. Радиотерапия при раке лёгких осуществляется под местным наркозом. В выбранный участок через фибробронхоскоп вводится зонд размером 3 мм, состоящий из полимерных материалов. На расстоянии двух крайних точек располагается аппликатор, перекрывающий опухоль на 1,5 см. Пациент находится под врачебным контролем. Также доктор прослеживает показатели артериального давления, функционирования сердца, частоту дыхания и степень поступления кислорода в кровь.
Технология лечения характеризуется повышенной действенностью. У 50% пациентов уменьшаются и проходят проявления симптомов. Положительной стороной и преимуществом схемы лечения является расположение источника излучения на близком расстоянии к поражённому участку. Высокая дозировка и влияние на здоровые ткани сокращаются. На центральную область опухоли наносится двойной удар по сравнению с периферическими тканями. Зачастую центр вырабатывает устойчивость к излучению. Показания к проведению брахитерапии:
- Расположение опухоли вблизи бронха.
- Малая величина новообразования.
- Рак, расположившийся вдали от бронхов и углубившийся в ткани лёгких. В данном случае процедура является дополнительным мероприятием к внешнему облучению.
- Улучшение путей проходимости бронхов из-за проникновения раковых клеток в бронхиальный просвет.
Методика представляет собой уничтожение опухолевых клеток при повышении дозировки облучения. При этом упор делается на клетки, способные к активному делению. Во время процедуры важно защитить здоровые ткани от попадания под облучение. Для этого создается компьютерная 3D-модель опухоли. Во время построения новообразования рассчитывается дозировка облучения и число здоровых клеток, впоследствии сэкономленных в сравнении с традиционной лучевой терапией. Также излучение не должно воздействовать на сердце.
Технология основывается на информации, полученной по мультиспиральной компьютерной и позитронно-эмиссионной томографии груди. Предварительное обследование включает в себя анализ крови, исследование мокроты, плевральную пункцию и торакоскопию. Указанные диагностические мероприятия нацелены на исключение вероятного метастазирования участков. Если конечный результат гистологического и цитологического обследования отрицательный, проводится моделирование территории облучения.
Метод раскрывает алгоритм деления раковых клеток. При применении небольших дозировок в день увеличивается суммарная дневная норма дозы, и снижается вероятность появления побочных реакций от излучения, рецидивного развития и метастазирования опухолевых клеток. При продолжительном сроке облучения выявляется отрицательное влияние на эффективность процедуры. Лечение рака проходит на протяжении 12 суток вместо 1,5 месяца. При этом суммарная дозировка достигает 54 Грей вместо 60.
Облучение осуществляется 3 раза в сутки каждые 6 часов с перерывом на сон. Единичная доза равняется 1,5 Гр. По сравнению со стандартной схемой лечения токсичность повышена. Однако превышение фиксируется только на начальных этапах после терапии.
Побочные эффекты возникают независимо от технологии применения. Отмечается высокий показатель выживаемости пациентов, подвергнувшихся указанной методике лечения, и сниженное формирование новых метастазов. Основываясь на токсичности лечения, исследователи предложили другую технологию терапии – по 2 Гр раз в сутки, 5 раз в неделю. Продолжительность курса – 5-7 недель.
Контактная представляет собой методику лечения, когда источник лучей располагается максимально близко к опухолевому очагу и находится прямо в опухоли. Для осуществления терапии применяют рентгенологическое, гамма и бета излучение. Высокая действенность схемы отмечается при некрупных наростах размером до 20 мм в диаметре. Доза рассчитывается исключительно на участок поражения. Однако терапия ухудшается при необходимости диагностировать подобный рак.
Согласно фокусной технологии лучи направляются на некотором расстоянии от поражённого места. При полостном облучении на участок вводится зонд и находится внутри на протяжении всей процедуры. Тканевый метод требует непрерывную поставку дозы. Радиохирургическая методика разрушает оставшиеся раковые клетки и очищает территории расположения опухолевых тканей после удаления. При наложенном воздействии проводится лечение аппликатором на слизистых оболочках злокачественного нароста.
Схема настраивает нужное направление потока, отодвинутого на установленное расстояние для охватывания полноценной поверхности опухоли. Ускоренные электроны и высокая энергия обеспечивают увеличенную плотность излучения. Технология допускает повышение дозы, так как благодаря установленному режиму влияния не затрагиваются здоровые клетки. Во время статистического направления пациент и аппарат попадают в стационарное состояние. Однако такая схема считается устаревшей. При подвижной схеме удаётся вращать луч согласно заданным траекториям, достигая максимальной дозировки для злокачественных тканей.
На стадии планирования врачи разрабатывают модель для расчёта дозировки, времени и путей облучения. Основываясь на изображениях, появившихся после диагностики, расписывается схема дальнейшей компьютерной обработки. Доктора разбирают методы подачи и оптимизацию поступления активного элемента. В каждой отдельной ситуации применяется разный вид излучения.
Для брахитерапии моделируют расположение катетера и время экспозиционного влияния. Планирование состоит из расчёта технологии соотношений дозировки и объёма для выявления территории поражённого участка. Параллельно врачи разрешают вопрос по сохранению и устранению максимальной площади нормальных тканей.
Возможные побочные реакции и осложнения
Максимальная эффективность терапии и применение инновационных методов лечения сопровождаются негативными побочными эффектами. Несмотря на возможность сохранения большего числа здоровых клеток, процедура вызывает неприятные симптомы. После лучевой терапии отмечают такие последствия и осложнения:
Реабилитация
После завершения курса лечения пациент проходит первый врачебный осмотр спустя 6 недель. Проходить обследования требуется раз в 3 месяца в течение двух лет. Через 2 месяца по окончанию терапии онколог проводит контрольное диагностическое исследование. Результаты компьютерной томографии отразят эффективность лечения. Полученные тесты сравнивают с прошлой картиной болезни.
Обследование позволяет врачу увидеть прохождение рубцевания клеток, что является неотъемлемой частью лучевой терапии. Анализ и диагностика способствуют своевременному обнаружению рецидива и проявления осложнений. Реабилитация требует строгого соблюдения правил и ответственного исполнения врачебных рекомендаций. В период восстановления требуется составить меню, включающее правильное и полноценное питание, а также использовать растения и травы, помогающие ослабленному организму восстановиться.
В домашних условиях пациент занимается дыхательной гимнастикой. Важно ускорить выздоровление и нормализацию привычного образа жизни. После лучевой терапии в первые 2 недели требуется:

- Выпивать достаточный объём жидкости – норма 8-10 стаканов воды.
- Отказаться от сладкого.
- Уменьшить порции, но кушать чаще. Из-за воздействия лучей пищевод и желудок ослаблены, и в них ещё наблюдается воспалительный процесс.
- Исключить из рациона молочную продукцию.
- Отказаться от острых и пряных блюд.
- Исключить сырые овощи, бобовые и цельнозерновые продукты.
- Использовать настойки из крапивы, левзеи, родиолы, сельдерея и элеутерококка.
Со временем разрешается добавлять каши из зёрен, картофель и бульоны. Продолжается травяная терапия. Также важно заняться активностью и двигательными функциями для профилактики пролежней и пневмонии. Регулярно проводится дыхательная гимнастика. Рекомендуется полностью отказаться от употребления алкогольных напитков и курения.
Эффективность лучевой терапии
Наибольшая эффективность и успех лечения рака лёгких наблюдается на начальных стадиях развития онкологических патологий. Действенность лучевой терапии основывается на:
- виде рака;
- этапе развития болезни;
- выбранном способе лечения;
- возрасте пациента;
- существующих хронических болезнях.
Брахитерапия обеспечивает повышение пятилетней выживаемости до 70%. При проведении конформационной терапии в 40% случаев у пациентов с 3 этапом опухоли отсутствует рецидив рака на протяжении 2 лет. При применении гиперфракционного способа лечения показатель выживаемости возрастает в 2 раза. Однако методика тяжело переносится людьми. Поэтому технология используется в редких случаях.
Плоскоклеточный рак легких относится к немелкоклеточному раку легких (НМРЛ). На его долю приходится около 40-50% всех случаев злокачественных новообразований бронхолегочной системы. Как правило, он развивается из эпителия крупных бронхов 2-4 порядка.
- Факторы развития плоскоклеточного рака легких
- Симптомы плоскоклеточного рака легких
- Стадии заболевания
- Диагностика плоскоклеточного рака
- Лечение плоскоклеточного рака легкого
- Выживаемость при раке легких
Основные формы плоскоклеточного рака легких:
- Центральный рак — это новообразование, которое разрастается из эпителия крупных бронхов 1-4 порядка.
- Периферический рак — эта форма рака легкого поражает мелкие периферические бронхи и альвеолы. Особенностью данной локализации является поздняя симптоматика. Первые признаки заболевания проявляются, когда опухоль начинает прорастать соседние ткани и достигает просвета крупных бронхов, или альвеол. Из-за этого опухоль поздно диагностируется, что неблагоприятно сказывается на прогнозе.
Второстепенные формы злокачественных новообразований легкого:
- Диссеминированный рак — диагностируется несколько опухолевых очагов, которые могут располагаться по всему легкому. Заболевание очень быстро прогрессирует.
- Медиастинальная форма — изначально опухоль имеет внелегочную локализацию, и поражает легкие при метастазировании в медиастинальные лимфатические узлы.
Факторы развития плоскоклеточного рака легких
Главным фактором развития плоскоклеточного рака легкого является курение. В целом у курильщиков риск развития рака легких составляет 17-20%. При отказе от курения, этот показатель снижается, поскольку ткань бронхов восстанавливается. Особенно опасно курение для женщин, принимающих гормональную терапию, у них риск погибнуть от рака легкого на 60% выше, чем у женщин, не принимающих гормоны. Помимо этого, рак легкого, развившийся у курильщика, имеет более неблагоприятное и агрессивное течение, чем аналогичное заболевание у некурящего человека.

Также канцерогенным эффектом в отношении рака легких обладают:
- Радон. Является вторым по значимости фактором риска рака легкого. Радон – это природный газ, который образуется при распаде урана, который в тех или иных концентрациях присутствует в земной коре. Концентрация радона зависит от природных особенностей почвы. В целом 100 Бк/м3 увеличивает риск рака легких на 16%.
- Асбест. Данное вещество повышает риск развития многих видов злокачественных новообразований дыхательной системы, в том числе рака легких.
- Некоторые вирусы. Сюда относят вирус папилломы человека, обезьяний вирус, цитомегаловирус и др. Они влияют на жизненный цикл клетки, блокируют апоптоз (запрограммированную гибель клетки), что провоцирует неконтролируемое деление и рост эпителия.
- Пыль. Исследования, проведенные Американским обществом рака, доказали, что увеличение содержания пыли во вдыхаемом воздухе на 1% увеличивает риск развития рака легкого на 14%.
Из эндогенных причин выделяют следующие факторы риска рака легкого:
- Хронические заболевания легких.
- Гормональные нарушения.
- Возраст старше 50 лет.
- Наследственная предрасположенность.
Симптомы плоскоклеточного рака легких
Клиническая картина рака легких зависит от локализации опухоли и стадии заболевания. Симптоматика неспецифична, т. е. все признаки могут обнаруживаться при других заболеваниях органов дыхательной системы.
Все симптомы рака легких делят на 4 группы:
- Первичные. Эти симптомы развиваются из-за воздействия опухоли на бронхи и альвеолы.
- Симптомы, которые развиваются при прорастании опухоли легких на соседние органы.
- Симптомы, развивающиеся, когда опухоль дает отдаленные метастазы. Например, метастазирование в головной мозг может проявляться признаками инсульта или менингита, при обширном поражении печени может развиваться желтуха.
- Симптомы, возникающие из-за системного воздействия рака легких на организм. Сюда относят повышение температуры тела, похудание и истощение, общую слабость и упадок сил.
Наличие и проявление первичной симптоматики будет определяться локализацией и/или размерами опухоли. Раньше всего проявляются эндофитные (растущие в просвет бронха) опухоли плоскоклеточного центрального рака легкого. Первым симптомом является кашель. Сначала он сухой, возникает из-за рефлекторного раздражения стенки бронха. Затем из-за нарушения дренирования неизбежно присоединяется инфекция, и кашель становится влажным. На этом фоне может развиться пневмония. Антибактериальная терапия приносит облегчение, но неизбежно развивается рецидив.
При закупорке просвета бронха возникает чувство нехватки воздуха. Если поражен крупный бронх, может возникнуть ателектаз (спадение доли легкого).

- Боль. Бронхи и альвеолы не имеют болевых рецепторов, поэтому болезненные ощущения возникают при прорастании опухоли в соседние ткани, например, плевру. Также причиной развития боли может стать смещение органов грудной клетки и ателектаз.
- Одышка. Развивается из-за спадения легкого или его доли, при опухолевой обтурации просвета бронха, а также при развитии опухолевого плеврита, гемоторакса и др.
- Также вторичными симптомами является осиплость голоса из-за поражения возвратного нерва, нарушение глотания из-за врастания опухоли в пищевод и др.
Стадии заболевания
При первой стадии, опухоль не превышает 3 см. Отсутствуют признаки поражения лимфатических узлов и плевры. Эта стадия бессимптомна, новообразование диагностируется случайно, при обследовании по поводу другого заболевания.
При второй стадии опухоль достигает размеров в 5 см, могут иметься единичные метастазы в регионарные лимфатические узлы. На этой стадии уже появляются клинические симптомы.
3 стадия делится на 3а и 3b. При 3а стадии размеры новообразования превышают 5 см, опухоль прорастает плевру и грудную стенку. Имеются метастазы в регионарные лимфатические узлы. На этой стадии диагностируется более половины всех случаев плоскоклеточного рака легкого.
При 3b стадии опухоль прорастает кровеносные сосуды, плевру, пищевод, перикард (может поражаться сердце). Размер опухоли может быть любым.
При выставлении 4 стадии размер опухоли не имеет значения. Ключевым моментом является наличие отдаленных метастазов.
Диагностика плоскоклеточного рака
Для диагностики плоскоклеточного рака легких необходимо специальное обследование, поскольку ни анамнез, ни симптомы, ни данные физикального осмотра не позволяют заподозрить диагноз. Могут использоваться следующие методы:
- Рентгенологическое исследование. Не является точным методом диагностики рака легкого, поскольку чаще всего не позволяет визуализировать опухоль. Тем не менее, ее наличие можно заподозрить по ряду специфических признаков, характерных для нарушения вентиляции легочной ткани. Проводится рентгенография в переднезадней и боковой проекциях. Более информативным методом рентгендиагностики является компьютерная томография. Она позволяет выявить даже начальные формы новообразования до возникновения симптомов нарушения вентиляции, а также обнаружить перибронхиальный плоскоклеточный рак.
- УЗИ проводится для обнаружения отдаленных метастазов.
- Биопсия. Для того чтобы определить морфологический и молекулярно-генетический тип опухоли, необходимо исследовать ее фрагмент в лаборатории. Эти данные влияют на тактику лечения пациента и прогноз течения заболевания. Для проведения биопсии, используются различные методы, некоторые опухоли можно пропунктировать через грудную стенку, другие – во время бронхоскопии, биопсию более глубоколежащих новообразований проводят после хирургического удаления опухоли.
Лечение плоскоклеточного рака легкого
Основным методом лечения плоскоклеточного рака легкого является хирургическая операция. Ее объем будет определяться размером опухоли и ее взаимоотношением с окружающими тканями.
При периферической локализации плоскоклеточного рака удаляется доля легкого (лобэктомия), при центральном раке — все легкое (пневмонэктомия). Ингода при центральном раке есть возможность сохранить долю пораженного легкого с помощью бронхопластических операций, когда накладываются межбронхиальные анастамозы.
Современное развитие торакальной онкохирургии и анестезиологии позволяет проводить сложные обширные вмешательства при распространенных формах плоскоклеточного рака легких. Например, при прорастании опухоли в грудную стенку, пищевод и одновременно с удалением новообразования проводится резекция пораженных органов.
Также есть технологии, которые позволяют провести стандартные вмешательства с минимальной травматичностью. Например, лобэктомия проводится посредством видеоассистированной торакоскопии — все манипуляции выполняются через небольшие проколы в грудной стенке. Для того чтобы видеть, что происходит внутри, в грудную полость вводится миниатюрная видеокамера.
После удаления опухоли, ее отправляют в лабораторию для гистологического и молекулярно-генетического исследования. В зависимости от полученных результатов, будет решаться вопрос о назначении послеоперационной адъювантной химиотерапии.
К сожалению, у подавляющего большинства больных на момент постановки диагноза имеется местнораспространенная или метастатическая форма заболевания, поэтому такие пациенты нуждаются в химиотерапии. Ее применяют в следующих случаях:
- Как паллиативное лечение плоскоклеточной формы рака 3b-4 стадии.
- Предоперационная химиотерапия.
- Адъювантная (послеоперационная) химиотерапия.
- Совместно с лучевой терапией для лечения местнораспространенных форм опухоли.
Для химиотерапии плоскоклеточного рака легкого используются следующие двухкомпонентные платиносодержащие режимы:
- Гемзар + цисплатин.
- Таксотер+цисплатин.
- Навельбин + цисплатин.
На второй линии ХТ применяются алимта, доцетаксел, эрлотиниб, этопозид, гемцитабин. В качестве препаратов 3 линии используется эрлотиниб (тарцева).
Иммунотерапия применяется при лечении распространенных стадий заболевания у пациентов, не имеющих драйверных молекулярно-генетических нарушений. Используются препараты пембролизумаб (китруда) при положительной экспрессии PD-LI, и ниволумаб. При назначении ниволумаба в рамках терапии второй линии определение PD-LI не требуется.
Суть действия данных препаратов заключается в следующем:
злокачественные клетки блокируют противоопухолевое действие Т-лимфоцитов путем связывания рецептора PD с его лигандами. Пембролизумаб является моноклональным телом, которое блокирует эту связь, тем самым делая раковые клетки заметными для иммунной системы.
Долгое время лучевая терапия была основным методом лечения плоскоклеточного рака легких 3-4 стадии. Однако его результаты были неудовлетворительными — медиана выживаемости составляла около 10 месяцев, пятилетняя выживаемость не превышала 5%. В настоящее время используется комбинированное лечение, включающее лучевую терапию в СОД 60-65Гр и двухкомпонентную платиносодержащую химиотерапию. Такое лечение позволило в 2 раза увеличить пятилетнюю выживаемость и медиану жизни.
Симптоматическая терапия плоскоклеточного рака легких
Симптоматическая терапия направлена на облегчение состояния больного и устранение тягостных симптомов заболевания:
- В первую очередь необходимо адекватное обезболивание. Для этого используется паллиативная лучевая терапия, химиотерапия, анальгетики (в том числе наркотические) и другие методы.
- Паллиативная лучевая терапия проводится при кровохаркании и обструкции бронхов.
- Для лечения экссудативного плеврита, который сопровождается одышкой, проводят плевроцентез с эвакуацией выпота и введением в плевральную полость цитостатиков. При массивной экссудате решается вопрос об установке дренажа.
- При развитии легочного кровотечения показано оперативное вмешательство, если его проведение невозможно, выполняют консервативный гемостаз.
- При массивном распаде опухоли встает вопрос о паллиативной операции.
Выживаемость при раке легких
Прогноз выживаемости определяется стадией заболевания. При радикальном хирургическом лечении на начальных стадиях удается добиться 5-летней выживаемости у 50-70% больных. При распространенных формах болезни при отсутствии лечения, средняя продолжительность жизни колеблется в пределах 9 месяцев. Специальное лечение позволяет увеличить этот показатель до 2-х лет.
В мировой статистике среди всех злокачественных опухолей рак легкого занимает первое месте по показателям смертности. Пятилетняя выживаемость больных составляет 20%, то есть четверо из пяти пациентов умирают в течение нескольких лет после установления диагноза.
Сложность заключается в том, что начальные стадии бронхогенного рака трудно диагностировать (его не всегда можно увидеть на обычной флюорографии), опухоль быстро формирует метастазы, вследствие чего становится нерезектабельной. Около 75% случаев впервые установленного диагноза – это уже рак с метастатическими очагами (местными или отдаленными).
Лечение рака легких – актуальная проблема во всем мире. Именно неудовлетворенность специалистов результатами лечения мотивирует к поиску новых методов воздействия.
Основные направления
Выбор тактики напрямую зависит от гистологического строения опухоли. Принципиально выделяют 2 основных типа: мелкоклеточный рак легкого (МРЛ) и немелкоклеточный (НМРЛ), куда входят аденокарцинома, плоскоклеточный и крупноклеточный рак. Первая форма является наиболее агрессивной, рано образует метастатические очаги. Поэтому в 80% случаев применяют медикаментозное лечение. При втором гистологическом варианте — основной метод — хирургический.
Операция. В настоящее время, является единственным радикальным вариантом воздействия.

Таргетная и иммунотерапия. Относительно новые методы лечения. Основаны на целенаправленном точном воздейвлиянии на клетки опухоли. Не все случаи рака легкого подходят для такого лечения, только некоторые типы НМРЛ с определенными генетическими мутациями.
Лучевая терапия. Назначается пациентам, которым не показана операция, а также в составе комбинированного метода (предоперационное, послеоперационное облучение, химиолучевая терапия).
Симптоматическое лечение — направлено на облегчение проявлений болезни – кашля, одышки, боли и других. Применяется на любом этапе, является основным в терминальной стадии.
Хирургическое вмешательство
Оперативное лечение показано всем больным с немелкоклеточным раком легкого с 1 по 3 стадию. При МРЛ с 1 по 2 ст. Но, учитывая тот факт, что выявляемость на раннем этапе развития выявляемость новообразований крайне низкая, то хирургическое вмешательство проводится не более чем в 20% случаев.
Основные виды операций при раке легкого:
- Пульмонэктомия – удаление всего органа. Наиболее частый вариант хирургического лечения, выполняемый при центральном расположении (с поражением главных бронхов) опухоли.
- Лобэктомия – удаление доли, показанием является наличие периферического образования, исходящего из мелких воздухоносных путей.
- Клиновидная резекция – удаление одного или нескольких сегментов. Проводится редко, чаще у ослабленных больных и при доброкачественных новообразованиях.
Противопоказания для операции:
- Наличие отдаленных метастазов.
- Тяжелое общее состояние, декомпенсированные сопутствующие заболевания.
- Хронические патологии легких с имеющейся дыхательной недостаточностью.
- Близкое расположение опухоли к органам средостения (сердцу, аорте, пищеводу, трахее).
- Возраст старше 75 лет.
Перед операцией проводится подготовка больного: противовоспалительное, общеукрепляющее лечение, коррекция нарушений основных функций организма.
Операция чаще выполняется открытым методом (торакотомия), но возможно удаление доли органа и торакоскопическим доступом, что менее травматично. Вместе с тканью легкого удаляются и регионарные лимфоузлы.
После операции обычно проводится адъювантная химиотерапия. Возможно также проведение хирургического лечения после предоперационной (неоадъювантной) химиолучевой терапии.
Химиотерапия
По данным ВОЗ, химиотерапия при раке легких показана 80% больным. Химиопрепараты – это лекарства, которые либо блокируют метаболизм опухолевых клеток (цитостатики), либо напрямую отравляющие опухоль (цитотоксическое вохдействие) в результате чего деление их нарушается, карцинома замедляет свой рост и регрессирует.
Для лечения злокачественных опухолей легкого в качестве первой линии применяются препараты платины (цисплатин, карбоплатин), таксаны (паклитаксел, доцетаксел), гемцитабин, этопозид, иринотекан, циклофосфамид и другие.
Для второй линии — пеметрексед (алимта), доцетаксел (таксотер).
Применяют обычно комбинации из двух препаратов. Курсы проводятся с интервалом в 3 недели, количество — от 4-х до 6. При неэффективности 4-х курсов лечения первой линии применяются схемы второй линии.
Лечение химиопрепаратами более 6-ти циклов нецелесообразно, так как их побочные эффекты будут превалировать над пользой.
Цели химиотерапии при раке легких:
- Лечение больных с распространенным процессом (3-4 стадии).
- Неоадъювантная предоперационная терапия для уменьшения размеров первичного очага, воздействия на регионарные метастазы.
- Адъювантная послеоперационная терапия для профилактики рецидивов и прогрессии.
- В составе химиолучевого лечения при неоперабельной опухоли.
Различные гистологические типы опухолей обладают неодинаковым ответом на лекарственное воздействие. При НМРЛ эффективность химиотерапии колеблется от 30 до 60%. При МРЛ ее результативность достигает 60-78%, причем у 10-20% больных достигается полный регресс новообразования.
Химиотерапевтические препараты действуют не только на опухолевые клетки, но и на здоровые. Побочных эффектов от такого лечения обычно не избежать. Это выпадение волос, тошнота, рвота, диарея, угнетение кроветворения, токсические воспаления печени, почек.
Такое лечение не назначаются при острых инфекционных заболеваниях, декомпенсированных заболеваниях сердца, печени, почек, заболеваниях крови.
Таргетная терапия
Это относительно новый и перспективный метод лечения опухолей с метастазами. Если стандартная химиотерапия убивает все быстроделящиеся клетки, то таргетные препараты избирательно действуют на конкретные целевые молекулы, способствующие размножению раковых клеток. Соответственно они лишены тех побочных действий, которые мы наблюдаем в случае с обычными схемами.
Однако таргетная терапия подходит не всем, а только пациентам с НМРЛ при наличии определенных генетических мутаций в опухоли (не более 15% от общего числа больных).
Применяется такое лечение у пациентов с 3-4 стадиями рака чаще в комбинации с химиотерапией, но может выступать и как самостоятельный метод в случаях, когда химиопрепараты противопоказаны.
Широко применяются в настоящее время тирозинкиназные ингибиторы EGFR гефинитиб (иресса), эрлотиниб (тарцева), афатиниб, цетуксимаб. Второй класс таких препаратов – это ингибиторы ангиогенеза в опухолевой ткани (авастин).
Иммунотерапия
Это наиболее перспективный метод в онкологии. Основная его задача – усилить иммунный ответ организма и заставить его побороть опухоль. Дело в том, что раковые клетки подвержены различным мутациям. Они образуют на своей поверхности защитные рецепторы, которые препятствуют распознаванию их иммунными клетками.
Ученые разработали и продолжают разрабатывать препараты, блокирующие эти рецепторы. Это моноклональные антитела, которые помогают иммунной системе победить чужеродные опухолевые клетки.
Лучевая терапия
Лечение ионизирующим излучением направлено на повреждение ДНК раковых клеток, в результате чего они перестают делиться. Для такого лечения применяются современные линейные ускорители. При раке легкого проводится в основном дистанционная лучевая терапия, когда источник излучения не соприкасается с телом.
Лучевое лечение применяется у пациентов как с локализованным, так и с распространенным раком легкого. При 1-2 стадии выполняется пациентам с противопоказаниями к операции, а также у неоперабельных больных. Чаще проводится в комбинации с химиотерапией (одновременно или последовательно). Химиолучевой метод — основной в лечении локализованной формы мелкоклеточного рака легкого.
При метастазах в головной мозг МРЛ лучевая терапия является также основным методом лечения. Облучение применяется и как способ облегчить симптомы при сдавлении органов средостения (паллиативное облучение).
Предварительно опухоль визуализируется с помощью КТ, ПЭТ-КТ, на коже пациента наносятся метки для направления лучей.
В специальную компьютерную программу загружаются изображения опухоли, формируются критерии вохдействия. Во время процедуры важно не двигаться и задерживать дыхание по команде врача. Проводятся сеансы ежедневно. Существет гиперфракционная интенсивня методика, когда сеансы проводят каждые 6 часов.
Основные отрицательные последствия лучевой терапии: развитие эзофагита, плеврита, кашель, слабость, затруднение дыхания, редко – поражение кожи.

Воздействие происходит из нескольких положений, потоки излучения сходятся в ткани опухоли с точностью до миллиметра, не затрагивая здоровые структуры. Эффективность метода при некоторых опухолях достигает 100%.
Основные показания для системы Кибер-нож – это НМРЛ 1-2 стадии с четкими границами размером до 5 см, а также единичные метастазы. Избавиться от таких опухолей можно за один или несколько сеансов. Процедура безболезненная, бескровная, выполняется амбулаторно без наркоза. При этом не требуется строгая фиксация и задержка дыхания, как при других методах облучения.
Принципы лечения немелкоклеточного рака легкого
Стадия 0 (интраэпителиальная карцинома) – эндобронхиальное иссечение или открытая клиновидная резекция.
- I ст. — хирургическое лечение или лучевая терапия. Применяется сегментарная резекция или лобэктомия с иссечением медиастинальных лимфатических узлов. Лучевое лечение проводится пациентам с противопоказаниями к операции или отказавшимся от нее. Наилучшие результаты дает стереотаксическая радиотерапия.
- II ст. НМРЛ – хирургическое лечение (лобэктомия, пульмонэктомия с лимфаденэктомией), неоадъювантная и адъювантная химиотерапия, лучевая терапия (при неоперабельности опухоли).
- III ст. – хирургическое удаление резектабельных опухолей, радикальная и паллиативная химиолучевая терапия, таргетная терапия.
- IV ст. – комбинированная химиотерапия, таргетная, иммунотерапия, симптоматическое облучение.
Принципы лечения мелкоклеточного рака легких по стадиям
Для лучшего определения подходов к лечению онкологи делят МРЛ на локализованную стадию (в пределах одной половины грудной клетки) и обширную стадию (распространившуюся за пределы локализованной формы).
При локализованной стадии применяется:
- Комплексная химиолучевая терапия с последующим профилактическим облучением головного мозга.
Наиболее часто для химиотерапии используют препараты платины в комбинации с этопозидом (схема ЕР). Проводится 4-6 курсов с интервалом 3 недели. - Лучевое лечение, проводимое одновременно с химиолечением, считается предпочтительнее их последовательного применения. Оно назначается с первым или вторым курсом ХТ.
- Стандартный режим облучения – это ежедневно, 5 дней в неделю по 2 Гр на сеанс в течение 30-40 дней. Облучается сама опухоль, пораженные лимфоузлы, а также весь объем средостения.
- Гиперфракционный режим – это два и более сеанса облучения в сутки в течение 2-3 недель.
- Хирургическая резекция с адъювантной химиотерапией для пациентов с 1-й стадией.
При правильном и полном лечении локализованной формы МРЛ в 50% случаев достигается стойкая ремиссия.
При обширной стадии МРЛ основным методом является комбинированная химиотерапия. Наиболее эффективная схема – это EP (этопозид и препараты платины), могут быть использованы и другие комбинации.
- Облучение применяется при метастазах в головной мозг, кости, надпочечники, а также как метод паллиативного лечения при сдавлении трахеи, верхней полой вены.
- При положительном эффекте от химиотерапии проводится профилактическое краниальное облучение, оно снижает частоту метастазов в головной мозг на 70%. Суммарная доза – 25 Гр (10 сеансов по 2,5 Гр).
- Если после одного-двух курсов химиотерапии опухоль продолжает прогрессировать, продолжать ее нецелесообразно, пациенту рекомендуется только симптоматическое лечение.
Антибиотики при раке легкого
У больных раком легкого отмечается снижение местного и общего иммунитета, вследствие чего на измененной легочной ткани довольно легко может возникнуть бактериальное воспаление – пневмония, которая осложняет течение заболевания. На этапе лечения цитостатиками и облучением также возможна активация любой инфекции, даже условно-патогенная флора может вызвать тяжелое осложнение.
Поэтому антибиотики при раке легкого применяются довольно широко. Назначать их желательно с учетом бактериологического исследования микрофлоры.
Симптоматическое лечение
Симптоматическое лечение применяется на любых стадиях рака легкого, но на терминальном этапе оно становится основным и называется паллиативным. Такое лечение направлено на облегчение симптомов заболевания, улучшения качества жизни пациента.
- Облегчение кашля. Кашель при раке легкого может быть сухим надсадным (он обусловлен раздражением бронхов растущей опухолью) и влажным (при сопутствующем воспалении бронхов или легочной ткани). При сухом кашле применяются противокашлевые средства (кодеин), при влажном – отхаркивающие. Облегчают кашель также теплое питье и ингаляции с минеральной водой и бронхолитическими средствами через небулайзер.
- Уменьшение одышки. С этой целью применяются препараты эуфиллина, ингаляции бронхолитиков (сальбутамола, беродуала), кортикостероидные гормоны (беклометазон, дексаметазон, преднизолон и другие).
- Оксигенотерапия (ингаляция дыхательной смеси, обогащенной кислородом). Уменьшает одышку и симптомы гипоксии (слабость, головокружение, сонливость). С помощью концентраторов кислорода оксигенотерапию можно осуществлять и дома.
- Эффективное обезболивание. Пациент не должен испытывать боль. Анальгетики назначаются по схеме усиления препарата и увеличения дозы, в зависимости от их эффекта. Начинают с нестероидных противовоспалительных средств и ненаркотических анальгетиков, затем возможно применение слабых опиатов (трамадол), и постепенно переходят к наркотическим препаратам (промедол, омнопон, морфин). Обезболивающие группы морфина обладают также противокашлевым эффектом.
- Удаление жидкости из плевральной полости. Рак легкого часто сопровождается выпотным плевритом. Это утяжеляет состояние больного, усугубляет одышку. Жидкость удаляют путем торакоцентеза – прокола грудной стенки. Для уменьшения скорости повторного накопления жидкости применяют мочегонные препараты.
- Дезинтоксикационная терапия. Для уменьшения выраженности интоксикации (тошноты, слабости, лихорадки) проводят инфузионную поддержку солевыми растворами, глюкозы, метаболических и сосудистых препаратов.
Кровоостанавливающие средства при кровотечении и кровохарканье. - Противорвотные лекарства.
- Транквилизаторы и нейролептики. Они усиливают действие анальгетиков, уменьшают субъективное ощущение одышки, снимают тревогу, улучшают сон.
Заключение
Рак легкого – заболевание в большинстве случаев с неблагоприятным прогнозом. Однако лечить его можно на любой стадии. Целью может быть как полное выздоровление, так и замедление прогрессирования процесса, облегчение симптомов и улучшение качества жизни, как при любом хроническом заболевании.
Читайте также:

