Как попасть в экспериментальную группу по лечению рака
Злокачественная опухоль (рак) — бесконтрольное разрастание изменившихся клеток ткани. Во время роста злокачественная опухоль нарушает нормальную работу организма. Этот термин объединяет группу из более чем 100 заболеваний.
Все онкологические заболевания очень отличаются друг от друга. Для борьбы с онкологическими заболеваниями медицина, опирающаяся на науку, предлагает три основных вида лечения: химиотерапия, лучевая терапия и оперативное вмешательство.
Многие пациенты, потерявшие надежду излечиться посредством традиционных методов терапии, соглашаются опробовать на себе экспериментальную клиническую медицину.
Экспериментальные методы терапии онкологии — это методы лечения раковых опухолей, которые на сегодняшний день не до конца апробированы и не включены в протоколы ВОЗ, находятся на стадии клинических испытаний и требуют дальнейшего изучения.
Среди экспериментальных методов лечения рака можно выделить следующие:
- Генная терапия — разработана для людей, у которых по результатам личных исследований можно предположить генетическую предрасположенность к развитию злокачественных опухолей. Основан этот метод на том, что больному вводятся в опухоль гены, побуждающие клетки погибать, или, как минимум, препятствующие их размножению.
- Криоабляция — этот метод призван заморозить пораженную ткань и ввести ее в состояние некроза. Правда, прилегающие здоровые клетки пострадают тоже.
Высокоинтенсивный сфокусированный ультразвук (HIFU) — призван разрушить пораженные клетки. - Ангиостатические лекарства — их действие направлено на препятствование образованию капилляров в опухоли. Для того, чтобы существовать и расти, опухоли необходим приток крови. После того, как разрушаются капилляры, опухоль должна погибнуть.
- Лазеротерапия — во время подобного лечения энергия светового лазерного луча трансформируется в тепловую. Способ, призванный высокой температурой погубить раковые клетки.
Также в некоторых центрах лечения онкологических заболеваний используются анаэробные бактерии, уничтожающие самый центр опухоли, иногда остающийся частично недосягаемым для других лекарственных средств, тогда как периферийная часть опухоли гибнет под воздействием химиотерапии.
Нанотерапия — один из самых смелых и фантастичных экспериментальных способов лечения рака. Введенные в организм ракового больного наногильзы с крошечными частицами золота могут сами обнаружить в организме злокачественный очаг и полностью его уничтожить.
Одним из экспериментальных методов лечения является иммунотерапия. Ее цель заключается в стимуляции иммунной системы на борьбу с раковыми клетками. Противоопухолевая вакцинация — это способ создания активного специфического противоопухолевого иммунитета в организме с помощью вакцины, содержащей иммуногенные антигены.
Таргетная терапия или "терапия цели" — последняя технология лечения раковых опухолей, основанная на принципах целевого воздействия на фундаментальные молекулярные механизмы, лежащие в основе того или иного заболевания. Она вызывает только гибель опухолевых клеток, практически не оказывая неблагоприятного воздействия на здоровые ткани организма, и, следовательно, не вызывая таких побочных эффектов.
В последнее время в развитых странах все шире используется метод химиоэмболизации, сочетающий в себе эмболизацию опухоли (т.е. прекращение в ней кровотока, что уже само по себе оказывает лечебное воздействие), а также доставку в ее ткани химиопрепарата, который концентрируется именно в опухоли и оказывает фокусированное локальное воздействие.
К экспериментальным методам лечения рака прибегают только тогда, когда все традиционные клинические способы уже испробованы и не дали результатов. В основном на экспериментальные методы решаются люди с обильно метастазирующей опухолью, а также те, к кому уже применяется не радикальное, а паллиативное лечение.
По мнению некоторых специалистов-онкологов, реальная эффективность экспериментального лечения злокачественных опухолей варьируется от 11 до 27% (в среднем эффективность равна 22%).
Новым трендом в медицине становится персонифицированный подход, при котором лечение подбирается в зависимости от молекулярно-генетических особенностей конкретного пациента. Поскольку персонифицированная медицина только начинает зарождаться, то никто из врачей не может гарантировать пациенту, что дорогостоящая химиотерапия вместо лечения его не убьет, или таргетный препарат не вызовет появления новых типов опухолей и т.д.
Каждая страна имеет свои особенности лечения. Лечение рака в США отличается высокими ценами, однако новейшие разработки лучших онкологов позволяют достигать неизменно высокого процента ремиссии у детей с диагностированным раком. Лечение рака в Германии отличается использованием классических методов, которые полностью безопасны и эффективны. Несмотря на применение оборудования последнего поколения, использование экспериментальных методов лечения не приветствуется. В Израиле использование экспериментальных технологий и препаратов значительно шире, что позволяет добиваться стабильно высоких результатов в лечении.
Одним из крупнейших и старейших медицинских центров в мире, специализирующихся на онкологии, является Мемориальный онкологический центр им. Слоуна-Кеттеринга (Memorial Sloan-Kettering Cancer Center, MSKCC) в Нью-Йорке (США). В учреждении проводятся операции по эмболизации опухоли, процедуры химической и термической абляции и др., применяются новейшие методы химиотерапии.
Немецкий центр изучения рака (DKZF) при университете Гейдельберга — один из самых авторитетных онкологических центров не только в Германии, но и в мире. Центр ионно-лучевой терапии при университете Гейдельберга активно применяет одно из самых перспективных открытий в лечении злокачественных опухолей — облучение тяжелыми ионами.
Один из самых известных частных медицинских центров Израиля — клиника Топ Ихилов (Top Ichilov Clinic). Клиника располагается на территории крупной израильской государственной больницы "Ихилов" в Тель-Авиве. Здесь применяются все известные в настоящее время методы лечения онкологических заболеваний, в том числе иммунотерапия, выжигающая терапия (воздействие на опухоль ультразвуком высокой частоты), генотерапия, воздействие на мембраны клеток опухоли. В процентном соотношении, стоимость услуг израильских специалистов ниже стоимости обслуживания в странах Европы примерно на 40% и ниже стоимости медицинских услуг в США на 60%.
Клиники Индии предлагают высокий уровень лечения онкологических заболеваний, такой же что и ведущие страны Западной Европы, Израиль и США, но по ценам в несколько раз ниже. Среди лучших онкологических клиник Индии — больница Дхарамшила (Dharamshila) в Нью-Дели и Мемориальная больница Тата (Tata Memorial) в Мумбаи, при которой работает всемирно известный Центр лечения, исследований и образования в онкологии (ACTREC). Мемориальная больница Тата — лидер в области клинических исследований. Кроме того, эта больница изыскивает возможности, чтобы бесплатно лечить почти 70% своих пациентов.
Многие экспериментальные программы проводятся в Китае, который является разработчиком целого ряда экспериментальных препаратов. Есть разработки у Японии и Южной Кореи.
В России крупнейшими государственными клиническими учреждениями онкологического профиля являются Московский научно-исследовательский онкологический институт им. П.А. Герцена, Российский онкологический научный центр им. Н.Н. Блохина РАМН, НИИ онкологии им. Н.Н. Петрова Минздрава РФ, Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева. Среди крупных частных клиник — Научно-практический центр современной хирургии и онкологии (Европейская клиника), Европейский медицинский центр (в составе сети клиник, которые функционируют по всей Европе), Швейцарская университетская клиника SwissClinic.
Многие федеральные и региональные клиники России проводят многоцентровые рандомизированнные (со случайным отбором кандидатов) контролируемые исследования по изучению новых противоопухолевых агентов, часть из которых, пройдя все фазы исследования и регистрацию, получают статус противоопухолевого лекарства на основании большой доказательной базы (так называемая "доказательная медицина"). Но до завершения этих исследований и регистрации препарата запрещено публиковать какие-либо данные, относящиеся к конкретному протоколу лечения. Сам же больной обязательно подписывает информационное согласие на участие в экспериментальном лечении.
По мнению специалистов, экспериментальных программ в России мало, нет значимых отечественных разработок. В стране ученые работают примерно со 150 лекарственными молекулами, а в мире их разрабатывается 2,5 тысячи.
В тех случаях, когда возможности отечественной медицины исчерпаны и есть возможность продолжить лечение за границей, российские онкологи сами предлагают это сделать. И тут очень нужна помощь благотворительных фондов, если не получается быстро получить государственные средства.
Внутри благотворительных фондов существует механизм принятия решения. Например, с фондом помощи детям с онкогематологическими и иными тяжелыми заболеваниями "Подари жизнь" работают медицинские эксперты — ведущие детские онкологи и гематологи страны. Именно они принимают все решения о том, будет фонд оказывать помощь или нет. Помощь фонд оказывает только в том случае, если эксперты подтвердят: лечение, которое необходимо ребенку для полного выздоровления, нельзя провести в России, но можно в зарубежной клинике. Если это не так — фонду приходится отказывать родителям. Также фонд не вправе собирать средства, если ребенку можно помочь в российской клинике, но родители хотят лечить его только за границей. В таком случае родителям приходится самим искать деньги. Если фонд собирает больше средств, чем нужно конкретному ребенку, то передает их на лечение других детей.
Уровень и квалификация российских специалистов ни в чем не уступает специалистам лучших западных онкологических центров. Многие из разрабатываемых лекарственных препаратов, включая таргетные препараты и противоопухолевые вакцины, тестируются совместно европейскими, американскими и российскими центрами с набором больных из Европы, Северной Америки и Российской Федерации.
Материал подготовлен на основе информации РИА Новости и открытых источников
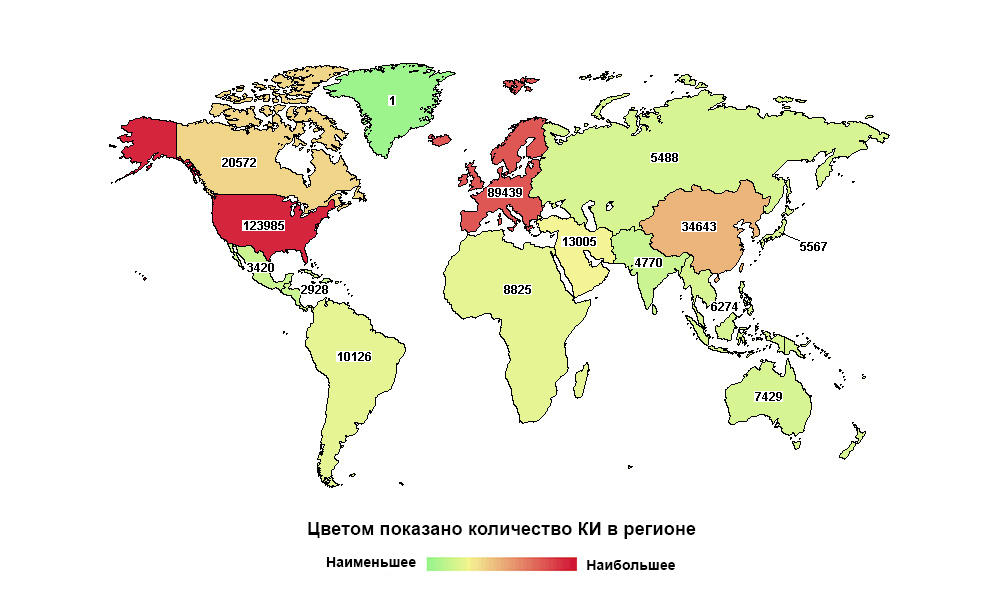
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата – единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Клиническое исследование/испытание (далее – КИ)– научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
И именно клинические исследования – основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996-97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Весь процесс создания препарата можно поделить на 3 крупных фазы.
1. Поиск идеи и доклинические исследования – в пробирках и на животных.
2. Если на этом все не закончилось – то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
3. Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
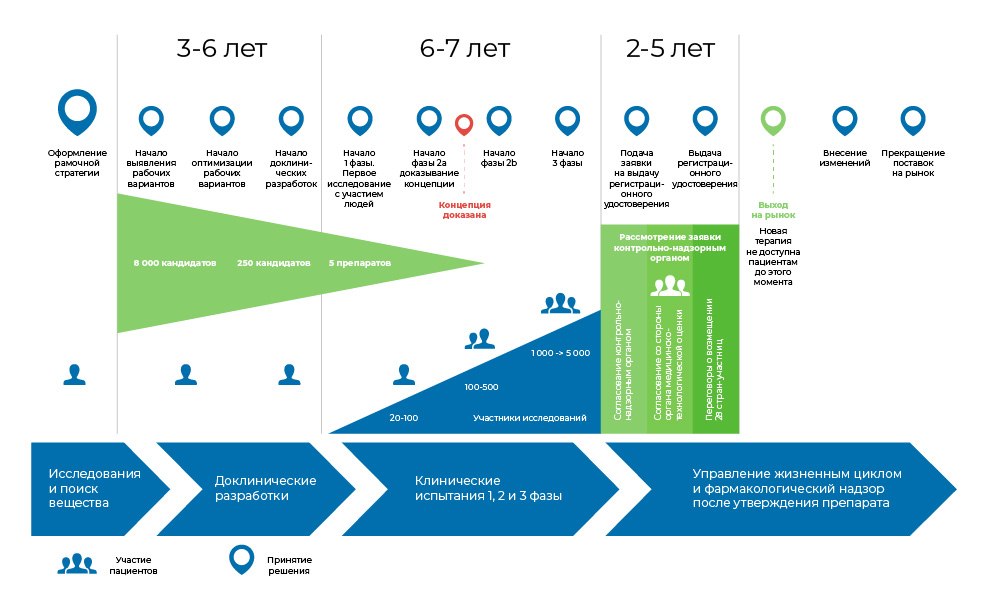
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это кому-нибудь нужно? Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности в лекарствах. По данным Всемирной организации здравоохранения, в 2018 году онкологические заболевания убили 9,6 миллиона человек. Часто опухоли обнаруживают на поздних стадиях, когда остается лишь паллиативное лечение.
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов – одно из самых наукоемких и востребованных направлений медицины.
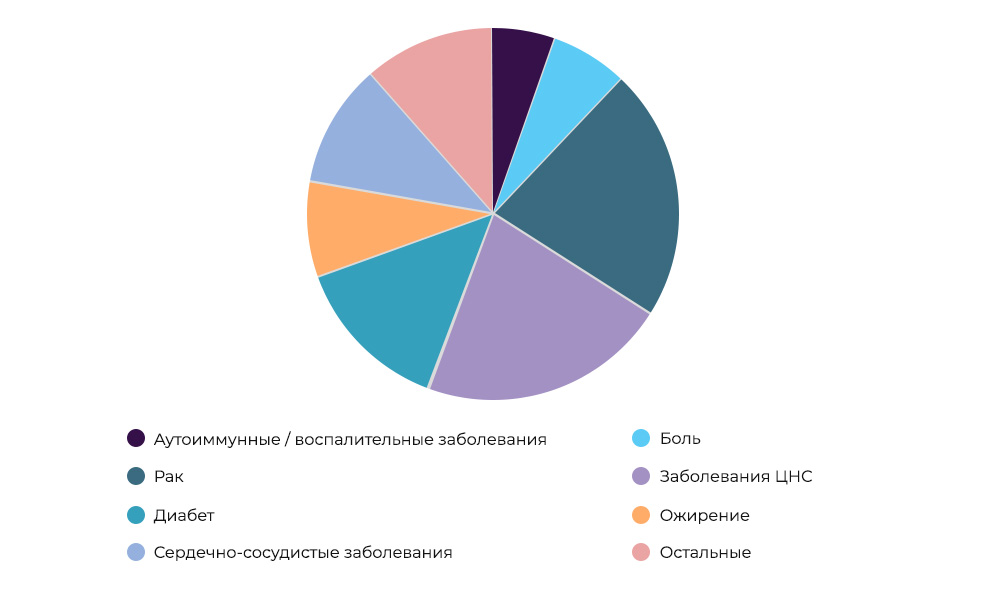
Исследования противораковых препаратов – 23% всех КИ в мире
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.

Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio – то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве – производят по специальным правилам (в России это ГОСТ Р 52249-2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь – двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий – нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
И до сих пор в медицине без опытов на животных – не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода и т.п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма, и т.п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да – то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях – пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности и т.п.
- Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста – получить оценку и заключение комитета по этике.
Комитет по этике – это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний – на людях.
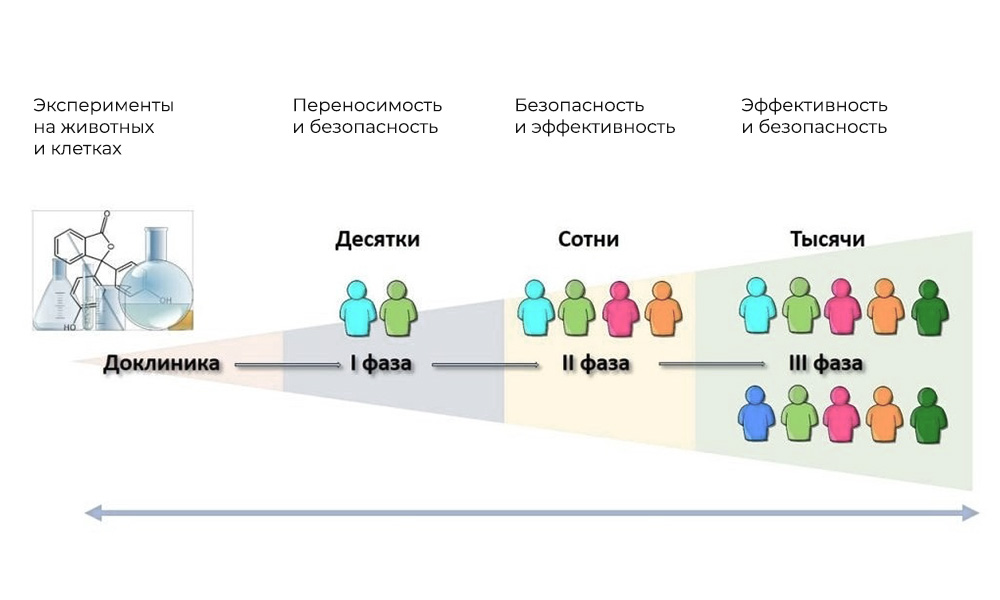
Основные фазы клинических исследований – на людях
Участники: 20 – 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Участники: 100 – 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто – плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом – с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.

Всем – одинаковые на вид, вкус и запах лекарства.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Количество участников: 300 – 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку – и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12-18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25-30% случаев от всех, что были на старте третьей фазы.
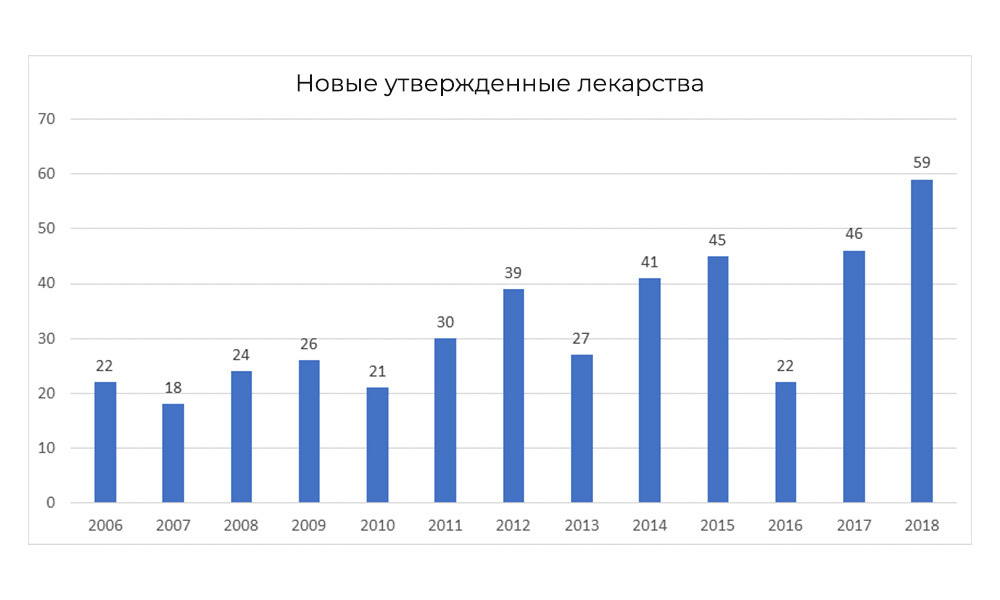
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний – 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2-3 года замедляет пациентам доступ к новым лекарствам.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер – для пациентов. Чтобы запуститься в первый раз – пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.

Для разных препаратов – разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т.п. Все это отражено в особом документе —информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались – для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет – мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике – совсем не то, что в большом НИИ, но обычно 3-4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение – бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике – если это не запрещено дизайном КИ и пациент чувствует себя хорошо – он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами – расширенной возможностью применения новых препаратов – будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
— Пётр Михайлович, не могли бы вы рассказать, в чём заключается суть вашего метода?
— Есть вирусы, которые могут подавлять рак. Они обладают онколитическими свойствами. И они безвредны для здоровья человека. Этот способ лечения практически не даёт побочных эффектов. Возможно только кратковременное повышение температуры, что является положительным признаком, говорящим о том, что вирус в организме прижился и оказывает реакцию. Это легко снимается обычными жаропонижающими средствами.
— Когда метод станет широко применяться в практической медицине?
— Сейчас основная наша задача — сертифицировать те препараты, которые у нас есть. Эта работа поддерживается Минздравом и Минобрнауки. У нас есть несколько грантов, по которым мы испытываем эти препараты. Мы делаем новые варианты онколитических вирусов с усиленными свойствами. Скоро должны начаться доклинические испытания в институте имени Смородинцева в Санкт-Петербурге. Мы уже передали туда препараты. Врачи говорят, что на испытания уйдёт месяцев пять-шесть. Учитывая ситуацию с коронавирусом, я думаю, что в начале 2021 года испытания могут быть закончены и тогда мы уже сможем договариваться с клиниками о проведении клинических испытаний.
— Что собой представляет препарат, который должен пройти испытания?
— Препарат — это живой вирус, который выращивается на культурах клеток. Это лекарство нового типа, которого не нужно много. Важно, чтобы он попал в организме в те клетки, которые чувствительны к нему. А дальше он сам размножается. То есть лекарство само себя воспроизводит уже в том месте, где оно нужно. Это раствор, 100 млн вирусных частиц в 1 мл. Но самая большая проблема в этом лечении — это способ доставки вируса в опухоль, в случае с глиобластомой — в мозг, в ту область, где находится опухоль.
Если препарат ввести просто внутривенно, то очень небольшая часть вируса может попасть в опухоль. В кровотоке есть неспецифические факторы, которые этот вирус быстро инактивируют. Кроме того, в мозгу есть гематоэнцефалический барьер, который препятствует попаданию туда всяких нежелательных агентов, в том числе и вирусов. Поэтому вирусу очень трудно добраться до опухоли.
— Как вы смогли решить эту проблему?
Эти клетки, как торпеды, идут в очаги воспалений, где находится опухоль. Там вирус выходит из них и начинает убивать опухолевые клетки. Этот метод мы уже отработали на нескольких пациентах. Есть хорошие примеры, когда на МРТ или КТ видно, как опухоль уменьшается и исчезает. Но это происходит не у всех.
— Почему же одни и те же вирусы не справляются с одними и теми же видами опухолей?
— Дело в том, что каждый конкретный вирус нашей панели действует только на 15—20% пациентов. Остальные оказываются к вирусу устойчивы. Однако у нас есть много разных вирусов, и мы можем подобрать свой для любого пациента. Но для этого нужно иметь живые клетки пациента.
Сейчас мы разрабатываем такие тесты, которые могут по обычной биопсии быстро показать, к какому вирусу опухоль будет чувствительна. Это очень сложная работа. Возможно, в будущем специальные клинические лаборатории будут получать от пациентов все необходимые материалы и в режиме конвейера проводить тестирование, подбирать препараты и далее — лечение.
Но сейчас к нам обращаются те, кому уже никто не может помочь. Некоторые из них лечатся у нас по полгода и более. Если идёт стабилизация и видно, что опухоль не растёт, мы делаем перерыв до тех пор, пока рост не возобновится. Но есть случаи, когда рост не возобновляется. У нас есть пациент, который живёт уже четыре года, притом что шансов у него не было. Глиобластома — это смертельное заболевание, средняя продолжительность жизни с ним — 12—15 месяцев с момента постановки диагноза.
— Прежде всего должен сказать, что пока это экспериментальное лечение. Когда Макаров доложил об этом методе на совещании у президента, мне кажется, он не рассчитывал на то, что это вызовет такой резонанс. Сейчас меня буквально атакуют письмами десятки больных с просьбой помочь.
Мне кажется, что не стоило рассказывать про Заворотнюк. Я знаю, что родные Анастасии долгое время вообще не комментировали её состояние и не хотели, чтобы в прессе поднимали этот вопрос. Сам я Анастасию ни разу не видел. Ко мне обращались её близкие с просьбой о помощи. Я сказал, что мы могли бы на первом этапе протестировать её клетки.
Дело в том, что во время операции были забраны живые клетки опухоли и переданы в один из институтов, где их удалось вывести в культуру клеток, чтобы они делились в пробирке. Мы взяли их и протестировали на чувствительность к нашим онколитическим вирусам, которые мы рассматриваем как средство лечения глиобластомы. Обнаружилось, что из 30 вирусов 7—8 вполне подходящие. И на этом этапе мы остановились, потому что муж Анастасии Пётр Чернышов сказал, что сейчас ситуация более-менее спокойная, если будет крайняя необходимость, они к нам обратятся. Это всё, что касается Заворотнюк.
Но всё это мы делали и делаем в очень ограниченном масштабе. Сейчас, когда всё выплеснулось в СМИ, мы просто не справимся с таким валом пациентов.
— Можете ли вы прокомментировать связь между ЭКО и появлением глиобластомы? Есть такие исследования?
— Как я понимаю, этот вопрос опять поднят историей Заворотнюк. В данном случае у неё было ЭКО. Но это никак не говорит о том, что есть какая-то связь. Во-первых, ЭКО не так много делают и глиобластомы — это 1% всех опухолей. Глиобластома встречается не только у женщин. Я думаю, что никакой связи нет. Ведь как может воздействовать ЭКО? Повышается уровень половых гормонов. Но тех гормонов, которые достаточно физиологичные, и так всегда есть в организме. Они просто появляются в другое время и в другой дозе. И вряд ли могут оказать влияние именно на глиальные клетки, с тем чтобы они переродились.
— В мире ведутся подобные исследования по лечению глиобластомы? Что вам известно об этом?
— Мы не первые, кто проверяет вирусы на глиобластоме. Сейчас это очень горячая тема во всём мире. И разные вирусы тестируют для лечения разной онкологии во многих странах. Я знаю один случай, который начали лечить в 1996 году вирусом болезни Ньюкасла, это птичий вирус. И больной до сих пор живёт с глиобластомой. Это опубликованные данные. И есть ещё несколько случаев лечения с помощью рекомбинантных вирусов герпеса.
В прошлом году вышла нашумевшая работа о том, что 20% больных глиобластомой могут быть вылечены вакциной рекомбинантного вируса полиомиелита.
Но нейрохирурги — люди консервативные. Они ни за что не согласятся даже в порядке эксперимента проводить такие опыты на людях. Потому что они очень сильно рискуют, если будет осложнение. Поэтому мы должны дождаться доклинических испытаний, с тем чтобы потом убедить их опробовать схему с прямым введением вируса прямо в опухоль.
— А кто и когда впервые заметил действие вируса на раковые клетки?
— Ещё в начале ХХ века учёные заметили, что опухолевые клетки особенно хорошо размножают вирусы. После инфекционных вирусных заболеваний у некоторых больных при разных видах рака наблюдались ремиссии. И уже тогда возникла мысль о том, что в будущем можно будет лечить онкобольных с помощью вирусов.
В 1950-е годы в Америке проводились эксперименты по лечению рака безнадёжных больных с помощью патогенных вирусов. Считалось, что это меньшее зло по сравнению с самим раком. И тогда были получены положительные результаты. Но поскольку многие больные умирали от инфекционных заболеваний, возник очень большой резонанс. Врачи, которые начали это делать, дискредитировали всю эту область на долгие годы. Были введены дополнительные этические правила. Само упоминание о том, что вирусом можно лечить рак, стало табу.
В 1990-е годы уже стало понятно, как устроены вирусы, структура их генома. Учёные научились вносить изменения в геном вирусов, чтобы сделать их безвредными. И тогда во всём мире начался бум разработки препаратов на основе вирусов для лечения рака. Но тут новая беда. Этому стали сопротивляться фармацевтические компании. Потому что это совершенно другой способ лечения, который подрывает базу их благосостояния.
В начале 10-х годов нашего века многие небольшие компании разрабатывали препараты, которые потом проходили какие-то клинические испытания, были показаны какие-то многообещающие свойства. Но фармацевтические компании скупали эти разработки и практически прекращали деятельность этих небольших стартапов.
— Удалось ли кому-нибудь преодолеть фармацевтическое лобби и зарегистрировать препарат?
— Сейчас в мире зарегистрировано три препарата онколитических вирусов. Один препарат разрешён к использованию в США для лечения злокачественных меланом. Ещё один рекомбинантный аденовирус — в Китае, и один энтеровирус — в Латвии. Но, в общем-то, каждый из этих препаратов находит пока очень ограниченное применение, из-за того что все они действуют только на часть пациентов.
— Пётр Михайлович, а как давно вы ведёте свои исследования?
— Всю жизнь, ещё с 1970-х годов. Мне выпало такое время, когда мы вначале практически ничего не знали о вирусах. И по мере того, как мы что-то узнавали, мы вносили какой-то вклад в эту науку и сами учились. И я начинал как раз с вирусов. Потом переключился на проблему рака — фундаментальные механизмы деления клеток: как нормальная клетка превращается в рак. А потом снова вернулся в вирусологию.
Должен сказать, что и мои родители были вирусологами, они занимались противополиомиелитной кампанией. Моя мать в 1970-е годы изучала, как у детей образуются антитела к полиомиелитной вакцине, и она обнаружила, что у многих детей не образуются антитела. Оказалось, что в кишечнике у детей в это время шла бессимптомная инфекция другого безвредного энтеровируса. И он вызывал неспецифическую защиту от вируса полиомиелита. Поэтому вакцинный полиовирус не мог индуцировать антитела у этих детей. Эти безвредные вирусы были выделены из кишечника здоровых детей. И на их основе были созданы живые энтеровирусные вакцины, которые испытывались для того, чтобы предотвращать какие-то ещё неизвестные инфекции.
И вот мы решили возобновить тот подход, который был предложен моей мамой, когда используется панель энтеровирусов. Оказалось, что те больные, которые нечувствительны к одному вирусу, могут быть чувствительны к другому. Возникла идея подбора вируса под пациента. Мы разработали целую панель собственных вирусов, которые могут также обладать усиленными свойствами. Мы продолжаем эту разработку.
— Ваши вирусы могут побеждать рак. А есть вирусы, которые вызывают развитие опухоли?
— Да. Например, рак шейки матки в 95% случаев вызывается вирусом папилломы. Сейчас уже есть даже вакцины против онкогенных папилломовирусов 16—18-го серотипа, которые применяются для девочек, чтобы не заболевали раком шейки матки. Но это самый большой пример. У большинства видов рака сейчас можно полностью исключить вирусную природу.
— Вы используете естественные вирусы или конструируете их?
— У нас разные есть вирусы. Как я говорил, первая панель была выделена из кишечника здоровых детей. Это природные непатогенные вирусы, которые, кстати говоря, хорошо защищают детей от многих вирусных инфекций. Кроме того, мы делаем синтетические и рекомбинантные вирусы, когда мы вводим определённые изменения в их состав, которые усиливают их онколитические свойства.
— На планете есть ещё места, где может быть очень много вирусов, о которых мы ещё и понятия не имеем. Например, те, что живут в океанских глубинах. Как вы считаете, если вдруг кто-то возьмётся за изучение океана именно с точки зрения вирусов, там могут найтись полезные для вас?
— Да, и сейчас это тоже очень горячая тема. Когда разработали метод секвенирования геномов, ДНК, РНК, то возник соблазн: профильтровать сточные воды, океанические воды, из прудов, морей. Уже пробурили скважину в Антарктиде к древнему озеру, чтобы посмотреть, что там, выделить оттуда биологические компоненты и секвенировать их. И оказывается, что нас окружает огромное количество вирусов, которые абсолютно безвредны. И такое впечатление, что наше исходное представление о вирусах как о чём-то вредном и вызывающем только болезни неверно. Болезнетворный вирус — скорее исключение, чем правило.
Читайте также:

