Выбор тактики лечения рака
Якунина М.Н, к.б.н., Шимширт А.А.
Клиника экспериментальной терапии ГУ РОНЦ им Н. Н. Блохина РАМН
Выбор тактики лечения злокачественных опухолей у животных является сложной задачей любого практикующего ветеринарного врача. При решении вопроса о лечении того или иного пациента врач должен четко расставить приоритеты и рассмотреть лечение согласно следующим критериям:
Кроме того необходимо определить стадию опухолевого процесса, ориентируясь на состояние первичного опухолевого очага, скорость роста, характер роста (экспансивный или инфильтративный), отношение новообразования к окружающим тканям, его морфологическое строение, выявить наличие метастатических поражений внутренних органов, тем самым оценив степень ее злокачественности и распространенности.
Долгое время основным методом лечения любого онкологического заболевания являлось хирургическое, однако, с развитием таких методов, как лучевая терапия и химиотерапия, оно стало носить комплексный характер.
Основные задачи лечения онкологического больного:
Необходимость проведения того или иного лечебного воздействия на опухоль, их последовательность носит индивидуальный характер и зависит от локализации процесса, его стадии, морфологического варианта опухоли, степени дифференцировки клеток, факторов прогноза.
Хирургическое лечение является основным методом при многих опухолевых заболеваниях. Задача метода состоит в удаление полного массива опухоли, при этом в 1/3 случаев можно достичь полного излечения больного. Однако он имеет ряд существенных недостатков: недоступен при нерезектабельных опухолях, не предотвращает развитие рецидива и метастазирования. Метод используется как основной, а также в качестве паллиативного в комбинации с другими при большом объёме опухолевой массы, мешающей нормально функционированию организма.
Лучевая терапия является методом локального воздействия на первичный опухолевый очаг. Задача лучевой терапии состоит в разрушение опухолевых клеток посредством ионизирующей радиации, снижении интенсивности кровообращения в патологическом очаге и перифокального воспаления. К недостаткам метода относят: невозможность выполнения в неспециализированных центрах, резистентность некоторых новообразований к лучевой терапии. Лучевая терапия применяется как самостоятельный вид воздействия на опухолевый очаг, так и в предоперационном и послеоперационном периоде с целью уменьшения объёма оперативного вмешательства и профилактики развития местных рецидивов.
Химиотерапия относится к системным методам лечения. Задача химиотерапии: разрушение опухолевых клеток путем введения антимитотических агентов, действующих на делящиеся клетки. К её недостаткам относят относительную токсичность метода. Химиотерапия используется как в предоперационном периоде с целью воздействия на первичный опухолевый очаг и микрометастазы, так и послеоперационном периоде, для предотвращения распространения опухолевого процесса.
Иммунотерапия является так же методом системного воздействия путем стимуляции противоопухолевого иммунитета.
Таким образом, особенности развития и прогрессирования спонтанных злокачественных опухолей животных определяют выбор тактики лечения, приоритет в котором принадлежит оперативному лечению в комбинации с лучевой терапий, химиотерапий и иммунотерапией.
Summary
M.N. lakunina, A.A. Shimshirt: The approach to treatment of oncological patients. "Biocontrol" veterinary clinic.
The biological behavior of malignant tumors of animals determines a choice in tactics of treatment. The basic role in treatment of malignant tumors comes in combination of surgery, radiotherapy, chemotherapy and immunotherapy.
Источник: материалы 18-Московского международного ветеринарного конгресса
Каждый день общественность получает все больше новой информации о раке простаты. Должны ли врачи проводить скрининг для его обнаружения? И как мы должны относиться к болезни, когда она диагностирована? Некоторые даже спрашивают, должны ли мы лечить рак простаты вообще. В зависимости от вашей точки зрения, ответы остаются неизвестными и даже запутанными.
В эксперименте принимали участие пациенты, которые обследовались еще до того, как был доступен анализ крови на специфический антиген простаты, и у 88% мужчин была диагностирована болезнь, которую сегодня врачи называют местно-распространенным раком простаты. Это означает, что у данных пациентов рак был обнаружен путем пальпации узелков, замеченных во время ректального обследования.
Спустя 20 лет после установления диагноза, 28% не прооперированных мужчин, которым было назначено бдительное ожидание, умерли от рака простаты, в то время как количество скончавшихся мужчин, получивших вовремя хирургическое лечение, составляет лишь 17%. Эти данные четко представляют значительную разницу в пользу операции.
Так как же это исследование вписывается в огромное количество данных результатов скрининга и лечения рака предстательной железы?
Целевая группа по превентивным мерам в США рекомендует не проводить анализ крови на специфический антиген простаты. Опираясь на выводы, сделанные из полученных данных, ученые заявили, что скрининг простаты никак не влияет на сокращение общей смертности от рака предстательной железы. Таким образом, исследователи полагают, что открытие, сделанное раннее, не приносит пользы.
Большое количество пациентов, с обнаруженным предраковым состоянием, подверглись хирургическому вмешательству. Как показала практика, лечение не принесло пользы и не повлияло на улучшения в вопросе смертности от рака простаты, поэтому теперь чаще всего предраковые состояния оставляют без лечения.
Предположим, что при помощи анализа крови на специфический антиген простаты у пациента выявляется предраковое состояние или рак на самом раннем этапе (рак с низким уровнем риска). Внимательно наблюдая за развитием болезни, врачи обеспечивают лечение тем больным, у кого низкий уровень риска становится средним или высоким, однако, рак, обнаруженный при скрининге, лечится незамедлительно. По сути, именно это и предлагает исследование, показывая, как врачам следует действовать, чтобы реально влиять на общую выживаемость.
Если мужчинам был проведен скрининг на наличие рака предстательной железы при помощи анализа крови на специфический антиген простаты и результаты обследования показали наличие заболевания, то врачи теперь знают, что лечение в данном случае необходимо. К сожалению, мужчин, у которых было выявлено предраковое состояние или рак в начальной стадии, ни раннее, ни даже позднее хирургическое вмешательство не сможет обезопасить от развития рака простаты в будущем.
Целью данного исследования было определение наилучшего пути решения при выборе между операцией и тактикой выжидания. Помимо вышеперечисленных методов лечения также существует лучевая терапия, эффективность которой сравнима с хирургическим вмешательством, поэтому лечащему врачу и пациенту следует рассмотреть все варианты лечения в равной степени.
Аннотация научной статьи по клинической медицине, автор научной работы — Насхлеташвили Д. Р., Карахан В. Б., Севян Н. В.
При выборе схем химиотерапии (ХТ) у больных с метастатическим поражением головного мозга (ГМ) традиционно учитывают в первую очередь способность препаратов проникать через гематоэнцефалический барьер (ГЭБ). Препараты паклитаксел и карбоплатин обладают низкой способностью проникать через ГЭБ при его нормальном состоянии. В настоящее время существуют экспериментальные и клинические доказательства нарушения функции ГЭБ при метастазах в ГМ. Представленный клинический случай является еще одним доказательством успешного применения стандартных подходов в выборе схем ХТ при рецидивах болезни у больных платиночувствительным раком яичников в ситуации, когда болезнь рецидивирует и прогрессирует в виде метастатического поражения ГМ. Также показано эффективное использование комбинированного лечения: ХТ в сочетании с лучевыми методами лечения (стереотаксической радиохирургией и традиционной лучевой терапией на весь ГМ) с достижением полной регрессии опухолевого процесса у больной раком яичников с метастатическим поражением ГМ.
Похожие темы научных работ по клинической медицине , автор научной работы — Насхлеташвили Д. Р., Карахан В. Б., Севян Н. В.
Choice of treatment policy for ovarian cancer patients with metastatic brain involvement
The capacity of drugs to penetrate across the blood-brain barrier (BBB) is primarily traditionally taken into account on choosing chemotherapy (CT) regimens for patients with brain metastatic involvement. Paclitaxel and carboplatin have a low ability to cross the BBB in its normal state. As of now, there is experimental and clinical evidence for BBB dysfunction in brain metastases . The described case serves as another evidence for the successful application of standard approaches to choosing CT regimens for patients with platinum-susceptible recurrent ovarian cancer when the disease recurs and progresses as brain metastatic involvement. The above example also shows the effective use of combination treatment: CT in combination with radiation treatments (stereotactic radiosurgery and conventional whole brain radiotherapy), with the complete tumor regression being achieved in a patient with ovarian cancer and brain metastatic involvement.
Выбор тактики лечения больных раком яичников с метастазами в головном мозге
Д.Р. Насхлеташвили, В.Б. Карахан, Н.В. Севян
РОНЦ им. Н.Н. Блохина РАМН, Москва
Контакты: Давид Романович Насхлеташвили Nas-david@yandex.ru
При выборе схем химиотерапии (ХТ) у больных с метастатическим поражением головного мозга (ГМ) традиционно учитывают в первую очередь способность препаратов проникать через гематоэнцефалический барьер (ГЭБ). Препараты паклитаксел и кар-боплатин обладают низкой способностью проникать через ГЭБ при его нормальном состоянии. В настоящее время существуют экспериментальные и клинические доказательства нарушения функции ГЭБ при метастазах в ГМ. Представленный клинический случай является еще одним доказательством успешного применения стандартных подходов в выборе схем ХТ при рецидивах болезни у больных платиночувствительным раком яичников в ситуации, когда болезнь рецидивирует и прогрессирует в виде метастатического поражения ГМ. Также показано эффективное использование комбинированного лечения: ХТ в сочетании с лучевыми методами лечения (стереотаксической радиохирургией и традиционной лучевой терапией на весь ГМ) с достижением полной регрессии опухолевого процесса у больной раком яичников с метастатическим поражением ГМ.
Ключевые слова: головной мозг, метастазы, рак яичников, химиотерапия
Choice of treatment policy for ovarian cancer patients with metastatic brain involvement
D.R. Naskhletashvili, V.B. Karakhan, N.V. Sevyan
N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences, Moscow
The capacity of drugs to penetrate across the blood-brain barrier (BBB) is primarily traditionally taken into account on choosing chemotherapy (CT) regimens for patients with brain metastatic involvement. Paclitaxel and carboplatin have a low ability to cross the BBB in its normal state. As of now, there is experimental and clinical evidence for BBB dysfunction in brain metastases. The described case serves as another evidence for the successful application of standard approaches to choosing CT regimens for patients with platinum-susceptible recurrent ovarian cancer when the disease recurs and progresses as brain metastatic involvement. The above example also shows the effective use of combination treatment: CT in combination with radiation treatments (stereotactic radiosurgery and conventional whole brain radiotherapy), with the complete tumor regression being achieved in a patient with ovarian cancer and brain metastatic involvement.
Key words: brain, metastases, ovarian cancer, chemotherapy
Метастазы злокачественных опухолей в центральную нервную систему (ЦНС) развиваются у пациентов в 20—25 % наблюдений. Наиболее часто в ЦНС метаста-зируют рак легкого, рак молочной железы, рак почки, желудочно-кишечного тракта и меланома. Метастазы рака яичников в головном мозге (ГМ) клинически проявляются относительно редко (1—2 % случаев). Это связано, вероятно, с прогрессированием основного заболевания, которое приводит к смерти пациенток от осложнений еще до развития метастазов в ГМ [1, 2, 4, 5].
В настоящее время нет исследований, отвечающих на вопрос, какова возможная медиана выживаемости и ответ на проводимую терапию у больных раком яичников с метастатическим поражением ЦНС в сравнении с другими пациентами (церебральные метастазы рака легкого, молочной железы, меланомы). Так, медиана выживаемости больных с церебральными метастазами зависит от биологических особенностей опухоли, чувствительности к химиотерапии (ХТ) и лучевой терапии (ЛТ). У больных меланомой с метастазами
в ГМ медиана выживаемости низкая и составляет 4—6 мес, а у больных раком молочной железы с метастатическим поражением ГМ медиана выживаемости достигает 12 мес при применении современных методов лечения. Церебральные метастазы при раке яичников возникают редко, и информация о больных основана только на данных РОНЦ им. Н.Н. Блохина РАМН, полученных в период с 1990 по 2010 г. За это время было зарегистрировано относительно небольшое — всего 23 — число подобных наблюдений, что свидетельствует о малоизученности проблемы.
Из-за редкости этой патологии стандартов лечения для данной группы пациентов в настоящее время нет. Хотя в литературе описаны случаи метастазирования рака яичников в ЦНС, в основном информация о лечении церебральных метастазов больше основана на данных пациентов с метастазами в ЦНС рака легкого, молочной железы и меланомы. Лечение этих пациентов, как правило, включает хирургию, ЛТ и ХТ. Существуют доказательства того, что хирургическое
Рис. 1. МРТ-исследование ГМ от 08.02.2010
Рис. 2. МРТ-исследование ГМ от 22.06.2010 ( после 4-го курса ХТ). Размеры метастаза 1,3 х 0,5 см
Рис. 3. МРТ-исследование ГМ от 14.07.2010 (после 6-го курса ХТ). Размеры метастаза 0,5 х 0,2 см
Рис. 4. МРТ-исследование ГМ от 13.08.2010 (после 6-го курса ХТ и стереотаксической радиохирургии)
лечение в сочетании с ХТ и ЛТ превосходит результаты комбинированного лечения (ЛТ + ХТ) у отдельных групп пациентов, при солитарных метастазах в ГМ [3, 6, 8—10].
Тем не менее применение ХТ без хирургического лечения остается независимым предиктором выживаемости. ХТ часто используется для пациентов с распространенным процессом. Следовательно, она может увеличить выживаемость, при экстра- и интракраниальных проявлениях заболевания [7].
Ниже представлено клиническое наблюдение пациентки с церебральным метастазом рака яичника, получившей комбинированное лечение (ХТ, ЛТ).
Пациентка Д., 71 год, клинический диагноз: рак яичников T3N0M0, IIIС стадия заболевания. Метастазы по брюшине, в большом сальнике.
Анамнез заболевания. 05.02.2008 больной выполнена экстирпация матки с придатками. С 05.03.2008 по 18.06.2008 проведено 6 курсов ХТ по схеме: пакли-таксел + карбоплатин. Регрессия заболевания сохранялась в течение 19 мес.
В феврале 2010 г. отмечено прогрессирование заболевания: метастаз в правую теменную долю ГМ (размеры очага 3,1 х 2,7 см) (рис. 1). В неврологическом статусе — левосторонний гемипарез (3 балла), когнитивные нарушения.
С 26.02.2010 по 24.06.2010 проведено 6 курсов полихимиотерапии (ПХТ) по схеме: паклитаксел + карбоплатин. Частичная регрессия зарегистрирована уже после 2-го курса ХТ (по данным магнитно-резонансной томографии (МРТ) ГМ отмечено уменьшение метастатического очага более чем на 50 %). Уровень СА-125 — 30 ЕД/мл (до начала лечения — 330 ЕД/мл). Неврологическая симптоматика значительно регрессировала (восстановились двигательные функции).
После проведения 3-го курса ХТразмеры метастаза составили 1,6 х 1,1 см, после 4-го —1,3 х 0,5 см (рис. 2), после 6-го — 0,5 х 0,2 см (рис. 3).
В августе 2010 г. была проведена стереотаксическая радиохирургия на область метастаза в суммарной очаговой дозе (СОД) 26 Гр, после которой была отмечена полная регрессия опухоли (рис. 4). Неврологическая симптоматика полностью регрессировала. Содержание СА-125 составило — 25 ЕД/мл.
В дальнейшем с 15.09.2010 по 12.10.2010 был проведен курс ЛТ на весь ГМ: разовая очаговая доза (РОД) 2 Гр, СОД40 Гр. После окончания лечения по данным клинического обследования подтверждена полная регрессия заболевания. Уровень СА-125 — 25 ЕД/мл. Продолжительность жизни пациентки от начала основного заболевания по настоящее время составляет 44мес. Продолжительность жизни пациентки после выявления метастаза в ЦНС составляет 20 мес, с полной регрессией заболевания.
При выборе схем ХТ у больных с метастатическим поражением ГМ традиционно учитывают в первую очередь способность препаратов проникать через гематоэнцефалический барьер (ГЭБ). Препараты па-клитаксел и карбоплатин обладают низкой способностью проникать через ГЭБ в норме. В настоящее время существуют экспериментальные и клинические доказательства нарушения функции ГЭБ при метастазах в ГМ. Вышеуказанный случай является еще одним доказательством успешного применения стандартных подходов в выборе схем ХТ при рецидивах у больных платиночувствительным раком яичников в ситуации, когда болезнь рецидивирует и прогрессирует в виде метастатического поражения ГМ.
На приведенном примере показано эффективное применение комбинированного лечения, ХТ в сочетании с лучевыми методами лечения (стереотаксическая радиохирургия и традиционная ЛТ на весь ГМ), с достижением полной регрессии опухолевого процесса у больной раком яичников с метастатическим поражением ГМ.
1. Ромаданов А.П., Зозуля Ю.А.,
Соснов Ю.Д. Метастатические опухоли головного мозга. Киев, 1973. С. 194.
2. Barker G.H., Orledge J., Wiltshaw E. Involvement of the central nervous system inpatients with ovarian carcinoma.
Br J Cancer 1981;88:690-4.
3. Bonnefoi H., A’Hern R.P., Fisher C. et al. Natural history of stage IV epithelial ovarian cancer. J Clin Oncol 1999;17:767-75.
4. Cormio G., Maneo A., Parma G. et al. Central nervous system metastases inpatients with ovarian carcinoma. Ann Oncol 1995;6:571-4.
5. Li A.J., Karlan B.Y. Genetic factors
in ovarian carcinoma. Curr Oncol Rep 2001; 3:27-32.
6. Mayer R.J., Berkowitz R.S., Griffiths C.T. Central nervous system involvement by ovarian carcinoma: A complication of prolonged survival with metastatic disease. Cancer 1978;41:776-83.
7. McGuire W.P., Ozols R.F. Chemotherapy of advanced ovarian cancer. Semin Oncol 1998;25:340-8.
8. Patchell R.A., Tibbs P.A., Walsh J.W A randomised trial in the surgery of treatment of single metastasis
to the brain. N Engl J Med 1990; 332:494-500.
Факторы риска
В настоящее время установлены различные экологические, алиментарные, гормональные, инфекционные и генетические факторы риска для многих типов онкологических заболеваний, возникающих у подростков. В отличие от раковых заболеваний у пожилых людей опухоли у подростков и молодых взрослых в большей степени обусловлены генетической предрасположенностью и воздействием модифицирующих факторов риска на ранних этапах жизни [2]. Развитие неэпителиального рака с большой вероятностью ассоциировано с вирусной инфекцией, радиацией, генетическими факторами, а также влиянием многочисленных химических канцерогенов окружающей среды. Тем не менее, большинство форм рака у подростков встречаются в виде спорадических событий с неизвестной этиологией. А такие орфанные синдромы, как Ли-Фраумени, пигментная ксеродерма, атаксия-телеангиэктазия, синдромы Тернера и Беквита-Видемана связаны с повышенным риском развития рака [3]. Вероятность возникновения острых лимфобластных и нелимфобластных лейкозов в возрастном диапазоне от 5 до 29 лет среди людей с синдромом Дауна примерно в 10 раз выше, чем в остальной группе населения [4]. Нейрофиброматоз (обычно 1-го типа) несет в себе повышенный риск для опухолей центральной нервной системы и сарком мягких тканей. Наследственный синдром Ли-Фраумени, заключающийся во врожденной предрасположенности к развитию различных новообразований, в первую очередь остеогенных сарком, сарком мягких тканей, рака молочной железы, лейкемии, опухолей мозга, адренокортикальных карцином характеризуется ранним возникновением опухолей у подростков [5]. Различные виды опухолей, особенно саркомы у молодых людей, чаще встречаются в составе семейного ракового синдрома (синдрома Линча).
Инфицирование вирусом папилломы человека является установленным фактором риска развития большинства форм рака шейки матки. Доказана инициирующая роль вируса гепатита В как этиологического фактора гепатоцеллюлярной карциномы.
Крипторхизм, гидроцеле и паховая грыжа были последовательно определены как предикторы тестикулярного рака [6, 7]. Опухоли яичка имеют пик в подростковом возрасте. Восемьдесят четыре процента герминогенных опухолей встречается среди мужчин в возрасте от 15 до 44 лет, 15% — приходится на возраст 45 лет и старше, в то время, как только 1% — на возраст младше 15 лет (рис. 1).
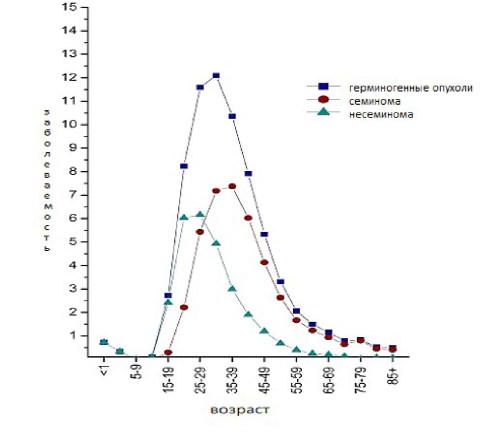
Рис. 1. Заболеваемость опухолями яичка
Щитовидная железа чувствительна к воздействию ионизирующего излучения, при этом вероятность развития рака повышается при экспозиции дозы облучения в раннем возрасте.
Эффективность лечения
Сейчас уже неоспорим тот факт, что результаты лечения больных раком молодых людей значительно хуже, чем пациентов детского и пожилого возраста. И хотя общая выживаемость у больных с опухолями резко возросла в последние годы, результаты у подростков оказались менее впечатляющими. В 70-х гг. прошлого столетия цифры общей выживаемости больных раком подростков были выше, чем у детей и пожилых пациентов, однако это преимущество снижалось в течение последующих двадцати лет и было утеряно в середине 90-х гг. Популяционный анализ эффективности лечения злокачественных опухолей в США за последнюю четверть века показал, что при более высоких темпах роста заболеваемости раком у подростков и молодых взрослых в возрасте от 15 до 45 лет значительных успехов в улучшении выживаемости в этой возрастной категории не достигнуто [9]. В частности, среднегодовое улучшение 5-летней выживаемости превысило 1,5% у детей младше 15 лет и взрослых старше 50 лет. Однако у лиц в возрасте 15-24 лет улучшение отмечено в среднем менее чем на 0,5%, а в возрасте 25-34 лет вообще не было никакого заметного прогресса [10]. Причины различий в результатах лечения подростковой и других возрастных групп не совсем ясны и, скорее всего, являются многофакторными.
Биологические особенности опухолей
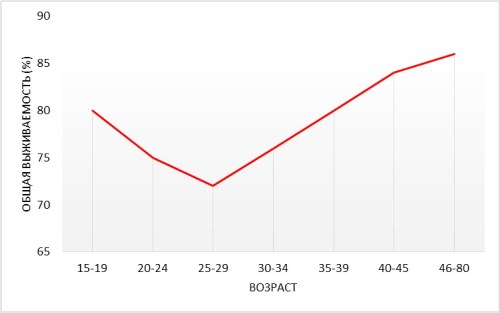
Рис. 2. Выживаемость больных РМЖ в зависимости от возраста
Социальные и психологические факторы
Социально-демографические и поведенческие характеристики уникальны для этой возрастной группы и, возможно, весьма драматичны в степени их влияния на результативность противоопухолевой терапии. Подростковый возраст — это период экспериментов с употреблением табака, алкоголя и наркотических веществ, многие из которых могут повлиять на метаболизм химиопрепаратов. Нередки случаи несоблюдения
подростками режима проводимого лечения или полного отказа от него в силу психологических особенностей этого возрастного периода. Исследование C.K. Tebbi и соавт. (1986) с участием 46 пациентов в возрасте от 2,5 до 23 лет показало, что соблюдение назначений врача достоверно коррелирует с возрастом и значительно хуже у подростков, чем у детей младшего возраста. На двадцатой неделе лечения средний возраст пациентов, часто пропускавших прием пероральных препаратов, составил 17,4 лет, изредка пропускавших назначения — 10,5 лет и выполнявших все назначения — 9,5 лет [13]. Большое значение имеет социальная пассивность и стремление к отрицанию очевидных проблем в подростковой среде. В частности, была доказана взаимосвязь между социальноэкономическим статусом и риском поздней стадии лимфомы Ходжкина (ЛХ) у молодых взрослых [14]. ЛХ составляет 12% всех новообразований в этой возрастной группе. Среди больных с низким социально-экономическим статусом отмечена большая частота поздних стадий, при которых пятилетняя выживаемость составляет 63%, в то время как у больных с I—II стадиями процесса этот показатель достигает 90%. При сравнении показателей летальности по полу выявлено, что у мужчин старше 15 лет этот показатель выше, чем у женщин. Доказано, что мужской пол является неблагоприятным фактором риска у пациентов 15-40 лет. Женщины, как известно, имеют более благоприятный прогноз заболевания в связи с преобладанием у них локализованных стадий. Ретроспективный анализ более 7000 пациентов, получавших лечение с 1998 по 2006 гг. в США, показал, что среди больных с прогрессирующей ЛХ было больше мужчин с низким социальноэкономическим статусом [14].
Выбор тактики лечения
Лимфома Ходжкина. Летальность 15-29-летних пациентов с ЛХ составляет 4,82 случая на миллион в год. У больных в возрасте 20-24 лет летальность в 2 раза выше, чем у пациентов 15-19 лет, приближаясь к 5,23 на миллион в год (у больных 15-19 лет эта цифра равна 2,31 на миллион в год). Уровень летальности 25-29- летних достигает максимума (7,22 на миллион в год) [16].
Стандарты лечения для подростков не установлены до сих пор, поскольку они могут получать терапию как в педиатрических, так и во взрослых клиниках, практикующих разные технологии. Оба подхода считаются эффективными, так как обеспечивают длительные ремиссии и высокие показатели общей выживаемости. Современные режимы химиолучевой терапии позволяют излечить приблизительно 80% больных. Однако результаты некоторых исследований свидетельствуют о худшем прогнозе у подростков, леченных по взрослым программам [17, 18].
Опухоли мозга. J. Wolfson и соавт. (2014) проанализировали выживаемость 560 детей и 784 подростков и молодых взрослых с опухолями центральной нервной системы, получавших лечение в период с 1998 по 2008 гг. [23]. У пациентов всех возрастных групп с опухолями Grade II по классификации ВОЗ результаты лечения были хуже, если они не включались в исследовательские протоколы. Среди включенных в исследование больных выживаемость у молодых людей была хуже, чем у детей.
Фармакокинетика
Одним из факторов, потенциально влияющих на результативность лечения, является различие в фармакокинетике противоопухолевых препаратов у детей, подростков и молодых взрослых. Известно, что концентрация препарата в крови и длительность его экспозиции во многом определяют эффективность и токсичность противоопухолевой терапии. Эти параметры хорошо изучены во взрослой популяции. Однако подростки во время процесса роста и полового созревания переживают разнообразные физиологические и физические изменения, которые потенциально могут повлиять на распределение лекарственных средств. Увеличение роста и веса во время подросткового ростового скачка сопровождается полспецифичными изменениями в составе тела. Для девушек характерно большее увеличение жировой массы, в то время как у юношей преобладает прирост мышечной массы. При этом в последние годы отмечено повышение индекса массы тела среди подростков. Доказано, что подростки с высоким индексом массы тела имеют худшие результаты при лечении острого миелобластного лейкоза [24]. Ожирение не только может нарушить распределение препарата в организме из-за изменения клиренса лекарственного вещества, но и является дополнительным фактором развития лекарственных осложнений.
Обсуждается активация секреции гормона роста, инсулиноподобного фактора роста-1 (ИПФР-1) и опосредованное влияние их на метаболизм лекарственных препаратов через воздействие на половые гормоны и, в конечном итоге, активность печеночных ферментов [25]. Секреция и биологическая активность гормона роста как у мужчин, так и у женщин зависима от уровня половых стероидов. Тестостерон стимулирует центральную секрецию соматостатина и активность его на периферии, увеличивающую выброс ИПФР-
- Эстроген повышает секрецию гормона роста по принципу отрицательной обратной связи, ингибируя выброс ИПФР-1. Хотя связь концентрации гормона роста с активностью метаболизма лекарственных средств до конца не изучена, исследования показали, что экзогенный гормон роста может изменить метаболизм препарата. Одна из гипотез заключается в том, что это происходит путем влияния на экспрессию ферментов печени, принимающих непосредственное участие в метаболизме лекарств. В частности, в одном из исследований введение экзогенного гормона роста человека удлиняло время полужизни антипирина со 128 до 176% от контрольных значений [26], однако не получено убедительных доказательств зависимости метаболизма лекарственных препаратов от уровня эндогенного соматотропного гормона.
Отдаленные последствия
Использование в схемах полихимиотерапии блеомицина, высоких доз циклофосфамида, нитрозомочевины, бусульфана и облучение легких нередко служат причиной развития пневмофиброза. Облучение центральной нервной системы приводит к развитию таких осложнений, как церебральная атрофия, демиелинизирующие заболевания, лейкоэнцефалопатия и нейрокогнитивные расстройства. Частота развития осложнений варьирует от 30 до 70% в зависимости от возраста, дозы и сочетания с нейротоксическими препаратами (ифосфамид, метотрексат, цитарабин) [30].
Облучение средостения у девочек в возрасте 10-16 лет ведет к повышению риска развития рака молочной железы по сравнению с девочками младшего возраста, что подтверждает теорию индуцирования ионизирующим излучением солидных опухолей в растущей ткани молочной железы [31]. Цифры кумулятивной заболеваемости раком молочной железы (13,9% в 40 лет и 20,1% в 45 лет) являются поводом для пересмотра суммарных доз и полей облучения в зависимости от возраста пациентки [32].
Еще одним последствием химио- и лучевой терапии у молодых людей является нарушение фертильности. Частота, степень и продолжительность бесплодия зависят от дозы и механизма действия препарата, возраста пациента и особенностей самой опухоли. Частота бесплодия варьирует от 20 до 90% у мужчин и от 15 до 75% у женщин [5]. Облучение яичек, яичников и гипоталамо-гипофизарной области может привести к необратимой стерильности. Создание банка половых клеток, проведение заместительной гормональной терапии оказывают значительное влияние на улучшение качества жизни молодых людей.
По мере увеличения числа пациентов, излеченных от злокачественных заболеваний, стало очевидным, что за выздоровлением от первичной опухоли стоит целый спектр отдаленных последствий терапии. Через 15-20 лет после проведения лечения у пациентов намного больше шансов умереть от вторичных опухолей и сердечнососудистых заболеваний, чем у их здоровых сверстников [30].
Выводы
За последние 30 лет в мире не было достигнуто прогресса в лечении опухолевых заболеваний у больных в возрасте 15-29 лет. Существует несколько объяснений данного факта:
Создание многоцентровых исследовательских групп по лечению злокачественных новообразований у подростков и молодых взрослых, более активное включение пациентов данной группы в исследования позволят со временем добиться лучших результатов выживаемости и снижения частоты отдаленных последствий у больных в возрасте 15-29 лет.
Авторы статьи: Иванова С.В., Карицкий А.П., Кулева С.А., Фасеева Н.Д.
Читайте также:

