Интраоперационная лучевая терапия при саркомах

Стадии саркомы
Главное для всех сарком не столько размер и расположение, как степень злокачественности, поскольку она определяет прогноз по развитию рецидива после радикального удаления опухоли и вероятность метастазов. И конечно, именно степень злокачественности саркомы определяет тактику лечения.
Проведение биопсии опухоли
Степень злокачественности определяет только исследование микроскопического строения опухоли, конечно же, опытный клиницист может сделать предположение по виду опухоли и скорости её роста, что это такое, но подобного предположения для планирования лечения будет явно недостаточно.
Биопсию небольшой опухоли, которую можно и планируется радикально удалить, можно и не делать, достаточно тщательно исследовать под микроскопом иссеченную опухоль. Перед началом лечения все опухоли размером более 5 см требуют проведения гистологии.
Поскольку мягкотканые саркомы развиваются везде, где есть мягкие ткани, то они встречаются и в грудной клетке, и в брюшной полости, и в тазу. Биопсия не поверхностно располагающихся сарком может потребовать использования эндоскопии для точного наведения пункционного инструмента.
Лечение
Лечение саркомы мягких тканей комплексное, поэтому до его начала проводится консилиум с участием нескольких специалистов. В первую очередь, хирурга, радиолога и химиотерапевта, но может потребоваться мнение патоморфолога, проводившего исследование биоптата, и лучевого диагноста.
План лечения определяется размером и степенью злокачественности опухоли, но во всех случаях ведущий метод — хирургический, только он обеспечивает возможность излечения. Лучевое воздействие и противоопухолевая химиотерапия — важные компоненты лечения, но это только дополнительные методы, не обещающие ни радикальности, ни излечения.
Операция по удалению саркомы
Операция — стандартное лечение сарком мягких тканей низкой степени злокачественности и маленьких опухолей — не более 5 см средней и высокой степени злокачественности. Разумеется, если высоко злокачественную саркому больших размеров технически можно удалить, то ни в коем случае от операции не отказываются. Но в этом случае хирургия очень важный, но не единственный метод лечения — придётся присоединять и лучевую, и химиотерапию. То есть во всех случаях, когда представляется возможным иссечь саркому, это должно делаться, другое дело, когда опухоль прорастает важные анатомические структуры и удаление нереально.
Объём иссечения опухоли очень важен, поскольку радикальное удаление — залог успешности всего лечения, правда, даже это не даёт гарантии 100-процентного излечения, потому что у 15% оперированных с соблюдением всех онкологических канонов бывают рецидивы опухоли в области послеоперационного рубца.
При крупных саркомах может потребоваться не только удаление большого мягкотканого объёма, но мышечного массива, и даже резекция магистрального сосудистого пучка, удаление подлежащих костей, части грудной и брюшной стенки, в общем, рубец будет очень заметным, но это во благо дальнейшей жизни и здоровья, хоть и не удовлетворяет эстетическим требованиям.
Лучевая терапия сарком
Лучевая терапия в комбинации с удалением опухоли проводится до операции, во время операции и после неё. Все варианты преследуют определённые цели, но в целом выбирается оптимальная тактика лечения.
Предоперационное облучение решает следующие задачи:
- Снижение биологической активности опухоли, что уменьшает вероятность рецидива и метастазов;
- Уничтожение высоко злокачественных, а потому наиболее чувствительных к облучению клеток, которые имеют максимальный метастатический потенциал;
- Повреждение невидимых — субклинических очагов в тканях вокруг материнской опухоли;
- Создание лучших условий для операции за счёт уменьшения отёка окружающих тканей и самой опухоли, более чёткого отграничения опухоли от окружающих здоровых тканей.
Возможно проведение лучевой терапии непосредственно после операции, сразу в операционной — интраоперационная лучевая терапия. Этот метод обсуждается в отдельных клинических случаях, принципиально её задачи мало отличаются от целей предоперационной терапии, при меньшей выраженности непосредственного результата. Лучевая терапия во время операции позволяет максимально эффективно подвести необходимую дозу излучения на отдельные зоны операционной раны. Клинические испытания показали её эффективность в отношении уменьшения вероятности рецидива опухоли.
Послеоперационная лучевая терапия саркомы проводится для предупреждения рецидива и метастазов, поскольку разрушает оставшиеся в ране и окружающих сосудах опухолевые клетки или нерадикально удалённые остаточные опухоли.
Саркомы высокой степени злокачественности
Если под действием терморадиохимиотерапии опухоль полностью регрессировала или, к примеру, пациент не настроился на операцию, то в том же режиме ещё 2 недели продолжается терморадио-или терморадиохимиотерапия.
При неоперабельной опухоли, когда изначально удалить саркому не представляется возможным, проводятся два этапа терморадио- или терморадиохимиотерапии. При невозможности проведения локальной гипертермии выполняется только лучевая терапия или химиолучевое лечение.
Химиотерапия
Саркомы мягких тканей не считаются высокочувствительными к противоопухолевым препаратам, но при некоторых гистологических типах сарком химиотерапия до операции применяется. Считается, что цитостатики позволяют уменьшить объём операции и одновременно тестируется индивидуальная чувствительность опухоли к лекарствам, которую определяют в удалённой ткани по специфическим изменениям клеток опухоли.
При высокой чувствительности опухоли к предоперационному лекарственному воздействию есть мотивация для планирования послеоперационной химиотерапии. Дополнительный выигрыш в уменьшении опухоли даёт добавление к лекарственному воздействию локальной гипертермии.
Послеоперационная или адъювантная химиотерапия признана не везде, в европейских странах она не входит в стандарты лечения, но в США широко используется.
При неоперабельных саркомах применяется химиотерапия в сочетании с лучевой терапией, локальной гипертермией, о чём говорилось выше.
Лечение саркомы с метастазами
Под распространённым процессом понимается неоперабельная опухоль или операбельная с метастазами в другие органы — диссеминированная. Химиотерапия — ведущий метод лечения, но не радикальный.
Используются комбинации доксорубицина, ифосфамида, дакарбазина. При ангиосаркомах эффективны таксаны. При липосаркоме, лейомиосаркоме, синовиальной и экстраоссальной форме саркомы Юинга эффективны трабектедин и пазопаниб. Лейомиосаркома отзывается на терапию гемцитабином и дакарбазином. Иматиниб — стандарт лечения дерматофибросаркомы.
Рекомендовано проводить только две линии терапии. На первом этапе проводится несколько циклов лечения комбинацией наиболее эффективных препаратов — полихимиотерапия, у пожилых и ослабленных пациентов применятся доксорубицин в монорежиме. При отсутствии эффекта от лечения, что проявляется увеличением опухоли или метастазов, проводится терапия лекарственными средствами, не использованными ранее — вторая линия терапии.
При частичной регрессии опухоли и метастазов в результате первой линии терапии, циклы проводятся до достижения полной регрессии опухоли или её устойчивой стабилизации. В дальнейшем — наблюдение, и при возобновлении роста начинают лечение. Выбор препаратов зависит от срока начала продолженного роста, если он более полугода, то используют те же препараты, если меньше — меняют на другие цитостатики.
Лечение рецидивов сарком
Рецидивы лечатся также как и местно-распространённые опухоли: если возможно удаление — операция, если невозможно — химиотерапия или лучевая терапия в сочетании с гипертермией или без неё. Лучевая терапия возможна, если ранее её не проводили — два раза одно место облучать нельзя из-за развития массивного лучевого повреждения тканей.
Лечение метастазов
После радикального лечения опухоли могут появиться метастазы, но время до их развития сугубо индивидуально: месяцы и годы. Чаще всего появляются метастазы в лёгких, по возможности их удаляют после нескольких курсов химиотерапии. При прочих внелёгочных локализациях метастазов метод выбора — химиотерапия.
Для подбора онкологической клиники, где проводят комплексное лечение при саркомах, позвоните нам по номеру +7 (495) 023-10-24 . Мы в кратчайшие сроки организуем ваш визит к онкологу-эксперту.
К.м.н. А.Л. Зубарев (Обнинск)
XV Российский онкологический конгресс
(15-17 ноября 2011 г., Москва)
Уважаемые председатели, уважаемые коллеги! Я бы хотел предложить поговорить о месте и возможности лучевой терапии в лечении сарком мягких тканей. Как вы знаете, саркома мягких тканей представляет собой группу относительно редких злокачественных новообразований, различной локализацией, гистологической структуры, насчитывающих более 100 форм, и составляет около одного процента злокачественных опухолей у взрослых.
В настоящее время только ни одно хирургическое лечение, несмотря на совершенствование техники операции, не позволяет обеспечить высокие показатели выживаемости, особенно при местнораспространенных высокой степени злокачественности опухолях.
Основные проблемы лечения таких опухолей:
- высокая частота локального рецедивирования и отдаленного метастазирования,
- отсутствие четких стандартов в применении лучевой терапии,
- отсутствие методик оптимального комбинированного лечения.
Основными этапами ведения таких больных обязательно является гистологическая верификация формы опухоли с определением степени злокачественности, установка диагноза по TNM и непосредственно выбор тактики лечения на консилиуме специалистов состоящих из патоморфолога, радиолога, химиотерапевта, хирурга с привлечением специалиста по реконструктивной хирургии.
Лучевая терапия – это высокоэффективный метод лечения местно–распространенных сарком мягких тканей. Но надо обязательно помнить, что это только один из компонентов мультимодального лечения вместе с операцией полиохимиотерапии и модифицирующими видами воздействия на эти опухоли. В работе Странбера (Швеция) было проанализировано более 70 исследований, обработаны данные более чем 3.000 пациентов и доказана эффективность лучевой терапии.
Применение лучевой терапии у больных саркомами мягких тканей после условно-радикальных и нерадикальных операций позволило добиться достаточно высоких показателей локального контроля от 70 до 90 и выше процентов.
В настоящее время применяется фотомная терапия, в России на том же уровне, примерно, гамматерапия, активно развивается и применяется андронная терапия, нейтронная и протонная терапия. Основные виды лучевой терапии сарком мягких тканей — это дистанционная лучевая терапия, предоперационной и послеоперационной, и интраоперационная лучевая терапия, ведущая к фотонной терапии.
В настоящее время стандартом лучевой терапии становится камфорная лучевая терапия, которая требует обязательного применения 3Д планирования облучения и применение линейных ускорителей с многолипестковыми калиматорами.
Следующими шагами в развитии лучевой терапии, в том числе и сарком мягких тканей, является интенсивно модулированная радиотерапия, которая позволяет создавать не только поля любой требуемой формы, но и осуществлять облучение одного и того же сеанса с различной интенсивностью. И радиотерапия, корректируемая изображением. Это когда линейный ускоритель устанавливается детектор большой площади для осуществления объемной компьютерной томографии на конусном пучке, что позволяет вычислять мониторинг процесс индификации мишени и эффективное приложение дозы в реальном времени.
Применение андронной терапии, в частности протонной и нейтронной терапии, позволило в исследовании, которое проведено в Детройтском медицинском центре США. При облучении больных саркомой мягких тканей высокой степени злокачественности после нерадикальных операций, добиться достаточно высоких показателей, в частности трехлетний локальный контроль (91 процент) и выживаемость без признаков прогрессирования метастазов рецидива (78 процентов). При этом процент осложнения всего составил 13 процентов и это было после длительного заживления послеоперационной раны.
Основным преимуществом андронной терапии является увеличение эффективности воздействия на опухоль. В том числе радиорезистентной из-за способности доставлять высокие дозы радиации точно на область поражения и за счет этого уменьшать побочные эффекты на кожу, на окружающие мягкие ткани.
Основными недостатками — это большая стоимость курса лечения и возможность облучения опухоли до 10 см. Хотя и в настоящее время с этим недостатком уже практически справились. Разработаны и применяются новые ускорители для проведения интенсивно-модулированной протонной терапии, которая по дозному распределению даже лучше чем интенсивно-модулированная фотомная терапия и как видно на слайде позволяет облучать достаточно большие объемы опухоли, в частности больной, представим с саркомой юэнга правой половины таза.
Следующий вид лучевой терапии это интраоперационная лучевая терапия она позволяет укоротить время лучевой терапии, уменьшить дозу как предоперационной, так и послеоперационной лучевой терапии.
Применение интраоперационной лучевой терапии увеличение сарком мягких тканей позволило в большом количестве исследований добиться достаточно неплохих показателей локального контроля от 60 до 90 и выше процентов.
Как я говорил, в настоящее время применяется как предоперационная, так и послеоперационная лучевая терапия. В Национальном институте рака Канады было проведено рендомизированное исследование по данным, в которых не было обнаружено различий между группами по локальному контролю, отдаленным метастазам и общей выживаемости по группам предоперационной и послеоперационной терапии. Однако, значительно больше осложнений было отмечено в группе с послеоперационным облучением. С другой стороны частота ранних послеоперационных осложнений оказалась значительно выше в группе с предоперационной лучевой терапией.
Тем не менее, при проведении анализа соотношения размеров опухоли и уровня локального контроля, при опухолях превышающих 8-10 см. более эффективно оказалась неадекватная лучевая терапия.
Таким образом, аргументы за предоперационную лучевую терапию:
- возможность подведения низких доз,
- использования меньших размеров полей облучения,
- реже развиваются поздние постлучевые осложнения,
- более лучшие функциональные результаты,
- нет задержки лучевой терапии за заживление послеоперационной раны.
- выше риск послеоперационных заживлений,
- меньше риск ранних послеоперационных осложнений,
- приходится применять более высокие дозы облучения,
- больше размер полей облучения,
- больше поздних постлучевых осложнений,
- более худшие функциональные результаты,
- возможно, задержка лучевой терапии из-за заживления послеоперационной раны.
Суммарные дозы по данным различных центров для предоперационной лучевой терапии составляет 50 Грэй, послеоперационной при негативном крае резекции 60 Грэй и край резекции 1Р2дозы доводятся до 65и 70 Грэй.
Какие же основные пути повышения эффективности лучевой терапии? Мне представляется, что это уменьшение облучаемого объема за счет совершенствования технологий планирования облучения, и подведения дозы к опухоли, которые можно осуществить за счет точной визуализации опухолевого процесса для планирования лучевой терапии. 3Д планирование и расчет лучевой терапии с применением оптимального объема облучения, как для предоперационной лучевой терапии, так и послеоперационной терапии.
Применение новых методов фотонной лучевой терапии, в частности интенсивно-модулированной фотонной терапии, радиотерапией, коррегируемой по изображению.
И следующий шаг в этом применении роботизированных систем, кибер найф систем, с проведением стереотаксической радиационной терапией. Основными ограничениями для этого вида лучевой терапией является до недавнего времени размер опухоли до 4 см. Но по последним данным, проведённом в Японии исследовании, уже до 6 см. можно проводить облучение, конечно при большей стоимости курса лечения, но, как говорится, это стоит того.
Например, в исследовании которые проведены в Сеуле было облучено, проведено только на кибер найф системе 13 пациентов с хардомой, хондросаркомой костей оснований черепа и шейных позвонков. Наблюдения: уже 30 месяцев не одного рецидива у 4 полный ответ.
Следующий путь — это усиление реакции опухолевых тканей на облучение путем применения модификатора с возможным уменьшением очаговой суммарной дозы. Применение в неоадьювантном режиме лучевой терапии локальной гипертермии позволило в исследовании, проведенным Дерхам в США, получить десятилетний локальный контроль на 94 процента при локализации опухоли на конечности и 63 локализации на туловище.
Применение в неоадъювантном режиме лучевой химиотерапии позволило добиться десятилетнего локального контроля 84 процента в исследовании и проведенным в Массачусетском центральном госпитале в Бостоне по сравнению с группой, где было проведено только лучевая терапия с операцией 46 процентов и более 81 процента более локального контроля в исследовании проведенного в клинике Сан-Пауло.
Термохимиолучевая терапия по данным ряда центра тоже позволила добиться, высоких показателей локального контроля, в частности в нашем институте в Обнинске, наблюдается группа уже 4 года больных, где проведена термохимиолучевая терапия с последующим оперативным вмешательством, пока мы ни у одного больного локального рецидива не наблюдаем.
В медицинском радиологическом научном центре в Обнинске разрабатывается и применяется схема комбинированного лечения больных саркомы мягких тканей с применением предоперационной лучевой терапией. На первом этапе выполнялась неадьювантная полеохимеотерапия 3 цикла с учетом морфологического диагноза, предоперационная лучевая терапия по методике ускоренного облучения локальной гипертомией. На втором этапе — оперативное вмешательство с интраоперационной лучевой терапией, край резекции Р1-2. И на 3 этап адьювантная полеохимиотерапия 3 цикла, но уже с учетом лечебного патоморфоза после операции.
И несколько клинических примеров: больная 84 года рождения, был установлен диагноз светлоклеточная саркома мягких тканей, подтвержденная в трех центрах, левой надключичной области. Больной перед операцией выполнена термохимиотерапия. Отмечалось уменьшение на 70 процентов опухоли. К сожалению, в дальнейшем отказалась, как от операции, так и от проведения химиотерапии. Но контроль за ней мы проводили. Через 6 месяцев отмечался полный ответ, но, к сожалению, менее чем через 2 года развились метастазы в легких и в кости, и больная умерла от прогрессированного процесса через 3 года. Но, тем не менее, локального рецидива при этом не наблюдалось.
Больная 69 года рождения, был установлен диагноз приметивной эмаротермальной опухоли. Проведена термохимиолучевая терапия, соответственно через 3 месяца отмечались уменьшения опухоли на 65 процентов. Больному выполнено оперативное вмешательство и она продолжает наблюдаться без признаков рецидива метастазов, получает химиотерапию.
Больной 72 года рождения, с диагнозом синовиальная саркома мягких тканей левого плеча, после предоперационной термохимиолучевой терапии отмечалось уменьшение опухоли на 60 процентов. Выполнено оперативное вмешательство больной продолжает наблюдаться без признаков прогрессирования.
Больной 70 года рождения, с диагнозом злокачественная опухоль периферических оболочек нервов правой подключичной области. После термалучевой химиотерапии отмечалась стабилизация, достаточно большая опухоль и нервно сосудистый пучок проходил, выполнено вмешательство с интраоперационной лучевой терапией. Больной наблюдается более 5 лет ни без каких признаков прогрессирования.
Таким образом, лучевая терапия – обязательный и важный компонент комбинированного лечения высоко-злокачественных местно-распространенных сарком мягких тканей и перспективное применение новых методов лучевой терапии андронной терапии, предоперационной, термохимиолучевой терапии, интраоперационной лучевой терапии, позволит повысить эффективность радиотерапии и улучшить результаты сарком мягких тканей.
До последнего времени основным, а нередко и единственным методом лечения больных саркомами мягких тканей был хирургический, поскольку на протяжении длительного времени не существовало каких-либо других более или менее эффективных методов лечения. Благодаря созданию мегавольтных источников ионизирующего излучения расширились возможности лучевой терапии (рис. 54).
Рис. 54. Современные аппараты лучевой терапии.
По мере накопления клинического опыта было установлено, что практически все саркомы в той или иной степени реагируют на лучевое воздействие. Экспериментальные исследования, проведенные за рубежом, показали отсутствие различий при сопоставлении по тесту на выживаемость клеток немелкоклеточного рака легкого, глиобластомы и саркомы мягких тканей в условиях применения режима фракционирования разовой дозой 2,0 Гр фотонного излучения, что меняет представление о резистентности сарком мягких тканей к лучевой терапии. Однако в клинической практике радиорезистентность сарком мягких тканей проявляется вследствие больших размеров опухоли, различных гистологических форм и степени злокачественности, из-за чего необходимость применения дополнительной лучевой терапии при комбинированном лечении продолжает обсуждаться исследователями. Облучению предшествует весьма ответственный этап предлучевой топометрической подготовки: уточняются размеры и местное распространение опухоли, ее топика, соотношение с магистральными сосудами, нервными стволами и костными структурами. С этой целью используют перечисленные выше методы уточняющей диагностики. После сопоставления полученных данных и уточнения границ опухоли выбирают объем облучения, который во всех случаях должен превышать размеры опухоли.
При комбинированном лечении больных СМТ применяют следующие виды лучевой терапии:
1. Послеоперационная лучевая терапия (проводят в тех случаях, когда диагноз саркомы мягких тканей не был установлен до операции, большие размеры опухоли, клетки опухоли по линии резекции послеоперационной раны).
2. Предоперационная лучевая терапия (диагноз верифицирован, опухоль небольших размеров, пластика послеоперационного дефекта).
Послеоперационную лучевую терапию, как правило, проводят в режиме классического фракционирования дозы - 2 Гр, 5 фракций в неделю, до суммарной очаговой дозы 45 – 60 Гр. В предоперационном периоде лучевую терапию чаще проводят в режимах нетрадиционного фракционирования дозы (средний, укрупненный и динамический)
Средний режим фракционирования дозы. Разовая очаговая доза 3 Гр, 11-13 фракций. Суммарная очаговая доза составляет 33-36 Гр, с учетом ВДФ эквивалентно 40-42 Гр классического фракционирования дозы.
Укрупненный режим фракционирования дозы. Первые три фракции проводят ежедневно в разовой очаговой дозе по 4 Гр. Затем облучение проводят в режиме классического фракционирования дозы 2 Гр 5 раз в неделю до суммарной очаговой дозы 36-40 Гр, с учетом ВДФ эквивалентно 45-50 Гр классического фракционирования дозы.
Динамический режим фракционирования дозы. Первые три фракции проводят ежедневно в разовой очаговой дозе 4 Гр. Далее облучение осуществляется через день в дневной дозе 4 Гр с двукратным ее дроблением через 4-5 часов (2 Гр 2 раза в день). Суммарная очаговая доза при этом составляет 36-40 Гр, что с учетом ВДФ эквивалентно 45-50 Гр классического фракционирования дозы.
Как показали многочисленные клинические исследования и изучение лучевого патоморфоза опухолей, по степени поражения опухоли и защите окружающих здоровых тканей наиболее эффективной на предоперационном этапе является лучевая терапия с использованием нетрадиционных режимов фракционирования разовой очаговой дозы.
Задачи послеоперационной лучевой терапии: разрушение диссеминированных в ране клеток для предупреждения развития рецидивов и метастазов, при условии условно-радикального оперативного вмешательства, подавление роста оставшейся опухоли.
В Университете Флориды Health Proton Therapy Institute лечат пациентов с саркомой с осторожностью, но и с уверенностью.
О саркоме и протонной терапии
Характер саркомы костей или саркомы мягких тканей делает пациентов с этими заболеваниями идеальными кандидатами для лечения протонной терапией.
Поскольку опухоли саркомы часто расположены вблизи чувствительных тканей и требуют высоких доз для лечения, важно очень точно направить лучи радиации в опухоль. Согласно руководящим принципам лечения саркомы в Национальной комплексной онкологической сети (NCCN), протонная терапия может дать терапевтическое преимущество перед традиционными методами лучевой терапии при лечении саркомы.

Изображение саркомы позвоночника на лицевой стороне (рисунок A) и вид сбоку (рисунок B). Опухоль (T) и спинной мозг (SC) обозначены.
Протонная терапия успешно использовалась для лечения различных видов сарком, показывая низкую частоту возникновения побочных эффектов.
Протонную терапию можно использовать для лечения многих видов саркомы, в том числе саркомы у детей и саркомы, которые локализуются в трудно доступных местах, таких как основание черепа и позвоночника.
Показания к применению протонной терапии:
Злокачественная фиброзная гистиоцитома
Злокачественная опухоль периферических нервных оболочек
Альвеолярная мягкотканная саркома
В последние годы все большее внимание уделяется функциональным результатам и качеству жизни пациентов с саркомой. Протонная терапия предлагает инновационный новый подход для достижения этих целей. По состоянию на 2008 год в мире насчитывается 26 центров протонной терапии.
Благодаря уникальным физическим характеристикам протонов, которые заставляют их останавливаться в тканях, протонная терапия может обеспечить высококонформное излучение с минимальной дозой излучения или вовсе без неё для здоровых органов.
Например, когда саркома находится в брюшной полости или в забрюшинном пространстве, протонная терапия может использоваться для спасения почек от разрушительных эффектов излучения. Во время лечения возникает меньше тошноты, потому что кишечнику достаётся совсем небольшая доза радиации.
Ниже вы увидите сравнение распределения дозы между обычным планом излучения (рисунок A) и планом протонной терапии (рисунок B) у пациента с абдоминальной саркой. Обратите внимание на разницу в дозе в почках (K).

При саркомах, возникающих на руке и на ноге, протонная терапия может использоваться, чтобы полностью избавиться от тканевого лоскута, который хирург использует для восстановления кожи после удаления опухоли, тем самым способствуя скорейшему заживлению.
Кроме того, когда саркома упирается в кость, пациенты имеют высокий риск получения перелома, связанного с хирургией и излучением. Уменьшая дозу облучения кости, конформная протонная терапия может снизить вероятность перелома кости в будущем.
Избегая любой выходной дозы, другие теоретические преимущества протонной терапии при лечении саркомы нижних конечностей включают в себя предотвращение доз облучения в паху и перианальной области. Эти области крайне радиочувствительны, а раздражение кожи во время лечения может вызвать неприятные симптомы при лечении. Избегая яичек и яичников у молодых пациентов, радиационные онкологи могут использовать протонную терапию в попытке поддерживать плодовитость пациентов. Наконец, уменьшая нормальную тканевую дозу по сравнению с обычной радиотерапией, протонная терапия должна свести к минимуму риск возникновения вторичных злокачественных новообразований, вызванных радиацией, у выживших.
Протонная терапия успешно использовалась в сочетании с хирургией для лечения пациентов с саркомой по всему миру.

На фото: проведение сеанса протонной терапии
Преимущества использования протонной терапии для нормальных тканей распространяются на опухоли, непригодные для операции. При саркомах, возникающих в позвоночнике или рядом с ним, полная резекция часто является проблемой. Доставка адекватной дозы облучения ограничена окружающими радиационно-чувствительными нормальными тканями, включая спинной мозг, кишечник, легкие, сердце и почки.
Многие агрессивные саркомы мягких тканей и остеосаркомы лечатся химиотерапией, которая может неблагоприятно взаимодействовать с радиацией. Например, в исследованиях описаны частые раздражения кожи и переломы костей после комбинированного лечения лучевой и химиотерапией. Путем минимизации перекрытия химиотерапии и радиации в нормальной ткани протонная терапия имеет все шансы на более успешное лечение.
Как работает интраоперационная лучевая терапия (IORT)?
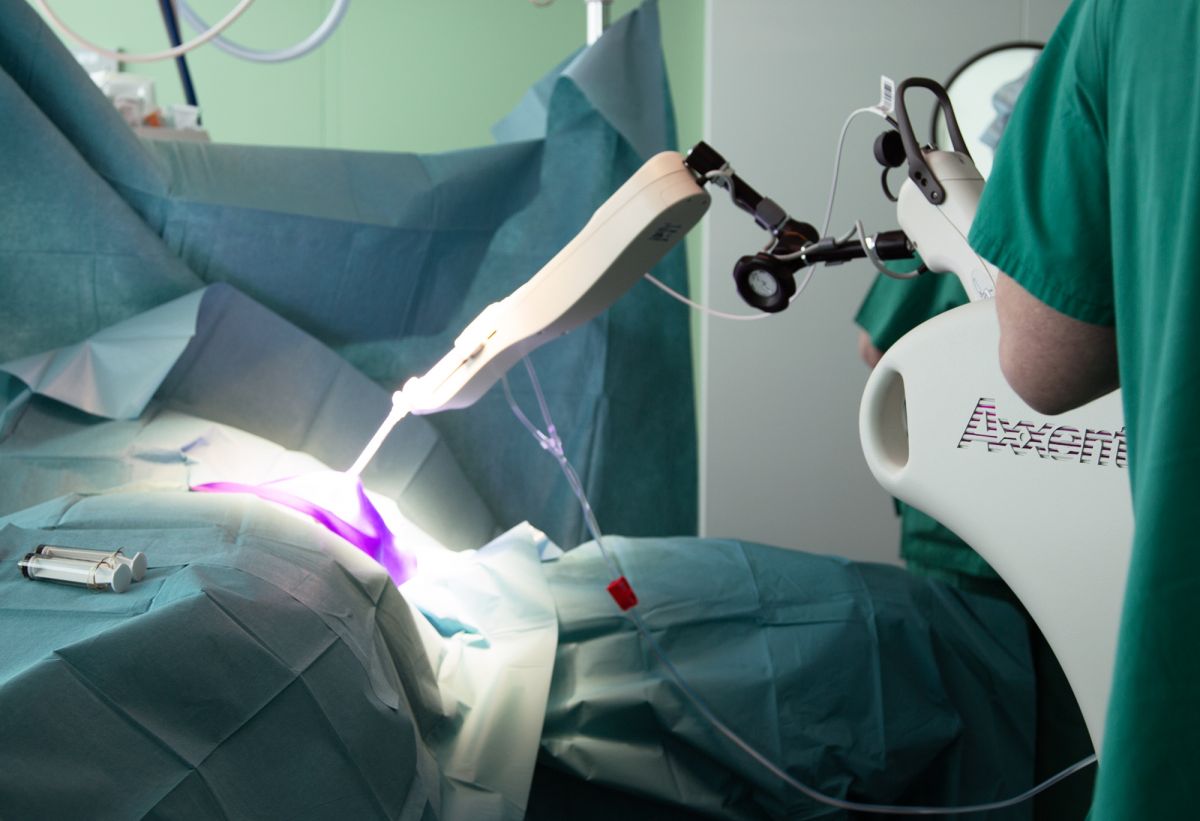
ЕМС — одна из немногих клиник, где применяется инновационная методика интраоперационной лучевой терапии (IORT). Сущность методики сводится к подведению высокодозного ионизирующего излучения в процессе хирургического лечения именно на место, где находилась опухоль, а также на зоны риска развития рецидива. Преимущество IORT – это возможность с максимальной точностью, узконаправленно подвести необходимую дозу радиационного излучения к опухоли, при этом прилежащие органы и ткани не входят в поле воздействия радиации, поэтому снижается возможность развития лучевых реакций.
Цель IORT - минимизация риска рецидива за счет уничтожения опухолевых клеток, которые могут быть оставлены по краям операционной раны.
Несмотря на то что система IORT легко перемещается и устанавливается в операционной, данная методика сложна в проведении. Для ее осуществления требуется слаженность действий специалистов: хирурга, анестезиолога, радиолога, физика, дозиметриста, медицинские сестры. Лечение производится при помощи зонда, который вводится непосредственно в операционное поле.
Преимущества IORT по сравнению с традиционной лучевой терапией
При использовании лучевой терапии непосредственно после хирургического лечения возможно замедление заживления послеоперационной раны, за счет этого рекомендуется ее начинать примерно через 30 дней после проведения хирургического лечения, поэтому увеличивается риск возникновения рецидива. IORT применяется непосредственно во время хирургического лечения, уменьшая риск развития рецидива за счет прямого воздействия на опухолевые клетки в операционной ране.
IORT максимально прецизионно воздействует именно на область, где находилось новообразование в хирургической ране, минимизируя действие ионизирующего излучения на окружающие не задействованные в опухолевом процессе ткани.
Показания для IORT
Рак молочной железы является основным заболеванием, при котором используется IORT. В ЕМC широко применяется органосохраняющее хирургическое лечение рака молочной железы с сохранением структуры молочной железы. Соответственно, чтобы снизить риск неполного удаления опухоли, оптимально применение IORT. Также применение IORT показало хорошую эффективность при глиобластомах.
Как происходит лечение?
После удаления новообразования в послеоперационную полость вводится сферический баллон-аппликатор и подсоединяется источник ионизирующего излучения. После подведения необходимой дозы ионизирующего излучения аппликатор удаляется, операционная рана ушивается. Длительность процедуры, как правило, не превышает 30 минут. При проведении данной методики пациенты находятся под общим наркозом, таким образом, возникновение болевых ощущений у пациентов исключено. Следует отметить, что пациенты в послеоперационном периоде наблюдаются так же, как пациенты без проведения IORT, и риск дополнительных осложнений от проведенного лечения минимальный.
Важно отметить, что использование методики IORT не исключает возможное применение традиционной лучевой терапии при наличии соответствующих показаний.
Читайте также:

