Интерфероны в лечение грибовидного микоза
Одной из наиболее актуальных задач современной дерматологии является изучение механизмов развития, разработка ранних критериев диагностики и дальнейшее совершенствование методов лечения злокачественных Т-лимфом. Среди них наибольший удельный вес приходит
Одной из наиболее актуальных задач современной дерматологии является изучение механизмов развития, разработка ранних критериев диагностики и дальнейшее совершенствование методов лечения злокачественных Т-лимфом. Среди них наибольший удельный вес приходится на грибовидный микоз (ГМ). Согласно современным взглядам, биологическая сущность ГМ, вне зависимости от клинических проявлений и стадии процесса, определяется как пролиферация трансформированных Т-лимфоцитов [3, 6]. Причем ГМ относится к лимфомам низкой степени злокачественности.
Разнообразие клинических проявлений, отсутствие единых критериев систематизации патологического процесса, а также изменение представлений о кроветворении объясняют разнообразие различных классификаций злокачественных лимфом кожи. Так, L. Fuks оценивает степень тяжести ГМ следующим образом: I стадия — поражение только кожи; II стадия — поражение кожи и дерматопатический лимфаденит; III стадия — поражение кожи, регионарных лимфоузлов и/или селезенки; IV стадия — кожные и внекожные поражения с или без вовлечения в патологический процесс лимфоузлов и селезенки. Группа исследователей из ФРГ выделяет 5 стадий ГМ: I–III стадии — кожный ГМ (I — экзематоидные очаги поражения, II — папулы и бляшки, III — опухолевидные очаги поражения); IV стадия — кожный ГМ с лимфоаденопатией; V стадия — любые клинические проявления при наличии поражения внутренних органов. В основу классификации, применяемой в США, положена оценка степени выраженности следующих элементов лимфопролиферативного процесса: клиническая характеристика кожного процесса (T — tumor); наличие или отсутствие клинической и гистологической патологии лимфоузлов (N — nodus); наличие или отсутствие патологии внутренних органов (M — metastasis). Каждый элемент имеет несколько градаций, обозначаемых цифрами, которые отражают степень или распространенность патологического процесса. Учитывая несовершенство многочисленных классификаций ГМ, до настоящего времени в дерматологии широко применяется деление ГМ на 3 стадии: экзематоидно-эритродермическую, инфильтративно-бляшечную и туморозную [4, 5].
Таким образом, анализ литературного материала показал, что ГМ выделяется в самостоятельную нозологию и рассматривается как экстранодальная, поражающая преимущественно кожу, эпидермотропная лимфома, представленная инфильтрацией Т-хелперных клеток, имеющая своеобразную клинику, течение и патогистологическую картину.
Этиология и патогенетические механизмы ГМ до сих пор не ясны. До настоящего времени не известны побудительные мотивы неконтролируемой Т-клеточной пролиферации. Предполагается, что возникновение ГМ может быть связано с персестирующей вирусной инфекцией. Так, в ряде работ сообщается о выявлении в первичной клеточной культуре, полученной из лимфоузла больного в инфильтративно-бляшечной стадии ГМ, вирусных частиц, морфологически характерных для ретровирусов типа С [15]. Кроме того, в ДНК первичных клеточных культур, полученных от больных ГМ, выявлено наличие последовательности, родственной гену gag HTLV-1.
Определенную роль в возникновении злокачественных лимфом отводят генетическим факторам. Доказано, что развитие различных видов солидных опухолей и лейкемий связано с появлением и дальнейшим нарастанием хромосомных аномалий. В последние годы появились публикации о хромосомных перестройках при ГМ, которые способствуют активации онкогенов и инактивации генов опухолевой супрессии при развитии лимфопролиферативного процесса. В настоящее время в литературе широко обсуждается положение о том, что значимые патогенетические факторы ГМ могут быть носителями ксеногенной информации, приводящей к патологическим сбоям в функционировании различных систем и клеток макроорганизма [13]. В первую очередь такие изменения наблюдались со стороны иммунокомпетентных клеток, эпидермоцитов, макрофагальных элементов кожи, рецепторного аппарата кожи и продукции цитокинов. Имеющиеся в отечественной и зарубежной литературе сведения о состоянии иммунного гомеостаза убедительно свидетельствуют о стойких патологических сдвигах как в клеточном, так и в гуморальном звеньях иммунитета. Анализ иммунного статуса показал, что у большинства больных ГМ при нормальном количестве в сосудистом русле В-лимфоцитов среднее содержание Т-клеток значительно снижено по сравнению с показателями здоровых доноров. Отмечено снижение как Т-супрессорных, так и Т-хелперных лимфоцитов, причем количество последних снижается более существенно. Относительную лимфопению многие авторы рассматривают как наиболее часто встречающийся гематологический признак ГМ. Другие, кроме того, отмечают наличие абсолютной лимфопении в опухолевой стадии заболевания. Функциональная активность лимфоцитов у больных ГМ, по данным ряда авторов, снижена. Другие сообщают об отсутствии достоверных различий в характере пролиферации лимфоцитов периферической крови больных и здоровых лиц. Установлено, что течение патологического процесса при ГМ сопровождается снижением активности естественных киллеров.
Разноречивы результаты исследований состояния гуморального звена иммунитета. В ряде работ не выявлено существенных нарушений в продукции В-лимфоцитами иммуноглобулинов. Вместе с тем есть указания на наличие при ГМ явного IgМ- и скрытого IgA- и IgG-дефицита антителообразования. Другие исследователи выявили увеличение в крови больных ГМ количества IgA, IgМ, а также значительный рост концентрации IgG. При этом увеличение уровня иммуноглобулинов объясняют хелперным фенотипом опухолевого субстрата при ГМ. Таким образом, изменения показателей иммунного статуса у больных ГМ характеризуются значительной вариабельностью и отсутствием признаков, имеющих безусловное диагностическое значение.
В последние годы достигнут значительный прогресс в терапии ГМ, однако лечение больных с этим тяжелым, неуклонно прогрессирующим заболеванием представляет значительные сложности. Ситуация усложняется еще и тем, что не существует лабораторных критериев, позволяющих четко определить дозы, сроки или эффективные комбинации препаратов. Руководствуясь принципом интенсивной терапии опухолевых процессов, для лечения ГМ используют различные полихимиотерапевтические схемы: ЦОП — блео (циклофосфан, винкристин, преднизолон, блеомицин), ЦХОП (циклофосфан, винкристин, доксорубицин, преднизолон), МОПП (мехлорэтамин, винкристин, прокарбазин, преднизолон). Противоопухолевые средства, вошедшие в практику лечения ГМ, относятся к различным группам: антиметаболиты (метотрексат, метотрексат лахема, метотрексат-эбеве, меркаптопурин, пури-нетол), замедляющие нуклеиновый обмен и рост активно пролиферирующих тканей; алкилирующие агенты (циклофосфан, циклофосфамид-тева, циклофосфан-ЛЭНС, тиофосфамид), действующие непосредственно на ДНК клетки; вещества растительного происхождения (винкристин, винкристин ликвид-рихтер, винбластин, винбластин-рихтер), блокирующие деление клеток на стадии метафазы; синтетические противоопухолевые антибиотики (спиробромин, проспидин); противоопухолевые антибиотики (адриамицин, блеомицин, брунеомицин).
Препараты назначались в общепринятых для лечения онкологических заболеваний дозировках и режимах введения. Однако различные осложнения (чаще всего угнетение костно-мозгового кроветворения), а также недостаточная эффективность явились основанием для исключения из практики ряда цитостатических препаратов.
Высокой терапевтической эффективностью в сочетании с небольшими дозами кортикостероидов при лечении ГМ обладает проспидин. Существенным достоинством проспидинотерапии, отличающим ее от лечения другими химиопрепаратами, является отсутствие серьезных побочных эффектов. Это связано с тем, что основной мишенью действия проспидина являются не ДНК клеток, а их мембраны. Однако длительное применение препарата приводит к привыканию, в связи с чем эффективность терапии заметно снижается.
Для лечения больных ГМ широко используется ПУВА-терапия, основанная на применении фотосенсибилизаторов в комбинации с УФ-облучением в области А [7, 11]. Учитывая тот факт, что зона воздействия УФА-света находится в пределах эпидермиса и верхней трети дермы, целесообразно применение данного метода в доопухолевых стадиях заболевания. В опухолевой стадии ГМ обычно используют сочетание УФ-облучения с полихимиотерапией или рентгеновским облучением. Для лечения больных ГМ применяется также электронно-лучевая терапия, основанная на облучении быстрыми электронами. Данная методика позволяет воздействовать на опухолевый субстрат в глубоких отделах кожи, что значительно повышает эффективность лечебных мероприятий при ГМ. На ранних стадиях ГМ часто используются ретиноиды (изотретиноин, этретинат, тигазон), действие которых направлено на процессы созревания Т-хелперов [12].
В последние годы большое внимание уделяется разработке иммунокоррегирующих методов лечения ГМ. Иммуномодулирующее воздействие гемосорбции, плазмафереза, лейкофереза, фотофореза при ГМ позволяет сократить разовые и курсовые дозы цитостатиков, что в определенной степени способствует снижению частоты побочных эффектов химиотерапии. Мы изучали влияние тимодепрессина на состояние иммунного статуса у 12 больных ТМ. Препарат вводился ежедневно всем по 2 мл в течение 3 семидневных курсов лечения с недельным перерывом. Изучение иммунного статуса больных ГМ показало, что тимодепрессин сдерживает развитие пула атипичных Т-лимфоцитов, устраняя воспалительные и пролиферативные изменения в эпидермодермальном пространстве пораженных участков кожи. После окончания терапии состояние клинической ремиссии было достигнуто у 5 больных, значительное клиническое улучшение — у 6 пациентов, в течение года состояние клинической ремиссии сохранялось у 4 больных, еще у 4 больных возникли рецидивы ГМ спустя 3–6 мес после лечения. Повторное назначение тимодепрессина во всех случаях позволило купировать патологический процесс.
В терапевтические схемы лечения ГМ нередко включаются гормоны тимуса: Т-активин, тимопоэтин, тимозин, тималин, тимоген и др. Применяется также леакадин, обладающий противоопухолевым и иммуномодулирующим действием. Широко используются при лечении ГМ интерфероны [8, 14]. Они обладают выраженной противоопухолевой активностью, обусловленной не только прямым цитостатическим действием на опухолевые клетки, но и модуляцией механизмов гуморальной регуляции иммунного ответа. Установлено, что препараты данной группы (α-интерферон — виферон, реальдирон, вэллферон; β-интерферон — ребиф 22, бетаферон, лейкинферон; γ-интерферон — имукин) активируют макрофагальную и комплементарную системы организма, нормализуют продукцию провоспалительных цитокинов, воздействуют на экспрессию генов и антигенов главного комплекса гистосовместимости.
Сравнительный анализ терапевтических возможностей различных методов лечения ГМ позволил американской медицинской ассоциации рекомендовать следующую тактику ведения больных ГМ. На ранних стадиях лимфопролиферативного процесса показаны наружное применение кортикостероидов (локоид, полькортолон, фторокорт, целестодерм-в, флуцинар, элоком, адвантан, кутивейт, дермовейт), ПУВА-терапия, локально наносимые цитостатики, радиотерапия быстрыми электронами и мягколучевая рентгенотерапия. При прогрессировании ГМ используется системная терапия в виде комбинации ПУВА-терапии с ретиноидами или рекомбинантным α-интерфероном. При эритродермической форме ГМ рекомендован экстракорпоральный фотофорез в сочетании с α-интерфероном или ретиноидами. Таким образом, анализ литературного материала убедительно показал целесообразность дальнейшего изучения биологической сущности ГМ и разработки более эффективных схем его лечения.
- Гостева И. В. Фотофорез в комплексной терапии Т-клеточных злокачественных лимфом кожи: Автореф. дис. . канд. мед. наук. — 1995. — С. 22.
- Вавилов А. М., Лезвинская Е. М. Иммунокомпетентные структуры кожи и их роль в развитии первичных кожных лимфом//Архив патологии. 1996. — № 6. — С. 7–2.
- Ершов В. И., Бочкарникова О. В., Соколова И. Я. Кожные лимфомы//Актуальные вопросы внутренней медицины и педагогики: Сб. науч. тр. — 2000. — C. 232–240.
- Ламоткин И. А. Типы клинического течения грибовидного микоза// Междунар. мед. журн. — 2001. — № 5. — С. 427–428.
- Кутасевич Я. Ф. Особенности патогенеза, методы ранней диагностики и рациональной терапии грибовидного микоза: Автореф. дис. . докт. мед. наук, 1989. — С. 33.
- Трофимова И. Б. Т-клеточные злокачественные лимфомы кожи: иммунофенотипические особенности и терапия// Автореф. дис. . докт. мед. наук, 1994. — С. 34.
- Самсонов В. А., Вавилов А. М., Васина Н. И. Эффективность фотохимиотерапии в сочетании с лейкинфероном на различных стадиях Т-клеточных злокачественных лимфом кожи: Сб. науч. тр. — Астрахань, 1998. — С. 117–118.
- Самсонов В. А., Чистякова И. А., Аверина Л. В. Гаммаферон в терапии больных грибовидным микозом// Вестник дерматологии и венерологии, 1995. — № 5. — С. 4 — 6.
- Хасан Хамад А., Попова О. Н., Силуянова С. Н., Белушкина Н. Н. Исследование апоптоза лимфоцитов периферической крови больных с Т-клеточной лимфомой кожи и ангиитами кожи// Вопр. биол. мед. и фармац. химии. — 2000. —№ 4. — С. 22 — 25.
- Чиарион В., Бонони А., Форнаса К. Вторая фаза исследования применения интерферона-альфа с ПУВА-терапией у больных Т-клеточной лимфомой кожи// Журнал клинической онкологии. — 2002. — № 15. — С. 2876 — 2880.
- Carretero C. D., Fivenson D. P. A complement and durable response to denileukin diftitoх in a patient with micosis fungoides. J. Acadam Dermatol., 2003; 48, 275 — 276.
- Eichmuller S., Usener D. Tumor-specific antigens in cutaneous T-cell lymphoma. Int. J. Cancer. — 2003; 104. Р. 482 — 487.
- Kim Y., Martines G. Topical nitrogen mutard in management of micosis fungoides. Arch.Dermatol. — 2003; 139. Р. 165 — 173.
- Ferenczi K. Increased CCR4 expression in cutaneous T cell lymphoma. J. Invest Dermatol. 2002; 119; 1405 — 1410.
- Mucher J. Vaccination therapy for cutaneous T-cell lymphoma. Clin Exp. Dermatol. 2002; 27; 602 — 607.
- Rook A., Wysocka M. Citokines and other biologic agents as immunotherapeutics for cutaneous T-cell lymphoma. Adv. Dermatol. 2002; 18; 29 — 43.
Н. Г. Короткий, доктор медицинских наук, профессор
М. В. Уджуху
РГМУ, Москва

Первичные Т-клеточные лимфомы кожи (ПКТКЛ) представляют собой гетерогенную группу лимфопролиферативных заболеваний, характеризующихся клональной пролиферацией Т-лимфоцитов в коже. ПКТКЛ являются самостоятельными клинико-морфологическими формами экстранодальных неходжкинских лимфом и отличаются от нодальных гистологических аналогов характером течения, прогнозом и подходами к терапии. Наиболее распространенной формой ПТКЛ являются грибовидный микоз, частота его встречаемости среди всех ПКТКЛ составляет 50–72%.

Грибовидный микоз в большинстве случаев характеризуется хроническим медленно прогрессирующим течением с чередованием периодов обострения и клинического улучшения. Характер кожных поражений при грибовидном микозе может быть разнообразным и зависит от клинического варианта заболевания и стадии опухолевого процесса.При ранних стадиях заболевания могут наблюдаться разнообразныеэритематозные пятна, уртикароподобные, псориазо- и парапсориазоподобные, экземоподобныекожные элементы. Поздние стадии грибовидного микоза характеризуются появлением опухолевидных образований на коже, нередко с изъязвлениями, экстрадермальными очагами поражения, лейкемизацией опухолевого процесса.
Для правильного выбора терапевтической тактики необходимо руководствоваться принципами терапии грибовидного микоза, сформулированными Американским консорциумом по кожным лимфомам (UnitedStatesCutaneousLymphomaConsortium – USCLC, 2011) в 2011 г.:
1. Т-клеточные лимфомы кожи, в частности грибовидный микоз, отличаются от нодальныхлимфом характером течения заболевания, прогнозом, подходами к терапии;
2. Масса опухоли и скорость прогрессии определяют подходы к лечению;
3. Максимально сохранить собственный иммунный ответ;
4. Использовать иммунотерапию до тех пор, пока возможен контроль над заболеванием. Химиотерапия должна назначаться только тогда, когда исчерпаны другие ресурсы;
5. Всегда должна рассматриваться возможность комбинированного лечения (иммунотерапия + местная терапия);
6. Своевременное применение антибиотиков (колонизация кожи Staphylococcusaureus);
7. Сохранение качества жизни – лечение кожного зуда.
Т-клеточные лимфомы кожи, в частности грибовидный микоз, отличаются от нодальных лимфом характером течения заболевания, прогнозом, подходами к терапии.Поздние стадии грибовидного микоза, проявляющиеся образованием опухолевидных образований, изъязвлений кожи, экстрадермальной локализацией очагов поражения, необходимо отграничить от нодальных лимфом, протекающих с первичным поражением лимфоузлов и метастатическим поражением кожи. Важно помнить, что пациент с грибовидным микозом может обратиться к врачу на любой стадии опухолевого процесса. При поздних стадиях грибовидного микоза одновременно с опухолевыми образованиями, изъязвлениями будут наблюдаться эритематозные пятна и бляшки на коже, характерные для ранних стадий. Вид кожных элементов при метастатическом поражении кожи при нодальных лимфомах будет одинаковым. Тщательной анализ клинической картины и сбор анамнеза, комплексное обследование помогут разграничить первичное и метастатическое поражение кожи, верифицировать диагноз, а значит, выбрать правильную тактику лечения.
Своевременное применение антибиотиков (колонизация кожи Staphylococcusaureus). Нарушение барьерной функции кожи при грибовидном микозе, а также колонизация Staphylococcusaureus, приводит к развитию тяжелых инфекционных процессов. Своевременное назначение антибактериальной терапии уменьшает количество фатальных осложнений.
Сохранение качества жизни – лечение кожного зуда. Большинство пациентов на ранних и/или поздних стадиях заболевания испытывают мучительный кожный зуд. Снижение интенсивности зуда и различных нейропатий (ощущений жжения, боли, стягивания кожи, парестезий) для больных грибовидным микозом имеет важное психоэмоциональное значение. Для уменьшения этих ощущений используются увлажняющие кремы и антигистаминные препараты. При выраженном зуде рекомендовано назначение габапентина – препарата, используемого для лечения нейропатических болей. Кроме того, побочный эффект в виде седации нормализует ночной сон. Несоблюдение вышеизложенных принципов терапии снижает продолжительность и качество жизни пациентов и доставляет им мучительные страдания.
закономерность, чем больше курсов полихимиотерапии проводится, тем быстрее начинает прогрессировать заболевание.Нужно заметить, что на ранних стадиях грибовидного микоза, мы наблюдаем хрупкий баланс между опухолью и иммунитетом: часть появляющихся пятен регрессирует без какой-либо терапии. Не следует спешить назначать системную терапию, а эскалация противоопухолевого воздействия должна быть поэтапной, соответствующей характеру и распространенности кожных элементов. Системную терапию назначают только тогда, когда все виды наружной терапии исчерпаны и/или появились опухолевидные образования на коже и экстрадермальные очаги поражения. Необходимо объяснять пациентам, что не всегда нужно добиваться полного исчезновения проявлений заболевания, наличие косметических дефектов (пятен) не повод к экстренному проведению терапии. Цитостатическая терапия изменяет количество и функциональные характеристики иммунокомпетентных клеток. С каждым новым видом терапии сокращается продолжительность ремиссий.
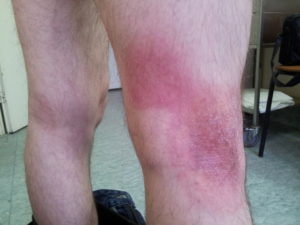
Другой распространенной ошибкой в лечении грибовидного микоза является длительная терапия глюкокортикоидами. Помимо побочных эффектов, таких как стероидный сахарный диабет, синдром Иценко-Кушинга, артериальная гипертензия, мы наблюдаем большее количество тяжелых инфекционных осложнений вследствие колонизации кожи Staphylococcusaureus и снижения количественных и функциональных характеристик иммунной системы. Кроме того, возможность проведения цитостатической терапии у пациентов с развившимися осложнениями после длительной терапии глюкокортикостероидами крайне ограничена. Глюкокортикостероиды могут быть включены в схему лечения коротким курсом продолжительностью 7-10 дней для усиления противоопухолевого эффекта цитостатической терапии и/или уменьшения симптомов воспаления, кожного зуда.
Мало внимания уделяется психоэмоциональному состоянию больных грибовидным микозом. Каждому больному необходимо объяснить характерные особенности заболевания и принципы лечения. Некоторые больные грибовидным микозом не могут смириться с неизлечимым характером заболевания, ходят от врача к врачу, подсознательно пытаясь найти того, кто пообещает вылечить от неприятного недуга.Как правило, обращаются к парамедицинским личностям (шаманы, народные целители и т.д.), прекращая при этом рекомендованную врачом терапию. В некоторых случаях находится малоопытный врач, который назначает полихимиотерапию, тем самым сокращая жизнь больного.
Грибовидный микоз являются редкой формой экстранодальных неходжкинских лимфом. Заболеваемость грибовидным микозом за последние десятилетия растет, значит, будет увеличиваться количество пациентов с этой нозологией.Своевременная верификация диагноза, правильно выбранная тактика лечения, коррекция кожного зуда позволят увеличить продолжительность жизни и обеспечить социальную адаптацию больных.
Местные кортикостероиды класса III или IV
Эти препараты могут вызвать клиническую ремиссию на самой ранней стадии ограниченного пятна. Их можно назначать в качестве дополнительного лечения при одном из других местных методов.
Фототерапия ультрафиолетом Б (УФБ)
Сообщается, что эта терапия приводила к полной ремиссии у 25/35 (71%) пациентов с ранним грибовидным микозом в стадии пятна при средней продолжительности ремиссии 22 мес. При применении этой схемы лечения 2-3 раза в неделю среднее время ремиссии составило 6 мес. УФБ необходимо начинать с 50% от минимальной дозы эритемы с последующим повышением дозы в зависимости от индивидуальной реакции кожи.
Фототерапия ультрафиолетом А (УФА)
Псорален в комбинации с УФА (ПУВА) впервые был применен в 1976 г. для лечения грибовидного микоза, а затем во многих других исследованиях. Это эффективная и относительно безопасная терапевтическая модальность для ранней стадии пятна/бляшки при грибовидном микозе. Псорален (8-метоксипсорален) активируется УФА. Активированный псорален связывается с ДНК, образуя моно- и бифункциональные добавки к пиримидиновым основаниям. Общий эффект может быть вызван преимущественной ингибицией митоза или гибелью неопластических Т-лимфоидных клеток в коже или кожных капиллярах. К тому же ПУВА препятствует презентации антигенов и производству цитокинов в коже.
ПУВА-терапия требует приема внутрь 0,6 мг/кг 8-метоксипсоралена за 2 ч до облучения всей кожи УФА. Лечение следует начинать с 2-3 сеансов в неделю при 50% от минимальной фототоксической дозы УФА, которую увеличивают каждый раз в зависимости от наличия эритемы. Эту схему применяют в течение 3-6 мес. до достижения полной ремиссии. Для поддерживающей терапии облучение проводят 1 раз в неделю или 1 раз в 2 нед. в течение нескольких месяцев.
Большинство пациентов хорошо переносят ПУВА-терапию. Побочные эффекты, такие как эритема, тошнота и зуд, встречаются у 10-20% пациентов. Долговременные побочные эффекты включают повышенный риск плоскоклеточного рака, развитие пигментных пятен, пигментацию ногтей и образование катаракты. По этой причине необходим соответствующий контроль за всеми пациентами.
ПУВА-терапия при грибовидном микозе дает ПР в 80-90% случаев.
Комбинация ПУВА-терапии с ретиноидами (реПУВА) дает полную ремиссию, сравнимую с отдельной ПУВА-терапией. Однако добавление ретиноидов уменьшает количество необходимых сеансов ПУВА-терапии. Изотретиноин назначается в дозе 0,5 мг/кг.
Комбинация ПУВА-терапии с интерфероном-альфа2 увеличивает эффект ПУВА. Однако у большинства пациентов побочные эффекты включают лихорадку, озноб, усталость и боль в мышцах. Интерферон назначают внутримышечно (3 млн МЕ 3 раза в неделю). В исследовании Kuzel (1995) доза интерферона повышалась постепенно по 3 млн ME в течение 6-8 нед. до конечной дозы 12 млн ME. Дозу пришлось снизить у многих пациентов из-за побочных эффектов.
УФА-1 (340-400 нм) является эффективным и хорошо переносимым лечением для пациентов с грибовидным микозом в стадии I и II. У 11 из 13 пациентов наступила полная ремиссия.
Местная химиотерапия мехлорэтамином (азотистым ипритом HN2)
При этой терапии полная ремиссия достигает 60% в зависимости от площади поражения кожи. Этот метод прост и может проводиться пациентом дома с помощником или без него. 10 мг HN2 растворяют в 50 мл водопроводной воды и наносят свежеприготовленный раствор на всю поверхность кожи (за исключением век и губ) ежедневно. Продолжительность и частота лечения может отличаться в различных медицинских учреждениях. В Нидерландах начинают с ежедневного применения препарата в течение 5 дней в неделю при длительности лечения как минимум 3 мес. Если очаги исчезают, мы назначаем поддерживающее лечение 1-2 раза в неделю в течение нескольких месяцев или даже лет.
Могут иметь место реакции замедленной гиперчувствительности или токсичности. В таких случаях целесообразны открытые лоскутные тесты с несколькими концентрациями, поскольку это позволяет продолжить лечение при концентрации, которая дает минимальную эритему. Из-за возможной сенсибилизации персоналу, помогающему пациенту при нанесении раствора, рекомендуется ношение защитных двойных пластиковых перчаток (из ПВХ), а также маски на нос и рот. Вероятность аллергических реакций при применении HN2 на мазевой основе более низкая. При этом 10 мг мехлорэтамина содержится в 100 г eucerine безводного.
Побочные эффекты при местном применении HN2 включают эритему, зуд, телеангиэктазию, гиперпигментацию и долговременные эффекты, такие как вторичная плоскоклеточная карцинома кожи. Аномалий костного мозга и легких не наблюдалось. Местная терапия посредством HN2 представляется относительно безопасной для пациентов с ранней стадией грибовидного микоза.
Местная химиотерапия кармустином (BCNU)
Это альтернативная терапия для пациентов с грибовидным микозом. Иммунологически она не является перекрестно реактивной с HN2 и по этой причине применяется у тех пациентов, у которых развивается контактная аллергия на HN2. BCNU применяется в форме 5% мази, стабильной при комнатной температуре. При применении BCNU может возникать супрессия костного мозга, если общая доза превышает 600 мг, поэтому необходим гематологический мониторинг.
Облучение всей кожи пучком электронов
Это отличный метод лечения пациентов с распространенным поражением кожи при наличии бляшек и кожных опухолей. Метод 6 полей обеспечивает наилучшую гомогенность дозы, поступающей на всю поверхность кожи пациента. Большая часть дозы (80%) поступает на глубину 1-го сантиметра поверхности кожи, не задевая более глубокие слои дермы. В Нидерландах мы применяем 4 МэВ с общей дозой 30-35 Гр. Волосистую часть головы, промежность и подошвы облучают дополнительно. Побочные эффекты включают сухость кожи, пигментацию, телеангиэктазию и иногда постоянную потерю волос на волосистой части головы. Возможен вторичный рак кожи, особенно у пациентов, получающих последующее местное лечение с применением HN2 или ПУВА-терапию. Примерно у 50% пациентов через 1-2 года наступает рецидив. В этом случае они получают бустерную дозу облучения, или HN2 местно, или ПУВА-терапию.
Местная лучевая терапия
Она рекомендуется при единичных опухолях или торпидных бляшках у пациентов с грибовидным микозом. Очаги грибовидного микоза чрезвычайно чувствительны к лучевой терапии, поэтому даже низкие дозы излучения дают полную ремиссию в 90% случаев.
Под редакцией А.Д. Кацамбаса, Т.М. Лотти
• Редкость грибовидного микоза обусловливает ограниченность данных о доказательных методах лечения, поскольку хорошо организованные проспективные контролируемые клинические исследования, в которых бы сравнивались различные виды терапии отсутствуют.
• Для первой стадии заболевания с локализацией патологического процесса в коже, рекомендуется симптоматическая терапия эмолентами, противозудными препаратами (доксепин крем 5%) и местными стероидами высокой степени активности (клобетазол крем 0,05% два раза в день) в амбулаторных условиях. Местные ретипоиды (бексаротен по 300 мг/м2 один раз в день внутрь ежедневно) или местная химиотерапия (азотистый иприт, бихлороэтилнитрозомочевина или кармустин) являются альтернативными методами лечения при локальной форме заболевания и эффективными дополнительными мероприятиями при генерализации процесса.
• Если, несмотря на лечение, заболевание персистирует пли при непереносимости других препаратов может применяться бексаротен 1% местный гель. Когда бексаротен используется в комбинации с усиленным псораленом ультрафиолетовым светом (ПУВА), общая дозировка УФА снижается, а если он используется в качестве поддерживающей терапии, увеличивается продолжительность ремиссии.
• Альтернативно, ПУВА-терапия может также использоваться одновременно с интерфероном (ИФ) (три раза в педелю) или ретиноидами до разрешения очагов, затем лечение продолжается в качестве поддерживатощей терапии.
• При бляшках, не реагирующих на комбинированную терапию (ПУВА + ретиноид), в одном из исследований было показало успешное разрешение очага после применения 5% местного крема имиквимода.
• УФА вместо псоралена может также усиливаться метоксаленом или оксораленом.
• Была доказана эффективность применения УФВ узкого спектра действия на ранней стадии грибовидного микоза с продлением ремиссии, однако оптимальный протокол поддерживающей терапии еще предстоит определить. • При фотодинамической терапии 5-аминолевулиноная кислота была эффективнее в отношении отграниченных инфильтратов, чем местные стероиды, однако для стандартизации этого метода лечения необходимо большое количество исследований. В основном, фотодинамическая терапия действует через механизмы непосредственной цитотоксичности, альтерации стенок сосудов и воздействия на иммунный ответ организма.
• Во второй стадии грибовидного микоза поражаются регионарные лимфатические узлы, при этом применяются те же методы терапии, что и при стадии I. Для стадии ИВ чаще всего рекомендуется тотальная кожная электронная лучевая терапия (ЭЛТ), за которой следует лечение азотистым ипритом в течение > 6 месяцев. При рецидиве заболевания после ЭЛТ может применяться ПУВА в комбинации с интерфероном или системным ретиноидом. Другие методы системной терапии включают использование фузионных рекомбинантных токсином, моноклональпых антител и мопохимиотерапию. Свидетельств в пользу более высокой выживаемости при лечении рецидивирующих опухолей с помощью комбинированной системной химиотерапии по сравнению с монотерапией не получено.
• В стадии III или при эритродермической форме без впекожных проявлений, либо только с ограниченным вовлечением лимфатических узлов и чеченце 4 недель применяется химиотерапия или фотофорез. Экстракорпоральная фотохимиотерапия подразумевает облучение лейкоцитов с ПУВА-терапией после лейкофереза перед внутривенной реинфузией клеток крови. Если ответная реакция задерживается, фотоферез можно комбинировать с интерфероном или системными ретиноидами.
• В стадии IV, характеризующейся внекожным поражением, назначается системная химиотерапия. Хотя после комбинированной химиотерапии наступает улучшение, оно длится менее одного года. Различные режимы включают следующие методы и препараты: циклофосфамид, випкристин и преднизон (ЦВП); ЦВП плюс адриамицин; ЦВП плюс метотрексат или циклофосфамид, винкристин, адриамицин и этопозид. При адъювантном лечении используются интерферон, системные ретиноиды и фотоферез. При монохимиотерапии применяются метотрексат, липосомальный доксорубицип, гемцитабин, этопозид, циклофосфамид и пуриновые аналоги. Таких пациентов необходимо направить к дерматологу, онкологу и специалисту по лучевой терапии.
• Пациенты должны находиться под наблюдением в связи с возможным развитием вторичных злокачественных опухолей.
Рекомендации пациентам с грибовидным микозом:
• Пациентам с грибовидным микозом следует избегать воздействия солнца, находиться в прохладной окружающей среде и постоянно смазывать кожу смягчающими препаратами.
• При ранней диагностике, если пятнистые или папулезные бляшки запимают менее 10% поверхности кожи (стадия IA), продолжительность жизни не меняется.
• В остальных случаях терапия при грибовидном микозе и синдроме Сезари малоэффективна, продолжительность жизни при стадии ИВ с поражением кожи составляет 4-6 лет, при стадии III - стадии генерализованной эритродермии - 3,2 года и менее 1,5 лет при стадии IVA и стадии IVB с вовлечением лимфоузлов и внутренних органов.
Через несколько дней появились другие гипопигментированные пятна и бляшки, распространившиеся на руки и бедра. При физикальном исследовании лимфаденопатия не выявлена. При исследовании материала, полученного с помощью трепанобиопсии и окрашенного гематоксилин-эозином, у дермо-эпидермального соединения были выявлены лимфоциты с мозговидными ядрами, характерные для грибовидного микоза - разновидности кожной Т-клеточной лимфомы. Основные показатели крови были в норме, тест на ВИЧ-инфекцию - отрицательный.
Пациентка сообщила об отсутствии улучшения после местного применения кортикостероидов высокой степени активности, которые наносились на пораженные участки, в связи с чем ей назначена терапия УФ-Б узкого спектра действия два раза в неделю.
Читайте также:

