Иммуно молекулярные методы в терапии опухолей
Иммунодиагностика опухолей. Иммунотерапия опухолей. Методы иммунотерапии при опухолях. Адъюванты. Иммуномодуляторы. Особенности иммунотерапии опухолей.
Методы выявления опухолевых Аг принципиально аналогичны применяемым в отношении других Аг. Наиболее часто для их идентификации применяют иммуноферментный метод и иммуно-флюоресцентную микроскопию. Распространение получили непрямые методы, позволяющие обнаружить незначительные количества опухолевых Аг на поверхности клеток. Также применяют цитотоксические тесты, учитывающие гибель опухолевых клеток под действием сыворотки крови больного и комплемента. Для подсчёта содержания онкоантигенов и определения места их фиксации применяют иммуноферментный анализ (ИФА) и РИА. Большое прогностическое значение имеет оценка иммунного статуса пациента, особенно реактивности Т-лимфоцитов.
Методы иммунотерапии при болезнях злокачественного роста не получили достаточного теоретического обоснования, хотя история их применения начитывает более 50 лет. Широкому внедрению иммунотерапии мешает отсутствие чётких показаний к её назначению и критериев эффективности. Избежать многих побочных эффектов иммунотерапии можно путём рационального использования и прогнозирования её действия. Попытки переноса пациенту иммунокомпетентных клеток, сенсибилизированных антигенами опухоли, наталкиваются на развитие реакций отторжения трансплантата. Большие перспективы имеет применение препаратов, оказывающих стимулирующий эффект на активность защитных факторов. Способностью воздействовать на активность иммунокомпетентных клеток при антигенной стимуляции обладают различные химические агенты (алюминий, латекс), вещества растительного происхождения (лектины, сапонины), микроорганизмы и их метаболиты, митогены (фитогемагглютинин, митоген лаконоса), витамины (ретинол, токоферол), нуклеиновые кислоты, синтетические полинуклеотиды, ИФН, гормоны (тимозин, эстрогены) и другие вещества. Для иммунотерапии опухолей возможно применение нескольких групп препаратов.
Каждый адъювант имеет свои эффекты и клетки-мишени. Молекулы адъюванта сорбируются на клетках-мишенях, запуская их пролиферацию, дифференцировку, изменение мембранных функций и секрецию медиаторов. Основное действие большинства адъювантов — увеличение цитотоксического эффекта. На практике наибольшее распространение нашли различные микроорганизмы и их продукты (БЦЖ, ЛПС грамотрицательных палочек, продигиозан и др.).
Иммуномодуляторы — группа природных и синтетических веществ, восстанавливающих утраченные или подавленные функции иммунокомпетентных клеток. К природным продуктам относят экстракты вилочковой железы, тимозин и различные медиаторы иммунных реакций (тимопоэтин, миелопид). Синтетические вещества — большая группа соединений; в терапии болезней злокачественного роста наиболее длительно применяют левамизол и изопринозин (инозиплекс). Эти вещества повышают функциональную активность периферических Т-лимфоцитов, фагоцитов, стимулируют предшественники Т-лимфоцитов, вызывая их дифференцировку и созревание. Левамизол и изопринозин входят в особую группу препаратов — тимоми-метиков; они имитируют действие гормонов тимуса, стимулируя созревание Т-лимфоцитов.
Введение низких доз иммуномодуляторов часто стимулирует ответ на опухолевые Аг. Высокие дозы препаратов могут подавлять иммунный ответ на опухолевые Аг. Один из критических факторов успешности терапии — степень генетической несовместимости опухолевых Аг и нормальных Аг МНС организма. При слабых антигенных различиях можно наблюдать супрессорное действие иммунотерапевтических препаратов. Таким образом, для эффективного осуществления иммунотерапии опухолей необходимо иметь данные о состоянии иммунного статуса больного.
• Иммунотерапию назначают после химиотерапии и других видов противоопухолевого лечения через определённый срок, необходимый для восстановления иммунной реактивности-. Проведение иммунотерапии перед химиотерапией нецелесообразно, поскольку возможно взаимное усиление супрессорного эффекта.
• Для проведения иммунотерапии объём опухоли должен быть сокращен до минимального предела всеми видами противоопухолевой терапии. Иммунотерапия при больших опухолях обычно бесперспективна.
• Восстановление иммунной реактивности после хирургического удаления опухоли или химиотерапии у больных с иммуносупрессией — прогностически благоприятный признак. Появление признаков иммунодефицита может быть сигналом рецидива опухоли.

Во время деления клеток в нашем организме периодически возникают ошибки. Это неизбежно. Если что-то пошло не так, после деления дочерние клетки имеют неправильное строение, могут становиться раковыми. Иммунная система всегда настороже и готова их уничтожить.
Однако, иммунитет справляется со своей функцией не всегда — в противном случае ни у кого бы не возникали злокачественные опухоли.
Раковые клетки коварны, они могут обзавестись разными видами защиты:
- Если раковая клетка вырабатывает недостаточно много чужеродных веществ, иммунитет её не замечает.
- Некоторые опухоли умеют вырабатывать вещества, которые подавляют работу иммунных клеток.
- Иногда ведущая роль принадлежит микроокружению опухоли — клеткам и молекулам, которые окружают раковые клетки. Микроокружение тоже может подавлять иммунитет.
Для того чтобы иммунная система начала расправляться с опухолью, её нужно активировать, либо предоставить ей необходимые компоненты. Современные врачи и ученые знают, как это сделать. Такое направление лечения рака называется иммунотерапией. Существует несколько её разновидностей.
Какие бывают разновидности иммунотерапии?
На данный момент онкологам доступны разные виды иммунотерапии:
Многие ученые считают, что за иммунотерапией будущее в лечении рака. Исследования в этом направлении продолжаются, в лабораториях разрабатывают и тестируют новые препараты.
Моноклональные антитела
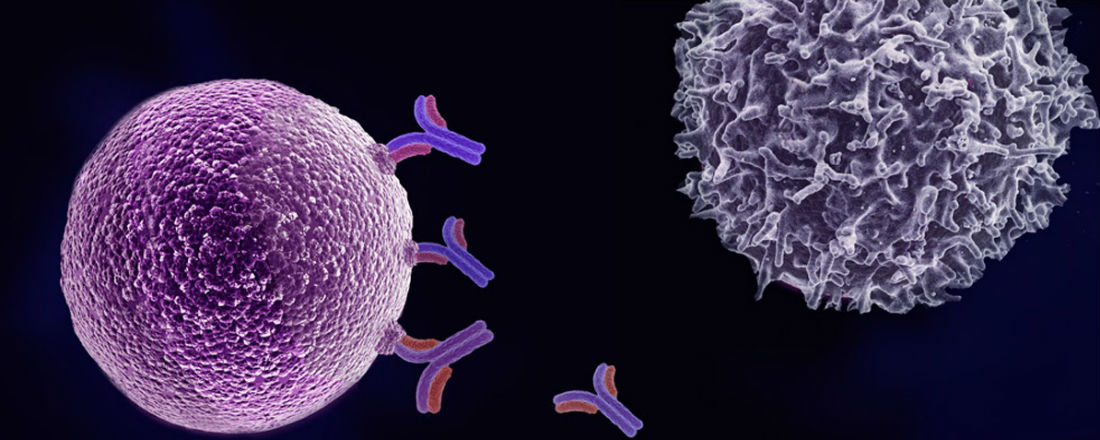
Чужеродные вещества в организме человека называют антигенами. В ответ на их внедрение иммунная система вырабатывает специфические белковые молекулы — антитела. Каждое антитело связывается с соответствующим ему антигеном, после чего происходит ряд событий, приводящий к уничтожению чужеродного агента.
Моноклональные антитела — по сути искусственные заменители собственных антител человека. Каждое из них находит в организме свою молекулу-мишень и связывается с ней. В случае с онкологическими заболеваниями такой мишенью является определенное вещество, которое раковые клетки вырабатывают в достаточно большом количестве, а здоровые — в очень малом, или не вырабатывают вообще.
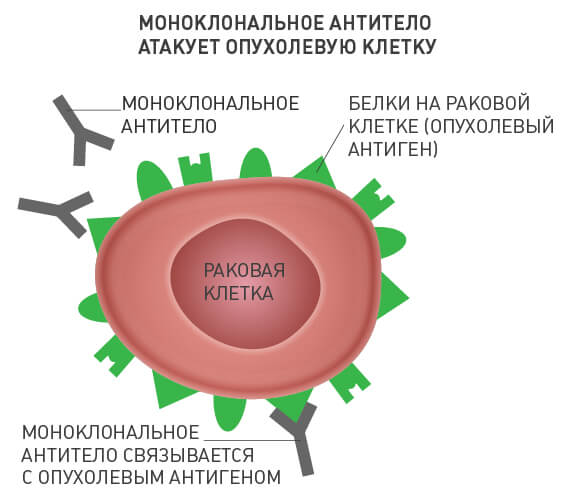
Различные моноклональные антитела действуют по-разному:
Моноклональные антитела можно использовать для доставки к раковым клеткам других лекарств. Например, можно прикрепить к молекуле антитела радиоактивную частицу или химиопрепарат.
За последние годы в мире было одобрено и внедрено в клиническую практику более десятка разных моноклональных антител. Они применяются для лечения ряда злокачественных опухолей, обладающих определенными молекулярно-генетическими характеристиками. В настоящее время ученые работают над созданием новых препаратов, некоторые лекарства проходят испытания и, возможно, вскоре будут введены в клиническую практику.
Кейтруда (Пембролизумаб)
PD-1 – это рецептор, который находится на поверхности T-клеток. Когда он взаимодействует с белком PD-L1, замедляется размножение иммунных клеток, они перестают выделять цитокины и атаковать опухолевую ткань. Кейтруда разрывает эту связь и снимает блок с лимфоцитов:
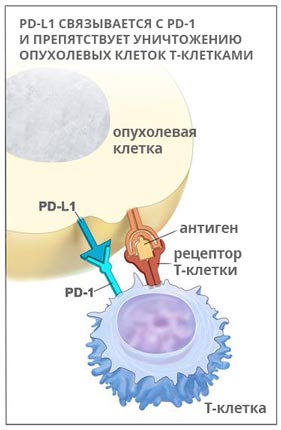
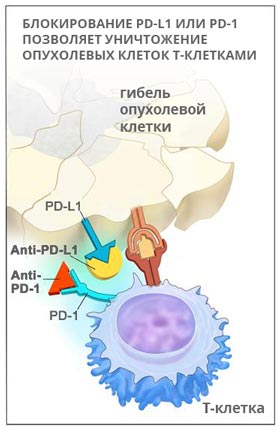
Пембролизумаб был одобрен к применению в Америке в сентябре 2014 года. В настоящее время его используют для лечения меланомы, немелкоклеточного рака легких, опухолей головы и шеи. Кейтруду обычно назначают при некурабельных опухолях, которые невозможно удалить хирургически, если другие методы лечения не помогают.
Ниволумаб (Опдиво)
Ниволумаб, как и Кейтруда, является ингибитором белка-рецептора PD-1. В декабре 2014 года этот препарат был одобрен в Америке для лечения меланомы. В настоящее время основными показаниями к применению Ниволумаба являются: метастатическая и неоперабельная меланома, местнораспространенный или метастатический мелкоклеточный и немелкоклеточный рак легких, почечно-клеточный рак на поздних стадиях. В ряде случаев ниволумаб сочетают с другим ингибитором контрольных точек – ипилимумабом (Ервой).

Ритуксимаб (Мабтера, Ритуксан)
Мишень для ритуксимаба — рецептор CD20, который находится на поверхности B-лимфоцитов. Соединяясь с рецептором, препарат заставляет NK-клетки (натуральные киллеры — разновидность иммунных клеток) атаковать B-лимфоциты, как злокачественные, так и нормальные. После курса лечения организм производит новые нормальные B-лимфоциты, их количество восстанавливается.
Ритуксимаб был одобрен к применению достаточно давно — еще в 1997 году. В настоящее время его используют для лечения аутоиммунных и онкологических заболеваний: хронического лимфолейкоза, вульгарной пузырчатки, неходжкинской лимфомы, идиопатической тромбоцитопенической пурпуры.
Ипилимумаб (Ервой)
Ервой связывается с молекулой CTLA-4 и активирует иммунную систему, для того чтобы она могла бороться с раком. Исследования показывают, что препарат помогает надолго остановить рост опухоли, а в 58% случаев способствует уменьшению её размеров, как минимум, на треть.
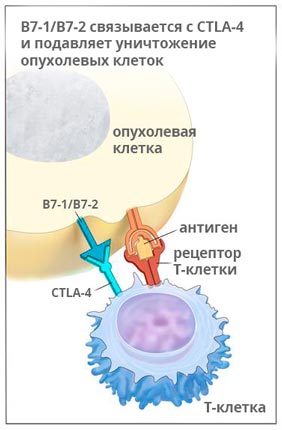
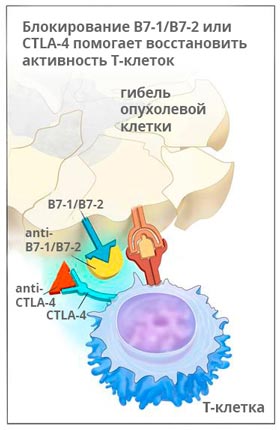
Ипилимумаб применяют у пациентов, страдающих меланомой на поздних стадиях, раком легкого, простаты.
Цитокины
Цитокины – это неспецифические стимуляторы иммунитета. Они активируют иммунную систему не против какого-то определенного антигена, а в целом. В настоящее время в онкологии главным образом применяют два препарата – интерлейкин-2 (ИЛ-2) и интерферон-альфа.
Интерлейкин-2 представляет собой молекулу, которая переносит биохимические сигналы между лейкоцитами. Он ускоряет рост и размножение иммунных клеток. Этот препарат находит применение при распространенном раке почек, метастатической меланоме. Иногда ИЛ-2 сочетают с химиотерапией и другими цитокинами. При этом его действие усиливается, но повышается риск серьезных побочных эффектов.
В настоящее время ведутся исследования по возможности применения в онкологии других типов интерлейкинов, таких как ИЛ-7, ИЛ-12, ИЛ-21.
Интерфероны – вещества, которые принимают участие в борьбе с вирусами и раковыми клетками. Существует три типа интерферона, названных по буквам греческого алфавита – альфа, бета и гамма. Для лечения рака применяют препараты интерферона-альфа. Они помогают усилить противоопухолевый иммунный ответ, непосредственно замедлить рост раковых клеток и кровеносных сосудов, которые обеспечивают опухоль кислородом и питательными веществами.
Интерферон-альфа применяют при раке почек, меланоме, волосатоклеточном лейкозе, некоторых типах лимфомы, саркоме Капоши.
Иммунотерапия при раке легкого
Рак легких — одно из самых распространенных онкологических заболеваний. По заболеваемости и уровню смертности он занимает первое место у мужчин и третье место у женщин. Почти 20% пациентов, умерших от злокачественных опухолей, погибли от рака легкого. В группе повышенного риска находятся курильщики в возрасте старше 50 лет. На каждые 3–4 миллиона выкуренных сигарет приходится одна смерть от рака легких.
Заболевание часто диагностируют на поздних стадиях, когда многие виды лечения оказываются неэффективны. В таких случаях пользу может принести иммунотерапия.
При раке легкого применяют такие препараты, как ниволумаб (Опдиво), ипилимумаб (Ервой), пембролизумаб (Кейтруда), атезолизумаб (Тецентрик).
В Европейской клинике применяются наиболее современные методы лечения рака легкого, меланомы и других онкологических заболеваний. Благодаря сотрудничеству с зарубежными коллегами, мы может предоставить пациентам возможность пройти курс иммунотерапии, персонализированного лечения в нашем центре иммунотерапии. Мы знаем, как продлить жизнь и избавить от мучительных симптомов при запущенном раке. Мы знаем, как помочь.
Иммунотерапия при меланоме
Меланома — далеко не самая распространенная (всего 2%) форма рака кожи, но она очень агрессивна и чаще других опухолей приводит к смерти. Так, в 2012 году в мире было диагностировано 232 000 новых случаев меланомы, 55 000 больных погибли. Меланома рано метастазирует, после чего многие методы лечения становятся неэффективны.
На поздних стадиях для лечения меланомы применяют пембролизумаб (Кейтруда), ипилимумаб (Ервой), ниволумаб (Опдиво).
Отзыв пациента о лечении меланомы иммунотерапией:
Мне 41, я бывший спортсмен-байдарочник, волосы черные, глаза карие — то есть, я нормально переношу загар, кожа смуглеет быстро, а ожогов у меня не бывает. Я, конечно, слышал, что длительное пребывание на солнце чревато всякими проблемами, а так как основную часть времени я проводил как раз на солнце, регулярно проверялся у дерматолога. От него и узнал, что есть такая беда, как меланома — рак кожи. Но, по его словам, мне она не грозит, как раз ввиду особенностей моей кожи.
Ну, и, конечно, у меня нашли меланому. Причем, что обидно, не на спине или плечах, что было бы логично — эти места постоянно под лучами, а на бедре.
В первую очередь, по совету дерматолога, отправился в одну небезызвестную клинику. Приняли охотно, сказали, что вероятность хорошего исхода большая, так как обнаружена она достаточно рано.
Но, этот выигрыш они благополучно спустили на недельные обследования. По результатам мне назначили операцию ещё через неделю, а потом Интерферон. Я обратился к тому же дерматологу, который послушал меня, и несколько удивился. Ничего толком не сказал, но намекнул на то, что можно бы получить и второе мнение, да побыстрее.
Иммунотерапия при раке желудка
При раке желудка I–III стадии основным методом лечения является хирургическое удаление опухоли, нередко его дополняют курсом химиотерапии и лучевой терапии. На IV стадии, когда опухоль распространяется за пределы органа и дает метастазы, шансы на полную ремиссию стремятся к нулю. В таких случаях проводят лечение, направленное на замедление роста опухоли, сокращение её размеров, продление жизни пациента.
Именно на IV стадии, когда рак желудка не реагирует на другие виды лечения, может принести пользу иммунотерапия. Эффективны такие препараты, как трастузумаб и рамуцирумаб. В настоящее время исследования в отношении иммунотерапии при раке желудка ведутся в четырех основных направлениях: ингибиторы контрольных точек, таргетная иммунотерапия моноклональными антителами, противораковые вакцины и клеточная иммунотерапия.
Иммунотерапия при раке почки
При лечении рака почек иммунотерапией применяет две группы иммунопрепаратов:
- Цитокины — белки, которые активируют иммунную систему и заставляют её бороться с раком. Для лечения применяют искусственно синтезированные аналоги этих белков: интерлейкин-2 (IL-2) и интерферон-альфа.
- Ингибиторы контрольных точек. Контрольные точки — это особые молекулы иммунной системы, которые она использует, чтобы сдерживать себя от атаки здоровых клеток. Иногда они мешают бороться против опухолевых клеток. При раке почек применяют Ниволумаб (Опдиво) — он блокирует PD-1, белок, который находится на поверхности T-лимфоцитов.
Иммунотерапия при раке яичников
В последние годы хирургическое лечение и химиотерапия при раке яичников значительно продвинулись вперед, и все же ситуация пока еще далека от идеальной. У многих женщин опухоль рецидивирует, перестает реагировать на препараты, которые помогали ранее. Из иммунопрепаратов при раке яичников в настоящее время применяется Бевацизумаб (Авастин) — представитель группы моноклональных антител, который блокирует фактор роста эндотелия сосудов. Раковые клетки синтезируют это вещество в большом количестве, чтобы стимулировать рост новых сосудов, обеспечить себя кислородом и питательными веществами. Некоторые методы иммунотерапии при раке яичников в настоящее время находятся на стадии разработки и тестирования: моноклональные антитела, ингибиторы контрольных точек, иммуномодуляторы, противораковые вакцины, иммуноклеточная терапия, онколитические вирусы.
Побочные эффекты иммунотерапии
Лечение иммунотерапевтическими препаратами имеет некоторые общие моменты с химиотерапией. Такое сходство заключается в том, что клетки опухоли погибают в пределах органов и тканей тела, и организму приходится избавляться от них, как от чужеродного вредоносного материала. Это очень ресурсоёмкая задача, поэтому пациент может испытывать симптомы, вызванные перенапряжением различных систем организма.
Иногда иммунотерапия активирует иммунные клетки чрезмерно, и они начинают атаковать нормальные ткани организма. Из-за этого могут возникать некоторые побочные эффекты:
- При поражении слизистой оболочки полости рта и глотки на ней возникают болезненные язвы, которые могут инфицироваться. Обычно они проходят в течение 5–14 дней после окончания лечения.
- Кожные реакции: покраснение, отечность, сухость, повышение чувствительности к свету, трещины на кончиках пальцев.
- Симптомы, напоминающие грипп: слабость, разбитость, повышенная температура, озноб, кашель.
- Тошнота и рвота.
- Головные боли, головокружения.
- Повышение или снижение артериального давления.
- Мышечные боли.
- Одышка.
- Отеки на ногах.
- Увеличение веса из-за задержки жидкости в организме.
- Диарея.
У разных иммунопрепаратов побочные эффекты выражены по-разному. Лучше заранее поговорить с врачом и спросить, каких проблем можно ожидать во время курса лечения, как с ними бороться.
Иммунотерапия: за и против
Однако, не всё так гладко. У иммунопрепаратов есть и минусы. Они работают далеко не у всех пациентов. Иногда опухоль удается уничтожить полностью, а иногда — лишь замедлить её рост. Ученые пока не могут объяснить, почему результаты лечения бывают такими разными. Несмотря на то, что побочные эффекты встречаются не так часто, как при химиотерапии, иногда они могут быть весьма серьезными.
Иммунотерапия — это всегда длительное лечение. Со временем иммунопрепарат, который помогал пациенту ранее, может перестать работать. К минусам можно отнести и достаточно высокую стоимость иммунотерапии при раке. Таким образом, в каждом случае решение нужно принимать индивидуально. Прежде чем назначить иммунотерапию, врач обязательно взвесит все возможные преимущества и риски.
Ещё один минус иммунотерапии — она подходит не для всех типов рака. Существует не так много онкологических диагнозов, для которых разработан препарат, способный точно и эффективно воздействовать на клетки данного рака. Однако это путь, по которому онкология продолжает идти, открывая всё новые и новые препараты и их комбинации, способные воздействовать на новые виды опухоли. Всё остальное — это исключительно преимущества, которые могут отменить остальные виды лечения уже в обозримом будущем.
Сколько стоит иммунотерапия?
Иммунотерапия — это самый современный медикаментозный метод лечения рака. Стоимость иммунотерапии рака немаленькая. Особенно в сравнении с другими известными методами. Стоимость лечения зависит от вида применяемого иммунопрепарата, типа и стадии опухоли, ее степени агрессивности. Высокая цена иммунотерапии связана с тем, что производство иммунопрепаратов — сложный и дорогой процесс.
В России очень немного клиник, которые проводят лечение иммунотерапией. В большинстве случаев, чтобы пройти курс иммунотерапии, россиянину приходится обращаться к посредникам для лечения за границей. В основном это Израиль, Германия и США. В таком случае стоимость перелёта и лечения составит огромную сумму. Но теперь в России есть возможность пройти иммунотерапевтическое лечение рака в Европейской клинике, что делает его доступным для многих пациентов.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Что такое иммунотерапия?
Объясните, как это работает?
Откуда вообще взялся этот метод лечения?
Первые попытки вылечить пациентов, больных раком, с помощью иммунотерапии были предприняты более ста лет назад. Одним из родоначальников метода считается хирург Уильям Коли. Он заметил, что у некоторых пациентов с рожистым воспалением (бактериальной кожной инфекцией) онкологическое заболевание полностью регрессировало. Коли предположил, что инфекция стимулирует иммунитет на уничтожение опухолевых клеток, и решил подтвердить свои догадки экспериментально. В 1891 году он ввел стрептококковые бактерии пациенту с саркомой кости и смог добиться сокращения злокачественной опухоли.
Тогда его исследования подверглись активной критике, так как не имели внятного теоретического обоснования. Постепенно накапливались знания о физиологии иммунитета, вместе с этим предпринимались новые попытки активировать собственные защитные силы организма для борьбы со злокачественными опухолями — иммунотерапия получила развитие.
Если иммунотерапия существует так давно, почему о ней активно заговорили только сейчас?
Потому что настоящие прорывы произошли лишь в последние годы. Так, в 2018-м Нобелевскую премию по медицине вручили ученым Джеймсу Эллисону из США и Тасуку Хондзё из Японии за открытие контрольных точек — благодаря этому было создано несколько иммунотерапевтических препаратов. Короткий промежуток между теоретическим открытием и внедрением его результатов в медицинскую практику — еще одна причина того, что о новой методике активно говорят. Иммунотерапия открыла новые возможности для борьбы с онкологическими заболеваниями, которые лечатся с большим трудом, например с меланомой и раком легких. Теперь некоторые такие пациенты могут жить на несколько лет дольше без прогрессирования болезни.
Любой ли рак можно вылечить с помощью иммунотерапии?
Это зависит от препарата и особенностей опухоли. Так, препарат пембролизумаб стал первым, который можно назначать вне зависимости от места возникновения рака, если опухоль имеет специфический биомаркер — микросателлитную нестабильность, или PDL-экспрессию. Иммунотерапию применяют для лечения меланомы, рака легких, почки, желудка, мочевого пузыря, простаты, поджелудочной железы, глиобластомы, лимфомы Ходжкина и еще нескольких видов опухолей. Но пока лучшие результаты терапия показала в лечении меланомы и рака легких. Определить, какое лечение подойдет в конкретном случае, может только лечащий врач.
А побочные эффекты есть?
Есть. Так же как и у других эффективных методов лечения онкологических заболеваний — но они отличаются от нежелательных явлений при химиотерапии: причина их возникновения не токсическое действие самих препаратов, а сильный иммунный ответ. Нередко пациенты на иммунотерапии могут сталкиваться с усталостью, кашлем и тошнотой, теряют аппетит, а на коже может появиться сыпь. Реже эти лекарства могут вызывать более серьезные проблемы в легких, кишечнике, печени, почках и других органах. Обычно так бывает, если иммунитет начинает атаковать не только опухолевые клетки, но и здоровые. Пациенты, которые проходят лучевую терапию, также нередко испытывают усталость, у них могут быть проблемы с кожей, а люди, которые получают химиотерапию, сталкиваются с потерей волос, анемией, тошнотой и рядом других проблем.
Объясните, как проходит лечение. Обязательно ложиться в больницу?
В России этот метод лечения популярен?
Нет. Некоторые препараты, например пембролизумаб, ниволумаб, ипилимумаб и атезолизумаб, зарегистрированы в России. Но о широком доступе к терапии говорить не приходится. Препараты зарегистрированы не по всем показаниям, и во многих ситуациях назначить их можно только офлейбл (не по инструкции), но тогда лечение нельзя будет получить бесплатно по полису ОМС.
Полученные в последние 25 лет данные о состоянии иммунной системы у онкологических больных свидетельствуют, что рост большинства злокачественных новообразований сопровождается определенными нарушениями иммунного ответа.
Выявлены закономерности влияния развивающейся опухоли на иммунную систему организма, зависимость степени подавления иммунного ответа от размера опухоли и проводимого лечения.
Эти данные послужили основанием для использования методов иммунотерапии в комплексном лечении злокачественных новообразований.
Основные задачи современной иммунотерапии опухолей:
1) снижение побочных эффектов традиционной противоопухолевой терапии (миелосупрессии, иммуносупрессии), коррекция общетоксических эффектов;
2) профилактика и лечение сопутствующих инфекционных осложнений;
3) профилактика рецидивов опухоли;
4) непосредственный противоопухолевый эффект.
К настоящему времени реальные достижения наблюдаются в решении первых трех задач. С этой целью используются различные иммуномодуляторы, которые в терапевтических дозах восстанавливают функции иммунной системы. Почти 25-летний опыт применения различных иммуномодуляторов в онкологии выявил как положительные, так и отрицательные стороны этого вида лечения.
Показано, что ряд препаратов способствует быстрому восстановлению иммунологических и гематологических показателей после хирургического лечения, химио- и лучевой терапии, что позволяет раньше начать следующие курсы лечения, а это, в свою очередь, повышает эффективность проводимой терапии.
Ряд препаратов при их профилактическом применении способствует увеличению длительности ремиссии. В то же время отмечено, что неадекватное применение иммунотропных препаратов может способствовать ускорению опухолевого роста.
Агенты, способные изменять биологическую реакцию организма на опухоль таким образом, что это дает терапевтический эффект, называют модификаторами биологических реакций. К числу таких препаратов относятся цитокины (интерфероны, интерлейкины, фактор некроза опухолей, колониестимулирующие факторы, таргетные модуляторы иммунного ответа (производные талидомида — леналидомид), иммуноконъюгаты, включая иммунотоксины (денилейкин дифтитокс), а также неспецифические иммуномодуляторы (полиоксидоний, иммунофан, галавит, ликопид и др.).
Цитокины
Основные функции цитокинов: регуляция гемопоэза, иммунного ответа и воспалительных процессов, участие в ангиогенезе, апоптозе, хемотаксисе, эмбриогенезе. Продукция цитокинов определяет развитие ряда заболеваний, в связи с чем встает вопрос об их использовании или применении антагонистов к ним в терапевтических целях. Цитокины нашли наиболее широкое применение в онкологической практике.
В настоящее время имеется обширная литература по эффективности применения цитокинов при различных злокачественных новообразованиях как в режиме монотерапии, так и в сочетании с химиотерапией и другими видами лечения. В клиническую практику вошло применение интерферона-альфа (ИФН-а), интерлейкина (ИЛ-2) и их комбинаций при лечении некоторых опухолей. Проводятся исследования по применению фактора некроза опухоли (ФНО) и интерферона-гамма (ИФН-у).
Интерферон-альфа. Изучение эффективности ИФН-а проводилось при всех формах злокачественных новообразований. К настоящему времени в ведущих клиниках США и Европы выполнено большое количество проспективных кооперированных исследований, которые позволили разработать ряд рекомендаций. Показано, что адьювантное применение малых доз ИФН-а (3-5 млн ME) дает определенный эффект на ранней стадии заболевания, что выражается в снижении риска метастазирования и улучшении показателей безрецидивной выживаемости.
Лечение хорошо переносится больными (возможны лишь температурные реакции) и должно продолжаться не менее 12-18 мес. Использованные дозы ИФН обладали иммунокорригирующим свойством: у больных повышались число NK-клеток и их активность, увеличивалась экспрессия CD95 и ряда активационных антигенов, а также активировались процессы апоптоза.
В настоящее время Европейское медицинское агентство по изучению эффективности лекарственных средств рекомендует назначение малых доз ИФН-а в качестве профилактического лечения меланомы 11 стадии после операции. В то же время для больных с меланомой III стадии малые дозы ИФН оказались недостаточными для получения клинического эффекта, в связи с чем предложены схемы, включающие высокие дозы ИФН (10-20 млн МЕ/м2), при которых сам ИФН-а проявляет антипролиферативное действие.
В международных исследованиях было показано, что использование высоких доз ИФН позволяет добиться увеличения не только безрецидивной, но и общей выживаемости. Безусловно, такие дозы ИФН достаточно токсичны. Наиболее часто наблюдаются гриппоподобные симптомы (лихорадка, озноб, миалгия), усталость, депрессия, миелосупрессия, тромбоцитопения, нарушение функции печени.
Кроме того, оказалось, что длительность клинического эффекта напрямую связана с общей продолжительностью лечения, т.к. после отмены препарата довольно скоро возникал рецидив заболевания. В связи с этим вопросы дозы и длительности применения ИФН у больных с метастатической меланомой являются предметом проходящих в настоящее время кооперированных исследований.
Рекомбинантный ИФН-а2 при метастатическом раке почки оценивался во многих исследованиях. По данным РОНЦ РАМН, эффективность различных режимов колеблется от 6 до 26 %, при этом у больных с хорошим соматическим статусом и длительным безрецидивным периодом после нефрэктомии она достигала 30% при продолжительности ремиссий более 27 мес.
Особый интерес представляют данные об использовании ИФН при лечении гемоб-ластозов. Наиболее широко он исследовался в детской гематологии как у нас, так и за рубежом. Оказалось, что как клинический, так и иммунокорригирующий эффект зависел от стадии заболевания и сроков начала лечения относительно периода ремиссии.
В отделении детской гематологии РОНЦ РАМН препарат применяли в комплексном лечении 351 ребенка с диагнозом острый лимфобластный лейкоз (ОЛЛ) (220 детей) и НХЛ (131 ребенок). Проведенное рандомизированное исследование показало способность рекомбинантного ИФН повышать эффективность проводимого комплексного лечения и улучшать его отдаленные результаты.
Препараты ИФН часто используются в онкологии с целью иммунокоррекции. Например, Виферон — комплексный препарат, в состав которого входят рекомбинантный ИФН-а, мембраностабилизирующие компоненты, токоферола ацетат, аскорбиновая кислота и основа, применяется в качестве иммуномодулятора в комплексной терапии злокачественных новообразований при снижении показателей естественного иммунитета, для профилактики хронических воспалительных заболеваний, лечения и профилактики рецидивирования вирус-ассоциированных неопластических заболеваний: генитальной папилломавирусной инфекции, саркомы Калоши.
У больных с онкологическими заболеваниями для терапии хронических вирусных гепатитов В и С препарат назначают по схеме: при гепатите В — суточная доза 5 млн МЕ/м2, при гепатите С — 3 млн МЕ/м2 3 раза в неделю в течение 6-12 мес. Виферон совместим и хорошо сочетается с химио- и гормонотерапией, не вызывая каких-либо побочных эффектов.
ИФН-у — лимфоцитарный иммунный интерферон является ключевым цитокином как естественного, так и адаптивного иммунитета. Он играет центральную роль в защите организма от патогенных микроорганизмов и служит необходимым компонентом системы иммунного надзора и регуляции опухолевого роста. По-видимому, противоопухолевое действие ИФН-у обусловлено комбинацией его иммуномодулирующей активности, прямого антипролиферативного действия на опухолевые клетки с подавлением ангиогенеза.
В Российском онкологическом научном центре им. Н.Н. Блохина РАМН проводилось исследование влияния отечественного рекомбинантного ИФН-у Ингарона на эффективность химиотерапии и продолжительность ремиссии у больных диссеминиро-ванной меланомой кожи. Применялась комбинация противоопухолевых препаратов: дакарбазин + ломустин + цисплатин.
Ингарон назначался по 500 000 ME п/к 5 дней в неделю до недельного курса химиотерапии и затем, после химиотерапии, 3 дня в неделю. Было проведено 84 курса химиотерапии и 1180 введений Ингарона. Оценено 39 больных. Результаты лечения: полный эффект — 10,3%, частичный эффект — 23,1 %, стабилизация болезни — 40,3%.
ИЛ-2 — белок с молекулярной массой 15 кДа, был впервые описан в 1976 г. как фактор роста Т-клеток. Он продуцируется активированными Т-клетками и способствует дальнейшему росту Т-лимфоцитов. ИЛ-2 — важный медиатор, в основном, клеточного иммунитета. К настоящему времени более 20 000 больных во всем мире получили лечение ИЛ-2 по различным схемам: самостоятельно в различных дозах, ИЛ-2 + ЛАК (лимфокин-активированные клетки), ИЛ-2 + ИФН, ИЛ-2 + цитостатики и др.
Однако, несмотря на большие надежды, спектр опухолей, при которых ИЛ-2 эффективен, оказался довольно узким, наилучшие результаты получены при раке почки и метастатической меланоме. Высокодозная иммунотерапия ИЛ-2 имеет в основном историческое значение и практически не используется в настоящее время из-за возникающих осложнений, вызванных токсичностью препарата.
Один из подходов повышения эффективности терапии рака почки и злокачественной меланомы — комбинация ИЛ-2 и ИФН-а + химиопрепараты. Комбинация данных цитокинов с 5-фторурацилом в нескольких исследованиях вызвала до 17 % полных ответов и 12-39% частичных ответов у больных метастатическим раком почки. В других исследованиях с помощью химиоцитокинотерапии объективный эффект достигнут в 33% случаев, комбинация ИЛ-2 + ИФН-а давала 28% эффективности, а только ИЛ-2 — всего 6%.
Длительные инфузии ИЛ-2 в низких дозах применяются для стимуляции иммунного ответа против инфекционных агентов и подавления роста опухолевых клеток у больных гемобластозами после трансплантации костного мозга.
Наиболее часто встречающимся проявлением токсичности при в/в введении были развитие в ближайшее время после него озноба, повышение АД, тахикардия; спустя 1-2ч — повышение температуры тела длительностью в несколько часов. Учитывая дозолимитирующую токсичность при системном введении, разрабатываются альтернативные методы введения, позволяющие создать локально высокую концентрацию препарата.
Один из таких методов — создание искусственного круга кровообращения для введения ФНО больным с локализацией опухоли на конечностях. Введение больным с меланомой и саркомой мягких тканей фактора некроза опухоли в дозе до 0,2 мг в течение определенного времени (от нескольких часов до суток) в изолированную конечность самостоятельно или в комбинации с ИФН-а и химиопрепаратами давало значительный клинический эффект. К данному методу можно также отнести разрабатываемое в настоящее время в России регионарное введение препарата при меланоме глаза (сучетом анатомических особенностей кровоснабжения).
В настоящее время изучается отечественный препарат Альнорин — человеческий рекомбинантный ФНО, это полипептид из 153 аминокислотных остатков, выделенных из трансформированных клеток e.соlle. Введение Альнорина в течение 2 нед. (1-3 ME в 1-3-й день) до химиотерапии позволило получить медиану общей выживаемости больных с диссеминированной злокачественной меланомой 27 мес. по сравнению с 9,3 мес. в контрольной группе.
В настоящее время проводятся исследования по изучению клинической эффективности некоторых других цитокинов и их комбинации с противоопухолевыми препаратами.
Цитокины способны стимулировать рост и дифференцировку клеток — предшественников гемопоэза, т.е. являются ростовыми факторами гемопоэза. Группа ростовых факторов гемопоэза получила название колониестимулирующих факторов (КСФ), т.к. они определяются в основном по способности формировать клеточные колонии в культуре клеток костного мозга. КСФ не обладают противоопухолевыми свойствами, но учитывая то значение, которое они приобрели в современной клинической химиотерапии опухолевых заболеваний.
Иммуномодуляторы
В последние годы появились принципиально новые иммуномодуляторы направленного (таргетного) действия. К ним относятся производные талидомида и иммуноконъюгаты.
Леналидомид (Ревлимид) — производное талидомида, обладает иммуномодулирующим свойством (пролиферация Т-лимфоцитов, продукция ИЛ-2 и ИФН-у, ингибирует синтез ФНО-а и ИЛ-6 и снижает экспрессию молекулы адгезии, подобно талидомиду, подавляет ангиогенез). При приеме внутрь в дозе 10 мг/сут используется при трансфузионно-зависимых миелодиспластических синдромах (МДС) низкого и промежуточного риска с делецией 5q. В сочетании с дексаметазоном в качестве второй линии химиотерапии применяется при множественной миеломе в дозе 25 мг/сут (1-21-й день каждые 28 дней). Учитывая опасность пороков развития плода, абсолютно противопоказан при беременности.
Денилейкин дифтитокс (Онтак) — это рекомбинантный иммунотоксин, представляющий собой химерный белок из фрагмента человеческого ИЛ-2 и субъединиц А и В дифтерийного токсина. Специфически связываясь с рецептором ИЛ-2, CD52 проникает в клетку, где высвобождение дифтерийного токсина приводит к ее гибели. В дозе 9-18 мкг/сут каждый 21-й день применяется при Т-клеточных лимфомах кожи, экспрессирующих CD52, в случае устойчивости к стандартной химиотерапии и при рецидивах. Побочные эффекты: гриппоподобный синдром, аллергические реакции, повышенная проницаемость капилляров, диарея, гепатотоксичность.
Неспецифические иммуномодуляторы
Иммуномодуляторы в настоящее время широко используются в онкологии. Однако рекомендованы могут быть лишь те препараты, которые прошли клинические исследования и для которых разработаны показания и режимы введения.
Большинство этих препаратов обладает хорошо изученным механизмом действия и преимущественным влиянием на то или иное звено иммунной системы, что указывает на необходимость предварительной оценки состояния иммунитета в каждом конкретном случае и назначения препарата в соответствии с ее дефектом.
Наиболее целесообразно применять их при вторичных иммунодефицитах, являющихся следствием опухолевого процесса, а также хронических, вялотекущих и рецидивирующих инфекционно-воспалительных процессах любой локализации. Рекомендуется также раннее применение иммуномодуляторов при назначении этиотропных химиотерапевтических средств или в различных комбинациях со стандартным противоопухолевым лечением.
Влияние полиоксидония на эффективность лечения онкологических больных, переносимость послеоперационной химиотерапии исследовалось при широком спектре злокачественных новообразований.
В большинстве исследований с применением полиоксидония у онкологических больных сообщается об иммунокоррекции основных иммунологических и гематологических показателей, что позволяет проводить адекватное лечение и улучшать качество жизни больных. Оказалось, что применение препарата по 6 мг в/м через день в интервалах между курсами химиотерапии сопровождается улучшением как основных, так и дополнительных показателей качества жизни больных раком молочной железы (РМЖ). Режим удобен для амбулаторного применения и может быть использован в качестве сопроводительной терапии у онкологических больных.
Химиотерапия в сочетании с иммунофаном проводилась больным с различными злокачественными опухолями. В исследовании, включавшем 224 больных, препарат назначался по 1 мл в/м через день, 10 инъекций или по 2 мл через день, 5 инъекций. Как правило, лечение иммунофаном начиналось за 3-5 дней до введения противоопухолевых препаратов и продолжалось во время химиотерапии. Положительное влияние иммунофана на продолжительность ремиссии отмечено при РМЖ и мелкоклеточным раком легкого (МРЛ).
При химиотерапии опухолей различной локализации у больных, леченных с применением иммунофана, лейкопения возникает на 4-30% (в среднем на 17 %) реже, гепатотоксичность встречалась в 1,5-2 раза реже. В целом пациенты, получавшие иммунофан, переносили химиотерапию лучше, чем те, кто не подвергался иммунокоррекции.
Исследование иммунологических показателей выявило, что применение иммунофана способствовало сохранению и даже повышению уровня Т-клеточных популяций у больных, проходивших агрессивную химиотерапию. Кроме того, полученные данные указывают, что сопутствующие вирусные заболевания при использовании иммунофана возникают в 1,5-2 раза реже.
Побочные явления иммунофана выявлены у 2,4 % больных и выражались в сыпи, зуде кожи, аллергических реакциях в виде затрудненного дыхания, беспокойства, возбуждения. Указанные токсические реакции, связанные с приемом иммунофана, характеризовались умеренной выраженностью и продолжались после отмены препарата не более 1 нед.
Галавит — натриевая соль аминофталазина, зарегистрирован как противовоспалительный препарат с иммуномодулирующим действием. Основные свойства препарата (регуляция активности макрофагов и синтеза ими про- (ИЛ-1, ИЛ-6, ФНО-а) и противовоспалительных (ИЛ-10) цитокинов; стимулирующее действие на фагоцитарную активность нейтрофилов при ее исходном дефиците; антиоксидантное действие; регуляция репарации поврежденных тканей) позволили применять его в онкологии.
Исследования проводились при различных нозологических формах опухолей (рак желудка, пищевода, молочной железы, мочевого пузыря и др.). Применение галавита в ранний послеоперационный период (за 5 дней до и в течение 5 дней после операции ежедневно в дозе 0,1 г, суммарная доза 1 г) вызывало статистически значимое увеличение количества лимфоцитов, экспрессирующих CD3, CD7, CD38, CD50, CD20.
Кроме того, исследовали поглотительную способность и ферментативную функцию нейтрофилов (миелопероксидаза, щелочная фосфатаза). Показано, что применение галавита способствует снижению частоты развития и тяжести течения инфекционных заболеваний; улучшает переносимость полихимиотерапии, снижая частоту развития побочных эффектов; улучшает общее состояние больных и повышает качество их жизни; способствует коррекции показателей иммунной системы.
Ликопид представляет собой синтезированный универсальный фрагмент клеточной оболочки практически всех бактерий (глюкозаминилмурамилдипептид). Основной мишенью препарата являются клетки моноцитарно-макрофагального ряда. Под влиянием ликопида повышается фагоцитоз, возрастает продукция цитокинов (ИЛ-1, ФНО, КСФ, ИФН и др.), растет экспрессия антигенов HLA-DR.
Ликопид применялся у больных раком легкого и желудочно-кишечного тракта (ЖКТ) (больные получали препарат по стандартной схеме 10 мг внутрь утром натощак в течение 7-10 дней, 1 или 2 курса препарата с интервалом 2 нед. на фоне основной терапии). В группе получавших ликопид отмечалась положительная динамика иммунологических показателей: увеличение клеток CD3+, CD4+, соотношения CD4+/CD8+, усиление поглотительной и переваривающей функций нейтрофилов, уменьшение или отсутствие эпизодов инфекционных заболеваний, положительная клиническая динамика в виде уменьшения тяжести течения инфекционного процесса.
Таким образом, результаты исследований позволяют заключить, что ликопид может применяться при лечении инфекционных осложнений у больных с распространенными формами злокачественных новообразований в комплексной поддерживающей терапии данной категории пациентов.
Читайте также:





