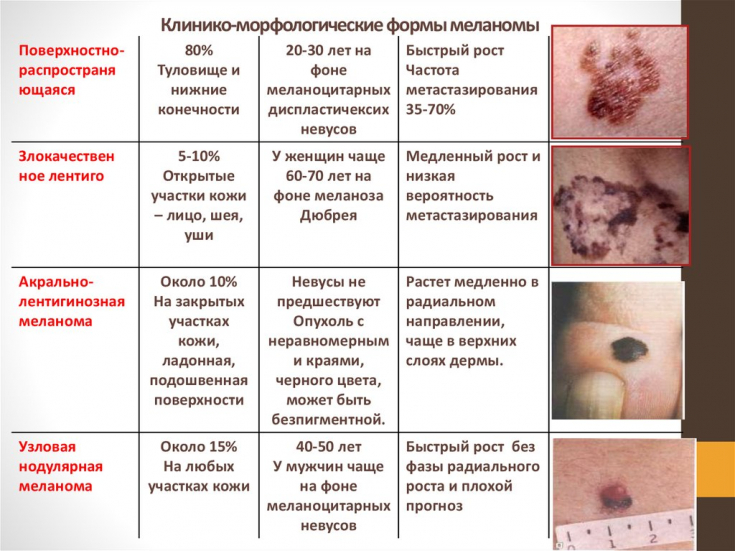
Клинические исследования препаратов для лечения меланомы

Причиной смерти пациента-испытателя назвали неожиданную реакцию организма на экспериментальный препарат производства "Биокад". Ранее фармзавод удостоился похвалы Минздрава за "фантастические результаты" в лечении опухолей. Лекарство должно было появиться на рынке ещё год назад. Не остановит ли смерть добровольца исследования и когда ждать отечественное лекарство от рака — в расследовании Лайфа.
Одна из самых секретных разработок российской медицины попала в неприятную историю, которая могла бы так и остаться в стенах петербургской лаборатории. Рассказываем, как российские учёные изобретали молекулу для лечения меланомы и рака лёгких и с какими трудностями столкнулись.
1. Экспериментальный препарат стал главной темой онкологического конгресса
В ноябре 2018 года состоялся XXII Российский онкологический конгресс. Представители фармзавода "Биокад" и врачи рассказали об успешных испытаниях на людях новейшего отечественного лекарства от рака. Он заставляет иммунные клетки атаковать опухоль.
Речь о препарате под кодовым названием BCD-100. Это одна из самых засекреченных разработок отечественной фармацевтики — не разглашают даже имена учёных, разработавших молекулу (основное действующее вещество).
Препарат показал ошеломляющие результаты в лечении неоперабельной меланомы. Когда опухоль даёт метастазы, зловредные клетки проникают в окружающие органы и там формируют вторичные очаги болезни. Справиться с метастазирующей меланомой гораздо труднее. Однако BCD-100 сумел полностью убрать подобные опухоли у 7% пациентов. Ещё у 29% пациентов размер опухоли уменьшился не меньше чем на треть. В исследовании участвовало 126 онкобольных с неоперабельной меланомой. Испытания финансировал сам "Биокад".
Меланома (рак кожи)
Не самый частый, но один из самых агрессивных видов рака (≈74 тысяч больных в РФ). С 1950-х мировая заболеваемость выросла на 600%
Однако пациентов ждут серьёзные побочные эффекты, которые стали сюрпризом и для врачей — препарат-то новый.
"Внедрение [иммунотерапии], по-русски сказать, взорвало химиотерапевтам мозг. Мы столкнулись со спектром сложных и не понятных для нас [побочных] реакций. Может поражаться любой орган: начиная от щитовидной железы и заканчивая воспалением сосудов".
онколог центра им. Блохина Михаил Федянин
Но в декабре 2018 года НИИ онкологии им. Н.Н.Петрова (Санкт-Петербург) презентовал новые данные о результатах того же исследования.
У пациентов, принимавших BCD-100, чаще воспалялась щитовидная железа, чем у пациентов, принимающих аналогичные зарубежные препараты. Об этом заявил на конференции Федянин, то же впоследствии подтвердил и химиотерапевт из НИИ онкологии им. Н.Н. Петрова Алексей Новик. Его выступление находится в открытом доступе. Однако другие показатели побочных явлений не сильно отличались от уже выпущенных на рынок аналогов, так что Новик осторожно назвал BCD-100 "не менее безопасным", чем ему подобные.
2. Летальный исход, о котором умолчали
В ноябрьском выступлении доктор Федянин коротко обмолвился: были описаны смертельные случаи после приёма подобных препаратов. Одна из причин летальности — воспаление сердечной мышцы (миокардит).
Ни Федянин, ни Новик подолгу не останавливались на опасностях подобного рода препаратов. Врачи не упомянули и о смертельном случае с одним из пациентов-добровольцев. А самое главное, этого не сделала медицинский директор фармзавода "Биокад" Юлия Линькова.
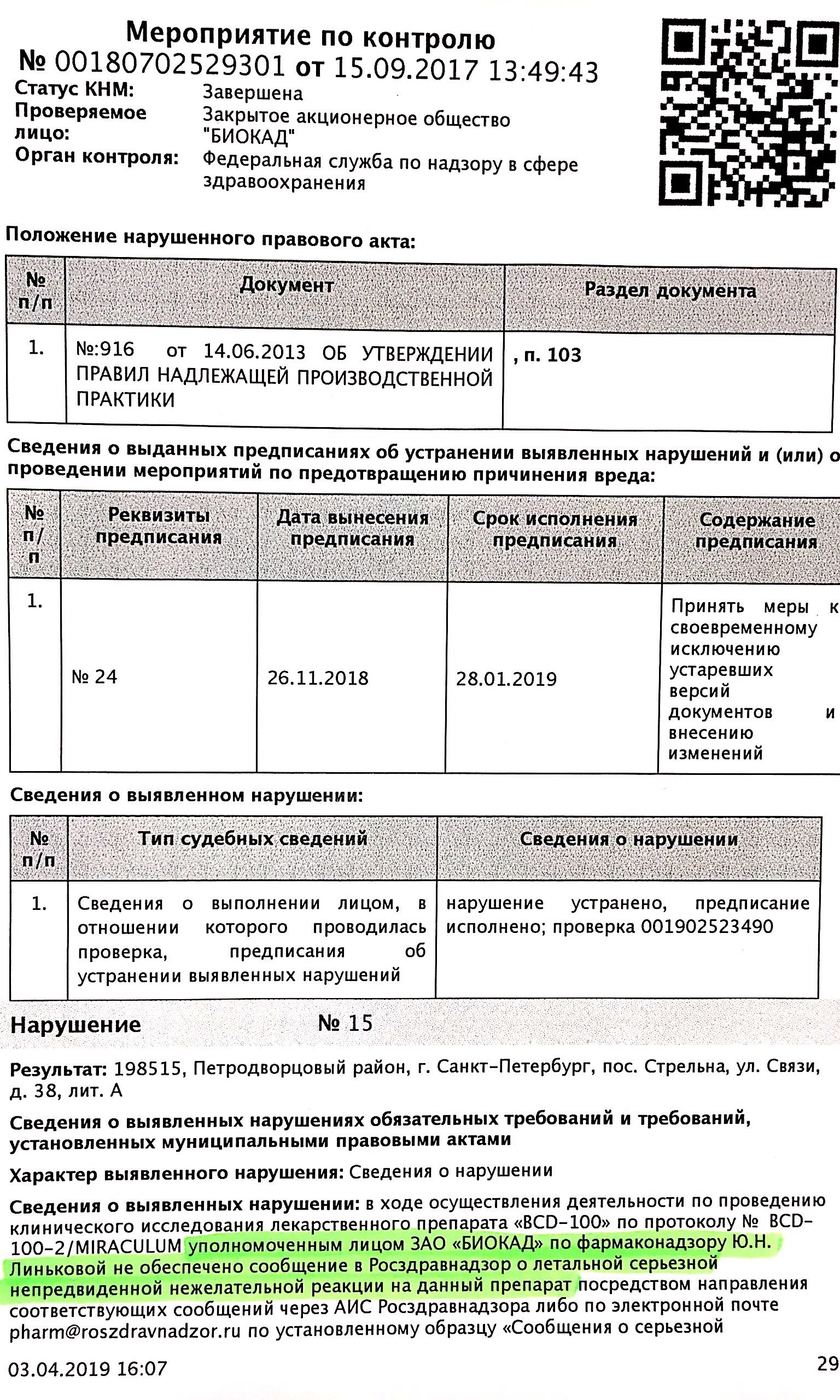
Представители завода "Биокад" вовремя не проинформировали государственные службы о смерти пациента из-за приёма BCD-100. Об этом говорится в материалах проверки Росздравнадзора, которые попали в Лайф из прокуратуры.
"В ходе клинического исследования препарата BCD-100 по протоколу Miraculum уполномоченное лицо ЗАО "Биокад" Юлия Линькова [не сообщила] в Росздравнадзор о летальной непредвиденной нежелательной реакции на данный препарат".
Материалы проверки Росздравнадзора от 26.11.18
Линькова обязана была уведомить о произошедшем либо через защищённую информационную систему Росздравнадзора, либо просто по электронной почте.
В том же предписании Росздравнадзор отмечает, что ни в 2017-м, ни в 2018-м в адрес ведомства вообще не поступало данных о безопасности трёх других препаратов, которые разрабатывает "Биокад".
Недавние исследования показали — больше половины российских медиков не сообщают в Росздравнадзор о побочных эффектах на препараты, с которыми столкнулись их пациенты. Ещё 8% вообще считают, что рассказывать о нежелательных реакциях нецелесообразно.
3. В надежде на "чудо"
Ещё в 2016 году министр здравоохранения Вероника Скворцова назвала результаты использования BCD-100 фантастическими. Протоколу, по которому исследовали лекарство, даже придумали соответствующее метафорическое название. С латыни "miraculum" переводится как " чудо". И действительно, с некоторыми пациентами BCD-100 сотворил чудо.
У 64-летней пациентки из Питера был опухолевый очаг в лёгком
Через несколько месяцев после приёма BCD-100 опухоль заметно уменьшилась в объемах. Это видно на снимках НМИЦ им. Н.Н.Петрова.
Но для других пациентов чудо обернулось проблемами или трагедией. Побочные эффекты от BCD-100 испытывали 80% пациентов, заявил на ноябрьской конференции доктор Федянин.
Чтобы разобраться, как работает BCD-100, важно понимать принцип работы иммунной системы человека.
Очень упрощённо иммунитет можно описать как систему "свой-чужой". Некоторые клетки крови умеют распознавать чужеродные бактерии и опасные тела и уничтожать их. Такой тип иммунных клеток называют Т-лимфоцитами. Получается эдакий "иммунный спецназ", который способен проникать через стенки сосудов в окружающие ткани и проводить там боевые действия против чужаков.
На поверхности Т-лимфоцита живёт белок PD-1, который отвечает за восприятие чужеродных клеток. Раковые же клетки "прячутся" от лимфоцитов, обманывая белок PD-1. Лимфоциты начинают думать, что раковая клетка — "своя", и не трогают смертельную опухоль.
Учёные по всему миру ломают головы над тем, как взломать маскировку и обучить лимфоциты распознавать в раковой клетке врага. Как уверяют создатели Miraculum, именно это им и удалось.

Создатели препарата рассчитывают, что его можно будет использовать не только для лечения меланомы и рака лёгких, но и других видов онкологии.
Поначалу на заводе "Биокад" рассчитывали выпустить лекарство на рынок в 2018 году. Сейчас сроки отодвинулись до 2022 года. Причин может быть множество: от недостаточного финансирования до неожиданно вскрывшихся проблем при использовании препарата.
В одном из интервью представители завода сравнивали цены на зарубежные аналогичные препараты. Выходило, что лечиться израильскими либо японскими средствами стоит примерно 9 миллионов рублей за курс. Отечественные разработчики обещали существенно меньшую цену за курс BCD-100. Возможно, в разы.
Хронология разработки препарата
4. Человечество писало кровью правила исследований препаратов
Лайф попросил эксперта, который много лет занимается клиническими исследованиями, рассказать о морально-этической стороне испытаний препаратов на людях. Вот что рассказала исполнительный директор Ассоциации организаций по клиническим исследованиям Светлана Завидова.
"Человечество двигалось к системе регулирования через лекарственные трагедии. Где-то, конечно, своим умом доходили, но в основном двигателем послужил негативный опыт, который и приводил к разработке тех или иных правил. Правила писали "на крови".
Светлана Завидова, Ассоциация по клиническим исследованиям
Один из первых мировых законодательных актов на тему регулирования исследований препаратов появился в США в 1938 году. Взяться за его разработку пришлось после того, как из-за неподтверждённого по критериям безопасности препарата сульфаниламида погибло 107 человек, большинство из которых — дети. Именно после этой трагедии фармпроизводителей обязали подтверждать безопасность лекарств. В том числе и на пациентах.
Исследования на людях идут в три фазы и длятся годами. В первую, как правило, включают только здоровых добровольцев. Вторая фаза — это испытания на пациентах, страдающих от конкретного заболевания. Обычно в них участвует несколько сотен человек. Третья фаза — самая масштабная: здесь в выборку могут включить несколько тысяч больных. Именно на третьей фазе появляется большинство данных о побочных реакциях и их частоте. Все добровольцы подписывают информированное согласие, соглашаясь на все риски (вплоть до летального исхода). Для многих пациентов участие в испытаниях — последний шанс.
Только при успешном завершении третьей стадии препарат регистрируют в госорганах и завозят в аптеки.
Второй случай изучают в медвузах как пример халатного отношения к безопасности препарата в угоду его продаваемости. Препарат талидомид в середине ХХ века был одним из самых продаваемых успокоительных и снотворных. Особенно его рекомендовали беременным и кормящим матерям, чтобы справляться с ночной бессонницей, утренней тошнотой и беспокойством. При этом никакие тесты влияния таблеток на плод не проводились. Препарат активно продавался в Европе. Через несколько лет стали чаще рождаться дети с патологиями: у новорожденных не было рук, ног либо ушей.
Ещё год потребовался властям нескольких стран, чтобы увязать страшную статистику с популярностью талидомида. Всё это время компания-производитель не признавала связи между этими событиями и продолжала рекламировать лекарство как безопасное.
5. Биокад: мы ничего не пытались скрыть!
Действия петербургской фармацевтической компании, которая не сообщила в Росздравнадзор о смерти пациента, на первый взгляд выглядят попыткой скрыть негатив во избежание репутационных и иных потерь. Однако в "Биокаде" заявляют, что специально ничего не утаивали.
"Первично полученные данные не соответствовали определению "Серьёзная непредвиденная нежелательная реакция". После получения дополнительных сведений информация была передана в Росздравнадзор".
Юридический департамент ЗАО "Биокад"
— Предположение о том, что ЗАО "Биокад" пыталось скрыть летальный случай, не соответствует действительности, поскольку данная информация сообщалась в ряд компетентных органов и учреждений, — добавили представители фармзавода. — Компания провела внутреннюю проверку, по результатам которой были детализированы внутренние процедуры.
Один из корпусов завода "Биокад" в Петербурге.
Компания "Биокад" создана в 2001 году. Это одна из крупнейших биотехнологических компаний России, где разрабатывают, изучают и производят новые типы лекарств. В штате трудятся более 1800 человек. Компания фокусируется на препаратах для терапии онкологических и аутоиммунных заболеваний, также ведёт разработки в области терапии других социально значимых заболеваний.
19 апреля 2019 года Национальный медицинский исследовательский центр радиологии Минздрава сообщил об увеличении числа онкобольных в стране. На первом месте в России рак лёгких. Каждый год онкологией заболевают около 600 тысяч человек. Всего в России на онкологическом учёте стоят 3,6 миллиона человек.

Меланома — самый агрессивный вид рака кожи. Безусловно, ультрафиолетовое излучение активно способствует её появлению, но она может возникнуть и на тех участках, куда солнечные лучи не попадали. Несмотря на то, что она прогрессирует активнее остальных видов рака кожи, существуют специфичные препараты, которые помогают лечить меланому и справляться с ней. А на ранних стадиях число окончательно выздоровевших людей приближается к 100 процентам.
- Как лечат меланому на разных стадиях?
- Химиотерапия меланомы
- Операция при меланоме
- Лучевая терапия
- Современные методы лечения меланомы
- Иммунотерапия меланомы
- Таргетная терапия
- Наблюдение за пациентом после лечения меланомы и других видов рака кожи
- Стоимость лечения меланомы
Как лечат меланому на разных стадиях?
Стадия 0 (in situ): меланома находится только в верхних слоях кожи. Полное выздоровление наступает практически в 100 процентах случаев. После иссечения меланомы и небольшого количества здоровой кожи вокруг, возможно, врач рекомендует ежегодно посещать дерматолога и ежемесячно проводить самообследование на наличие подозрительных родинок и увеличенных лимфоузлов.
Зачем нужны дальнейшие проверки? Чтобы поймать меланому, вернувшуюся вокруг шрама, распространившуюся в лимфоузлы или другие части тела, а также новую меланому совсем в другом месте.
Как проводить ежемесячное самообследование?
- Разденьтесь и встаньте перед большим зеркалом в хорошо освещённой комнате. Возьмите в руке зеркало поменьше и исследуйте лицо, а также рот и уши.
- С помощью маленького и большого зеркал осмотрите затылок, уши и шею. Осмотрите руки со всех сторон, кожу между пальцами и под ногтями, а также подмышки.
- С помощью обоих зеркал исследуйте плечи, верхнюю часть спины и рук, поясницу, ягодицы, кожу между ними и задние части обеих ног.
- Сядьте и исследуйте свои ноги, лодыжки, стопы, кожу между пальцами ног и под ногтями. С помощью зеркала исследуйте гениталии.
Стадия меланомы 1 или 2A: толщина опухоли меньше 4 мм, без изъязвления, или толщина меньше 2 мм, но с изъязвлением. Одна только операция приводит к излечению в 70–90 процентах случаев. На стадии IA человек должен в течение первого года 2–4 раза посетить врача, затем доктор может рекомендовать ежегодный осмотр. Также каждый месяц пациент должен проводить самообследование. Если меланому обнаружили на стадии IB, то дерматолога нужно посещать каждые 3 месяца в течение 3 лет. Затем каждые полгода в течение 2 лет. Самообследование также необходимо. Если врач посчитает нужным, он изменит эти рекомендации.
Стадия 2B или 2C: толщина опухоли 2,1–4 мм, есть изъязвление, или толщина больше 4 мм, но нет изъязвления. После удаления опухоли рецидив случается у 40–70 процентов пациентов. Тем, у кого риск таких последствий высок, обычно рекомендуется лечение меланомы 2 стадии интерфероном альфа-2b, однако рекомендация не строгая, так как действенность этого препарата вызывает некоторые сомнения, а побочные эффекты возникают нередко.
После операции или окончания лечения меланомы 2 стадии к врачу нужно приходить каждые 3–6 месяцев в течение 2 лет, затем каждые 3–12 месяцев в течение 2 лет, потом ежегодно. Самообследование также необходимо. Врач, кроме прочего, может назначить регулярное прохождение компьютерной томографии.
Стадия 3: раковые клетки есть в лимфатических протоках, окружающих опухоль, или прилежащих лимфоузлах. Дополнительная терапия крайне рекомендуется, так как больше чем в половине случаев меланома возвращается. Иммунотерапия интерфероном альфа-2b снижает риск рецидива. Она может усилить иммунный ответ так, чтобы организм лучше боролся с клетками опухоли. Лечение меланомы 3 стадии длится до 12 месяцев (делаются подкожные инъекции). Однако не во всех руководствах можно встретить такую рекомендацию из-за того, что интерферон нередко провоцирует гриппоподобные симптомы (жар, боль в мышцах и суставах, усталость, потерю аппетита), подавленное состояние и др.
После удаления раковых клеток меланомы 3 стадии осмотр у врача нужно приходить каждые три месяца в течение трёх лет, затем — каждые полгода в течение 2 лет. Если у доктора возникнут какие-то подозрения, он попросит сделать анализ крови, пройти компьютерную томографию или ультразвуковое исследование.
Стадия 4: метастазы есть в более отдалённых частях тела (обычно это удалённые лимфоузлы, лёгкие, печень, мозг, также нередко встречаются метастазы меланомы в костях). Существуют разные способы лечения меланомы на 4 стадии, но все они преследуют одну цель — продлить жизнь человека, насколько это возможно, и сохранить её качество, справляясь с симптомами. Благодаря лечению раковые клетки погибают или их рост на время останавливается. Для этого могут использоваться иммунотерапия, таргетные препараты, операции, лучевая или химиотерапия.
На 4 стадии нет чётких рекомендаций по лечению злокачественной меланомы, так как у всех методов есть свои достоинства и недостатки, к тому же проявления болезни и пожелания у каждого пациента свои и при выборе терапии отталкиваться необходимо от этого.

Химиотерапия меланомы
Химиотерапия убивает раковые клетки или подавляет их рост. Однако она менее эффективна, чем иммунотерапия и таргетная терапия, поэтому используется реже (обычно при маленьких опухолях).
В основном применяются препараты дакарбазин, темозоломид, цисплатин, винбластин и кармустин. Например, одна из схем лечения меланомы химиотерапией включает цисплатин, винбластин и дакарбазин. Другая — цисплатин, дакарбазин, кармустин и тамоксифен (по некоторым данным, последний препарат можно не включать в эту схему). Есть также основания полагать, что препараты карбоплатин и паклитаксел в комбинации с сорафенибом имеют хороший эффект, к тому же они менее токсичны, чем дакарбазин.
Из-за химиотерапии обычно ухудшаются анализы крови, появляется диарея, боль во рту, усталость, выпадают волосы. Если первичная опухоль находится на руке или ноге, то врач может предложить регионарную (местную) химиотерапию — когда препарат не циркулирует по организму, а попадает только в конечность. Такая процедура проводится под общей анестезией. Хирург помещает трубку в сосуд, который проводит кровь в руку/ногу и из неё. Трубки подсоединяются к машине, которая вводит необходимые препараты вместе с подогретой кровью, через короткое время кровоток восстанавливается. Также к этой смеси можно добавить кислород и тогда процедура займёт около часа. Очевидный плюс такого подхода в том, что химиопрепараты не воздействуют на весь организм человека, поэтому побочных эффектов не так много: боль в области введения трубок, потеря волос на руке или ноге, покраснение и отёк конечности примерно через 48 часов после лечения, затем кожа может стать коричневой, иногда отёк сохраняется достаточно долго, также может возникнуть атрофия мышц. Если в необычном месте в конечности появилась боль, необходимо сразу сказать врачу: это может оказаться тромб.
Операция при меланоме
Операция иногда нужна, если меланома распространилась на каком-то ограниченном участке, и опухоль или метастазы можно вырезать. Это нередко позволяет не только продлить жизнь на месяцы и годы, но и уменьшить боль из-за опухоли, например, если она в лёгком или мозге.
Варианты хирургического лечения меланомы:
- Простое и широкое иссечение опухоли. Обычно применяются при небольших меланомах. Хирург удаляет злокачественное новообразование и небольшое количество тканей вокруг него.
- Операция Мооса в настоящее время применяется редко, как правило, если меланома находится на лице. Опухоль удаляют послойно, каждый удаленный слой изучают под микроскопом. Когда опухолевые клетки перестают обнаруживаться в образце, считается, что меланома удалена полностью.
- Ампутация. К ней прибегают, если меланома находится на пальце и успела прорасти глубоко в ткани.
- Лимфодиссекция — удаление ближайших лимфатических узлов, в которые распространились опухолевые клетки.
- При метастазах меланомы во внутренних органах хирургия малоэффективна.
Лучевая терапия
Современные методы лечения меланомы
Меланома — относительно редкий, но очень агрессивный, самый смертоносный тип рака кожи. В ней быстро возникают новые мутации, за счет которых опухоль может выработать устойчивость к химиопрепаратам в течение 6 месяцев. Ученые постоянно ищут более эффективные новые методы лечения меланомы. Большие надежды возлагаются на иммунотерапию, таргетные препараты. В Европейской клинике для пациентов доступны наиболее современные препараты для лечения меланомы, зарегистрированные на территории России. Мы можем организовать для онкологических больных участие в клинических испытаниях новых препаратов — иногда это становится последней надеждой, когда все доступные препараты не принесли эффекта.
Иммунотерапия меланомы
Препараты, использующиеся для иммунотерапии помогают иммунной системе бороться с раковыми клетками, стимулируя или усиливая её. Эти препараты входят в группу ингибиторов иммунных контрольных точек (ниволумаб, пембролизумаб, ипилимумаб). Они очень эффективны при мутации гена BRAF, в некоторых случаях их используют вместе с лечением меланомы химиотерапией. К сожалению, у этих препаратов могут быть серьёзные побочные эффекты. Из-за ниволумаба и пембролизумаба иммунная система может атаковать свои же ткани. Это вызывает сыпь, гепатит и колит (как следствие — диарею или кровотечение), воспаление лёгких, кожи, почек, органов эндокринной системы. Меньше чем в 5 процентах случаев симптомы могут быть жизнеугрожающими. Поэтому даже о небольших побочных эффектах стоит говорить врачу.
Ипилимумаб менее эффективен, чем ниволумаб и пембролизумаб. Обычно его используют в паре с ниволумабом. Среди побочных эффектов — колит, сыпь, гепатит, воспаление органов эндокринной системы. Это случается у 5–30 процентов пациентов.
Интерлейкин–2 также может применяться для иммунотерапии. На такое лечение меланомы ответ лучше всего у людей с метастазами в мягких тканях и лёгких. Этот препарат вводят подкожно или внутривенно, в том числе с помощью капельницы. Необходимо сказать, что интерлейкин–2 ещё менее безопасен, чем другие препараты. Почти у половины пациентов снижается давление, примерно у трети возникает рвота, диарея, олигурия (уменьшенное выделение мочи), также человек становится подверженным различным инфекциям, появляются гриппоподобные симптомы и диарея. Такая терапия может довести до реанимации. Поэтому чтобы лечиться интерлейкином–2, исследование функции лёгких должно дать хороший результат, как и магнитно-резонансная томография головного мозга, электрокардиография с нагрузкой; почки и печень также должны работать хорошо.
В качестве иммунотерапии иногда используется и интерферон.
Таргетная терапия
Примерно в половине случаев при меланоме с метастазами в гене BRAF обнаруживается мутация. В этом случае эффективны препараты вемурафениб, дабрафениб и траметиниб. Они относятся к группе ингибиторов протеинкиназы. Благодаря им опухоль может уменьшиться, но, к сожалению, в дальнейшем она продолжит расти. Чаще всего дабрафениб назначают вместе с траметинибом. Среди побочных эффектов этой комбинации — жар, сыпь, усталость, отклонения в анализах печени. При приёме вемурафениба может развиться другой рак кожи (он хорошо лечится простым удалением меланомы), также в некоторых случаях возникает светочувствительность кожи, боль в суставах, усталость, зуд, выпадение волос.
Наблюдение за пациентом после лечения меланомы и других видов рака кожи
Если лечение злокачественной меланомы закончилось успешно, и наступила стойкая ремиссия, у пациента остается повышенный риск меланомы или других злокачественных опухолей в будущем. Поэтому после выписки из больницы нужно обязательно наблюдаться у врача.
Частота визитов к онкологу зависит от стадии меланомы. Вам могут назначить осмотры через каждые 3–12 месяцев. Если рак не возвращается, и всё в порядке, перерывы между осмотрами можно увеличить. Во время приема врач осматривает кожу, ощупывает лимфатические узлы.
Обследование может включать рентгенографию, компьютерную томографию.
Стоимость лечения меланомы
Стоимость лечения меланомы и консультации зависит от площади, расположения и стадии опухоли, выбранной клиники. В Европейской онкологической клинике лечение проводится по современным протоколам, на уровне лучших зарубежных онкологических центров. Мы можем предложить технологии и препараты, которые не доступны в государственных клиниках. Цены на лечение:
- Консультация онколога — 4 500 руб.
- Консультация химиотерапевта — 6 900 руб.
- Проведение системной химиотерапии у пациентов с диссеминированной меланомой — 334 000 руб.
- Широкое иссечение новообразований кожи — 68 000 руб.
В Европейской онкологической клинике вы можете получить квалифицированную помощь. Наши врачи не только имеют большой опыт, но и постоянно обновляют свои знанию, следят за последними рекомендациями в дерматоонкологии. Вы можете быть уверены, что получите самую совершенную на сегодняшний день помощь.

Рак кожи с каждым годом становится все более распространенным заболеванием. Его разновидность – меланома относится к опухолям, которые устойчивы к лучевой терапии. Эффективное хирургическое лечения меланомы возможно на ранних стадиях. Поэтому так много внимания уделяется клиницистами к возможностям медикаментозного лечения меланом.
Ингибитором BRAF-киназы в лечении меланомы
Препарат дабрафениб, что относится к классу сульфанилидов, является обратным АТФ-конкурентным ингибитором BRAF-киназы I типа. Этот препарат был одобрен для лечения меланомы Управлением по контролю продуктов питания и лекарственных средств США и Европейским агентством по лекарственным средствам.
Читайте нас в Instagram!
Основанием для этого стали результаты многоцентрового открытого рандомизированного исследования III фазы BREAK-3. Доклинические испытания показали, что взаимодействие препарата дабрафениба в наномолярных концентрациях с клеточными линиями меланомы в течение 72 ч характеризовалось мощным торможением фосфорилирования внеклеточной сигнал-регулируемой киназы (extracellular signal-regulated kinase, ERK) и пролиферации клеток.
В экспериментальной модели меланомы с BRAFV600E мутацией пероральный прием дабрафениба обеспечивал торможения ERK и угнетение роста опухоли.
Оптимальным режимом назначения препарата дабрафениба является доза 150 мг перорально дважды в день в виде монотерапии или в комбинации с траметинибом. После приема препарат достигает максимальной концентрации в плазме крови через 2 ч; средняя биодоступность составляет 95%. В нескольких исследованиях было также продемонстрировано ответ на лечение дабрафенибом метастазов в мозг.
Новая эра лечения меланом
Открытие роли сигнального пути RAS / RAF / MEK / ERK в меланомагенезе и его дальнейшее изучение ознаменовали начало новой эры в лечении меланом. Впрочем, несмотря на отличные результаты применения ингибиторов киназы I поколения, которые значительно превышали эффективность традиционной схемы − сочетание оперативного вмешательства и химиотерапии, − средняя продолжительность терапевтического ответа была небольшой в связи с запуском генетических и эпигенетических механизмов резистентности к лечению, в основном за счет парадоксальной реактивации сигнального пути митоген-активированной протеинкиназы (mitogen-activated protein kinase, MAPK).
Инновационной стратегии, направленной на противодействие этой резистентности, стало сообщение ингибиторов BRAF-киназы с ингибиторами киназ нисходящего сигнального пути фосфорилирования MAPK, а именно MEK и ERK.
Подобная комбинация позволяет преодолеть парадоксальные эффекты, блокируя важнейший путь выскальзывание опухоли из-под терапевтического воздействия, и к тому же характеризуется рядом дополнительных преимуществ, в том числе более мощным и длительным клиническим ответом, а также меньшей токсичностью и снижением количества побочных эффектов, которые возникали вследствие парадоксальной реактивации сигнального пути MAPK при монотерапии BRAF-ингибитор.
Кроме преодоления данной парадоксальной активации важным показанием к назначению ингибиторов MEK является лечение по гену NRAS-мутантных меланом, которые характеризуются большей агрессивностью и худшим прогнозом, чем BRAF-мутантные.
Траметиниб является обратным аллостерическим никак АТФ-конкурентным ингибитором МЕК1 и МЭК2 III типа. Препарат траметиниб может назначаться в виде монотерапии, однако чаще применяется в комбинации с дабрафенибом для лечения взрослых пациентов с неоперабельной или метастатической меланомой.
Траметиниб назначается внутрь в дозе 2 мг 1 раз / день; биодоступность этого препарата составляет 72%. Пациентов группы химиотерапии, в которых наблюдалось прогрессирования болезни, переводили на траметиниб. По сравнению со стандартной химиотерапией монотерапия траметинибом улучшала и общую выживаемость, и выживаемость без прогрессирования болезни.
Комбинация препаратов траметиниба и дабрафениба позволяет значительно улучшить клинический ответ на лечение, а также облегчить контроль токсичности, связанной с парадоксальной активацией МАРК-пути при применении BRAF-ингибиторов. У пациентов, подлежащих лечению комбинацией препаратов дабрафениба и траметиниба, выживаемость без прогрессирования болезни и общая выживаемость были выше, чем в группе монотерапии препаратом дабрафениба. Для группы комбинированного лечения было также подтверждено меньшее количество побочных эффектов.

Таким образом, в течение длительного времени стандартное ведения поздних стадий меланомы было ограничено химиотерапией, которая характеризовалась низкой частотой ответа на лечение и минимальным влиянием на выживаемость. Открытие роли мутаций гена BRAF в патогенезе меланом изменило взгляды на лечение этого новообразования, позволив выяснить, что причинным фактором меланомагенеза является активация сигнального пути МАРК под действием онкогенных мутаций. Именно этот путь поддерживает рост, выживание и распространение злокачественных меланоцитов.

Дальнейшие фармацевтические разработки позволяют тормозить сигнальный путь MAPK с помощью малых молекул, воздействуя на мутировавший BRAF-протеин и нисходящие MEK-киназы. Хотя монотерапия была клинически эффективной, комбинированное лечение BRAF- и MEK-ингибиторами разительно улучшило клинический ответ и выживаемость пациентов с меланомой.
Читайте также:

