Гепатит в лимфома лечение
Ассоциативная связь неходжкинских лимфом и вирусного гепатита С хорошо известна и многократно описана. В свою очередь, этиотропная терапия способствует вирусологическому и гематологическому ответу большинства неходжкинских лимфом, связанных с ВГС.
В последние годы противовирусные препараты прямого действия сделали возможным проведение лечения для большинства пациентов с ВГС. Недавно были высказаны некоторые опасения в отношении частоты и характера рецидивов ГЦК среди пациентов получавших данную группу препаратов.
Мы представляем описание клинического случая диффузной крупноклеточной В-клеточной лимфомы (ДККЛ) в стадии ремиссии после соответствующего лечения, на фоне вирусного гепатита С с исходом в цирроз печени, который был вылечен с помощью новых противовирусных препаратов прямого действия. Однако, вскоре после достижения УВО, произошел рецидив лимфомы, приведший к летальному исходу.
Связь между вирусом гепатита С (ВГС) и неходжкинской лимфомой (НХЛ) является распространенной, особенно отметим лимфому маргинальной зоны, диффузную крупноклеточную лимфому (ДККЛ) и в меньшей степени фолликулярную лимфому. Лимфомагенез ВГС представляет собой многофакторную модель злокачественной трансформации, включающую несколько механизмов, включая хроническую антигенную стимуляцию, взаимодействие с инфицированным микроокружением и воспалительными цитокинами, а также прямую трансформацию вирусными белками.
Среди ВГС-ассоциированных агрессивных НХЛ, ДККЛ является наиболее часто встречаемой во врачебной практике. Золотым стандартом и первой линией терапии является иммунохимиотерапия R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин, преднизон). С целью устранения одного из триггеров развития лимфомы и потенциального снижения риска рецидива, следует уделить внимание противовирусной терапии как в комбинации, так и после завершения иммунохимиотерапии.
Недавно проведенное большое когортное исследование показало, что устойчивый вирусологический ответ (УВО) после противовирусного лечения снижает риск рецидива B-клеточной НХЛ по сравнению с группой пациентов не принимавших лечение, направленное против ВГС.
Мы представляем клинический случай — 57-летнего мужчину направленного на лечение хронического гепатита С (ВГС), с В-клеточной НХЛ в анамнезе. У данного пациента была диагностирована ДККЛ (стадия IIA, по классификации Ann Arbor) после биопсии надключичного лимфатического узла, которая показала инфильтрацию злокачественными клетками CD20, CD10, Bcl-6 (40%), MUM1 (30%), положительной экспрессией Bcl-2 и отрицательной D1, CD5, CD23, CD3. Ki-67 был положительным на 50%. Пациенту провели 6 циклов R-CHOP и достигли полного ответа, подтвержденного КТ всего тела и результатами биопсии костного мозга.
Через восемнадцать месяцев после завершения химиотерапии пациент был направлен в гепатологическое отделение для лечения гепатита С. Клиническое исследование показало незначительное повышение уровня аминотрансфераз (АСТ 46, АЛТ 66), вирусная нагрузка была высокой (ВГС-РНК 1.600.000 МЕ/мл) и выявлен 3a генотип, эластичность печени (оцененная с помощью Fibroscan®) показывала значение 17,6 кПа, что соответствовало циррозу (Child A/5, MELD 8).
Проведенная эндоскопия показала небольшое варикозное расширение вен пищевода, тогда как визуализация печени (КТ брюшной полости) отсутствие любых видов очагового поражения или асцита (рис. 1).
На тот момент пациенту проводили лечение в соответствии с рекомендациями Европейской ассоциации по исследованию печени (EASL) c применением противовирусных препаратов прямого действия (ПППД): софосбувир 400 мг и велпатасвир 100 мг в сочетании с рибавирином длительностью 12 недель. Лечение проходило без каких-либо осложнений. Спустя три месяца после окончания лечения было зафиксировано достижение УВО.
Спустя два месяца после достижения УВО, и, несмотря на то, что неоднократно документировалась полная ремиссия ДККЛ (ПЭТ КТ, гематологические показатели), в течение двух последующих лет наблюдения, пациент поступил в стационар с отчетливой болью в правом верхнем квадранте и ухудшением функций печени.
Визуально отмечалась желтизна кожных покровов и склер. КТ показала генерализованную лимфаденопатию, аномальное утолщение конечной подвздошной кишки, гепатоспленомегалию с выраженным асцитом (рис. 2).

Рис. 2. CECT-сканирование. Неоднородная картина печени (ромб), увеличенные парааортальные лимфатические узлы (овалы), камни желчного пузыря (наконечник стрелки), скопление жидкости (звездочки).
Пункционная биопсия печени показала (рис. 3) обширную инфильтрацию ДККЛ в паренхиму печени (этап IV Энн Арбор при рецидиве, IPS: высокий, R-IPS: низкий). На момент исследования профиль ДККЛ был таким же, как и при первичном обращении (CD20+, PAX-5+, CD3-, CD30-). Летальный исход пациента был обусловлен развитием печеночной недостаточности незадолго до получения химиотерапии.
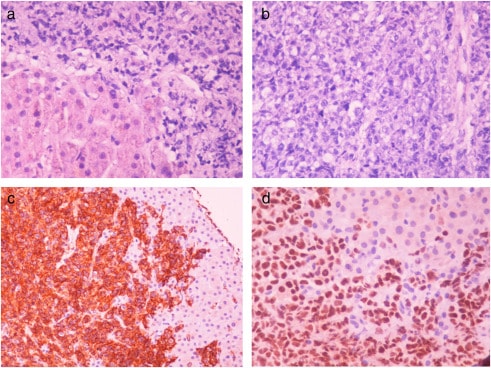
Рис. 3. Биопсия печени с обширной инфильтрацией агрессивной крупной В-клеточной лимфомой.
A и B — окраска гематоксилином и эозином, C — CD20-позитивная цитоплазматическая экспрессия, D— PAX-5, ядерная позитивная экспрессия.
В-клеточная НХЛ тесно связана с ВГС который является триггером хронической антигенной стимуляции. Проводимое этиотропное лечение может привести к вирусологическому и гематологическому ответу у двух третей пациентов с НХЛ, связанных с ВГС.
В мета-анализе 20 исследований, частота ответа при противовирусном лечении составила 73%, при этом, была выявлена сильная корреляция между достижением УВО и лимфомной реакцией. Сообщается, что использование в лечении ПППД снижает частоту возникновения злокачественных В-клеток в периферической крови пациентов, страдающих лимфопролиферативными нарушениями связанными с ВГС, однако моноклональные популяции могут сохраняться после эрадикации вируса.
На данный момент в современной литературе много споров о возможности возникновения рецидива гепатоцеллюлярной карциномы (ГЦК) после применения ПППД в группе пациентов с ВГС и ГЦК. Ряд клинических случаев показал неожиданно высокую частоту и агрессивную картину рецидива ГЦК в данной группе. Тем не менее, недавний систематический обзор и мета-анализ не обнаружили никаких доказательств того, что возникновение или рецидив ГЦК различаются между противовирусным лечением на основе интерферона (ИНФ) или ПППД.
Существует очень мало данных о рецидивах НХЛ после успешной противовирусной терапии ВГС среди пациентов с НХЛ. Недавнее исследование сообщило о возникновении НХЛ после достижения УВО у двух пациентов, получавших софосбувир и ледипасвир без гематологических заболеваний в анамнезе.
В аналогичной работе сообщалось о развитии высокоагрессивной лимфомы мантийной зоны спустя месяц после завершения лечения софосбувиром и рибавирином. В другой серии сообщалось о пяти случаях B-клеточных НХЛ после лечения ПППД, причем все пациенты, кроме одного, достигали не только УВО, но и полной ремиссии НХЛ.
Совсем недавно описание аналогичного случая опубликовали в Японии, в котором пациент проходивший лечение от ДККЛ, имел рецидив с летальным исходом спустя 7 лет после лечения лимфомы: пациент получал софосбувир и ледипасвир, при этом, сразу после достижения УВО, был зафиксирован рецидив агрессивной формы лимфомы.
Механизм возникновения рецидива ГЦК среди пациентов проходившим лечение ПППД пока неясен. Было выдвинуто предположение, что подобные схемы лечения восстанавливают количество и функции ряда иммунных клеток, таких как вирус-специфические CD8+, Т- и NK-клетки.
Кроме того, отсутствие постоянной стимуляции со стороны интерферона после элиминации вируса также может оказывать значительное влияние на внутрипеченочные иммунные реакции. Возможно, именно эти изменения внутрипеченочного иммунологического баланса были связаны с возникновением агрессивного рецидива ГЦК.
На данный момент, ввиду малого числа описанных случаев, нет соответствующих данных для группы пациентов с рецидивом лимфомы.
Восстановление опосредованного Т-клетками и В-клетками иммунного статуса благодаря эрадикации ВГС может привести к нарушению регуляции иммунного ответа, являясь фактором способствующим дополнительной клональной эволюции НХЛ.
Более того, есть подозрение, что ПППД может иметь более низкую антилимфомную активность, чем ИНФ, так как процент пациентов с прогрессом заболевания или гематологическим рецидивом, несмотря на достижение УВО гораздо выше, чем в случае применения ИНФ, который действует как иммунологический модулятор. Другим объяснением возможного снижения эффективности ПППД при ВГС-ассоциированных лимфомах является отсутствие у данной группы препаратов антипролиферативной активности.
В случаях ВГС-положительной ДККЛ была описана решающая роль дисрегуляции сети микроРНК, с последующим подавлением микроРНК-26b (miR-26b) которая напрямую участвует в ослаблении совокупности процессов подавления опухоли. Недавнее исследование показало обратную корреляцию вирусной нагрузки ВГС с экспрессией miR-26b в мононуклеарных клетках периферической крови среди пациентов с ВГС-НХЛ, что было предложено в качестве потенциального биомаркера для прогнозирования реакции лимфомы в данной группы пациентов.
Описанный нами клинический случай ДККЛ и последующим успешным лечением ВГС, вскоре за которым после достижения УВО произошел агрессивный рецидив со смертельным исходом, является редкостью. Это подчеркивает необходимость тщательного наблюдения за пациентами с НХЛ после лечения ВГС используя ПППД, в особенности, после достижения УВО.
Источники:
Коллектив авторов:
- Dimitrios N. Samonakis, Maria Psyllaki et all.
Опухолевая химиотерапия может ослабить иммунную систему пациентов, что может усилить чувствительность организма к экзогенным патогенам, среди которых следует обратить внимание на инфекцию вируса гепатита B (HBV) из-за более высоких шансов заражения и тяжелых последствий, особенно в Восточной Азии , Считается, что уровень титра поверхностного антитела к гепатиту В (HBsAb) выше 10 МЕ / л обеспечивает адекватную защиту иммунокомпетентных людей. Однако, остается ли этот уровень достаточным для пациентов с опухолями во время химиотерапии, остается неясным.
58-летний пациент с женской лимфомой был госпитализирован для астении, тошноты, рвоты и аномальной функции печени, продолжающейся более 1 недели и диагностированной как острый гепатит B. Пациент только что закончил курс химиотерапии с режимом CHOP и недавно запись (78,61 МЕ / л) положительного HBsAb. Единственный риск заражения, который мы могли обнаружить, заключался в том, что пациент получил переливание крови вскоре после химиотерапии от донора, который выздоравливал от бессимптомной острой инфекции HBV.
Пациент вводили с энтекавиром и агентом глицирризиновой кислоты, а затем болезнь успешно разрешалась серологическим преобразованием поверхностного антигена гепатита В.
Опухолевая химиотерапия может ослабить иммунную систему пациентов, которая не только стимулирует реактивацию латентных инфекций, таких как туберкулезные бактерии, вирус гепатита В и цитомегаловирус, но также усиливает чувствительность организма к экзогенным патогенам. 1 Различные противоопухолевые средства препараты имеют различные механизмы воздействия на иммунную систему, включая миелосупрессию, цитотоксичность и антипролиферацию и вызванные апоптозом эффекты. Инфекция вируса гепатита В (HBV) является проблемой, которая должна быть затронута во время и после опухолевой химиотерапии, одна из причин — более высокие шансы инфицирования HBV у пациентов с опухолями, особенно в Восточной Азии, и еще одна причина заключается в том, что инфекция HBV в иммунные скомпрометированные пациенты могут приводить к тяжелым результатам, таким как печеночная недостаточность [1,4]. Несколько исследований показали, что опухолевые пациенты, проходящие химиотерапию с неактивной инфекцией HBV, которая определяется как отрицательная или низкая вирусная нагрузка и нормальный фермент печени, могут развиваться вирусная репликация и повреждение функции печени. [2] Те же результаты можно было увидеть и у пациентов с одиночным гепатитом В (HBcAb). [3] Опухолевая химиотерапия может поражать специфический антивирусный иммунный ответ и нарушать баланс иммунной системы и HBV. Исследования показали, что обычные химиотерапевтические препараты, такие как циклофосфамид и преднизон, могут подавлять специфический гуморальный и клеточный иммунитет HBV через различные механизмы 5. На основании вышеизложенного риск инфицирования HBV значительно увеличивается во время и после опухолевой химиотерапии. Именно поэтому пациенты с опухолями, проходящие химиотерапию, были перечислены в качестве одной из групп высокого риска в руководящих принципах организации здравоохранения в Китае и в мире, и им было рекомендовано принять профилактическую инъекцию вакцины против HBV и контролировать уровень антител для поддержания эффективной иммунной защиты. [7-8 ]
Временные курсы аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), уровней вируса дезоксирибонуклеиновой кислоты гепатита В (HBVDNA) и серологических маркеров гепатита В (HBsAg, HBsAb, HBeAg, HBeAb и HBcAb). Время, поступившее в больницу, считалось 0-й неделей.
Стоит отметить, что пациент был вакцинирован против гепатита В 8 лет назад и имел достоверные данные о положительном значении HBsAb. Последний тест для HBsAb был почти за 8 недель до госпитализации, когда она готовилась к лечению химиотерапией. Точный титр составлял 78,6 МЕ / л, что в 7 раз больше, чем 10 МЕ / л, уровень, который должен обеспечивать достаточную защиту и не нуждаться в ревакцинации в соответствии с руководящими принципами или документами позиции из Соединенных Штатов, Китая и Всемирной организации здравоохранения (ВОЗ ). 7 Кроме того, было обнаружено, что ее уровни HBcAb и гепатита B e антитела (HBeAb) являются отрицательными, что свидетельствует о том, что положительный результат HBsAb, вероятно, не был результатом иммунитета постинфекции, а вакцинации.
Около 4 месяцев назад пациенту был поставлен диагноз диффузной большой В-клеточной лимфомы, а затем получен режим CHOP (циклофосфамид, винкристин, доксорубицин и преднизон). Значительные побочные эффекты включали анорексию, потерю волос и уменьшенные лейкоциты и тромбоциты, тогда как фермент печени и билирубин оставались нормальными все время. Симптоматическая инфекция вируса гепатита В появляется примерно через 4 недели после окончания химиотерапии. Рассчитывая на основании истории болезни пациента и периода инкубации инфекции вируса гепатита В, момент времени, когда она требовала, чтобы инфекция была во время химиотерапии или в течение очень короткого времени после нее. Затем мы решили подробно исследовать ее историю болезни еще раньше от ее последнего положительного результата HBsAb. Согласно ее повествованию, она отдыхала дома большую часть времени без подозрительных контактов и травм. За этот период не было выполнено никаких инвазивных манипуляций. Только один блок тромбоцитов был переливан для улучшения тромбоцитопении во время химиотерапии, примерно за 5 недель до того, как у пациента появились очевидные острые симптомы, связанные с гепатитом. Тесты донора регистрировались как сильфоны: нормальная функция печени, слабо положительная для HBsAb (6,82 IU / L) и отрицательная для HBsAg, HBcAb и HBeAb.
Затем мы обнаружили донора крови и попросили провести еще одно исследование примерно через 12 недель после сдачи на хранение. Донором является 28-летний не состоящий в браке здоровый мужчина, который не имел истории гепатита В и не получал вакцинацию против вируса гепатита В. Как и раньше, проверка функции печени была нормальной, а концентрация HBVDNA была ниже, чем определяемый предел (500 копий / мл). Неожиданно были обнаружены явные изменения в серологических маркерах HBV, включая HBsAb (255,82 МЕ / л), что было намного выше, чем у 12 недель назад, слабо положительного HBcAb и положительного HBeAb, которые были отрицательными до сдачи крови. Исходя из вышеприведенных данных, мы пришли к выводу, что донор должен быть бессимптомным острого человека, инфицированного ВГВ, и восстанавливался после сдачи крови 12 недель назад.
Циклофосфамид и доксорубицин являются неспецифическими антинеопластическими препаратами клеточного цикла, которые могут взаимодействовать или ингибировать внутриклеточную ДНК и РНК и блокировать пролиферацию клеток [10]. Быстрые пролиферативные клетки, включая опухолевые клетки, клетки костного мозга и иммунные клетки, более чувствительны к этим препаратам. Винкристин может ингибировать сборку микротрубочек и индуцировать самоубийство тубулина в спиральные агрегаты спирали, которые склонны влиять на те же самые типы быстро делящихся клеток, что и циклофосфамид. Предполагается, что преднизон, как своего рода глюкокортикоиды, оказывает общее подавляющее действие на иммунитет, особенно на специфические клеточные и гуморальные иммунные ответы [6]. Интересно, однако, что серологический защитный маркер HBsAb HBV был обнаружен намного выше, чем 10 МЕ / мл, прежде чем пациент принял химиотерапию, которая, как считается, имеет полный защитный эффект на вирус гепатита В. Из-за ретроспективного анализа мы не могли понять, снизился ли титр HBsAb этого пациента после химиотерапии. Чтобы оценить, может ли химиотерапия опухолей влиять на уровень антител, мы выбрали 5 пациентов с диффузным большим В-клеточной лимфомой с положительным HBsAb, выявили уровни антител до и после того, как они подверглись химиотерапии с режимом CHOP. Небольшое выборочное исследование и вышеприведенный отчет были одобрены Международным советом по обзору Международной больницы мира в Бетьюне. Как письменные, так и устные согласия были получены до того, как пациенты были опрокинуты, а соответствующие данные, предоставленные исследователям, были анонимизированы. Удивительно, но никаких явных изменений уровней HBsAb не было до и после химиотерапии (рис. 2А). Мы также обнаружили HBsAg-эпитоп-специфичные ответы цитотоксических Т-лимфоцитов (CTL) с помощью иммуноферментного анализа с использованием фермента (ELISPOT), которые были достигнуты мононуклеарными клетками периферической крови пациентов (РВМС), инкубированными с пептидом области HBV S 335-343 (WLSLLVPFV, 20 мкг / мл), рекомбинантный человеческий интерлейкин-2 (rhIL-2, 50IU / мл) вместе с соответствующими концентрациями rhIL-7 и rhIL-15 в течение 48 часов. Результаты показали, что драматические капли эпитопоспецифических CTL-ответов могут быть обнаружены после окончания химиотерапии опухоли (фиг.2B). Теоретически химиотерапевтические препараты выше могут ингибировать как врожденные, так и специфические иммунные ответы. Но для внутриклеточных микроорганизмов, таких как вирус гепатита В, специфический клеточный иммунитет может играть ключевую роль в предотвращении вторжения и репликации вируса [11]. Это может объяснить, почему опухолевые пациенты, получающие химиотерапию, склонны заражаться вирусом гепатита В. Для пациентов с опухолями, проходящих химиотерапию, уровень HBsAb выше 10 МЕ / мл не может использоваться в качестве критериев безопасности и не может обеспечить адекватно защитный эффект.
Влияние химиотерапии на специфические гуморальные и клеточные иммунные ответы на HBV у пациентов с HBsAb-положительной диффузной большой В-клеточной лимфомой. A, Изменения титров HBsAb (IU / mL) у пациентов с лимфомой до и после химиотерапии (n = 5). B, данные ELISPOT, показывающие количество SFC IFN-γ на миллион мононуклеарных клеток периферической крови (РВМС) при стимуляции пептидом HBV S региона 335-343 (WLSLLVPFV, 20 мкг / мл), рекомбинантным человеческим интерлейкином-2 (rhIL-2, 50IU / mL) вместе с соответствующими концентрациями rhIL-7 и rhIL-15 в течение 48 часов у пациентов с лимфомой до и после химиотерапии (n = 5). Значения P показаны.
В ретроспективном исследовании мы очень сомневаемся, что инфекция HBV у этого пациента была от донора крови, который восстанавливался после субклинической инфекции HBV, поскольку пациент получал тромбоциты донора из-за индуцированной химиотерапией тромбоцитопении. Интересно, что донор показал, что HBsAb слабо положительный и функция печени нормальна перед донорством крови, тогда как при исследовании через 6 недель отмечалось резкое увеличение титра HBsAb, и HBcAb и HBeAb оба оказались положительными. Мы пришли к выводу, что донор, страдающий субклинической инфекцией HBV, может по-прежнему иметь крошечное количество вируса HBV в периферической крови, хотя серологическая конвенция HBsAg имела место. Мы обычно думаем, что риск заражения HBV при переливании крови происходит главным образом из оконного периода доноров. [12] Хотя этот случай намекнул, что этап выздоровления острой инфекции HBV может рассматриваться как оккультная инфекция HBV и быть еще одним опасным периодом для доноров крови. Оккультная инфекция HBV очень легко ошибочно диагностируется из-за отрицательного HBsAg, даже с положительным HBsAb. Более высокие требования должны быть выдвинуты для проверки доноров крови, особенно для иммунных скомпрометированных реципиентов, таких как опухолевые пациенты, получающие химиотерапию.
Хотя слабый титр HBsAb может быть недостаточным для обеспечения защиты пациентов с опухолями при химиотерапии, эффективный уровень защиты HBsAb остается неопределенным. В будущем потребуются дополнительные отчеты о случаях и подробные механизмы.
Аббревиатуры: ALT = аланинаминотрансфераза, АСТ = аспартат-аминотрансфераза, CTL = цитотоксический Т-лимфоцит, ELISPOT = иммуноферментный анализ с ферментным связыванием, HBcAb = антитело к гепатиту B, HBeAg = антиген гепатита B e, HBsAb = поверхностное антитело против гепатита B, HBsAg = гепатит B поверхностный антиген, HBV = вирус гепатита B, HBVDNA = вирус-дезоксирибонуклеиновая кислота гепатита B, PBMCs — мононуклеарные клетки периферической крови, TBIL = общий билирубин.
Авторы заявляют никакого конфликта интересов.
АН – аналоги нуклеоз(т)идов
ВДХТ – высокодозная химиотерапия
ЛКМЗ – лимфома из клеток маргинальной зоны
НХЛ – неходжскинские лимфомы
ТГСК – трансплантация гемопоэтических стволовых клеток
HCV – вирусный гепатит С
1. 2016 Клинические рекомендации "Лимфомы у взрослых: Гепатиты В и С" (Национальное гематологическое общество, Российское профессиональное общество онкогематологов).
Алгоритм лечения
Медикаментозная терапия
Рекомендуется проведение только противовирусной терапии у больных лимфомой маргинальной зоны селезенки, ассоциированной с гепатитом С.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3++)
У пациентов с выявленными антителами к HCV, следует определять количественное содержание HCV РНК методом ПЦР, хотя нет данных о связи между вирусной нагрузкой и исходом лечения НХЛ. У пациентов с хроническим гепатитом С (HСV РНК+ в крови) перед началом химиотерапии необходимо определить тяжесть поражения печени (оценить активность печеночного процесса и стадию фиброза), а также исключить другие причины поражения печени.
В этой группе больных в качестве индукционной терапии может быть назначен интерферон-α без добавления химиотерапии. В настоящее время основу лечения хронического гепатита С составляют препараты прямого противовирусного действия (ингибиторы протеазы и полимеразы HCV), которые отличаются высокой эффективностью (в пределах 90-95%), хорошим профилем безопасности, удобным режимом дозирования (как правило, 1-2 таблетки в сутки в течение 12 недель). Уже отмечен опыт их успешного применения у больных лимфомой, в том числе, ассоциированной с HCV.
Рекомендуется проводить терапию больных другими вариантами НХЛ, инфицированных HCV, в соответствии с рекомендациями по лечению соответствующего варианта лимфомы. При необходимости, возможно проведение иммунохимиотерапии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2++)
Противовирусное лечение необходимо назначить одновременно или после завершения программы лечения лимфомы. Существуют данные, что у больных, инфицированных HCV и получающих иммунохимиотерапию, повышен риск печеночной токсичности. Кроме того, противоопухолевое лечение может привести к активации гепатита. В связи с этим при проведении химиотерапии показано строгое мониторирование функционального состояния печени, а также регулярное исследование количественного содержания HCV РНК с помощью ПЦР для контроля вирусной нагрузки. Мониторинг биохимических показателей крови и вирусной нагрузки необходимо продолжать в течение 6 месяцев после завершения противоопухолевого лечения , т.к. одним из важных факторов реактивации гепатита может быть восстановление иммунной системы.
Больным хроническим гепатитом С не противопоказана трансплантация костного мозга, однако она может быть ассоциирована с более высокой частотой развития венозных тромбозов, особенно у больных циррозом печени. После проведения трансплантации у больных с хроническим гепатитом С увеличивается риск развития цирроза печени. В то же время наличие высокоэффективных и безопасных схем лечения хронического гепатита С значительно снижает остроту и актуальность этой проблемы.
Реактивация гепатита В встречается у больных, получающих химиотерапию, особенно при использовании ритуксимаба. Результатом реактивации гепатита В могут быть развитие фульминантной печеночной недостаточности и смерть больного. Медиана времени до реактивации гепатита В после начала применения ритуксимаба составляет 4 месяца. По данным проспективных исследований, у HBsAg-позитивных больных, получающих химиотерапию, реактивация гепатита развивается в 67% случаев. При применении ритуксимаба, а также ВДХТ с ауто-ТГСК риск реактивации гепатита увеличивается. Другими факторами риска реактивации гепатита В являются молодой возраст, мужской пол, высокая вирусная нагрузка до начала лечения и продолжительная иммуносупрессия.
Реактивация гепатита B характеризуется выявлением и/или повышением в сыворотке крови уровня HBV ДНК с последующим (спустя 1-11 месяцев) увеличением АЛТ, отражающим острое повреждение печени. У части пациентов отмечается бессимптомное течение реактивации гепатита. Мониторинг уровня HBV ДНК в сыворотке крови необходимо проводить с помощью ПЦР не менее 1 раза в месяц. Диагностическими критериями реактивации гепатита В являются: пятикратное повышение АЛТ в сыворотке крови или повышение АЛТ в три раза от первоначального уровня; повышение уровня HBV ДНК сыворотки крови более чем на 1 log копий/мл от исходного уровня; увеличение вирусной нагрузки свыше 6 log копий/мл; выявление HBV ДНК у больных с позитивным HBsAg при ее отрицательном значении до начала химиотерапии или выявление HBsAg и HBV ДНК у больных с положительными маркерами anti-HBc, anti-HBe и/или anti-HBs. Увеличение вирусной нагрузки HBV ДНК в крови предшествует росту АЛТ в среднем на 3-4 недели.
Таким образом, количественная оценка HBV ДНК и уровня АЛТ в динамике являются ключевыми в диагностике и мониторинге реактивации HBV-инфекции.
В онкогематологической практике наиболее часто реактивация вируса обусловлена восстановлением иммунной системы пациента после отмены химиотерапии. При этом в течение нескольких недель или даже месяцев у большинства больных наблюдается обострение гепатита В вследствие усиленного лизиса гепатоцитов, инфицированных вирусом гепатита В. Эта стадия характеризуется нарастанием цитолиза, в ткани печени развиваются массивные некрозы, при тяжелом течении могут развиваться желтуха и, другие признаки декомпенсации заболевания печени (печеночная недостаточность, коагулопатия и печеночная кома).
Рекомендуется перед началом лечения всем больным, которым планируется химиотерапия с ритуксимабом или ВДХТ, выполнить исследование HBsAg и antiHBc.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2++)
В случае выявления одного из маркеров HBV следует провести количественное исследование HBV ДНК с помощью ПЦР для определения вирусной нагрузки. При проведении химиотерапии необходим мониторинг вирусной нагрузки и АЛТ каждые 3 месяца. При реактивации гепатита В рекомендуется исследовать HBV ДНК и АЛТ ежемесячно. В случае, если после назначения противовирусной терапии вирусная нагрузка не уменьшается, показана консультация гепатолога.
Рекомендуется больным, не имеющих маркеров HBV (HBsAg, anti-HBc, anti-HBs) в крови, в связи с отсутствием времени для полноценной вакцинации в режиме 0-1-6 месяцев вакцинация двумя дозами с интервалом в 4 недели, а третью дозу вводить через несколько месяцев после окончания химиотерапии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2++)
Успех данного режима вакцинации отмечается у 57% больных с гематологическими злокачественными заболеваниями и у 15-68% больных, которым проводится ТГСК. В дальнейшем рекомендован обязательный контроль количества anti-HBs через год после вакцинации и ежегодно в течение 5 лет наблюдения. Основная профилактика HBV реактивации заключается в вакцинации против гепатита В серонегативных больных со злокачественными опухолями.
Рекомендуется всем больным лимфомой с наличием HBsAg в крови необходима превентивная противовирусная терапия как можно раньше (перед началом иммунохимиотерапии), вне зависимости от наличия HBV ДНК в крови, и соответствующий мониторинг (АЛТ/АСТ, HBV ДНК качественный и/или количественный 1 раз в 3 мес.).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2++)
В большом количестве клинических исследований было показано, что профилактическое назначение противовирусной терапии значительно снижает риск реактивации гепатита В, печеночной недостаточности и смерти от гепатита В.
У пациентов без HBsAg с наличием anti-HBs и/или anti-HBc необходим регулярный мониторинг печеночных показателей, а также анализ на HBsAg (для раннего выявления возможной реверсии HBsAg) с интервалом не реже 1 раза в 3 мес. При появлении признаков реактивации гепатита В (обнаружение HBsAg, появление ДНК HBV и повышение активности АЛТ/АСТ) назначается противовирусная терапия. В случае использования ритуксимаба или аналогичных по механизму препаратов (угнетающих B-лимфоциты) рекомендуется превентивная противовирусная терапия и соответствующий мониторинг.
Рекомендуется проводить профилактическое лечение аналогами нуклеоз(т)идов АН в течение всего периода химиотерапии, независимо от уровня вирусной нагрузки, и еще 6-12 месяцев после ее окончания. Длительность терапии АН определяется вариантом онкологического заболевания, длительностью химиотерапии, степенью иммуносупрессии и может быть продолжительной.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2+)
Высокий риск развития резистентности к проводимой терапии ламивудином обусловливает дифференцированный подход к назначению противовирусных препаратов у больных лимфомой и положительными маркерами HBV инфекции.
Ламивудин (100 мг/сут) оправдан (из-за более низкой стоимости) в случае предполагаемого короткого курса химиотерапии (не более 6-12 мес.) и исходно низкой вирусной нагрузке (HBV ДНК 2000 МЕ/мл), которым планируется длительная химиотерапия и повторные курсы лечения , должны назначаться более мощные противовирусные препараты с высоким барьером развития резистентности, т.е. энтекавир (0,5 мг/сут) или тенофовир (300 мг/сут).
Лечение отдельных групп пациентов
Рекомендуется со всеми больными детородного возраста обоих полов обсуждать вопрос о возможности криоконсервации спермы или ткани яичника перед началом терапии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++)
Химиотерапия и облучение области таза могут привести к необратимой стерильности пациента.
Рекомендуется с женщинами детородного возраста обсуждать вопрос о необходимости гормональной защиты от беременности, а также о методах возможной гормональной защиты яичников при проведении интенсивных программ лечения .
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1++)
Читайте также:

