Эффективность лучевой терапии при плоскоклеточном раке
Нахождение оптимальных режимов фракционированного облучения является одним из основных путей дальнейшего повышения эффективности лучевой терапии. Между тем до настоящего времени остается не решенным вопрос, насколько существен вклад того или иного временного параметра в лечебный эффект ионизирующих излучений при лучевой терапии злокачественных новообразований.
Цель настоящей работы — изучение влияния числа фракций на терапевтический эффект быстрых электронов при облучении плоскоклеточного рака мышей.
Эксперименты были поставлены на 105 мышах-самцах линии СС57 Br. В качестве опухолевого штамма использовался перевиваемый плосклеточный рак преджелудка. Общепринятым методом опухоль преджелудка перевивали в мышцу бедра правой задней конечности. На 10-й день после перевивки, когда опухоли достигали в диаметре 9—10 мм, животных разделяли на группы и начинали локальное облучение быстрыми электронами, которые генерировались линейным ускорителем ЛУЭ-25. Опухоли облучались в проходящем пучке электронов с энергией 22 Мэв при мощности дозы 100—120 рад/мин. Для облучения использовался десятисекционный радиалыю-симметричпый станок, изготовленный из плексигласа (толщиной нижней стенки 1 см). Мыши с перевитыми в заднюю конечность опухолями привязывались за лапки к центру станка таким образом, чтобы опухоли плотно прилегали друг к другу. Для улучшения распределения дозы по облучаемому объему под станок помещали парафин толщиной 3 см.
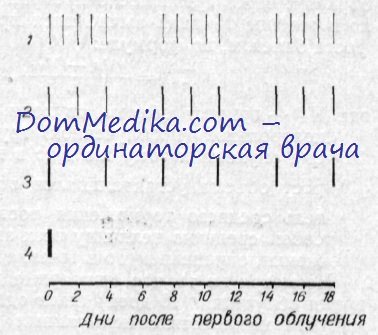
Терапевтическая эффективность режимов облучения оценивалась по средней продолжительности жизни животных-опухоленосителей и по изменению объема опухолей. Последнее определялось отношением Vt/V0 , где V0 —объем опухоли перед облучением, Vt — объем опухоли к определенному дню опыта. За критерий количественной оценки противоопухолевого эффекта применялся показатель среднего торможения роста (%). который определялся следующим образом: через сутки после прекращения облучения ежедневно в течение 10 дней вычислялся процент торможения (ПТ) роста бластом, по формуле: ПТ=(Vk-Vоп) /Vk 100%, где VK — прирост объема опухоли к определенному дню в контрольной (нсоблученной) группе, Von — прирост объема опухоли к тому же дню в подопытной группе. Прирост объема устанавливался отношением Vt/V0.
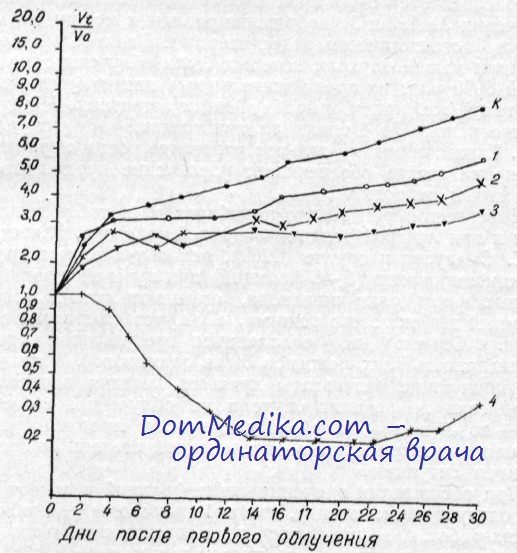
Показатель среднего торможения роста опухолей представлял собой среднюю величину всех значений процента торможения, определяемого в течение 10 дней. Несмотря на то, что суммарные дозы (6000 рад) и общее время облучения (18 дней) были одинаковыми, реакция преджелудка на действие испытанных режимов была довольно различной. При анализе кривых прироста объема опухолей и показателей среднего торможения опухоли преджелудка можно отметить определенную закономерность, выражающуюся в том, что с уменьшением числа фракций возрастает ингибпрующее действие быстрых электронов на плоскоклеточный рак. Так, при режиме № 4 (облучение одной фракцией) не наблюдалось не только прироста объема опухоли, но даже наступила выраженная регрессия. При режиме № 3 (6 фракций) с 11-го дня После начала облучения и до 25-го преджелудок практически не увеличивался. При режимах же № 1 и 2, где суммарная доза отпускалась соответственно 15 и 9 фракциями, прирост объема опухоли продолжался, хотя и медленнее по сравнению с необлученными опухолями.
Следует отметить, что ранее аналогичная зависимость противоопухолевого эффекта быстрых электронов от числа фракции была получена при облучении опухоли Эрлиха (А. П. Козлов и др., 1973).

Однако лечебный эффект лучевой терапии не обусловливается только реакцией опухоли на воздействие ионизирующего излучения. Она скорее характеризует радиочувствительность бластомы. Общеизвестно, что лучевая чувствительность и лучевая излечимость опухоли — понятия неидентичные (Fletcher, 1965). Именно поэтому, эффективность того или иного метода лучевого или какого-либо другого вида лечения определяется, в первую очередь, по срокам продолжительности жизни больного. В связи с этим, мы также использовали критерии средней продолжительности жизни мышей-опухоленосителей для оценки терапевтического эффекта быстрых электронов при облучении опухоли преджелудка.
Оказалось, что при облучении плоскоклеточного рака режимом № 1 мыши жили в среднем 48,1 ±2,4 дня, при режиме № 2 — 50,0±2,1, при режиме № 3 —45,3±2,5 и при режиме № 4 — 38,0±3,4, животные контрольной группы — 36,6± ±3,4 дня. Следовательно, продолжительность жизни мышей-опухоленосителей была практически одинаковой при режимах облучения № 1,2 и 3 (небольшие различия между режимами № 2 и 3 статистически недостоверны). Значительно меньше прожили мыши, опухоли которых были облучены однократно дозой 6000 рад; их продолжительность жизни была фактически такой же, как и у необлученных животных. Между тем, именно режим № 4 оказывал наибольший эффект на опухоль. Таким образом, сильное угнетение роста опухолей еще далеко не всегда обеспечивает увеличение продолжительности жизни животного.
Интересно отметить, что подобного рода наблюдения имеются и при лучевой терапии опухолей человека. В частности, А. С. Смагулов и другие (1969), используя режим крупного фракционирования (5—6 фракций) при лучевой терапии запущенных форм рака пищевода, отмечают лучший непосредственный эффект этого режима, чем курса ежедневного облучения. Однако но отдаленным результатам лечения эффективность этих режимов была одинаковой. Если учесть, что ближайшие результаты лучевого лечения определяются фактически по реакции опухоли па облучение, а отдаленные — по 3- или 5-летней выживаемости, то можно увидеть, что наши эксперименты в определенной степени моделируют сходную ситуацию.
При обсуждении значения числа фракций в лучевой терапии следует иметь в виду, что в большинстве радиобиологических работ, где учитывается повреждающее действие радиации, будь то выживаемость клеток в культуре Elkind, Sutton, 1960) или реакция кожи (Fowler и др., 1963), уменьшение числа фракций приводит к повышению эффекта. При этом обнаруживается прямая зависимость между биологическим эффектом суммарной дозы и числом фракций. Последнее дает основания Fowler считать, что число фракций и, следовательно, доза за фракцию играют большую роль в биологическом действии ионизирующего излучения, чем общее время облучения. Судя по нашим экспериментальным данным, это положение вполне правильно в отношении реакции опухоли на облучение. Однако в отношений такого интегрального показателя, как продолжительность жизни, число фракций не играет такой определяющей роли.
Это, вероятно, связано с тем, что продолжительность жизни животного-опухоленосителя (или выживаемость человека со злокачественным новообразованием), подвергающегося лучевому лечению, обусловлена не только действием радиации на опухоль, по и реакцией нормальных тканей, а также существующим взаимоотношением опухоль—организм. В связи с этим не исключено, что на продолжительность жизни большее влияние оказывает общее время облучения, чем число фракций. Для выяснения этого вопроса необходимы дальнейшие исследования по определению зависимости терапевтического эффекта ионизирующих излучений от общего времени облучения разных режимов фракционирования дозы.
Лучевая терапия – это группа лечебных курсов. Лечение рака представляет собой облучение раковых новообразований и повреждённых клеточных тканей рентгеновскими лучами. Воздействие лучей уничтожает патологические клетки. Однако во время проведения терапии затрагиваются и здоровые ткани, что приводит к появлению неприятных для организма пациента последствий.
Лучевая терапия характеризуется целенаправленным влиянием электромагнитных волн на злокачественные наросты. Излучение успешно разрушает структуру молекул повреждённых тканей, из-за чего клетки погибают. Повышенная действенность терапии замечена при лечении клеток, предрасположенных к повышенному размножению. Поэтому процедура направлена на борьбу именно с раковыми опухолями. Патологические ткани разрушаются первоочередно.
Показания и противопоказания
При раке лёгких лучевая терапия проводится согласно результатам диагностических процедур. Перед проведением терапии пациент проходит УЗИ и компьютерную или магнитно-резонансную томографию.
Лечение назначается, если:
- метастазные клетки попали в лимфоузлы;
- опухоль с метастазами размножилась по лимфоузлам средостения;
- нарост давит на близрасположенные структуры;
- развился рецидив;
- раковые клетки распространились по диафрагме и грудной клетке;
- опухоль с метастазами перешла на стенки груди или в часть сердца;
- опухолевые ткани проникли в надключичные участки;
- как профилактика размножения поражённых клеток после торакотомии.
Также показаниями к лучевой терапии являются:
- противопоказание к проведению оперативного вмешательства;
- отказ пациента от операции;
- как вспомогательная процедура для предупреждения вторичного появления болезни.
Врачи отмечают такие противопоказания к лечению:
- ателектаз;
- разрыв опухоли;
- существование полостей;
- кровотечение;
- повышенная температура;
- огромные размеры и территории поражения лёгких;
- кумуляция жидкости в плевре;
- воспалительный процесс в лимфатических сосудах;
- отравление организма;
- активное развитие туберкулёза открытой формы;
- перенесенный инфаркт меньше 6 месяцев назад;
- диабет на стадии декомпенсации;
- сердечная недостаточность;
- осложнённые патологии почек и печени;
- нарушение психического здоровья, нестабильность эмоционального фона.
Виды лучевой терапии
Диагностирование мелкоклеточного рака лёгких характерно для редких случаев. Данная разновидность характерна для курильщиков со стажем, отличается агрессивным характером и регулярно метастазирует. Для лечения рака прибегают к химиотерапии. Процедура выступает в качестве самостоятельного мероприятия или проводится совместно с лучевой терапией. Лучевая терапия эффективна, если злокачественное образование не начало процесс активного распространения, и не наблюдается рецидива.
Данный тип онкологии требует использования терапии превентивно. Облучают жизненно важные органы, в частности головной мозг, пока не сформировались отдалённые метастазные клетки. Процедура осуществляется методом стереотаксической радиотерапии. Направление лучей рассчитывается через компьютерную 3D-модель.
Вылечить немелкоклеточный и плоскоклеточный рак поможет радиотерапия совместно с хирургическим вмешательством. Иногда операция заменяется радиотерапией. Начало лечения приходится на момент диагностирования опухоли лёгких. Процедура при онкологии на 3 этапе применяется после окончания хирургического лечения. Это позволяет снизить вероятность рецидивирования злокачественного нароста.
Лучевая терапия, независимо от типа рака лёгкого, выступает способом локального и целенаправленного использования. Благодаря изучению пределов терапии удалось создать новейшие методики. В основу одних легло применение агрессивных мероприятий, а другие направлены на подведение лучей напрямую к опухолевым клеткам. Для достижения наибольшего эффекта процедуры комбинируют с химиотерапией или хирургическим лечением.
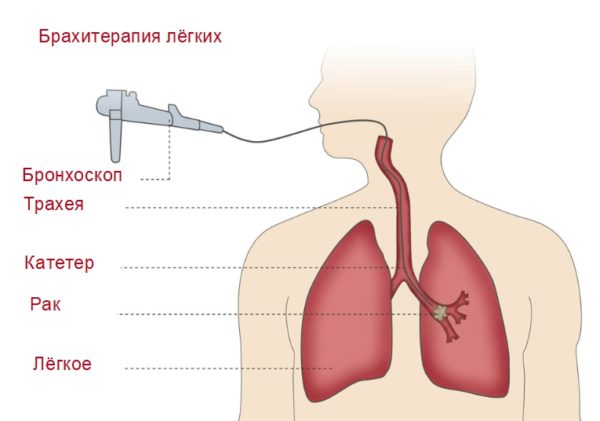
Эндобронхиальная брахитерапия назначается для нормализации путей проходимости, если новообразование подобралось близко к бронхам либо проросло в бронхиальную область. Радиотерапия при раке лёгких осуществляется под местным наркозом. В выбранный участок через фибробронхоскоп вводится зонд размером 3 мм, состоящий из полимерных материалов. На расстоянии двух крайних точек располагается аппликатор, перекрывающий опухоль на 1,5 см. Пациент находится под врачебным контролем. Также доктор прослеживает показатели артериального давления, функционирования сердца, частоту дыхания и степень поступления кислорода в кровь.
Технология лечения характеризуется повышенной действенностью. У 50% пациентов уменьшаются и проходят проявления симптомов. Положительной стороной и преимуществом схемы лечения является расположение источника излучения на близком расстоянии к поражённому участку. Высокая дозировка и влияние на здоровые ткани сокращаются. На центральную область опухоли наносится двойной удар по сравнению с периферическими тканями. Зачастую центр вырабатывает устойчивость к излучению. Показания к проведению брахитерапии:
- Расположение опухоли вблизи бронха.
- Малая величина новообразования.
- Рак, расположившийся вдали от бронхов и углубившийся в ткани лёгких. В данном случае процедура является дополнительным мероприятием к внешнему облучению.
- Улучшение путей проходимости бронхов из-за проникновения раковых клеток в бронхиальный просвет.
Методика представляет собой уничтожение опухолевых клеток при повышении дозировки облучения. При этом упор делается на клетки, способные к активному делению. Во время процедуры важно защитить здоровые ткани от попадания под облучение. Для этого создается компьютерная 3D-модель опухоли. Во время построения новообразования рассчитывается дозировка облучения и число здоровых клеток, впоследствии сэкономленных в сравнении с традиционной лучевой терапией. Также излучение не должно воздействовать на сердце.
Технология основывается на информации, полученной по мультиспиральной компьютерной и позитронно-эмиссионной томографии груди. Предварительное обследование включает в себя анализ крови, исследование мокроты, плевральную пункцию и торакоскопию. Указанные диагностические мероприятия нацелены на исключение вероятного метастазирования участков. Если конечный результат гистологического и цитологического обследования отрицательный, проводится моделирование территории облучения.
Метод раскрывает алгоритм деления раковых клеток. При применении небольших дозировок в день увеличивается суммарная дневная норма дозы, и снижается вероятность появления побочных реакций от излучения, рецидивного развития и метастазирования опухолевых клеток. При продолжительном сроке облучения выявляется отрицательное влияние на эффективность процедуры. Лечение рака проходит на протяжении 12 суток вместо 1,5 месяца. При этом суммарная дозировка достигает 54 Грей вместо 60.
Облучение осуществляется 3 раза в сутки каждые 6 часов с перерывом на сон. Единичная доза равняется 1,5 Гр. По сравнению со стандартной схемой лечения токсичность повышена. Однако превышение фиксируется только на начальных этапах после терапии.
Побочные эффекты возникают независимо от технологии применения. Отмечается высокий показатель выживаемости пациентов, подвергнувшихся указанной методике лечения, и сниженное формирование новых метастазов. Основываясь на токсичности лечения, исследователи предложили другую технологию терапии – по 2 Гр раз в сутки, 5 раз в неделю. Продолжительность курса – 5-7 недель.
Контактная представляет собой методику лечения, когда источник лучей располагается максимально близко к опухолевому очагу и находится прямо в опухоли. Для осуществления терапии применяют рентгенологическое, гамма и бета излучение. Высокая действенность схемы отмечается при некрупных наростах размером до 20 мм в диаметре. Доза рассчитывается исключительно на участок поражения. Однако терапия ухудшается при необходимости диагностировать подобный рак.
Согласно фокусной технологии лучи направляются на некотором расстоянии от поражённого места. При полостном облучении на участок вводится зонд и находится внутри на протяжении всей процедуры. Тканевый метод требует непрерывную поставку дозы. Радиохирургическая методика разрушает оставшиеся раковые клетки и очищает территории расположения опухолевых тканей после удаления. При наложенном воздействии проводится лечение аппликатором на слизистых оболочках злокачественного нароста.
Схема настраивает нужное направление потока, отодвинутого на установленное расстояние для охватывания полноценной поверхности опухоли. Ускоренные электроны и высокая энергия обеспечивают увеличенную плотность излучения. Технология допускает повышение дозы, так как благодаря установленному режиму влияния не затрагиваются здоровые клетки. Во время статистического направления пациент и аппарат попадают в стационарное состояние. Однако такая схема считается устаревшей. При подвижной схеме удаётся вращать луч согласно заданным траекториям, достигая максимальной дозировки для злокачественных тканей.
На стадии планирования врачи разрабатывают модель для расчёта дозировки, времени и путей облучения. Основываясь на изображениях, появившихся после диагностики, расписывается схема дальнейшей компьютерной обработки. Доктора разбирают методы подачи и оптимизацию поступления активного элемента. В каждой отдельной ситуации применяется разный вид излучения.
Для брахитерапии моделируют расположение катетера и время экспозиционного влияния. Планирование состоит из расчёта технологии соотношений дозировки и объёма для выявления территории поражённого участка. Параллельно врачи разрешают вопрос по сохранению и устранению максимальной площади нормальных тканей.
Возможные побочные реакции и осложнения
Максимальная эффективность терапии и применение инновационных методов лечения сопровождаются негативными побочными эффектами. Несмотря на возможность сохранения большего числа здоровых клеток, процедура вызывает неприятные симптомы. После лучевой терапии отмечают такие последствия и осложнения:
Реабилитация
После завершения курса лечения пациент проходит первый врачебный осмотр спустя 6 недель. Проходить обследования требуется раз в 3 месяца в течение двух лет. Через 2 месяца по окончанию терапии онколог проводит контрольное диагностическое исследование. Результаты компьютерной томографии отразят эффективность лечения. Полученные тесты сравнивают с прошлой картиной болезни.
Обследование позволяет врачу увидеть прохождение рубцевания клеток, что является неотъемлемой частью лучевой терапии. Анализ и диагностика способствуют своевременному обнаружению рецидива и проявления осложнений. Реабилитация требует строгого соблюдения правил и ответственного исполнения врачебных рекомендаций. В период восстановления требуется составить меню, включающее правильное и полноценное питание, а также использовать растения и травы, помогающие ослабленному организму восстановиться.
В домашних условиях пациент занимается дыхательной гимнастикой. Важно ускорить выздоровление и нормализацию привычного образа жизни. После лучевой терапии в первые 2 недели требуется:

- Выпивать достаточный объём жидкости – норма 8-10 стаканов воды.
- Отказаться от сладкого.
- Уменьшить порции, но кушать чаще. Из-за воздействия лучей пищевод и желудок ослаблены, и в них ещё наблюдается воспалительный процесс.
- Исключить из рациона молочную продукцию.
- Отказаться от острых и пряных блюд.
- Исключить сырые овощи, бобовые и цельнозерновые продукты.
- Использовать настойки из крапивы, левзеи, родиолы, сельдерея и элеутерококка.
Со временем разрешается добавлять каши из зёрен, картофель и бульоны. Продолжается травяная терапия. Также важно заняться активностью и двигательными функциями для профилактики пролежней и пневмонии. Регулярно проводится дыхательная гимнастика. Рекомендуется полностью отказаться от употребления алкогольных напитков и курения.
Эффективность лучевой терапии
Наибольшая эффективность и успех лечения рака лёгких наблюдается на начальных стадиях развития онкологических патологий. Действенность лучевой терапии основывается на:
- виде рака;
- этапе развития болезни;
- выбранном способе лечения;
- возрасте пациента;
- существующих хронических болезнях.
Брахитерапия обеспечивает повышение пятилетней выживаемости до 70%. При проведении конформационной терапии в 40% случаев у пациентов с 3 этапом опухоли отсутствует рецидив рака на протяжении 2 лет. При применении гиперфракционного способа лечения показатель выживаемости возрастает в 2 раза. Однако методика тяжело переносится людьми. Поэтому технология используется в редких случаях.

Лучевая терапия — это один из ведущих методов противоопухолевого лечения, основанный на использовании ионизирующего излучения. Может применяться как самостоятельный вид терапии, так и в рамках комбинированного/комплексного лечения (совместно с другими методами), в качестве радикальной, нео- и адъювантной, консолидирующей, профилактической и паллиативной терапии.
- Виды лучевой терапии
- Этапы лучевой терапии
- Побочные эффекты лучевой терапии
- Химиолучевая терапия

Виды лучевой терапии
Уже несколько десятилетий человечество изучает воздействие ионизирующего излучение на организм человека. При этом акцентируется внимание как на положительном, так и отрицательном эффекте, возникающем при его применении. Разрабатываются новые методы, которые позволяют добиваться максимального лечебного эффекта при снижении отрицательного действия на организм. Улучшается оборудование для проведения лучевой терапии, появляются новые технологии облучения.
Сейчас классификация методов лучевой терапии довольно обширна. Мы остановимся только на самых распространенных методиках.
При контактной лучевой терапии источник излучения вводится непосредственно в опухоль или прилегает к ее поверхности. Это позволяет прицельно облучать новообразование с минимумом воздействия на окружающие его ткани.
К контактным видам лучевой терапии относятся:
- Аппликационная лучевая терапия. Применяется при лечении поверхностно расположенных опухолей, например, новообразований кожи, слизистых оболочек гениталий. В этом случае используются индивидуально изготовленные аппликаторы, которые накладываются непосредственно на поверхность новообразования.
- Внутриполостная лучевая терапия. Источник ионизирующего излучения вводится в просвет полого органа, например, в пищевод, мочевой пузырь, прямую кишку, полость матки или влагалища. Для облучения используются специальные аппликаторы (их называют эндостатами), которые заполняются радионуклидами.
- Внутритканевое облучение. Источник ионизирующего излучения вводится непосредственно в ткань опухоли. Для этого используются интростаты, которые могут иметь вид игл, шариков, трубочек, заполненных источником излучения.
Кроме того, существует такой вид лечения, как радионуклидная терапия. В этом случае используются открытые источники излучения в виде растворов радионуклидов (радиофармацевтический препарат — РФП), которые при попадании в организм прицельно накапливаются в опухолевых очагах и уничтожают их. Чаще всего РФП вводится внутривенно. Наибольшее распространение получили следующие виды радионуклидной терапии:
- Терапия радиоактивным йодом. Используется для лечения ряда видов рака щитовидной железы, поскольку йод избирательно накапливается в тиреоидной ткани.
- Применение остеотропных РФП используется для лечения метастазов в костях или костных опухолей.
- Радиоиммунотерапия — радионуклиды присоединяют на моноклональные антитела, чтобы добиться прицельного воздействия на опухолевую ткань.
При дистанционной лучевой терапии источник излучения находится на расстоянии от тела пациента, при этом на пути его прохождения могут лежать здоровые ткани, которые в процессе проведения терапии также подвергаются облучению, что приводит к развитию осложнений разной степени выраженности. Чтобы их минимизировать, разрабатываются различные технологии, позволяющие сконцентрировать максимальную дозу ионизирующего излучения непосредственно на в мишени (опухоли). С данной целью используются:
- Короткофокусная рентгенотерапия. При облучении используется рентгеновское излучение малой и средней мощности, которое способно проникать в ткани на глубину до 12 мм. Метод назван так из-за того, что источник располагается на коротком расстоянии от облучаемой поверхности. Таким способом лечат неглубокие опухоли кожи, вульвы, конъюнктивы и век, ротовой полости.
- Гамма-терапия. Этот вид излучения имеет большую проникающую способность, поэтому может использоваться для лечения более глубоко расположенных опухолей, нежели рентген-терапия. Однако сохраняющаяся большая нагрузка на окружающие органы и ткани приводят к ограничению возможности использования данного метода в современной онкологии.
- Фотонная терапия. Именно этим видом излучения проводится лучевое лечение большинства онкологических пациентов в современном мире. Достаточно высокая проникающая способность в сочетании с высокотехнологичными способами подведения дозы (IMRT и VMAT), достаточно совершенные системы планирования позволяют очень эффективно использовать этот вид излучения для лечения пациентов с приемлемыми показателями токсичности.
- Применение корпускулярного излучения (электроны, протоны, нейтроны). Эти элементарные ядерные частицы получают на циклотронах или линейных ускорителях. Электронное излучение используют для лечения неглубоких опухолей. Большие надежды возлагаются на протонную терапию, с помощью которой можно максимально прицельно подводить высокие дозы излучения к глубоко расположенным опухолям при минимальном повреждении здоровых тканей за счет выделения радиационной дозы на определённом отрезке пробега частиц, однако пока эти виды излучения играют сравнительно небольшую роль в лечении онкологических заболевания из-за своей высокой стоимости и ряда не до конца решённых технологических аспектов реализации метода.
Этапы лучевой терапии
Весь процесс проведения лучевой терапии делят на три этапа:
- Предлучевая подготовка (КТ-симуляция), этап выбора объёмов облучения и критических структур, этап дозиметрического планирования, верификации плана лучевой терапии.
- Этап облучения.
- Постлучевой этап.
Как правило, этап планирования занимает несколько дней. В это время проводятся дополнительные исследования, которые призваны дать возможность врачу более точно оценить границы опухоли, а также состояние окружающих ее тканей. Это может повлиять на выбор вида лучевой терапии, режима фракционирования, разовой и суммарной очаговых доз. Основой же данного этапа является выполнение так называемой КТ-симуляции, то есть компьютерной томографии необходимого объёма с определёнными параметрами и в определённом положении тела пациента. Во время КТ-симуляции на кожу пациента и/или его индивидуальные фиксирующие устройства наносятся специальные метки, призванные помочь правильно укладывать пациента в дальнейшем, а также облегчить задачу навигации по время проведения сеансов облучения.
Затем врач-радиотерапевт рисует объёмы облучения и критических структур (тех, на которые будет предписано ограничение дозы) на полученных срезах КТ с учётом данных других диагностических модальностей (МРТ, ПЭТ). Далее формируется задача для медицинского физика, включающая определение доз, которые должны быть подведены к мишени, мишеням или отдельным её частям, а также тех, которые не должны быть превышены в объёмах здоровых органов и тканей. Медицинский физик разрабатывает дозиметрический план в соответствии с заданными параметрами, при соблюдении которых и успешной верификации данного плана на фантоме, можно считать пациента готовым к лучевой терапии.
На этапе подготовки к лучевой терапии пациенту рекомендуется придерживаться нескольких правил:
- Отказаться от средств, раздражающих кожу.
- Если на коже в месте воздействия имеются повреждения или элементы сыпи, следует проконсультироваться с врачом.
- Если предполагается лучевая терапия в челюстно-лицевой области, требуется санация полости рта.
- Воздержаться от загара.
- Главное правило на любом этапе: обсудить все нюансы предстоящих подготовки и лечения с лечащим врачом-радиотерапевтом и строго придерживаться полученных рекомендаций!
Проведение этапа облучения будет зависеть от выбранного метода лучевой терапии.
Проведение дистанционной лучевой терапии
Продолжительность курса дистанционной лучевой терапии зависит от выбранного режима фракционирования, а также цели лечения. Паллиативные курсы, как правило, короче неоадъювантных и адъювантных, а те, в свою очередь, менее продолжительны, чем радикальные. Однако подведение радикальной дозы возможно и за один-несколько сеансов в зависимости от клинической ситуации. В таком случае курс дистанционной лучевой терапии называется стереотаксической радиотерапией или радиохирургией. Варьирует и кратность сеансов в день и в неделю: чаще всего используются схемы с пятью сеансами в неделю, однако могут быть предложены и 2-3 сеанса в день (гиперфракционирование) и схемы с 1-4 и 6 сеансами в неделю.
Во время облучения пациент в подавляющем большинстве случаев располагается лежа на столе специальной установки. Крайне необходимо соблюдать полную неподвижность во время сеанса облучения. Для достижения этого могут использоваться специальные фиксирующие устройства и системы иммобилизации.
Перед тем как включить установку, медперсонал покидает помещение, и дальнейшее наблюдение осуществляется через мониторы или окно. Общение с пациентом осуществляется по громкой связи. Во время выполнения сеанса, части аппарата и стол с пациентом совершают движения по заданной траектории. Это может создавать шум и беспокойство у больного. Однако бояться этого не стоит, поскольку вся процедура контролируется.
Сам сеанс лучевой терапии может длиться как 5-10, так и 60-120 минут, чаще — 15-30 минут. Само воздействие ионизирующего излучения не вызывает никаких физических ощущений. Однако в случае ухудшения самочувствия пациента во время сеанса (выраженной боли, судороги, приступа тошноты, паники), следует позвать медицинский персонал заранее оговоренным способом; установку сразу отключат и окажут необходимую помощь.
Контактная лучевая терапия (брахитерапия)
Брахитерапия проводится в несколько этапов:
- Введение в облучаемую зону неактивных проводников — устройств, в которые затем имплантируют источник ионизирующего излучения. При внутриполостной лучевой терапии используются приспособления, называемые эндостатами. Их устанавливают непосредственно в полость облучаемого органа и рядом с ним. При внутритканевой лучевой терапии используются интростаты, которые устанавливаются непосредственно в ткань опухоли по заранее просчитанной схеме. Для контроля их установки, как правило, используются рентгенологические снимки.
- Перемещение источника излучения из хранилища в интро- и эндостаты, которые будут облучать опухолевую ткань. Время облучения и особенности поведения пациента будут зависеть от вида брахитерапии и используемого оборудования. Например, при внутритканевой терапии, после установки источника ионизирующего излучения пациент может покинуть клинику и прийти на повторную процедуру через рекомендуемый промежуток времени. Весь этот период в его организме будет находиться интростат с радионуклидами, которые будут облучать опухоль.
Проведение внутриполостной брахитерапии будет зависеть от используемых установок, которые бывают двух типов:
- Установки низкой мощности дозы. В этом случае один сеанс облучения длится около 2-х суток. Под наркозом имплантируются эндостаты. После контроля правильности их установки и введения радионуклидов, пациент переводится в специальное помещение, где должен будет находиться все время, пока длится процедура, соблюдая строгий постельный режим. Разрешается только немного поворачиваться на бок. Вставать категорически запрещено.
- Установки высокой мощности дозы. Время облучения составляет несколько минут. Для установки эндостатов наркоза не требуется. Но во время процедуры все равно необходимо лежать абсолютно неподвижно. Внутриполостная лучевая терапия установкой высокой мощности проводится несколькими сеансами с интервалами от одного дня до одной недели.
При радионуклидной терапии пациент принимает радиофармпрепараты внутрь в виде жидкого раствора, капсул или инъекций. После этого он помещается в специальную палату, имеющую изолированную канализацию и вентиляцию. По истечении определенного срока, когда мощность дозы снизится до приемлемого уровня, проводится радиологический контроль, пациент принимает душ и переодевается в чистую одежду. Для контроля результатов лечения проводится сцинтиграфия, после чего можно покинуть клинику.
Лучевая терапия является серьезным стрессом для организма. У многих пациентов в этот период ухудшается самочувствие. Чтобы его минимизировать рекомендуется придерживаться следующих правил:
- Больше отдыхать. Минимизируйте физическую и интеллектуальную нагрузку. Ложитесь спать, когда почувствуете в этом необходимость, даже если она возникла в течение дня.
- Постарайтесь сбалансировано и полноценно питаться.
- Откажитесь на время проведения терапии от вредных привычек.
- Избегайте плотной обтягивающей одежды, которая бы могла травмировать кожу.
- Следите за состоянием кожи в месте облучения. Не трите и не расчесывайте ее, используйте средства гигиены, которые вам порекомендует врач.
- Защищайте кожу от воздействия солнечных лучей — используйте одежду и головные уборы с широкими полями.

Побочные эффекты лучевой терапии
Лучевая терапия, как и другие методы противоопухолевого лечения, вызывает ряд осложнений. Они могут быть общими или местными, острыми или хроническими.
Острые (ранние) побочные эффекты развиваются во время проведения радиотерапии и в ближайшие недели после неё, а поздние (хронические) лучевые повреждения — через несколько месяцев и даже лет после ее окончания.
Угнетенное эмоциональное состояние
Подавляющее большинство пациентов, проходящих лечение по поводу злокачественного новообразования, испытывают тревожность, страх, эмоциональное напряжение, тоску и даже депрессию. По мере улучшения общего состояния, эти симптомы стихают. Чтобы облегчить их, рекомендуется чаще общаться с близкими людьми, принимать участие в жизни окружающих. При необходимости рекомендуется обратиться к психологу.
Чувство усталости
Чувство усталости начинает нарастать через 2-3 недели от начала терапии. На это время рекомендуется оптимизировать свой режим дня, чтобы не подвергаться ненужным нагрузкам. В то же время нельзя полностью отстраняться от дел, чтобы не впасть в депрессию.
Изменение крови
При необходимости облучения больших зон, под воздействие радиации попадает костный мозг. Это в свою очередь приводит к снижению уровня форменных элементов крови и развитию анемии, повышению риска кровотечения и развития инфекций. Если изменения выражены сильно, может потребоваться перерыв в облучении. В ряде случаев могут назначать препараты, стимулирующие гемопоэз (кроветворение).
Снижение аппетита
Обычно лучевая терапия не приводит к развитию тошноты или рвоты, но снижение аппетита наблюдается довольно часто. Вместе с тем, для скорейшего выздоровления требуется полноценное высококалорийное питание с высоким содержанием белка.
Побочные реакции со стороны кожи
Вероятность развития кожных реакций и их интенсивность зависят от индивидуальных особенностей пациента. В большинстве случаев через 2-3 недели в области воздействия возникает покраснение. После окончания лечения оно сменяется пигментированием, напоминающим загар. Чтобы предотвратить чрезмерные реакции, могут назначаться специальные кремы и мази, которые наносятся после окончания сеанса. Перед началом следующего их необходимо смыть теплой водой. Если реакция выражена сильно, делают перерыв в лечении.
Реакции со стороны полости рта и горла
Если облучают область головы и шеи, могут развиться лучевой стоматит, который сопровождается болью, сухостью во рту, воспалением слизистых, а также ксеростомия вследствие нарушения функции слюнных желез. В норме эти реакции проходят самостоятельно в течение месяца после окончания лучевой терапии. Ксеростомия может беспокоить пациента в течение года и более.
Осложнения со стороны молочной железы
При прохождении лучевой терапии по поводу рака молочной железы могут возникать следующие реакции и осложнения:
- Покраснение кожи груди.
- Отек груди.
- Боль.
- Изменение размера и формы железы из-за фиброза (в некоторых случаях эти изменения остаются на всю жизнь).
- Уменьшение объема движения в плечевом суставе.
- Отек руки на стороне поражения (лимфедема).
Побочное действие на органы грудной клетки
- Воспаление слизистой пищевода, которое приводит к нарушению глотания.
- Кашель.
- Образование мокроты.
- Одышка.
Последние симптомы могут свидетельствовать о развитии лучевого пневмонита, поэтому при их возникновении следует немедленно обратиться к вашему врачу.
Побочные реакции со стороны прямой кишки/петель кишечника
- Расстройство стула — диарея или наоборот, запоры.
- Боли.
- Кровянистые выделения из заднего прохода.
Побочные действия со стороны мочевого пузыря
- Учащенное болезненное мочеиспускание.
- Наличие примеси крови в моче иногда может быть настолько выраженным, что моча приобретает кроваво-красный цвет.
- Наличие патологических примесей в моче — кристаллы, хлопья, гнойное отделяемое, слизь.
- Уменьшение емкости мочевого пузыря.
- Недержание мочи.
- Развитие везиковагинальных или везикоректальных свищей.
Побочные эффекты при облучении опухолей забрюшинного пространства, печени, поджелудочной железы
- Тошнота и рвота.
- Ознобы после сеансов.
- Боли в эпигастрии.
Химиолучевая терапия
Лучевая терапия довольно редко проводится в качестве самостоятельного лечения. Чаще всего она сочетается с каким-либо другим видом лечения: хирургическим, а чаще всего — с лекарственным. Это может быть как вариант одновременной химиолучевой терапии, так и последовательной, а также варианты сочетания лучевой терапии с иммунотерапией, таргетной и гормональной терапии. Такие виды лечения могут иметь ощутимо более высокую противоопухолевую эффективность, однако необходимо тщательно оценить риски совместных побочных эффектов, поэтому принятие решения о любом объёме лечения с онкологической патологией должен принимать мультидисциплинарный онкологический консилиум.
Читайте также:

