Злокачественные опухоли у детей клинические рекомендации
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения 2017
Профессиональные ассоциации
- Российское общество детских онкологов
Оглавление
1. Краткая информация
Остеосаркома – первично злокачественная опухоль костей из примитивных мезенхимальных стволовых клеток, способных дифференцироваться в костную, хрящевую или фиброзную ткани.
- 3% от всех ЗНО
- 35-50% от всех злокачественных опухолей костей у детей
- 4 случая на 1 миллион детей и подростков
- 60% случаев в возрасте от 10 до 20 лет
- Преимущественно в препубертатном и пубертатном периодах
- Соотношение 1.3 -1.6 мальчиков к 1 девочке.
В 50% случаев в проекции коленного сустава:
- дистальные отделы бедренной кости,
- проксимальные отделы большеберцовой кости.
Третье место по частоте - поражение проксимального метадиафиза плечевой кости.
12-15% поражение аксиального скелета (таз, позвоночник)
C40.0 – Длинные кости верхней конечности, лопатка
C40.1 – Короткие кости верхней конечности
C40.2 – Длинные кости нижней конечности
C40.3 – Короткие кости нижней конечности
C41.2 – Позвоночный столб
C41.3 – Ребра, грудина, ключица
C41.4 – Кости таза, крестец, копчик
- Локализованный (местнораспространенный) вариант остеосаркомы 80% случаев
- Генерализованный (метастатический) вариант 20% случаев.
Гистологическая классификация
Центральная
Высокой степени злокачественности:
классическая: хондробластическая, фибробластическая, остеобластическая;
атипичные гистологические формы:
- остеобластическая остеосаркома – склерозирующий тип;
- эпителиойдная;
- остеобластома-подобная;
- хондробластома-подобная;
- подобная хондромиксойдной фиброме;
- подобная злокачественной фиброзной гистиоцитоме;
- гигантоклеточная.
Телеангиэктатическая остеосаркома
Мелкоклеточная остеосаркома
Низкой степени злокачественности:
- низкозлокачественная центральная;
- подобная фиброзной дисплазии;
- подобная десмопластической фиброме.
Поверхностная
- Низкой степени злокачественности: паростальная;
- Промежуточной степени злокачественности: периостальная;
- Высокой степени злокачественности: дифференцированная паростальная.
Интракортикальная
Гнотическая
Внескелетная: высокой и низкой степени злокачественности.
Вторичная (ассоциированная с болезнью Педжета, радиоиндуцированная): как правило высокой степени злокачественности.
TNM классификация от 2010 года
- болезненность в месте поражения,
- локальный отек тканей,
- нарушение функции в проекции пораженного сустава.
Редко при манифестации заболевания:
- лихорадка,
- снижение веса.
При метастатическом поражении легочной ткани возможна клиника пневмонии, плеврита.
2. Диагностика
- онкологический анамнез до манифестации заболевания,
- онкологические заболевания у родственников,
- анамнез травм и операций в зоне первичного очага,
- хронические заболевания опорно-двигательного аппарата.
Обратить внимание на изменения:
- сердечно-сосудистой, дыхательной, мочевыделительной систем,
- области первичного очага,
- регионарных лимфоузлов.
- Общий анализ крови с СОЭ.
- БАК: белок, билирубин, мочевина, креатинин, АСТ, АЛТ, ЛДГ, ЩФ, Na + , K+, Ca+, Cl - - для исключения тяжелых дисфункций.
- Общий анализ мочи, клиренс креатинина, анализ мочи по Нечипоренко.
- Коагулограмма.
Рентгенография области первичной опухоли в двух проекциях с масштабной разметкой:
- определения объема поражения,
- подбор эндопротеза (при необходимости).
КТ поражённого отдела скелета для более чёткой визуализации:
- кальциноза,
- периостального остеогенеза,
- корковой деструкции,
- вовлечения мягких тканей,
- 3D-реконструкции для планирования хирургического лечения.
МРТ первичного опухолевого очага со смежными суставами:
- оптимальное стадирование,
- определение поражения мышечных футляров.
Для исключения отдалённых метастазов:
- радиоизотопная диагностика (РИД) скелета;
- КТ органов грудной клетки.
УЗИ:
- мягких тканей области поражения;
- органов брюшной полости и забрюшинного пространства.
Трепан-биопсия опухоли для верификации.
Открытая инцизионная биопсия при невозможности верификации по трепан-биопсии.
Принципы биопсии:
1. Под КТ, УЗ-навигацией, рентгенографией;
2. Забор биопсийного материала с учетом планирования хирургического лечения;
3. Эксцизионная биопсия противопоказана, так как возможна опухолевая контаминация тканей;
4. Продольный разрез при открытой биопсии, впоследствии удаляемый вместе с опухолью;
5. При поражении позвоночника ограничиваться биопсией без ламинэктомии, при необходимости с декомпрессией спинного мозга;
6. После открытой биопсии - рентгенологический контроль области.
3. Лечение
Методы лечения остеосаркомы в последние 20 лет практически не менялись.
- цисплатин
- адриамицин
- метотрексат
- ифосфамид
- этопозид.
Локализованный вариант остеосаркомы 5-летняя:
- общая выживаемость (ОВ) 75%,
- бессобытийная выживаемость (БСВ) 62%.
Метастатическая остеосаркома 5-летняя:
- ОВ не превышает 35%,
- БСВ - 25%.
Лечение пациентов с локализованным вариантом остеосаркомы
Дозы препаратов:
- Р – цисплатин 120 мг/м 2 (разовая 60 мг/м 2 /день, в/в/кап за 24 часа)
- А – доксорубицин 90 мг/м 2 (разовая 45 мг/м 2 /день, в/в/кап за 24 часа)
- М – метотрексат 12 г/м 2 (в/в/кап за 4 часа)
- i – ифосфамид 12 г/м 2 (разовая 3 г/м 2 , в/в/кап за 4 часа)
- I – ифосфамид 14 г/м 2 (разовая 2,8 г/м 2 /день, в/в/кап за 6 часов) + месна в эквивалентной дозе + 20%
- G – гемцитабин 1000 мг/м 2 , в/в/кап за 2 часа, 1 и 8 дни курса
- D – доцетаксел 100 мг/м 2 , в/в/кап за 2 часа, 8 день курса
Продолжительность 35 дней.
- Р - цисплатин 120 мг/м 2 (разовая 60 мг/м 2 /день, в/в/кап за 24 часа), 1-2 дни
- А – доксорубицин 90 мг/м 2 (разовая 45 мг/м 2 /день, в/в/кап за 24 часа), 3-4 дни
- М - метотрексат 12 г/м 2 (в/в/кап за 4 часа), на 21 и 28 дни.Лейковорин с 24 часа по схеме.
i:
Продолжительность 35 дней.
- i – ифосфамид 12 г/м 2 (разовая 2,4 г/м 2 , в/в/кап за 4 часа), 1-5 дни + месна в эквивалентной дозе + 20%
Ai:
Продолжительность 21 день.
- А - доксорубицин 90 мг/м 2 (разовая 45 мг/м 2 /день, в/в/кап за 24 часа), 1-2 дни
- i – ифосфамид 9 г/м 2 (разовая 3 г/м 2 , в/в/кап за 4 часа), 1-3 дни перед доксорубицином + месна в эквивалентной дозе + 20%
iР:
Продолжительность 21 день.
- Р - цисплатин 100 мг/м 2 (разовая 50 мг/м 2 /день, в/в/кап за 24 часа), 1-2 дни
- i – ифосфамид 9 г/м 2 (разовая 3 г/м 2 , в/в/кап за 4 часа), 3-5 дни + месна по в эквивалентной дозе + 20% в последний день
GD:
Продолжительность к21 день.
- G – гемцитабин 1000 мг/м 2 , в/в/кап за 2 часа, 1 и 8 дни курса
- D – доцетаксел 100 мг/м 2 , в/в/кап за 2 часа, 8 день курса
Высокодозный ифосфамид:
- I – ифосфамид 14 г/м 2 (разовая 2,8 г/м 2 /день, в/в/кап за 6 часов) + месна в эквивалентной дозе + 20%
Лечение пациентов с метастатическим вариантом остеосаркомы
Дозы препаратов:
- Р – цисплатин 120 мг/м 2 (разовая 60 мг/м 2 /день, в/в/кап за 24 часа)
- А – доксорубицин 90 мг/м 2 (разовая 45 мг/м 2 /день, в/в/кап за 24 часа)
- М - метотрексат 12 г/м 2 (в/в/кап за 4 часа)
- I – ифосфамид 14 г/м 2 (разовая 2.8 г/м 2 /день, в/в/кап за 6 часов) + месна в эквивалентной дозе + 20%
- G – гемцитабин 1000 мг/м 2 , в/в/кап за 2 часа, 1 и 8 дни курса
- D – доцетаксел 100 мг/м 2 , в/в/кап за 2 часа, 8 день курса
- Z – золедроновая кислота 2,4 мг/м 2 , в/в/кап за 1 час, через 48-72 часа после адриамицина; суммарно до 4 введений (для пациентов старше 12 лет).
Продолжительность 35 дней.
- Р - цисплатин 120 мг/м 2 (разовая 60 мг/м 2 /день, в/в/кап за 24 часа), 1-2 дни
- А - доксорубицин 90 мг/м 2 (разовая 45 мг/м 2 /день, в/в/кап за 24 часа), 3-4 дни
- М - метотрексат 12 г/м 2 (в/в/кап за 4 часа), на 21 и 28 дни,лейковорин в/в с 24 часа по схеме.
GD:
Продолжительность 21 день.
- G – гемцитабин 1000 мг/м 2 , в/в/кап за 2 часа, 1 и 8 дни курса;
- D – доцетаксел 100 мг/м 2 , в/в/кап за 2 часа, 8 день курса
Высокодозный ифосфамид:
- I – ифосфамид 14 г/м 2 (разовая 2.8 г/м 2 /день, в/в/кап за 6 часов) + месна в эквивалентной дозе + 20%
Необходимый этап комбинированного лечения.
При отсутствии противопоказаний рекомендуется органосохраняющее лечение.
- рост опухоли на фоне ХТ
1. Вовлечение магистральных сосудов и нервов;
2. Местная инфекция и отдаленные хронические очаги инфекции;
3. Обширное вовлечение мышц, не позволяющее без ущерба для радикальности восстановить функции конечности и сформировать мышечный футляр вокруг эндопротеза.
Принципы органосохраняющих операций:
1. Широкая резекция кости в мышечно-фасциальном футляре;
2. Удаление блоком всех зон биопсий и других потенциально пораженных тканей;
3. Наложение турникета проксимальнее поражения;
4. Адекватная моторная реконструкция перемещением регионарных мышц;
5. Адекватное мягкотканое покрытие эндопротеза;
6. Морфология края резецированной кости после удаления в процессе операции.
Критерии Эннекинга для оценки края резекции при скелетно-мышечных опухолях с объемом диссекции:
- Интралезиональный край – внутри участка поражения
- Маргинальный - через псевдокапсулу или реактивную ткань
- Широкий - участок поражения с рубцом после биопсии, псевдокапсула и/или реактивная зона, неповрежденная часть нормальной ткани, окружающей опухолевые массы, удалены единым блоком
- Радикальный - полный анатомический компартмент с опухолью, удаленный единым блоком
Органоуносящая (калечащая) операция:
- при росте опухоли на фоне ПХТ,
- при невозможности выполнения органосохраняющей операции.
При билатеральных метастазах в легких удаление очагов проводят в 2 этапа.
4. Реабилитация
Следование основным принципам реабилитации:
1. Постепенное увеличение интенсивности упражнений;
2. Регулярность;
3. Восстановительная гимнастика для всего организма.
Периоды комплекса реабилитационных мероприятий
Ранний период:
- начало сразу после операции, после удаления дренажной системы, примерно на 2-3 сутки;
- упражнения с минимальной нагрузкой области вмешательства;
- использование аппаратов для пассивной разработки суставов;
- задача - добиться максимального объема движений без нагрузки на мышечные и костные структуры;
- постепенное увеличение угла сгибания и разгибания конечности.
Второй период:
- постепенное увеличение мышечной активности.
Третий период:
- увеличение мышечной массы.
При вмешательствах на нижних конечностях все этапы чередуются с занятиями ходьбой:
- с ходунками,
- на костылях,
- с палкой,
- без опоры.
5. Профилактика
6. Дополнительная информация, влияющая на течение и исход заболевания
Полный эффект (ПЭ):
- полная регрессия мягкотканного компонента опухоли,
- отсутствие или регрессия отдаленных метастазов,
- положительная динамика в виде исчезновения периостальной реакции,
- уменьшение остеолитических очагов по данным рентгенологического, КТ и МРТ исследований.
Частичный эффект (ЧЭ):
- редукция более 50% опухолевой массы по сравнению с первоначальным объемом.
Стабилизация заболевания (СЗ):
- сокращение менее 50% или увеличение не более 25% от первоначального объема.
Прогрессия заболевания (ПЗ):
- увеличение более 25% от первоначального объема или появление новых метастазов.
Клиническое течение опухолей СЖ во многом определяется локализацией, распространенностью и морфологическим строением. Среди доброкачественных новообразований у детей наиболее часто встречается плеоморфная аденома, развивающаяся в большинстве случаев в околоушной слюнной железе. Клинически опухоль, как правило, представляет собой безболезненное узловое образование плотно-эластической консистенции, не спаянное с кожей, подвижное при пальпации. Кожа над образованием обычно не изменена, нет признаков поражения ствола лицевого нерва или его ветвей. Опухоль характеризуется медленным клиническим течением и по данным различных авторов от первых признаков заболевания до установления правильного диагноза проходит от 1 до 18 мес.
Клиническое течение доброкачественных опухолей, локализующихся в глоточном отростке околоушной СЖ имеет свои особенности. Так снаружи опухоль не пальпируется, определяется лишь незначительная припухлость в околоушной области, а со стороны глоточной стенки выявляется деформация, которая может быть выражена различно, в зависимости от размеров образования. Рост опухоли практически всегда происходит в направлении ротовой полости, снаружи опухоль не распространяется, так как этому мешает нижняя челюсть.
При мукоэпидермоидном раке иногда отмечается инфильтрация кожи, ограничение смещаемости образования, редко - болезненность при пальпации. Явления пареза мимической мускулатуры у детей и подростков редки, в отличие от взрослых пациентов. Чаще дети жалуются на явления дискомфорта в околоушно-жевательной области.
Ацинозно-клеточный рак, цилиндрома имеют клиническую картину схожую с плеоморфной аденомой.
Злокачественные опухоли глоточного отростка околоушной слюнной железы, несмотря на медленное течение, довольно рано инфильтрируют слизистую глотки.
Следует отметить, что злокачественные опухоли СЖ в детском возрасте, в отличие от взрослых, характеризуются медленным ростом, крайне редко дают метастазы и при правильном лечении имеют хороший прогноз.
К наиболее частым клиническим проявлениям как доброкачественных, так и злокачественных опухолей СЖ у детей относится наличие пальпируемого безболезненного узлового образования в проекции пораженной железы плотно-эластической консистенции, не спаянного с кожей, подвижного при пальпации. Практически не наблюдаются такие симптомы, как парез мимической мускулатуры, инфильтрация кожи, описываемые у взрослых. Заболевание у детей характеризуется длительным, торпидным течением с крайне низкой потенцией к метастазированию и от обнаружения образования пациентом до его попадания в специализированное учреждение проходит в среднем 19 месяцев при доброкачественных процессах и 13 месяцев при злокачественных опухолях [1, 2, 3, 4].
Клиническое течение опухолей СЖ зависит от локализации, распространенности и морфологического вида. Как правило, развитие доброкачественных и даже злокачественных опухолей СЖ отличается довольно медленным клиническим течением. Новообразования могут быть расположены поверхностно или в глубоких отделах СЖ. Чаще других развиваются смешанные опухоли, преимущественно в околоушной СЖ, поражение всегда только с одной стороны. Опухоль безболезненна, относительно подвижна, кожа над ней не изменена, консистенция плотно-эластическая. В детском возрасте встречается мукоэпидермоидный рак, обладающий своеобразным клиническим течением. Опухоль в большей степени встречается у девочек и чаще поражает поднижнечелюстную, околоушную СЖ. В отличие от смешанных опухолей отмечается инфильтрация кожи, ограничение смещаемости, выраженная плотность новообразований, иногда болевой синдром. В ряде наблюдений опухоль достигает значительных размеров и обладает инфильтративным ростом. Особенность мукоэпидермоидных раков - выраженная тенденция к рецидивированию, несмотря на проведение радикальных операций. Ацинозноклеточные опухоли СЖ являются крайне редкими наблюдениями в детском возрасте. По клинике трудно дифференцировать этот вариант со смешанной опухолью, аденокарциномой или аденокистозной карциномой (цилиндрома), которые также редко встречаются у пациентов детского возраста. Аденокарцинома и цилиндрома чаще поражает малые СЖ. Выявляемость этих новообразований часто на ранних стадиях развития, так как пациенты обращают внимание, прежде всего на чувство дискомфорта в полости рта при приеме пищи и разговоре. Опухоли поднижнечелюстной СЖ обладают аналогичным клиническим течением, но в отличие от околоушной железы значительно чаще принимаются за воспалительные изменения, сиалоадениты и банальные лимфадениты. Знания о доброкачественных новообразованиях и неопухолевых процессах имеют большое значение, прежде всего с точки зрения дифференциальной диагностики со злокачественными поражениями СЖ.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГЕРМИНОГЕННЫЕ ОПУХОЛИ У ДЕТЕЙ
МКБ 10: C38.1/C48.0/C49.5/C52/C56/C62
Год утверждения (частота пересмотра): 2017 (пересмотр каждые 3 года)
- Российское общество детских онкологов (РОДО)
- опухоли крестцово-копчиковой области
ВОЗ - Всемирная Организация Здравоохранения
ДНК - дезоксирибонуклеиновая кислота
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
МТС - метастатическое поражение
CA 125 - раковый антиген 125
УЗИ - ультразвуковое исследование
ФСГ - фолликулостимулирующий гормон
ХГ - хорионический гонадотропин
AR - ген, ответственный за чувствительность клеток к мужским половым гормонам
BEP - bleomycin, etoposide, cisplatin - блеомицин, этопозид, цисплатин
COG - группа детских онкологов
FIGO - International Federation of Gynecology and Obstetrics - международное общество акушеров-гинекологов
GI - GIII - степень злокачественности незрелой тератомы
NANOG - ген полипотентности клеток
OCT 3/4 - ген полипотентности клеток
POG/CCG - Pediatric Oncology Group and Children's Cancer Group - детская онкологическая группа и детская группа по изучению рака
SIOP - международное общество детских онкологов
SRY - ген, расположенный на Y-хромосоме, ответственный за развитие организма по мужскому типу
TNM - международная классификация по стадированию злокачественных опухолей
Термины и определения
Безрецидивная выживаемость (БРВ) - от момента наступления ремиссии до момента возникновения рецидива.
Общая выживаемость (ОВ) - от начала лечения до окончания исследования или смерти больного.
Полихимиотерапия - схема введения нескольких химиопрепаратов, в которой учитывается доза, кратность, дни и способ введения цитостатика.
Прогрессирование - появление нового поражения и/или любой рост первичных поражений более, чем на 25%.
1. Краткая информация
Герминогенные опухоли - типичные новообразования детского возраста, обусловленные пороками развития первичной половой клетки, которая в процессе эмбриогенеза неправильно развивается или мигрирует. Герминогенные опухоли в зависимости от локализации процесса подразделяют на гонадные и внегонадные.
1.2 Этиология и патогенез
Примордиальные герминогенные клетки начинают пролиферировать по мере миграции из желточного мешка в эмбрион. В отличие от других клеток, примордиальные герминогенные клетки восстанавливают или сохраняют способность экспрессировать гены, связанные с полипотентностью, которые могут стать причиной злокачественного перерождения. Гены NANOG и OCT 3/4 являются важными факторами полипотентности и используются как чувствительные маркеры злокачественных герминативных клеток.
Правильная миграция примордиальных герминогенных клеток является критически важным условием выживания герминогенных клеток и формирования половых желез, в то время как неудачная миграция может стать причиной появления эктопических герминогенных клеток. Персистирование в организме эктопических герминогенных клеток может быть одним из возможных механизмов появления внегонадных герминогенных опухолей.
На рис. 1 представлено развитие половой клетки, которая в норме дает начало развития недифференцированным (мультипотентным) клеткам, формирующим в последующем эмбрион, и собственно половые клетки. При нарушении любого периода дифференцировки клеток возможно развитие герминогенной опухоли.
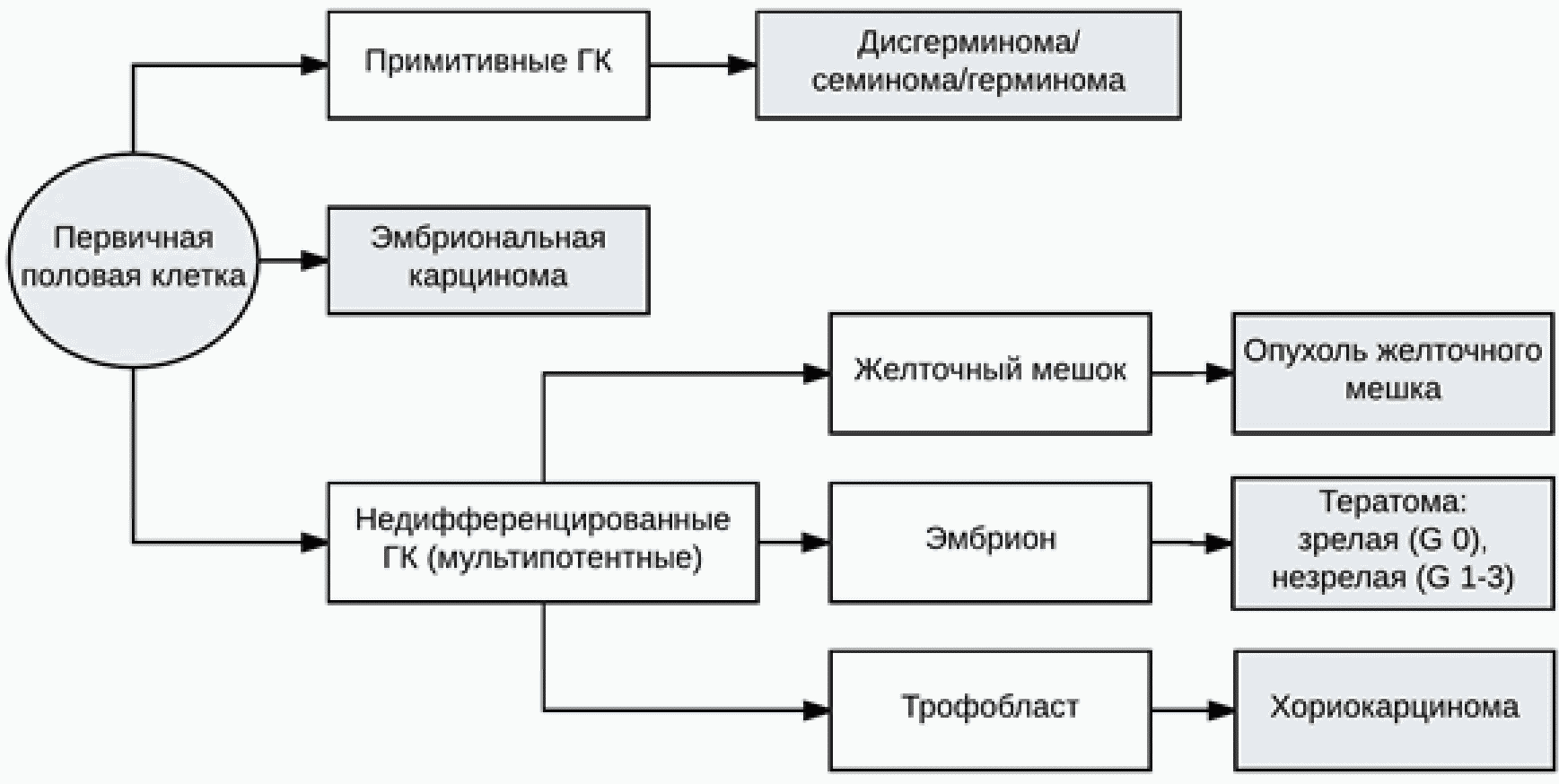
Рисунок 1 - Развитие половой клетки и формирование
Герминогенные опухоли чрезвычайно разнообразны по своему морфологическому строению, клиническому течению и прогнозу, могут быть как доброкачественными, так и злокачественными. Злокачественные герминогенные опухоли, по данным Rogers P.C. с соавторами, у детей (до 15 лет) составляют 3 - 4%.
Герминогенные опухоли составляют до 7% всех опухолей у детей и подростков до 20 лет: 2 - 4% у детей до 15 лет и около 14% у подростков от 15 до 19 лет. Вероятность заболеть у мальчиков-подростков до 20 лет выше, чем у девочек (12 против 11,1 на 1 млн. населения). Заболеваемость детей младшего возраста герминогенными опухолями внегонадной локализации выше, чем у подростков, у которых преобладают опухоли гонадной локализации.
Имеется два возрастных пика заболеваемости герминогенными опухолями: первый - до 2-х лет - преобладают опухоли крестцово-копчиковой области (74% составляют заболевших девочки) и второй - л8 - 12 лет - для девочек и 11 - 14 лет - для мальчиков, которых характеризуется наиболее частым поражением гонад.
Число диагностированных случаев герминогенных опухолей выросло с 3,4 на 1 млн. населения (до 15 лет) в 1975 - 1979 гг. до 5,1 в 1990 - 1995 гг. Особенно выражено увеличение заболеваемости в группе мужского населения с герминогенными опухолями яичка: заболеваемость выросла с 2 до 4,4 на 100 тыс. мужского населения.
Герминогенные опухоли обладают характерным генетическим маркером - наличием изохромосомы i (12p), которая появляется в результате потери длинного плеча и удвоения короткого плеча хромосомы 12p и определяется у большинства больных с герминогенными опухолями. Выявлены нарушения и в других хромосомах: увеличение материала в 1, 2, 7, 8, 9, а также потеря материала в хромосомах 1, 4, 5, 11, 16 и 18. Потеря материала хромосом 19 и 22 и увеличение на хромосомах 5, 6 и 13 наиболее характерно для несеминомных герминогенных опухолей. Таким образом, имеются гены или группы генов, участвующие в развитии определенных герминогенных опухолей.
Частота морфологических типов герминогенных опухолей определяется локализацией и возрастом ребенка (данные Pinkerton C.R., Dehner L.P, 2004.). Описаны герминогенные опухоли желудка, печени, почек (табл. 1).
Таблица 1 - Морфологические типы герминогенных опухолей в зависимости от локализации
Тератома: зрелая - 65%, незрелая - 5%, злокачественные 30% (чаще смешанные ГО и ОЖМ)
Зрелая тератома - 60%, смешанные ГО - 20%, ЭР - 20%
Зрелая, незрелая тератома, редко злокачественные ГО
Новорожденные грудные дети
Зрелая, незрелая тератома, редко злокачественные ГО
Тератома: зрелая - 65%, незрелая - 5%, ЗГО - 30%: дисгерминома, ОЖМ, ХК, смешанные ГО
Зрелая тератома - 20%, ЗГО - 80%: ОЖМ, ЭР, семинома, смешанные ГО
ЭР, герминома, зрелая тератома, ХК
ГО - герминогенная опухоль, ОЖМ - опухоль желточного мешка, ЭР - эмбриональный рак, ХК - хориокарцинома.
Морфологическая диагностика герминогенных опухолей сложна и определяется квалификацией патологоанатома, что особенно это важно при определении степени злокачественности тератомы. Разработана система определения степени злокачественности, основанная на определении нейроэпителиального компонента первичной опухоли и метастазов, включая глиальные имплантанты по брюшине и метастазы в лимфатических узлах. Степень злокачественности определяется в цифровых показателях от GI до GIII. Steeper T.A. и Mukai K. определяли процентное содержание нейроэпителия и в зависимости от этого выставляли степень злокачественности: до 10% - I, до 1/3 - II, до 50% и более - III. Учитывая степень злокачественности, определяли риски течения опухолевого процесса: GI - низкий риск, G II - III - высокий риск. Выживаемость пациентов в зависимости от степени злокачественности опухоли составила 81, 60 и 30% соответственно.
Впервые наличие глиальных имплантантов по брюшине при тератоидных опухолях было описано патологоанатомами Robboy S.J. и Scully R.E. в 1970 г. Глиоматоз брюшины - редкое явление, связанное, как правило, с тератомой яичника любой степени злокачественности. Первая теория происхождения глиоматоза брюшины генетически связана с тератомой яичника и поступлением ее содержимого через капсульные дефекты или лимфатические сосуды. По другой теории глиоматоз брюшины не связан генетически с тератомой и обусловлен метаплазией субмезотелиальных клеток в ответ на неблагоприятные эндогенные и экзогенные воздействия.
Злокачественная трансформация глиоматоза брюшины наблюдается, как правило, через 7 и более лет. В некоторых случаях данный диагноз ставиться после повторной лапаротомии и удаления рецидивирующей опухоли брюшной полости.
По данным исследования Международной группы по изучению рака у детей, наиболее часто незрелая тератома поражает яичники. У 30% больных с незрелой тератомой яичника установлено наличие глиоматоза брюшины.
O'Connor D.M. и Norris H.J. провели анализ влияния степени зрелости опухолевых клеток при I стадии незрелой тератомы яичника на прогноз заболевания. Ими было установлено, что большие размеры опухоли (более 1500 г) даже при I степени злокачественности клеток незрелой тератомы являются неблагоприятным прогностическим признаком. Norris H.J. с соавторами установили, что удаление незрелой тератомы яичника с III степенью злокачественности сопровождалось у 70% больных рецидивом заболевания.
Опухоль желточного мешка (опухоль эндодермального синуса [1], эмбриональный рак инфантильного типа, рак желточного мешка, опухоль Тейлума).
Термин "опухоль желточного мешка" был предложен N.J. Brown с соавторами, поскольку опухоль напоминает по строению желточный мешок на ранних стадиях эмбриогенеза.
Опухоли желточного мешка преобладают у детей младшего возраста. Наиболее часто опухоли имеют внегонадную локализацию: влагалище, крестцово-копчиковая область (10 - 20%). Встречается у новорожденных и детей до 10 лет, пик выявляемости - 1 - 4 года, средний возраст - 1,5 года. Однако это не исключает возможность выявления опухоли желточного мешка яичника у подростков. У детей старшего возраста при поражении гонад опухоль желточного мешка, как правило, является составляющей сложной герминогенной опухоли яичника, яичка и определяет, в большинстве случаев, прогноз заболевания. Установлено, что в половине случаев прогрессирования незрелой тератомы в составе первичной опухоли была обнаружена опухоль желточного мешка, которая и привела в последующем к прогрессированию опухолевого процесса.
Важным диагностическим маркером опухоли является выявление в сыворотке крови, а при пинеальной локализации в - спинномозговой жидкости, альфафетопротеина (АФП). Имеется корреляция между размерами опухоли и уровнем сывороточного АФП. После радикального удаления опухоли АФП нормализуется через 5 дней после операции. Если этого не происходит, то, возможно, опухоль была удалена не радикально или имеются метастазы.
Хориокарцинома яичника, не связанная с беременностью, чрезвычайно редкое заболевание. Данный вид опухолей может манифестировать клиническими признаками, обусловленными метастатическим поражением головного мозга, легких или разрывом опухоли с последующим кровотечением. Опухоль имеет тенденцию к широкому метастазированию: легкие - 100%, печень - 86%, головной мозг - 56%. Столь широкое и раннее метастазирование обусловлено действием хорионического гонадотропина. Чаще хориокарцинома является составляющей сложной герминогенной опухоли. Это облегчает диагностику заболевания, так как в данных случаях имеет место первичная хориокарцинома.
Смешанные герминогенные опухоли в структуре заболеваемости злокачественными герминогенными опухолями составляют 28,7%: наиболее часто определяются опухоль желточного мешка, эмбриональная карцинома, хориокарцинома. Полиэмбриома встречается только в составе смешанных герминогенных опухолей. Выявлен факт усложнения морфологического строения смешанных герминогенных опухолей яичников при увеличении возраста пациенток.
Частота экстренных оперативных вмешательств при герминогенных опухолях яичников составляет 24 - 30%. Подтвержден неблагоприятный прогноз течения заболевания при интраоперационном разрыве доброкачественной тератомы с последующей ее трансформацией и диссеминацией по брюшной полости. При отсутствии лечения в ближайшем послеоперационном периоде наступает диссеминация по брюшной полости, что сопровождается достоверно худшими результатами лечения больных с герминогенными опухолями яичников по сравнению с поражением забрюшинных и медиастенальных лимфатических узлов. Именно факт поражения брюшины после разрыва капсулы опухоли влияет на ухудшение результатов лечения пациентов с герминогенными опухолями яичников по сравнению с результатами лечения пациентов с опухолями яичка.
Наиболее часто экстренно оперируются больные с опухолью желточного мешка, эмбриональной карциномой. Основной причиной экстренных оперативных вмешательств являются перекрут ножки опухоли и разрыв капсулы опухоли. Установлено, что при дисгерминоме и незрелой тератоме яичников достоверно чаще бывает перекрут ножки опухоли по сравнению с разрывом капсулы опухоли. При опухоли желточного мешка, эмбриональной карциноме, смешанной герминогенной опухоли достоверно чаще бывает разрыв капсулы опухоли по сравнению с перекрутом ножки опухоли: 100%, 100%, 44% соответственно. Ранняя диагностика и своевременная операция позволяют предотвратить разрыв опухоли и улучшить прогноз заболевания.
Дисгерминома диагностируется в 32,8% случаев злокачественных герминогенных опухолей, имеет благоприятный прогноз, встречается реже, чем семинома при поражении яичка у мальчиков. Во 2 - 3 декадах жизни выявляется 80% всех дисгермином яичника, гораздо реже она встречается у детей до 10 лет. Дисгерминома составляет 20 - 30% злокачественных новообразований, обнаруженных во время беременности.
У 95% пациентов отмечается повышение лактатдегидрогеназы, могут повышаться щелочная фосфатаза и CA125. Дисгерминома редко протекает с повышением хирионического гонадотропина (ХГ) - при варианте опухоли с клетками синцитиотрофобласта.
У девочек при поражении гонад дисгерминомой чаще, чем у мальчиков с семиномой яичек, диагностируются пороки половой дифференцировки.
Герминогенные опухоли яичников и пороки развития
В группе пациентов с опухолями яичников отмечено наличие генетических заболеваний. Установлены определенные закономерности в сочетании пороков развития и морфологического строения опухоли. Герминогенные опухоли, особенно дисгерминома, часто сочетаются с пороками развития. Сочетание дисгерминомы и гонадобластомы (доброкачественной опухоли дисгенетичной гонады) - важный признак наличия порока половой дифференцировки. Опухоли желточного мешка и смешанные герминогенные опухоли также могут сочетаться с пороками развития. Гонадобластома и герминогенные опухоли яичников - основная группа опухолей, сочетающихся с пороками половой дифференцировки.
Ведущим синдромом, устанавливаемым у детей с пороками развития и опухолью яичников, является дисгенезия гонад. Генетическое обследование данной группы детей показало, что основной патологией является синдром Сваера и значительно реже определяется дисгенезия гонад с кариотипом 46 XX.
Определение уровня гормонов имеет большое диагностическое значение для подтверждения диагноза дисгенезии гонад. По этой причине при обследовании пациентов с опухолями яичников необходимы консультация генетика, как правило, с определением пола ребенка, а также определение уровня гормонов для подтверждения нарушения функции гонады. Большинство детей с опухолями гонад и пороками развития имеет синдромы, сопровождающиеся наличием Y-хромосомы: дисгенезия гонад, тестикулярная феминизация, синдром Шершевского-Тернера.
1.4 Кодирование по МКБ-10
C38.1 - Злокачественные новообразования переднего средостения
C48.0 - Злокачественные новообразования забрюшинного пространства
C49.5 - Злокачественные новообразования соединительной и мягких тканей таза
C52 - Злокачественные новообразования влагалища
C56 - Злокачественные новообразования яичника
C62 - Злокачественные новообразования яичка
1.5 Морфологическая классификация герминогенных опухолей
Морфологическая классификация герминогенных опухолей яичников (ВОЗ, 2003 г.):
- Опухоль желточного мешка (опухоль эндодермального синуса)
- Поливезикулярная вителлиновая опухоль
- Хориокарцинома, не связанная с беременностью
- Смешанная герминогенная опухоль
- Двухфазная и трехфазная тератомы
- Кистозная (дермоидная киста)
- Эмбрионоподобная тератома (гомункулюс)
- Монодермальная тератома и опухоли соматического типа, ассоциированные со зрелыми кистозными тератомами
Читайте также:

