Взаимодействие бензола с хлором в присутствии хлорида железа
Вот такое вот условие: Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
а)СН4 → С2Н2 → С6Н6 →
→ С6Н5ОН → 2,4,6-Трибромфенол
б)CH4→C2H6^с3н8^
→ С6Н14 → С6Н6 → Пикриновая кислота
Ну давай помогу)
а) Из метана при нагревании можно получит ацетилен: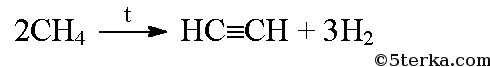
В присутствии катализатора ацетилен превращается в бензол (реакция тримеризации):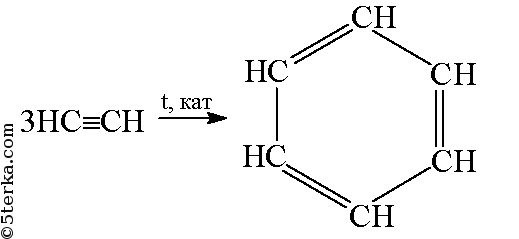
Фенол из бензола можно получить в две стадии. Бензол реагирует с хлором в присутствии хлорида железа, при этом образуется хлорбензол: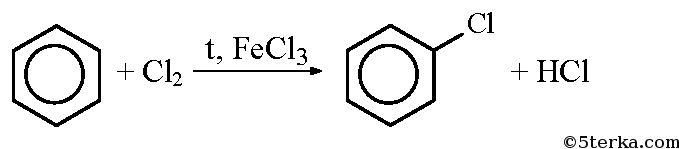
При действии на хлорбензол щелочи при высокой температуре происхо дит замещение атома хлора на гидроксильную группу и получается фенол: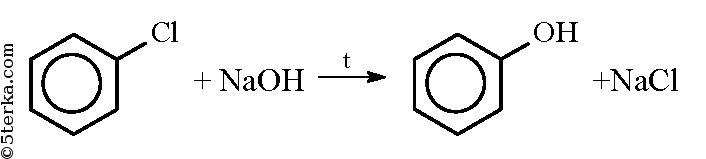
При действии на фенол брома образуется 2,4,6-трибромфенол: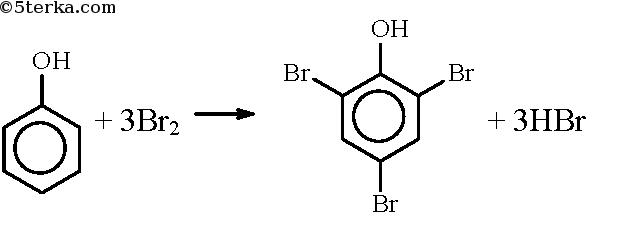
б) Этан из метана можно получить в две стации. При хлорировании метана образуется хлорметан. При хлорировании метана на свету образуется хлорметан: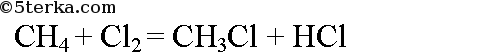
При взаимодействии хлорметана с натрием образуется этан (реакция Вюрца):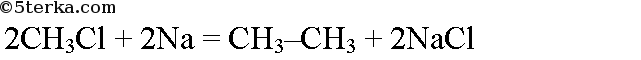
Пропан из этана также можно получить в две стадии. При хлорировании этана образуется хлорэтан: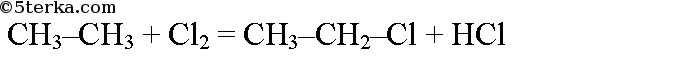
При реакции хлорэтана с хлорметаном в присутствии натрия образуется пропан: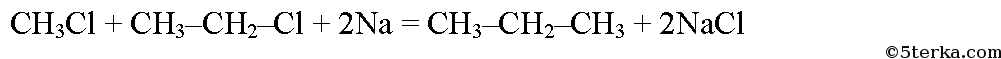
Из пропана в две стадии можно получить гексан. При хлорировании пропана образуется смесь изомеров - 1-хлорпропана и 2-хлорпропана. Изомеры имеют разные температуры кипения и их можно разделить перегонкой.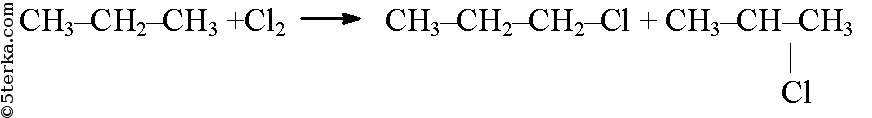
При взаимодействии 1-хлорпропана с натрием образуется гексан: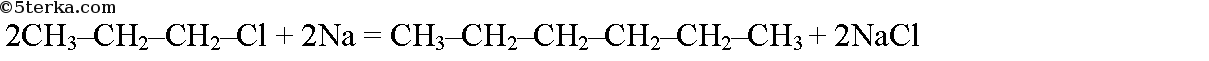
При дегидрировании гексана над катализатором образуется бензол: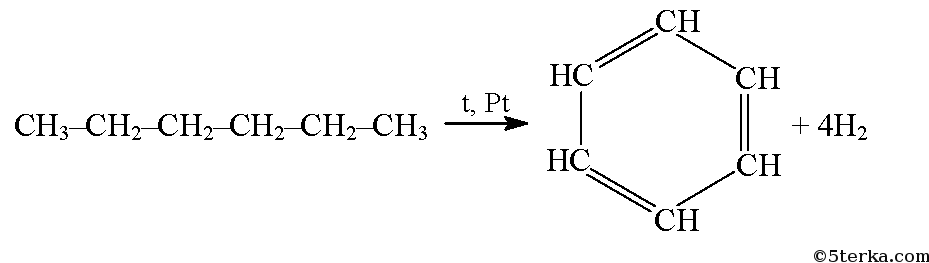
Из бензола можно в три стадии получить пикриновую кислоту (2,4,6-тринитрофенол). При реакции бензола с хлором в присутствии хлорида железа образуется хлорбензол: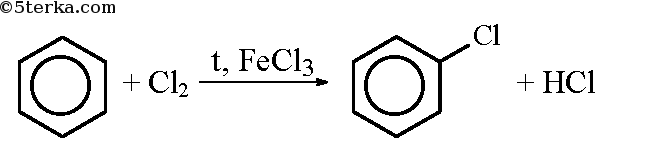
При действии на хлорбензол щелочи при высокой температуре происходит замещение атома хлора на гидроксильную группу и получается фенол: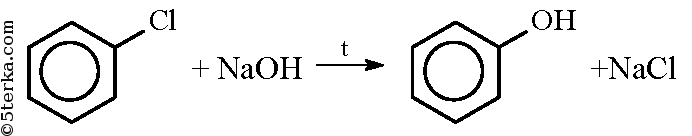
При реакции фенола со смесью азотной и серной кислот образуется пикриновая кислота (2,4,6-тринитрофенол): 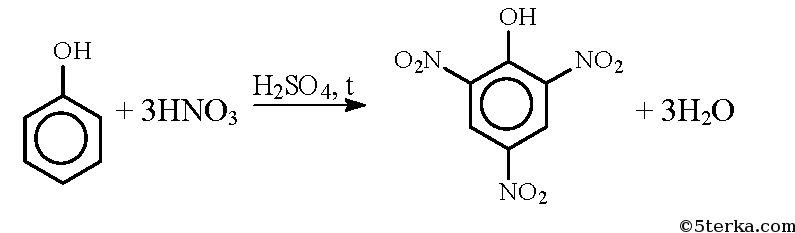
Химия | 10 - 11 классы
Продуктом взаимодействии бензола с хлором в присутствии хлорида железа.

Получится гексахлорбензол и соляная кислота.

Сколько граммов хлорида железа (3) можно получить при взаимодействии 5, 6 граммов железа с газообразным хлором?
Сколько граммов хлорида железа (3) можно получить при взаимодействии 5, 6 граммов железа с газообразным хлором.
Сколько молекул хлора при этом вступят в реакцию?

Вычислите массу хлорида железа образовавшуюся при взаимодействии 11, 2 литра хлора и железа?
Вычислите массу хлорида железа образовавшуюся при взаимодействии 11, 2 литра хлора и железа?

Сколько грамм хлорида железа (3) можно получить при взаимодействии 142 граммов хлора(2) с железом?
Сколько грамм хлорида железа (3) можно получить при взаимодействии 142 граммов хлора(2) с железом?

Какое количество хлорида железа 3 образуется при взаимодействии хлорида железа 2 с 142 г?
Какое количество хлорида железа 3 образуется при взаимодействии хлорида железа 2 с 142 г.

Выберите правильный ответ?
Выберите правильный ответ!
При взаимодействии бензола с бромом в присутствии катализатора хлорида железа (III) образуется : а)1, 2дибромбензол б)бромбензол в)бромциклогексан г)тодуол.

Определите объём хлора для реакции с 22?
Определите объём хлора для реакции с 22.
4 г железа, если продуктом реакции является хлорид железа.

При взаимодействии железа с хлором образуется хлорид железа (III), а при реакции железа с соляной кислотой получается хлорид железа(II)?
При взаимодействии железа с хлором образуется хлорид железа (III), а при реакции железа с соляной кислотой получается хлорид железа(II).

Составьте уравнение реакции взаимодействия железа с хлором и вычислите массу и количество вещества железа, необходимого для получения 42, 6 хлорида железа уравнение реакции взаимодействия железа с хло?
Составьте уравнение реакции взаимодействия железа с хлором и вычислите массу и количество вещества железа, необходимого для получения 42, 6 хлорида железа уравнение реакции взаимодействия железа с хлором (Cl2) и вычислите массу и количество вещества железа, необходимого для получения 42, 6 хлорида железа (FeCl3).

Взаимодействие бензола с хлором?
Взаимодействие бензола с хлором.

Хлорирование бензола в присутствии хлорида железа(3) в недостатке хлора?
Хлорирование бензола в присутствии хлорида железа(3) в недостатке хлора.
На этой странице сайта, в категории Химия размещен ответ на вопрос Продуктом взаимодействии бензола с хлором в присутствии хлорида железа?. По уровню сложности вопрос рассчитан на учащихся 10 - 11 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.

3 л х C3H8 + 5O2 = 3CO2 + 4H2O 1 моль 5 моль По уравнению реакции кислорода расходуется в 5 раз больше, чем вступает в реакцию пропана. Отсюда V(O2) = 5 * V(C3H8) V(O2) = 5 * 3 = 15 л.

Решение в приложенном файле, ацетилен (в - во Х).

Конечно у каждой медали 2 стороны И в химии плюсы и минусы. Например : Огромный плюс в том, что благодаря химии у нас есть лекарства, различные лаки (для волос, ногтей) , виды топлива, краски, строительные материалы Минусы : химические заводы на кот..

Q = 24. 305 * 4. 2 * 100 / 20 * 0. 833 Q = 612. 7 = 613кДж / моль.

Найди общую массу : 60 + 60 = 120г теперь найди массовую долю сахара : 60 / 120 = 1 / 2 или 0, 5.

Be + 2KOH + 2H2O = K2(Be(OH)4) + H2 Be - 2e = Be2 + 2 1 востановитель 2H + + 2e = H2 2 1 окислитель.

Формула кислоты - Формула ангидрида (кислотного оксида) H2SO4 - SO3 H2SO3 - SO2 H2CO3 - CO2 H2SIO3 - SiO2 HMnO4 - Mn2O7 H3BO3 - B2O3.

FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl около гидроксида железа поставьте стрелочку вниз, он нерастворим и выпадает в осадок.

При определённых условиях алкены взаимодействуют с : Водородом (катализатор - платина или никель, температура = 150 градусов). Водой ( катализатор - серная кислота или ортофосфорная. Нагревание) Кислородом (Нагревание). Со всеми остальными веществ..

2Ag + H2SO4 = Ag2SO4 + H2 Ag(0) - 1e = Ag( + 1) восстановитель h( + 1) + 2e = H2(0) окислитель.
Формула – С6Н6 (структурная формула – рис. 1). Молекулярная масса – 78, 11.
Рис. 1. Структурные и пространственная формулы бензола.
Все шесть атомов углерода в молекуле бензола находятся в sp 2 гибридном состоянии. Каждый атом углерода образует 3σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (σ-скелет молекулы бензола). Каждый атом углерода имеет одну негибридизованную р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое π-электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленного цикла. Углеводородный радикал, полученный от бензола носит название C6H5 – — фенил (Ph-).
Химические свойства бензола
Для бензола характерны реакции замещения, протекающие по электрофильному механизму:
— галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl3, FeCl3, AlBr3)
— нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот)
— алкилирование по Фридею-Крафтсу
Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
— гидрирование (реакция протекает при нагревании, катализатор – Pt)
— присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6)
Как и любое органическое соединение бензол вступает в реакцию горения с образованием в качестве продуктов реакции углекислого газа и воды (горит коптящим пламенем):
Физические свойства бензола
Бензол – жидкость без цвета, но обладающая специфическим резким запахом. Образует с водой азеотропную смесь, хорошо смешивается с эфирами, бензином и различными органическими растворителями. Температура кипения – 80,1
С, плавления – 5,5
С. Токсичен, канцероген (т.е. способствует развитию онкологических заболеваний).
Получение и применение бензола
Основные способы получения бензола:
— дегидроциклизация гексана (катализаторы – Pt, Cr3O2)
— дегидрирование циклогексана (реакция протекает при нагревании, катализатор – Pt)
— тримеризация ацетилена (реакция протекает при нагревании до 600
С, катализатор – активированный уголь)
Бензол служит сырьем для производства гомологов (этилбензола, кумола), циклогексана, нитробензола, хлорбензола и др. веществ. Ранее бензол использовали в качестве присадки к бензину для повышения его октанового числа, однако, сейчас, в связи с его высокой токсичностью содержание бензола в топливе строго нормируется. Иногда бензол используют в качестве растворителя.
Примеры решения задач
| Задание | Запишите уравнения, с помощью которых можно осуществить следующие превращения: CH4 → C2H2 → C6H6 → C6H5Cl. |
| Решение | Для получения ацетилена из метана используют следующую реакцию: |
2CH4 → C2H2 + 3Н2↑ (t 
= 1400
C).
Получение бензола из ацетилена возможно по реакции тримеризации ацетилена, протекающей при нагревании (t 
= 600
C) и в присутствии активированного угля:
Реакция хлорирования бензола с получением в качестве продукта хлорбензола осуществляется в присутствии хлорида железа (III):
| Задание | К 39 г бензола в присутствии хлорида железа (III) добавили 1 моль бромной воды. Какое количество вещества и сколько граммов каких продуктов при этом получилось? |
| Решение | Запишем уравнение реакции бромирования бензола в присутствии хлорида железа (III): |
Продуктами реакции являются бромбензол и бромоводород. Молярная масса бензола, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 78 г/моль. Найдем количество вещества бензола:
По условию задачи бензол вступил в реакцию с 1 моль брома. Следовательно, бензол находится в недостатке и дальнейшие расчеты будем производить по бензолу. Согласно уравнению реакции n(C6H6): n(C6H5Br) : n(HBr) = 1:1:1, следовательно n(C6H6) = n(C6H5Br) = : n(HBr) = 0,5 моль. Тогда, массы бромбензола и бромоводорода будут равны:
Молярные массы бромбензола и бромоводорода, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 157 и 81 г/моль, соответственно.
- Строение, номенклатура, изомерия
- Способы получения
- Химические свойства
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
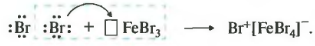
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
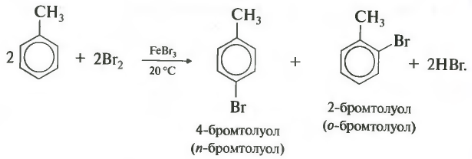
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
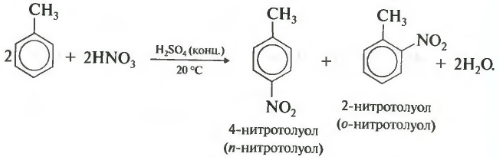
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
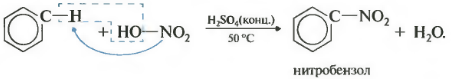
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.
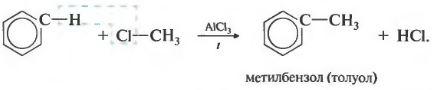
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.
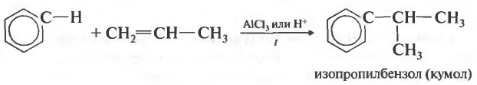
Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
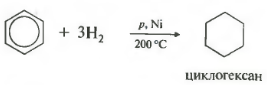
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
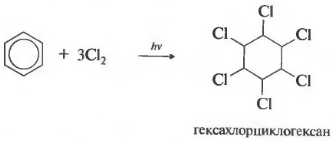
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
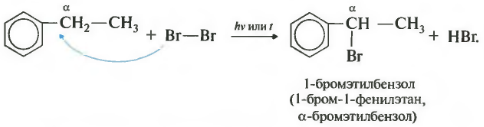
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
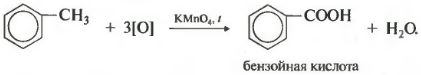
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
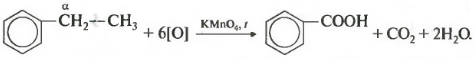
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
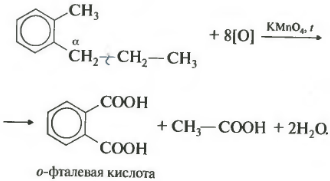
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
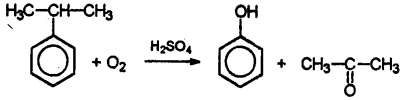
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.

По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
Из предложенного перечня выберите две схемы реакций, которые соответствуют реакциям соединения и замещения.
- $ZnO + H_2O →$ и $Zn + CuCl_2 →$
- $ZnO + Na_2O →$ и $Zn + NiCl_2 →$
- $ZnO + _2HNO_3 →$ …
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести взаимодействие метанола с калием.
- реакция нейтрализации
- окислительно-восстановительная реакц…
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести взаимодействие меди с раствором хлорида железа(III).
- необратимая
- каталитическая
- обратимая
- ге…
Из предложенного перечня выберите два типа химических реакций, к которым нельзя отнести взаимодействие гидроксида натрия с соляной кислотой.
- необратимая
- обратимая
- экзотермическая …
Из предложенного перечня химических реакций выберите две, которые можно отнести к каталитическим реакциям.
- угарный газ и водород
- азот и водород
- сера и кислород
- азот и литий
- бром и…
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести образование бромбензола при взаимодействии бензола с бромом.
- каталитическая реакция
- гомогенн…
Из предложенного перечня типов химических реакций выберите два типа реакций, к которым можно отнести взаимодействие брома с бензолом в присутствии хлорного железа.
- обратимая реакц…
Из предложенного перечня типов химических реакций выберите два типа реакций, к которым можно отнести взаимодействие карбоновой кислоты со спиртом в присутствии серной кислоты.
Из предложенного перечня типов химических реакций выберите два типа реакций, к которым можно отнести взаимодействие раствора хлорида меди(II) с порошком цинка при комнатной темпера…
Из предложенного перечня типов химических реакций выберите два типа реакций, к которым можно отнести взаимодействие хлора с метаном.
- реакция соединения
- эндотермическая реакция
- реа…
Из предложенного перечня типов химических реакций выберите два типа реакций, к которым можно отнести взаимодействие воды с ацетиленом.
- необратимая
- каталитическая
- обмена
- замещения …
Из предложенного перечня выберите два вещества, взаимодействие которых с водородом относится к реакциям гидрирования.
- кислород
- фтор
- олеиновая кислота
- ацетилен
- оксид свинца(II)
По радикальному механизму взаимодействуют
- циклогексан и хлор
- пропилен и вода
- пропилен и бромоводород
- пропилен и йод
- этан и азотная кислота
Запишите в поле ответа номера двух выбр…
Из предложенного перечня химических реакций выберите две реакции, которые можно отнести к эндотермическим реакциям.
- горение углерода
- образование аммиака
- взаимодействие сернистого …
Из предложенного перечня химических реакций выберите две реакции, которые не относятся к реакциям ионного обмена.
Из предложенного перечня типов химических реакций выберите два типа реакций, к которым можно отнести реакцию получения аммиака в промышленности.
- необратимая
- каталитическая
- обратим…
Установите соответствие между продуктами реакции и веществами, которые использовались для их получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, об…
Установите соответствие между исходными веществами и продуктами, которые преимущественно образуются при их взаимодействии с водородом: к каждой позиции, обозначенной буквой, подбер…
Установите соответствие между исходным веществом и продуктом(-ами), который(-е) преимущественно образуется(-ются) при их восстановлении: к каждой позиции, обозначенной буквой, подб…
Установите соответствие между исходным веществом и продуктами, которые преимущественно образуются при его гидролизе: к каждой позиции, обозначенной буквой, подберите соответствующу…
Соответствие чего будет определять экзаменуемый? Это зависит от варианта задания 19 ЕГЭ по химии: соответствие между реагирующей парой веществ и углеродсодержащим продуктом, который образуется в результате реакции или органическими продуктами их взаимодействия.
Задание 19 ЕГЭ по химии требует краткого ответа: ученик запишет его в специальную мини-таблицу в экзаменационном бланке, размещая цифровые значения напротив соответствующих букв.
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом (табл.1). Все они практически не смешиваются с водой, однако являются хорошими растворителями органических веществ.
Таблица 1. Физические свойства некоторых аренов
| Название | Тплавл., о С | Ткип., о С |
| Бензол | 5,5 | |
| Толуол | -95 | |
| Этилбензол | -94 | |
| о-Ксилол | -25 | |
| м-Ксилол | -47 | |
| п-Ксилол | ||
| Пропилбензол | -99 | |
| Изопропилбензол | -96 | |
| Стирол | -31 | |
| Фенилацетилен | -45 |
Многие ароматические углеводороды токсичны, причем вредны не только сами жидкости, но и их пары. Поэтому при работе с ними необходимо соблюдать особую осторожность. Разумеется, для нагревания аренов, как и других органических веществ, нельзя пользоваться открытым пламенем, так как они легко могут вспыхнуть. Их нагревают с помощью плиток или колбонагревателей с закрытой спиралью.
ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА
РЕАКЦИИ ЗАМЕЩЕНИЯ
Для бензола наиболее характерны реакции замещения атомов водорода ароматического ядра, в которых сохраняется устойчивая шести-p-электронная ароматическая система.
Реакции замещения протекают по ионному механизму (точнее, по механизму электрофильного замещения, см. приложение 1). Важнейшими примерами реакций замещения в ароматическом ряду являются галогенирование, нитрование и алкилирование бензола.
Замещение атома водорода в бензольном ядре на бром или хлор протекает в присутствии катализаторов – хлоридов алюминия и железа:
Реакция протекает под действием смеси концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
Алкилирование – это введение в молекулу алкильного радикала (-СН3, -С2Н5, -С3Н7 и др.), в результате чего образуются гомологи бензола.
Алкилирование бензола можно осуществить двумя путями. Во-первых, действием на бензол галогензамещенными алканами в присутствии катализаторов – галогенидов алюминия (алкилирование по Фриделю-Крафтсу):
Во-вторых, взаимодействием бензола с этиленовыми углеводородами в присутствии кислотных катализаторов (алкилирование алкенами):
При алкилировании бензола пропиленом образуется преимущественно изопропилбензол[1]:
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
В отдельных случаях бензол способен вступать в реакции присоединения.
Гидрирование бензола протекает при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd):
Аналогично протекает гидрирование и гомологов бензола, например:
Присоединение хлора происходит при действии солнечного света или ультрафиолетового излучения на раствор хлора в бензоле. Одновременно присоединяются сразу три молекулы хлора и образуется твердый продукт – гексахлорциклогексан:
ОКИСЛЕНИЕ
Бензол устойчив к окислению: он, в отличие от непредельных углеводородов, не обесцвечивает раствор перманганата калия. При поджигании бензол горит ярким коптящим пламенем:
Читайте также:

