Высокодифференцированный веретеноклеточный рак молочной железы
Апокриновый рак
При апокриновом раке более 90% опухолевой массы составляют клетки с признаками апокринизации.
Нужно отметить, что данная форма не имеет практического значения, а только теоретический интерес.
Апокриновый рак не имеет особенностей клинического течения и прогноза.
Частота выявления рака зависит от метода исследования. При использовании световой микроскопии колеблется в пределах 0,3-4%, при электронном микроскопическом исследовании — 0,4%. При использовании иммуногистохимического маркера анти-GCDFP-15 частота выявления составляет 12-72%.
Апокриновый рак может быть представлен двумя типами клеток: А и В. Клетки типа А — крупные, с выраженной монотонной эозинофильной цитоплазмой, их ядра крупные, светлые, похожие на клетки зернисто-клеточной опухоли.
Клетки типа В подобны клеткам гистиоцитарно-макрофагального происхождения и клеткам сального (sebaceous) рака. Отличие клеток от рака последнего типа заключается в отсутствии мелких светлых вакуолей липидов, цитоплазма апокринового рака монотонно светлая.
Представляет большой интерес иммунопрофиль апокринового рака. Позитивная реакция с антителом GCDFP-15 сочетается с отсутствием рецепторов эстрогена и прогестерона. Хотя ER мРНК в избытке содержится в ядрах опухолевых клеток, сам белок в большинстве случаев не продуцируется. Апокринный рак в 97% случаев имеет рецепторы андрогенов.
Метапластический рак
Метапластические карциномы составляют менее 1% всех инвазивных раков молочной железы (РМЖ). По имеющимся данным средний возраст больных 55 лет.
Клинические признаки данной опухоли не отличаются от инвазивной протоковой карциномы. В большинстве случаев отмечают хорошо отграниченную опухоль размером 3-4 см, однако существуют образования более 20 см, которые могут смещать сосок и изъязвлять кожу. На маммограмме большинство случаев рака метапластического типа выглядит в виде четко очерченного узла, иногда с микрокальцинатами.
Опухоль плотная на ощупь, хорошо отграничена от окружающей ткани. Зоны с плоскоклеточной или хондроидной дифференцировкой на поверхности разреза серого цвета, блестящие. В толще больших плоскоклеточных опухолей может находиться одна большая киста или несколько мелких (фото 80).

Фото 80. Внешний вид злокачественной листовидной опухоли, содержащей малигнизированный эпителиальный и стромальный компоненты
В зависимости от морфологического строения метаплacтические карциномы разделяют на подтипы: плоскоклеточный рак, аденокарпинома с веретеноклеточной метаплазией, аденосквамозная (железисто-плоскоклеточная) карцинома, смешанная эпителиально/мезенхимальная метапластическая карцинома, высокодифференцированная железисто-плоскоклеточная карцинома и другие.
Метапластическая плоскоклеточная карцинома молочной железы полностью построена из малигнизированного плоского эпителия с признаками ороговения или без них. Как и в других органах, плоскоклеточный рак может быть представлен веретенообразными клетками (фото 77, 78). Однако для установления диагноза необходимо исключить рак кожи или метастаз плоскоклеточного рака.

Фото 77. Метапластический рак. Видны очаги плоскоклеточной метаплазии с ороговением. Гематоксилин-эозин, х 100

Фото 78. Метапластический рак. Опухоль из веретенообразных клеток с очагами плоскоклеточной метаплазии. Гематоксилин-эозин, х 100
Плоскоклеточный рак молочной железы делят на фенотипы: крупноклеточный ороговевающий, неороговевающий, веретеноклеточный и акантотический. Возможны комбинации этих типов. Наиболее высокодифференцированные клетки часто ограничивают кистозные полости, в ходе распространения опухолевых клеток в окружающую строму эти клетки принимают всретеновидную форму и теряют черты, характерные для плоского эпителия.
В участках веретеноклеточной карциномы нередко отмечают пролиферацию стромальных клеточных элементов. Степень дифференцировки плоскоклеточной карциномы молочной железы зависит в основном от ядерной атипии.
При веретеноклеточном и акантотическом вариантах рака необходимо иммуногистохимическое подтверждение их эпителиальной природы. Эпителиальные опухолевые клетки дают позитивную реакцию с высокомолекулярными цитокератинами (СК5 и CK34betaE12), но негативную с маркерами сарком. Практически во всех метапластических карциномах молочной железы не выявляют рецепторов эстрогена и прогестерона (фото 77-79).
Аденокарцинома с веретеноклеточной метаплазией — это инвазивная карцинома с выраженной веретеноклеточной трансформацией (фото 79). Веретеновидныс клетки скорее всего образуются из железистого эпителия. Эту опухоль диагностируют главным образом у жен-шин в постменопаузальный период.

Фото 79. Метапластический рак. Опухоль из веретенообразных клеток. Гематоксилин-эозин, х 100
Опухоль состоит из тубулярных структур аденокарциномы, смешанных с опухолевыми веретеновидными клетками. Всретеновидные клетки имеют позитивную реакцию с эпителиальными маркерами, в том числе с цитокератином 7, но не с цитокератинами 5 и 6 или другими маркерами плоскоклеточной и миоэпителиальной дифференцировки.
Аденосквамозная (железисто-плоскоклеточная) карцинома — инвазивная карцинома с зонами хорошо развитых трубчато-железистых образований и широко распространенными солидными гнездами плоского эпителия.
Участки плоскоклеточной дифференцировки отмечали в 3,7% случаев инвазивной протоковой карциномы молочной железы, однако большая доля плоскоклеточной карциномы в опухолевой массе отмечается редко. Плоскоклеточный компонент, как правило, ороговевающий, однако зоны с выраженным ороговением могут соседствовать с участками неороговевающего рака.
Плоскоклеточный компонент дает отрицательную реакцию с антителами, выявляющими рецепторы эстрогена и прогестерона, в то время как протоковый компонент этих опухолей чаще позитивную.
Высокодифференцированная железисто-плоскоклеточная карцинома — это вариант метапластической карциномы, морфологическое строение которой похоже на аденосквамозную карциному кожи. Поэтому этот тип рака некоторые авторы классифицировали как сирингоматозную плоскоклеточную опухоль. Другие авторы обозначали ее как инфильтративную сирингоаденому с часто рецидивирующим после локального иссечения течением.
Возрастной диапазон заболевания широк. Опухоль, как правило, выявляют в виде небольшой пальпируемой массы размером от 5 до 80 мм.
Строма построена из бледных веретеновидных клеток. Стромальный компонент может содержать значительное количество коллагена, быть гиалинизированным, иметь клеточное строение, изредка выявляют фокусы хрящевой и костной ткани.
Высокодифференцированную железисто-плоскоклеточную карциному могут диагностировать в ассоциации с центральной склерозирующей пролиферацией (типа радиального рубца), склерозирующими папиллярными поражениями или склерозирующим аденозом.
Частота протоковой аденокарциномы in situ, ассоциированной с высокодифференцированной железисто-плоскоклеточной карциномой, вариабельна. Эти опухоли редко экспрессируют рецепторы эстрогена.
Аденосквамозный рак, как правило, имеет очень хороший прогноз, но в ряде случаев может давать рецидивы, что связано с неадекватностью локального иссечения. Метастатическое поражение лимфатических узлов отмечают редко.

Фото 81. Смешанная эпителиально-мезенхимальная опухоль с участком рабдоидной дифференцировки. Гематоксилин-эозин, х 100

Фото 82. Смешанная эпителиально-мезенхимальная опухоль, рабдоидная дифференцировка. Экспрессия Myogenina (клон F5D, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Отмечается позитивное окрашивание ядра опухолевых клеток, что характерно для РМЖ, х 200

Фото 83. Смешанная эпителиально-мезенхимальная опухоль, участок с остеогенной дифференцировкой. Гематоксилин-эозин, х 100

Фото 84. Карциносаркома молочной железы. Гематоксилин-эозин, х 100
Верстеноклеточные элементы часто экспрессируют цитокератины, хондроидные элементы белок S-100, однако могут отмечать коэкспрессию цитокератинов. Гладкомышечный актин в этих опухолях не выявляют. Как правило, рецепторы эстрогена и прогестерона как в участках аденокарциномы, так и мезенхимальной дифференцировки отсутствуют.
В случаях низкой дифференцировки карциносарком мезенхимальный компонент теряет любую иммунореактивность.
Дифференциальную диагностику между различными вариантами сарком и карциносаркомой проводят с помощью иммуногистохимических исследований.
Ангиосаркома по морфологическому строению похожа на веретеноклеточную плоскоклеточную карциному, однако наличие участков сквамозной дифференцировки облегчает диагностику. Наличие участков эпителиальной опухоли подтверждает негативная реакция с сосудистыми эндотелиальными маркерами (CD34, CD31) и позитивная — с цитокератинами.
Плоскоклеточную и железисто-плоскоклеточную карциному следует отличать от плеоморфной карциномы, для которой характерна смесь любого вида роста с большим количеством причудливых гигантских клеток; это важно, так как плеоморфная карцинома более агрессивна, чем любая разновидность плоскоклеточной или железисто-плоскоклеточной карциномы молочной железы.
Аденокарциному с хондроидной дифференцировкой нужно отличать от плеоморфной аденомы. Последняя неизменно имеет миоэпителиальный компонент (который иногда может доминировать), растущий вокруг пространств, ограниченных доброкачественными эпителиальными клетками. Миоэпителиальные клетки не определяют в аденокарциномах с хондроидной дифференцировкой.
Большинство известных метапластических карцином имели размер более 3-4 см. Метастазы в регионарных лимфатических узлах выявляли относительно редко. В подмышечные лимфатические узлы метастазируют приблизительно 10-15% опухоли с плоскоклеточной метаплазией, около 19-25% с костно-хрящевой. Отдаленные метастазы отмечены в 21 % случаев смешанной эпителиально-мезенхимальной метапластической карциномы.
Метапластические карциномы в лимфатических узлах сохраняют кроме участков рака и очаги метаплазии, как и в первичной опухоли.
Карциносаркомы очень агрессивные опухоли. При этом эпителиальный и мезенхимальный компоненты опухоли могут метастазировать как совместно, так и поодиночке.
5-летняя выживаемость больных карциносаркомами с костно-хряшевой дифференцировкой составляет 28-68%. Выживаемость больных с верстеноклеточной или плоскоклеточной карциномой составляет 5 лет в 63% случаев. Вовлечение лимфатических узлов в опухолевый процесс всегда связано с более агрессивным клиническим течением.
Среди плоскоклеточных карцином акантотический вариант является самым агрессивным.
На сегодня существует недостаточно информации об эффективности лечения метапластических карцином.
Л.М. Захарцева, М.В. Дятел, А.В. Григорук
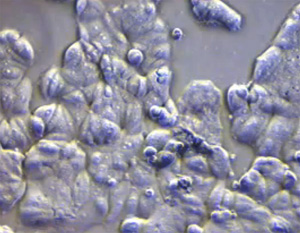
Веретеноклеточный и светлоклеточный протоковый рак in situ - это необычные варианты протокового рака молочной железы in situ. Некоторые из протоковых раков in situ содержат веретенообразные клетки, могут наблюдаться апокриновые, перстневидные, нейроэндокринные, светлые клетки, плоскоклеточная метаплазия.
Апокриновый протоковый рак in situ обычно высокозлокачественный, в большинстве случаев этот вариант дает отрицательные реакции на ER, PR и cerb-B2 и положительную реакцию на AR.
Веретеноклеточный и светлоклеточный протоковые раки in situ характеризуются умеренной степенью клеточной атипии и промежуточной злокачественностью.
Характеристика пролиферативных свойств внутрипротоковых пролиферативных нарушений
При использовании метода бромуридиновой метки значительных отличий между простой и атипической протоковой гиперплазией в пролиферации клеток не выявлено, однако показано увеличение фракции пролиферирующих клеток при внутрипротоковом раке.
Иммуногистохимческий маркер пролиферирующих клеток Ki-67 при высокозлокачественном протоковом раке in situ с наличием камедонекрозов достигает 13%, при низкозлокачественном варианте с фиброзными структурами - 4,5%, однако при микропапиллярном типе он находится на уровне 0%.
Плоидность
До 7% анеуплоидных клеток наблюдается при обычной протоковой гиперплазии, 13-36% - при атипичной гиперплазии и 30-72% - при протоковом раке in situ.
Экспрессия рецепторов гормонов
Эстроген играет центральную роль в регуляции роста и дифференцировки эпителия молочной железы. Его действие осуществляется через рецепторы эстрогена. Не менее важную роль в клетке имеют и рецепторы прогестерона. Присутствие двух рецепторов и их концентрация важны не только как клинический показатель потенциального терапевтического ответа, но и как прогностический маркер инвазивного рака.
В настоящее время эволюция ER во внутрипротоковых пролиферациях изучена сравнительно недостаточно. Известно, что 75% внутрипротоковых раков экспрессируют ER, а атипичная протоковая гиперплазия показывает высокий уровень экспрессии ER почти во всех клетках.
Дифференциальный диагноз
Солидный вариант низкозлокачественного протокового рака in situ следует отличать от дольковой неоплазии. Иммууногистохимическая экспрессия СК 1/5/ /10/14 (clone CK34BetaE12) в 92% протоковых раков отрицательная, а Е-кадгерина - в 100% положительная, при дольковой неоплазии наблюдаются обратные реакции.
Диагностической проблемой является и обнаружение микроинвазии, особенно индивидуальных опухолевых клеток и их мелких групп в плотном лимфоидном инфильтрате. Иммуногистохимическая окраска на эпителиальные и миоэпителиальные маркеры демаскирует беспорядочно лежащие в окружающей строме опухолевые клетки и отсутствие линии миоэпителиальных клеток, свидетельствующих о начале инвазивновного роста.
Генетические нарушения при внутрипротоковых пролиферациях
Большинство изученных соматических генных повреждений при предзлокачественных процессах молочной железы указывает на роль гена опухолевой супрессии р53 и онкогена cerb-B2, другими генами, также играющими определенную роль в канцерогенезе, являются c-myc, fes, c-met, ген опухолевой супрессии RB1.
CGH изучение протокового рака in situ показало большое число хромосомных повреждений: увеличение в 1q, 6q, 8q,17q, 19q, 20q и Xq и снижение в 8р, 13q, 16q, 17p, 22q.
Г.А.Галил-Оглы
"Веретеноклеточный и светлоклеточный протоковый рак in situ" и другие статьи из раздела Заболевания молочных желез
Веретеноклеточный и светлоклеточный протоковый рак in situ — это необычные варианты протокового рака молочной железы in situ. Некоторые из протоковых раков in situ содержат веретенообразные клетки, могут наблюдаться апокриновые, перстневидные, нейроэндокринные, светлые клетки, плоскоклеточная метаплазия.
Апокриновый протоковый рак in situ обычно высокозлокачественный, в большинстве случаев этот вариант дает отрицательные реакции на ER, PR и cerb-B2 и положительную реакцию на AR.
Веретеноклеточный и светлоклеточный протоковые раки in situ характеризуются умеренной степенью клеточной атипии и промежуточной злокачественностью.
Характеристика пролиферативных свойств внутрипротоковых пролиферативных нарушений
При использовании метода бромуридиновой метки значительных отличий между простой и атипической протоковой гиперплазией в пролиферации клеток не выявлено, однако показано увеличение фракции пролиферирующих клеток при внутрипротоковом раке.
Иммуногистохимческий маркер пролиферирующих клеток Ki-67 при высокозлокачественном протоковом раке in situ с наличием камедонекрозов достигает 13%, при низкозлокачественном варианте с фиброзными структурами — 4,5%, однако при микропапиллярном типе он находится на уровне 0%.
Плоидность
До 7% анеуплоидных клеток наблюдается при обычной протоковой гиперплазии, 13-36% — при атипичной гиперплазии и 30-72% — при протоковом раке in situ.
Экспрессия рецепторов гормонов
Эстроген играет центральную роль в регуляции роста и дифференцировки эпителия молочной железы. Его действие осуществляется через рецепторы эстрогена. Не менее важную роль в клетке имеют и рецепторы прогестерона. Присутствие двух рецепторов и их концентрация важны не только как клинический показатель потенциального терапевтического ответа, но и как прогностический маркер инвазивного рака.
В настоящее время эволюция ER во внутрипротоковых пролиферациях изучена сравнительно недостаточно. Известно, что 75% внутрипротоковых раков экспрессируют ER, а атипичная протоковая гиперплазия показывает высокий уровень экспрессии ER почти во всех клетках.
Дифференциальный диагноз
Солидный вариант низкозлокачественного протокового рака in situ следует отличать от дольковой неоплазии. Иммууногистохимическая экспрессия СК 1/5/ /10/14 (clone CK34BetaE12) в 92% протоковых раков отрицательная, а Е-кадгерина — в 100% положительная, при дольковой неоплазии наблюдаются обратные реакции.
Диагностической проблемой является и обнаружение микроинвазии, особенно индивидуальных опухолевых клеток и их мелких групп в плотном лимфоидном инфильтрате. Иммуногистохимическая окраска на эпителиальные и миоэпителиальные маркеры демаскирует беспорядочно лежащие в окружающей строме опухолевые клетки и отсутствие линии миоэпителиальных клеток, свидетельствующих о начале инвазивновного роста.
Генетические нарушения при внутрипротоковых пролиферациях
Большинство изученных соматических генных повреждений при предзлокачественных процессах молочной железы указывает на роль гена опухолевой супрессии р53 и онкогена cerb-B2, другими генами, также играющими определенную роль в канцерогенезе, являются c-myc, fes, c-met, ген опухолевой супрессии RB1.
CGH изучение протокового рака in situ показало большое число хромосомных повреждений: увеличение в 1q, 6q, 8q,17q, 19q, 20q и Xq и снижение в 8р, 13q, 16q, 17p, 22q.
Введение
Опухоль молочной железы — это избыточное и неконтролируемое организмом разрастание тканей (клеток) молочной железы. У собак встречаются: аденомы, фиброаденомы, протоковые папилломы и смешанные опухоли (фото 1). Синонимы: новообразование или неоплазия молочной железы.
Рак молочной железы — злокачественная опухоль из эпителиальной ткани молочной железы (фото 2). Описанные у собак злокачественные опухоли молочных желез: неинфильтрирующие карциномы (in situ), простые, комплексные и особые типы карцином, саркомы, карциносаркомы и другие. Синонимы: Низко/средне/высокодифференцированная аденокарцинома молочной железы, тубулярный рак молочной железы, папиллярный рак молочной железы.
Сокращения: ОМЖ — опухоль молочной железы; РМЖ — рак молочной железы; УЗИ — ультразвуковое исследование; КТ — компьютерная томография; МРТ — магнитно-резонансная томография.
- Каждый год диагностируют 198 новых случаев ОМЖ на каждые 100 000 самок собак в популяции;
- Частота встречаемости увеличивается с возрастом и варьируется в зависимости от породы, от 319 собак в год в группе риска (СГГР) до всего 5 СГГР у длинношерстных колли (Egenvall et al., 2005);
- В группу риска входят не стерилизованные самки 7-10 лет, а средний возраст появления ОМЖ составляет примерно 8 лет;
- Шансы появления опухоли молочных желез в 6 лет составляет — 1%, 8 лет — 6%, 10 лет — 13%;
- Примерно в 50% случаев опухоль молочных желез носит злокачественный характер и в половине из них отмечаются метастазы;
- Овариоэктомия (стерилизация) до первого эструса (течки) снижает вероятность появления ОМЖ до 0,5%, после второго эструса — до 8% (Schneider R., 1969);
- Ожирение в молодом возрасте и потребление несбалансированной домашней пищи связано с повышенным риском развития ОМЖ (Sonnenschein EG., 1991);
- Точных данных о породной предрасположенности нету, однако ряд авторов отмечает склонность к заболеванию некоторых крупных пород: английские спрингер-спаниели, британские сеттеры, британские спаниели, немецкие овчарки, пойнтеры, доберманы и боксеры;
- Кроме того существуют данные о тенденции к повышению риска развития опухолей молочных желез у собак мелких пород, таких как пудели, чихуа-хуа, спаниели, таксы, йоркширские терьеры и мальтезы.
Этиология и патогенез | Причины
Благодаря научным исследованиям было доказано, что опухоли молочных желез у собак развиваются постепенно, в несколько этапов — от предопухолевых поражений до инвазивных карцином. Этапы обычно подразделяют на аденоз, склерозирующий аденоз, внутрипротоковые папилломы, склерозирующие папилломы, протоковую гиперплазию и протоковую карциному in situ.
На развитие и прогрессирование опухолей молочных желез оказывают влияние женские половые гормоны – эстроген и прогестерон. Например, кастрация до 1-2-ух летнего возраста/первых трех течек – значительно снижает риск развития доброкачественных и злокачественных опухолей молочных желез в будущем. Повышение риска связано с увеличением числа половых циклов, прошедших у животного. У самцов изначально низкий уровень эстрогена/прогестерона в крови и как следствие, низкий риск развития рака молочных желез по сравнению с самками (не превышает 1%).
Нарушение в работе некоторых генов (чрезмерная экспрессия или мутация) может способствовать появлению опухоли молочных желез. Например, по данным Dutra и его коллег (2004) в 35,4% случаев раковая опухоль молочной железы имеет повышенную экспрессию гена c-erB-2/HER2 (эпидермальный фактор роста). В другом исследовании отмечалась мутация гена p53 (ген опухолевой супрессии/противоопухолевый ген) в 17% случаев рака молочных желез собак (Wakui S., 2001).
Нарушение экспрессии ряда белков (Е-кадгерин, коннексин, паксилин) и ферментов может способствовать прогрессированию опухолей молочных желез у собак. Например, доктор Dore с коллегами обнаружил повышенную экспрессию фермента ЦОГ-2 в 24% случаев доброкачественных новообразований молочных желез и 56% — злокачественных.
Введение
Опухоль молочной железы — это избыточное и неконтролируемое организмом разрастание тканей (клеток) молочной железы. У собак встречаются: аденомы, фиброаденомы, протоковые папилломы и смешанные опухоли (фото 1). Синонимы: новообразование или неоплазия молочной железы.
Рак молочной железы — злокачественная опухоль из эпителиальной ткани молочной железы (фото 2). Описанные у собак злокачественные опухоли молочных желез: неинфильтрирующие карциномы (in situ), простые, комплексные и особые типы карцином, саркомы, карциносаркомы и другие. Синонимы: Низко/средне/высокодифференцированная аденокарцинома молочной железы, тубулярный рак молочной железы, папиллярный рак молочной железы.
Сокращения: ОМЖ — опухоль молочной железы; РМЖ — рак молочной железы; УЗИ — ультразвуковое исследование; КТ — компьютерная томография; МРТ — магнитно-резонансная томография.
- Этиология и патогенез
- Постановка диагноза
- Классификация и стадии
- Тактика лечения и прогноз
- Советы по профилактике
- Частые вопросы
- Литература
- Каждый год диагностируют 198 новых случаев ОМЖ на каждые 100 000 самок собак в популяции;
- Частота встречаемости увеличивается с возрастом и варьируется в зависимости от породы, от 319 собак в год в группе риска (СГГР) до всего 5 СГГР у длинношерстных колли (Egenvall et al., 2005);
- В группу риска входят не стерилизованные самки 7-10 лет, а средний возраст появления ОМЖ составляет примерно 8 лет;
- Шансы появления опухоли молочных желез в 6 лет составляет — 1%, 8 лет — 6%, 10 лет — 13%;
- Примерно в 50% случаев опухоль молочных желез носит злокачественный характер и в половине из них отмечаются метастазы;
- Овариоэктомия (стерилизация) до первого эструса (течки) снижает вероятность появления ОМЖ до 0,5%, после второго эструса — до 8% (Schneider R., 1969);
- Ожирение в молодом возрасте и потребление несбалансированной домашней пищи связано с повышенным риском развития ОМЖ (Sonnenschein EG., 1991);
- Точных данных о породной предрасположенности нету, однако ряд авторов отмечает склонность к заболеванию некоторых крупных пород: английские спрингер-спаниели, британские сеттеры, британские спаниели, немецкие овчарки, пойнтеры, доберманы и боксеры;
- Кроме того существуют данные о тенденции к повышению риска развития опухолей молочных желез у собак мелких пород, таких как пудели, чихуа-хуа, спаниели, таксы, йоркширские терьеры и мальтезы.
Этиология и патогенез | Причины
Благодаря научным исследованиям было доказано, что опухоли молочных желез у собак развиваются постепенно, в несколько этапов — от предопухолевых поражений до инвазивных карцином. Этапы обычно подразделяют на аденоз, склерозирующий аденоз, внутрипротоковые папилломы, склерозирующие папилломы, протоковую гиперплазию и протоковую карциному in situ.
На развитие и прогрессирование опухолей молочных желез оказывают влияние женские половые гормоны – эстроген и прогестерон. Например, кастрация до 1-2-ух летнего возраста/первых трех течек – значительно снижает риск развития доброкачественных и злокачественных опухолей молочных желез в будущем. Повышение риска связано с увеличением числа половых циклов, прошедших у животного. У самцов изначально низкий уровень эстрогена/прогестерона в крови и как следствие, низкий риск развития рака молочных желез по сравнению с самками (не превышает 1%).
Нарушение в работе некоторых генов (чрезмерная экспрессия или мутация) может способствовать появлению опухоли молочных желез. Например, по данным Dutra и его коллег (2004) в 35,4% случаев раковая опухоль молочной железы имеет повышенную экспрессию гена c-erB-2/HER2 (эпидермальный фактор роста). В другом исследовании отмечалась мутация гена p53 (ген опухолевой супрессии/противоопухолевый ген) в 17% случаев рака молочных желез собак (Wakui S., 2001).
Нарушение экспрессии ряда белков (Е-кадгерин, коннексин, паксилин) и ферментов может способствовать прогрессированию опухолей молочных желез у собак. Например, доктор Dore с коллегами обнаружил повышенную экспрессию фермента ЦОГ-2 в 24% случаев доброкачественных новообразований молочных желез и 56% — злокачественных.

Злокачественные опухоли выглядят под микроскопом по-разному. В одних случаях они напоминают нормальную ткань, а в других сильно от неё отличаются. В зависимости от этого, патологоанатомы и врачи условно делят злокачественные новообразования на два типа:
- Высокодифференцированные опухоли сохраняют многие черты нормальных клеток и тканей. Они прорастают в соседние органы и метастазируют достаточно медленно.
- Низкодифференцированные опухоли содержат клетки и ткани, которые сильно отличаются от нормальных. Они ведут себя намного агрессивнее, быстрее распространяются по организму.
От степени дифференцировки рака зависит то, насколько быстро он способен распространяться по организму. А это, в свою очередь, напрямую влияет на прогноз для пациента. Кроме того, низкодифференцированные опухоли хуже реагируют на лучевую терапию и химиотерапию. Врач-онколог учитывает это, составляя программу лечения.

Какие бывают степени дифференцировки рака?
Показатель степени дифференцировки опухоли в онкологии принято обозначать латинской буквой G. Возможны пять вариантов:
- Gx — степень дифференцировки определить не удается.
- G1 — высокодифференцированные злокачественные новообразования.
- G2 — средняя степень дифференцировки.
- G3 — низкодифференцированные опухоли.
- G4 — недифференцированный рак. Опухолевые клетки утратили все внешние признаки и функции нормальных клеток. Они похожи друг на друга, как две капли воды, их единственными занятиями становятся рост и размножение.
Так выглядит общая схема, но для разных видов рака степень дифференцировки определяют по-разному. Например, во время осмотра под микроскопом опухолевой ткани из молочной железы учитывают наличие молочных канальцев, форму и размеры клеточных ядер, активность деления клеток. Каждый из трех признаков оценивают в баллах, затем подсчитывают их общее количество.
При раке простаты используют специальную систему Глисона. В ней предусмотрено 5 градаций, каждой из которых присвоено определенное количество баллов, в соответствии с нумерацией, от 1 до 5:
- В состав опухоли входят однородные железы, ядра клеток изменены в минимальной степени.
- В состав опухоли входят скопления желез, которые разделены перегородками из соединительной ткани, но расположены друг к другу ближе, чем в норме.
- В состав опухоли входят железы, имеющие разное строение и размеры, опухолевая ткань прорастает в перегородки из соединительной ткани и в соседние структуры.
- В состав опухоли входят клетки, которые сильно отличаются от нормальных. Опухоль прорастает в соседние ткани.
- Опухоль состоит из недифференцированных клеток.
Обычно рак простаты имеет неоднородное строение, поэтому врач должен выбрать из списка две градации, которые встречаются в большей части опухоли. Складывают баллы, по полученной цифре определяют степень дифференцировки.

Степень дифференцировки и стадия рака — это одно и то же?
Для описания злокачественной опухоли используют разные показатели. Деление в зависимости от степени дифференцировки — лишь одна из возможных классификаций.
Стадию рака определяют в зависимости от трех параметров, которые обозначают аббревиатурой TNM: насколько сильно опухоль проросла в соседние ткани, успела ли распространиться в лимфоузлы и дать метастазы.
Чем отличается лечение высокодифференцированного рака от низкодифференцированного?
Однозначно на этот вопрос ответить не получится, так как рак бывает очень разным. Для одних злокачественных опухолей (например, рак молочной железы, рак простаты) степень дифференцировки имеет особенно важное значение, в случаях с другими онкологическими заболеваниями данный показатель отходит на второй план.
В целом можно сказать, что низкодифференцированные опухоли более агрессивны и нуждаются в более агрессивном лечении.
Читайте также:

