Высокая радиочувствительность характерна для опухолей

Введение: Степень восприимчивости к излучению называют радиочувствительностью. Клетки, ткани, органы человека в разной степени чувствительны к облучению. Радиочувствительность тканей и клеток не является величиной постоянной, она меняется в зависимости от состояния организма и от действия внешних факторов, а также от уровня пролиферативной активности органов и тканей. Согласно заключению экспертов ВОЗ, успех лучевой терапии примерно на 50% зависит от радиочувствительности опухоли, на 25% от аппаратного оснащения, на 25% от выбора рационального плана лечения и точности его воспроизведения от сеанса к сеансу облучения[3].
Цель: разделение опухолей по степени восприимчивости к ионизирующему излучению; изучение факторов, от которых зависит радиочувствительность; рассмотрение всех способов радиомодификации.
С целью представления о радиочувствительности различных опухолей и тканей приведем таблицу 12.
Степень восприимчивости к ионизирующему излучению
Неходжкинская лимфома, лимфогранулематоз, лейкемия, семинома, мелкоклеточный рак легкого, опухоли головы и шеи, дисгерминома, опухоль Юинга
Кроветворная, лимфоидная ткань, сперматогенный эпителий, эпителий фолликулов яичников, эпителий ротоглотки, кожа
Опухоли молочной железы, немелкоклеточный рак легкого, аденокарцинома желудочно-кишечного тракта, рак шейки матки, рак предстательной железы
Железистый аппарат желудка, толстой кишки, молочной железы, эпителий слизистой тонкой кишки
Фибросаркома, остеогенная саркома, хондросаркома, рак почки, нейрогенные опухоли
Хрящевая, костная, мышечная, фиброзная ткани
Из данной таблицы следует, что наиболее чувствительны к облучению кроветворная, лимфоидная ткань, сперматогенный эпителий, эпителий фолликулов яичников, эпителий ротоглотки, кожа. Далее по степени радиочувствительности идут железистый аппарат желудка, толстой кишки, молочной железы, эпителий слизистой тонкой кишки хрящевая, костная, мышечная, фиброзная ткани. К радиочувствительным опухолям относят неходжкинская лимфома, лимфогранулематоз, лейкемия, семинома, мелкоклеточный рак легкого, опухоли головы и шеи, дисгерминома, опухоль Юинга. Промежуточной радиочувствительностью обладают опухоли молочной железы, немелкоклеточный рак легкого, аденокарцинома желудочно-кишечного тракта, рак шейки матки, рак предстательной железы. Резистентными являются фибросаркома, остеогенная саркома, хондросаркома, рак почки, нейрогенные опухоли. Несмотря на то, что в данной таблице отмечены железистый аппарат желудка, толстой кишки, эпителий слизистой тонкой кишки, обладающие промежуточной радиочувствительностью, при опухолях с локализацией в этих органах лучевую терапию применяют редко либо вовсе не применяют, так как опухоли данных локализаций подвижны из-за перистальтических движений желудка и кишечника[4]. А при раке печени не применяют лучевую терапию из-за низкой толерантности печени к ионизирующему излучению[5].
Радиочувствительность злокачественной опухоли к ионизирующему излучению определяется большим числом факторов: возрастом, состоянием больного, формой роста, гистологическим типом новообразования, состоянием тканей, окружающих опухоль, соотношением в опухоли клеточных и стромальных элементов, скоростью репопуляции клеток, степенью оксигенации тканей, наличием некротических участков и гипоксических клеток[3].
Рассмотрим некоторые факторы, влияющие на чувствительность опухолей:
- На чувствительность опухоли к излучению влияет степень дифференцировки клеток: чем менее дифференцированы клетки, тем выше радиочувствительность опухоли. Например, мелкоклеточный рак легкого намного чувствительный к облучению, чем плоскоклеточный рак или аденокарцинома этого же органа.
- Степень повреждающего действия зависит от фазы клеточного цикла, в которой находятся пролиферирующие клетки в момент облучения: наибольшей чувствительностью обладают клетки в фазе G2 и M, меньшей – находящиеся в фазах G1 и S.
- Чувствительность к излучению в значительной мере зависит от клеточного состава злокачественной опухоли.
Способы радиомодификации. Достижения в области радиобиологии – изучение прямого и косвенного действия радиации – привели к исследованию процессов радиомодификации.
Прежде чем перейти к способам радиомодификации необходимо знать некоторые понятия о радиомодификации: Радиомодификация – это целенаправленное изменение чувствительности тканей к облучению. Радиомодифицирующие агенты – это физические и химические факторы, с помощью которых эффективность лучевых воздействий может быть повышена путем усиления радиопоражаемости опухоли и ослабления лучевых реакций нормальных тканей. Радиосенсибилизация лучевого воздействия – это процесс, при котором различные способы приводят к увеличению поражения тканей под влиянием облучения. Радиопротекция - действия, направленные на снижение поражающего эффекта ионизирующего излучения. Соответственно радиопротекторы – это вещества, снижающие радиочувствительность.
На основании выше сказанного способы радиомодификации можно разделить на две большие группы. Первая группа это способы, повышающие радиочувствительность опухолей или, другими словами, повышающие радиопоражаемость, вторая группа – способы, понижающие радиочувствиетльность нормальных тканей.
Подробно рассмотрим каждую группу.
Первая группа способов, повышающих радиочувствительность опухолей:
- Чувствительность опухоли ионизирующего излучения можно повысить, сочетая лучевую терапию с приемом некоторых химиопрепаратов. Используя химиопрепараты в качестве синхронизаторов клеточного цикла (5-фторурацил, платидиам, винкристин и др.), можно на некоторое время задерживать опухолевые клетки в фазе S. Затем большинство клеток синхронно вступает в наиболее радиочувствительные фазы G2 и М, и именно в этот период желательно производить облучение опухоли.
В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалколоиды и таксаны. Гидроксимочевина тормозит цикл в фазе G1. Препараты платины при сочетании с лучевым воздействием тормозят процессы восстановления повреждений опухолевых клеток. Митомицин С – влияет на радиорезистентные клетки в состоянии гипоксии. Применение его в сочетании с лучевой терапией при злокачественных новообразованиях головы и шеи значительно повышает выживаемость больных.
- Терморадиотерапия – сочетание ионизирующего излучения с гипертермией. Повышение местной температуры в опухоли до 42-44 °С вызывает гибель многих клеток злокачественного новообразования. Осуществляют с помощью генераторов электромагнитного излучения в СВЧ-, УВЧ-диапазонах. Используют при лечении больных меланомой, рака прямой кишки, молочной железы, опухоли головы и шеи, саркомы костей и мягких тканей.
- Сочетание лучевой терапии с повышением содержания в опухоли кислорода. Содержание кислорода в опухоли удается повысить искусственным путем. Для этого применяют облучение больных с использованием для дыхания чистого кислорода при обычном давлении (оксигенорадиотерапия) либо в барокамере под давлением 3-4 атм. (оксигенобарорадиотерапия). Особенно эффективно при лучевой терапии недифференцированных опухолей головы и шеи.
В качестве модифицирующего агента также используют электрон-акцепторные соединения (ЭАС) – метронидазол, мизонидазол, имитирующие функцию кислорода – его сродство к электрону.
- Сочетание лучевой терапии с искусственной гипергликемией. В связи с активным поглощением и накоплением опухолевой тканью глюкозы крови, введение глюкозы больному приводит к временной гипергликемии. Что, в свою очередь, приводит к снижению рН в опухолевых клетках. Следовательно, будет повышаться радиочувствительность за счет нарушения процессов пострадиационного восстановления в кислой среде. Поэтому гипергликемию обуславливает значительное усиление противоопухолевого действия ионизирующего излучения.
На основании данных о способах радиосенсибилизации рассмотрим частоту использования трех основных методов повышения радиочувствительности (оксигенобарорадиотерапия, терморадиотерапия, химиолучевая терапия) при различных видах опухолей (табл.2)[1,2].
Злокачественные опухоли более чувствительны к лучевому воздействию, чем доброкачественные. По степени чувствительности их делят на радиочувствительные и радиорезистентные.
К радиочувствительнымновообразованиям относятся:
неходжкинская лимфома,
лимфогранулематоз,
мелкоклеточный рак легкого,
Sопухоли семейства Юинга.
Радиорезистентными являются:
фибросаркома,
остеогенная саркома,
хондросаркома,
гипернефрома.
Промежуточное место занимают плоскоклеточный рак и аденокарцинома желудочно-кишечного тракта.
О Чувствительность к излучениювзначительной мере зависит от клеточного состава злокачественной опухоли.
Каждая злокачественная опухоль состоит из четырех клеточных фракций. Одна из них активно пролиферирует. За счет клеток этой фракции происходит рост опухоли. При одинаковой скорости деления клеток темп роста новообразования тем выше, чем больше в ее составе активно делящихся клеток. В быстро растущих опухолях выше, чем в медленно растущих, процент клеток, участвующих в клеточном цикле.
Вторую фракцию составляют клетки полностью жизнеспособные, но временно не участвующие в процессе деления (фаза Go). Они являются резервом клеточного роста. При определенных условиях, в том числе и при гибели клеток первой фракции под влиянием лучевого лечения или химиотерапии, эти клетки начинают делиться, и рост опухоли возобновляется.
Две другие фракции представлены постепенно умирающими живыми клетками и полностью некротизированными. Ни те, ни другие делиться не могут и не оказывают влияния на рост и метастазирование опухоли.
• Степень повреждающего действия зависит от фазы клеточного цикла, в которой находятся пролиферирующие клетки в момент облучения.
Наибольшей чувствительностью обладают клетки в фазе G2 и М, меньшей - находящиеся в фазах Gs и особенно клетки, не участвующие в делении.
• На чувствительность опухоли к излучению влияет степень дифференцировки клеток: чем менее дифференцированы клетки, тем выше радиочувствительность опухоли. Например, мелкоклеточный рак легкого намного чувствительней к облучению, чем плоскоклеточный рак или аденокарцинома этого же органа.
Способы повышения радиочувствительности.Чувствительность опухоли к ионизирующему излучению можно повысить сочетая
лучевую терапию с приемом некоторых химиопрепаратов,
Синхронизирующее действие химиопрепаратов. Многие противоопухолевые препараты действуют на делящиеся клетки, находящиеся в определенной фазе клеточного цикла. При этом, кроме прямого токсического влияния на ДНК, они замедляют процессы репарации и тем самым задерживают прохождение клеткой той или иной фазы. В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалкалоиды и таксаны.
Гидроксимочевинатормозит цикл в фазе G1, более чувствительной к лучевой терапии по сравнению с фазой синтеза, 5-фторурацил - в S-фазе. В результате в фазу митоза одновременно приходит большее число клеток, и за счет этого усиливается повреждающее действие радиоактивного излучения. Другие химиопрепараты, в особенности препараты платины, при сочетании с лучевым воздействием тормозят процессы восстановления повреждений опухолевых клеток. Своеобразной способностью влиять на радиорезистентные клетки в состоянии гипоксии, обладает митомицин С. Применение его в сочетании с лучевой терапией при злокачественных новообразованиях головы и шеи значительно повышает выживаемость больных.
Сочетание ионизирующего излучения с гипертермией. Повышение местной температуры в опухоли до 43-44°С вызывает гибель многих, но не всех, клеток злокачественного новообразования. За счет сохранившихся клеток через некоторое время рост опухоли возобновляется. Сочетание радиоактивного облучения с гипертермией позволяет улучшить результаты лечения по сравнению с самостоятельным воздействием на опухоль каждого из этих способов. Такое сочетание используют при лечении больных меланомой, раком прямой кишки, молочной железы, опухолями головы и шеи, саркомами костей и мягких тканей.
При повышенном содержании кислорода количество делящихся клеток и скорость роста опухоли возрастают. Поэтому при прочих равных условиях хорошо кровоснабжающиеся опухоли более чувствительны к ионизирующему излучению. Злокачественные новообразования небольших размеров лучше кровоснабжаются, чем массивные опухоли. Они легче поддаются лучевому воздействию.
Содержание кислорода в опухоли удается повысить искусственным путем. Для этого применяют облучение больных в барокамере или вводят кислород в окружающие опухоль ткани.
• Такой же эффект получают при использовании лазерного излучения и радиомодификаторов (метронидазол, мизонидазол и др.).
Радиочувствительность — это ответ опухоли на облучение, который измеряется степенью регрессии, скоростью ее наступления и длительностью. Радиочувствительность зависит от ряда факторов: способности клеток устранять повреждение, гипоксии, периода клеточного цикла и доли растущих клеток. Кроме того, возможность ликвидации опухоли определяется ее начальным объемом.
Прекрасный пример относительно радиорезистентного новообразования — плоскоклеточный рак шейки матки (РШМ). Эта опухоль остается одной из самых излечиваемых, что объясняется возможностью подведения к ней высоких доз излучения и ее происхождением из тканей, которые также относительно радиорезистентны. Ключ к успешному лечению — хорошие условия для расположения радия или цезия в непосредственной близости к опухоли без превышения дозы на окружающие нормальные ткани выше переносимой.
Множество попыток было предпринято, чтобы найти способ определения радиочувствительности опухоли. Однако в настоящее время не существует надежного метода прогнозирования результата лечения данной конкретной опухоли. Не исключено, что опухоли состоят из нескольких популяций клеток с различной чувствительностью к XT и ЛТ. Чувствительные клетки погибают, а резистентные — продолжают расти. Это объясняет, почему вначале ответившие на лечение опухоли в конечном счете не излечиваются.
Для прогнозирования и изучения радиочувствительности опухолевых клеток разработаны модели in vitro. Клеточная радиочувствительность определяется в основном потерей репродуктивной способности, которую показывает кривая выживаемости, характеризующаяся начальным наклоном а и конечным b, причем а отражает невосстановимые повреждения клетки, а b — восстановимые. Отношение а/b — доза, при которой вклад от а эквивалентен вкладу от и, и есть показатель радиочувствительности.
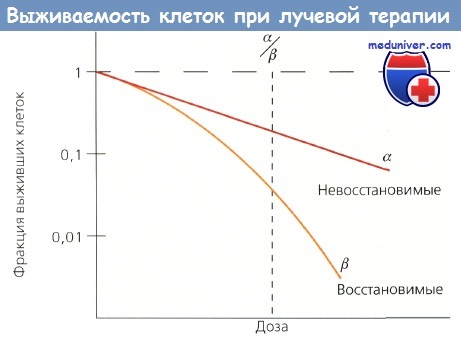
Кривая выживаемости клеток.
Начальный наклон (а) отражает невосстановимые повреждения, а конечный наклон (b) - восстановимые.
Отношение а/b — это точка на кривой, где два значения равны
Большие значения отношения характерны для быстроделящихся клеток, они помогают предсказать ответ опухолей и оценить раннюю эффективность облучения. Низкие значения характеризуют поздно реагирующие ткани.
Размер плеча кривой выживаемости дает важную информацию, т. к. отражает величину репарации сублетальных повреждений. Широкие плечи имеют низкие отношения а/b и хорошую репарацию сублетальных повреждений, которая занимает 2—6 ч. Способность клеток восстанавливать сублетальные повреждения служит основанием для фракционирования дозы ЛТ, при котором используются различия между способностью нормальных и опухолевых тканей к репарации.
Различная способность к репарации также служит основой для ускоренного фракционирования и гиперфракционирования, при которых доза подводится 2 раза в день. Такой подход дает хорошие результаты при быстро растущих опухолях. Лечение 2 раза в сутки оставляет достаточный срок нормальным тканям для репарации, тогда как опухолевые, менее организованные ткани погибают в силу нехватки времени для восстановления.
Некоторые клетки почти не имеют плеча на графике, что говорит об их ограниченной способности к репарации сублетальных повреждений; эти клетки погибают от относительно небольших доз радиации. Например, дисгерминомы излечиваются сравнительно невысокими дозами облучения (20—30 Гр) по сравнению с опухолями шейки матки, к которым необходимо подвести более 70 Гр для получения полного эффекта.
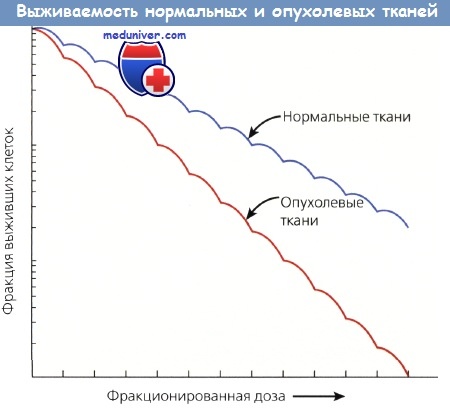
Различная выживаемость нормальных и опухолевых тканей зависит от разной их способности накапливать и репа-рировать сублетальные повреждения, полученные от фракционированных доз.
Нормальные ткани восстанавливаются быстрее и эффективнее
Способность кислорода усиливать излучение, или коэффициент кислородного усиления, вычисляется как отношение дозы излучения, производящей определенный эффект без кислорода, к дозе, дающей тот же эффект, но в присутствии кислорода. Для наблюдения полного кислородного эффекта необходимо наличие по крайней мере 2 % (17 мм рт. ст.) тканевого кислорода.
Способность опухолевых клеток к росту потенциально не ограничена, но практически зависит от поступающих с кровью питательных веществ. Известно, что любая опухоль размером более 200 мкм имеет некроз в центре вследствие ограниченной способности кислорода диффундировать на большие расстояния. Кислород легко проникает на 70 мкм от кровеносного сосуда.
Клетки, располагающиеся дальше этого расстояния, страдают от нехватки кислорода и переходят в фазу покоя. В них может развиться гипоксия и даже аноксия и некроз. Это важно с точки зрения радиобиологии, т. к. покоящиеся клетки проявляют более выраженную способность к восстановлению радиационных повреждений. Клетки в состоянии гипоксии более резистентны к облучению, чем нормально оксигенированные. Таким образом, большие опухоли труднее излечить с помощью ЛТ не только из-за большего числа составляющих их клеток, но и вследствие нахождения в них гипоксических, покоящихся и радиорезистентных клеток.
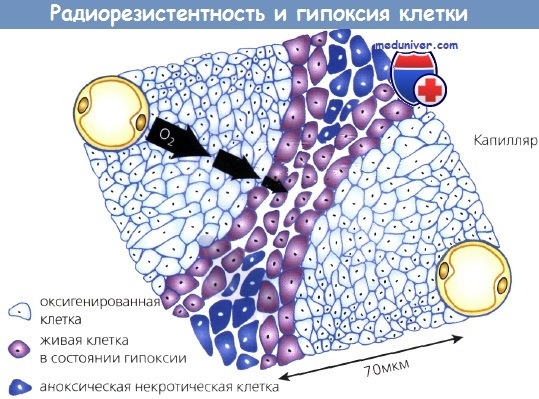
С увеличением расстояния от кровеносных сосудов клетки находятся в состоянии гипоксии и даже аноксии.
Гипоксические клетки более радиорезистентны и поэтому труднее поддаются лечению.
Кислород диффундирует примерно на 70 мкм от капилляров.
Клинический пример: замечено, что экзофитные рыхлые опухоли шейки матки, легко кровоточащие при контакте, лучше и быстрее отвечают на облучение, чем инфильтративные формы. Кровоснабжение и оксигенация этих двух видов новообразований значительно отличаются: рыхлая опухоль лучше васкуляризована и, следовательно, оксигенирована, поэтому ее радиочувствительность выше. К сожалению, к настоящему времени попытки преодолеть такое существенное различие в чувствительности к облучению с помощью гипербарической оксигенации и радиосенсибилизации не дали ожидаемых результатов.
Другим важным фактором, влияющим на радиочувствительность, служит содержание в опухоли митотических, или клоногенных, клеток. Размножающиеся клетки более чувствительны к облучению. Число митозов коррелирует с прогнозом лечения при многих опухолях. Фаза клеточного цикла тоже имеет большое значение. Клетки в поздней G2 и митотической (М) фазах наиболее чувствительны к облучению, а в поздней синтетической фазе (S) — наиболее резистентны. Это учитывается при совместном применении ЛТ и XT. Так, например, паклитаксел задерживает клетки в фазе митоза и, следовательно, выступает в роли чрезвычайно сильного радиосенсибилизатора.
От первоначального объема опухоли в значительной степени зависит возможность излечения: чем меньше объем, тем меньшая доза облучения требуется для уничтожения всехзлокачественных клеток и наоборот, при большем объеме доза, необходимая для исчезновения опухоли, возрастает. Принцип лечения сокращающимися полями заключается в последовательном уменьшении размера полей облучения с тем, чтобы подвести наибольшую дозу на центральную часть опухоли, где предположительно находятся наиболее радиорезистентные клетки в состоянии гипоксии.
В течение длительного времени клиницисты предпринимали попытки установить взаимосвязь между ответом опухоли на облучение и частотой местного рецидивировапия. В целом, чем полнее ответ опухоли к окончанию лечения и чем скорее он наступает, тем дольше период ремиссии, т. к. можно предположить, что отдаленные метастазы не появятся. Хотя эта зависимость не универсальна, при РШМ показана устойчивая корреляция между длительностью ремиссии и степенью резорбции опухоли к концу курса облучения — частичной или полной регрессией.

Grigsby установил взаимосвязь между выживаемостью и ответом опухоли к окончанию лечения, который он определял с помощью ПЭТ, основанной на измерении метаболизма глюкозы.
Другой фактор, ограничивающий излечиваемость с помощью лучевой терапии (ЛТ), — увеличение побочных эффектов со стороны нормальных тканей, связанное с повышением дозы. Появление этих осложнений зависит от суммарной дозы и дозы за фракцию, объема облученных тканей и их радиочувствительности. Цель любой терапии — достижение излечения с минимальным количеством побочных эффектов. Комбинирование ЛТ с хирургическим лечением или XT снижает толерантность нормальных тканей к облучению.
Установлены и хорошо обоснованы размеры полей, суммарные дозы и схемы фракционирования, но они не могут оставаться неизменными. Продолжают исследовать различные методы повышения процента выздоровления и снижения осложнений; для этого используют новые химиотерапевтические радиосенсибилизаторы, а также технические достижения в подведении излучения, такие как ЛТМИ и радиопротекторы, подобные этиолу.
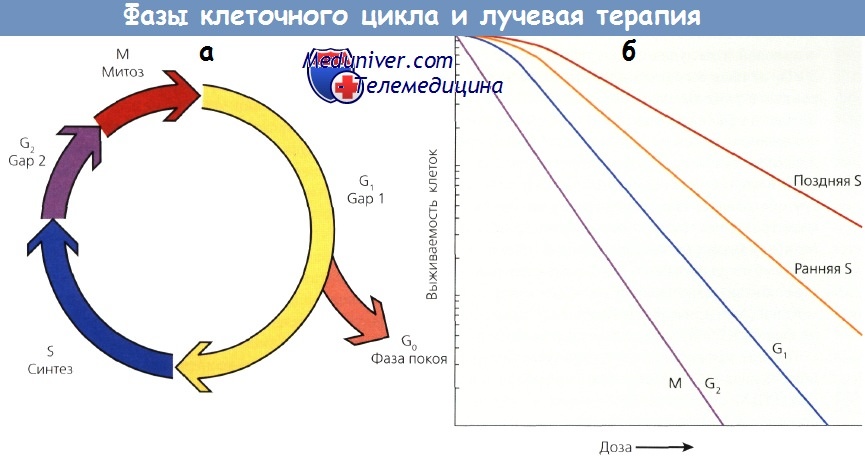
а - клеточный цикл
б - кривая выживаемости клеток в митозе и фазе G2 более крутая и не имеет плеча.
Кривая для клеток в поздней S-фазе более пологая и имеет большое плечо.
Фазы G1 и ранняя S характеризуются промежуточной чувствительностью.
Злокачественные опухоли более чувствительны к лучевому воздействию, чем доброкачественные. По степени чувствительности их делят на радиочувствительные и радиорезистентные.
К радиочувствительнымновообразованиям относятся:
неходжкинская лимфома,
лимфогранулематоз,
мелкоклеточный рак легкого,
Sопухоли семейства Юинга.
Радиорезистентными являются:
фибросаркома,
остеогенная саркома,
хондросаркома,
гипернефрома.
Промежуточное место занимают плоскоклеточный рак и аденокарцинома желудочно-кишечного тракта.
О Чувствительность к излучениювзначительной мере зависит от клеточного состава злокачественной опухоли.
Каждая злокачественная опухоль состоит из четырех клеточных фракций. Одна из них активно пролиферирует. За счет клеток этой фракции происходит рост опухоли. При одинаковой скорости деления клеток темп роста новообразования тем выше, чем больше в ее составе активно делящихся клеток. В быстро растущих опухолях выше, чем в медленно растущих, процент клеток, участвующих в клеточном цикле.
Вторую фракцию составляют клетки полностью жизнеспособные, но временно не участвующие в процессе деления (фаза Go). Они являются резервом клеточного роста. При определенных условиях, в том числе и при гибели клеток первой фракции под влиянием лучевого лечения или химиотерапии, эти клетки начинают делиться, и рост опухоли возобновляется.
Две другие фракции представлены постепенно умирающими живыми клетками и полностью некротизированными. Ни те, ни другие делиться не могут и не оказывают влияния на рост и метастазирование опухоли.
• Степень повреждающего действия зависит от фазы клеточного цикла, в которой находятся пролиферирующие клетки в момент облучения.
Наибольшей чувствительностью обладают клетки в фазе G2 и М, меньшей - находящиеся в фазах Gs и особенно клетки, не участвующие в делении.
• На чувствительность опухоли к излучению влияет степень дифференцировки клеток: чем менее дифференцированы клетки, тем выше радиочувствительность опухоли. Например, мелкоклеточный рак легкого намного чувствительней к облучению, чем плоскоклеточный рак или аденокарцинома этого же органа.
Способы повышения радиочувствительности.Чувствительность опухоли к ионизирующему излучению можно повысить сочетая
лучевую терапию с приемом некоторых химиопрепаратов,
Синхронизирующее действие химиопрепаратов. Многие противоопухолевые препараты действуют на делящиеся клетки, находящиеся в определенной фазе клеточного цикла. При этом, кроме прямого токсического влияния на ДНК, они замедляют процессы репарации и тем самым задерживают прохождение клеткой той или иной фазы. В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалкалоиды и таксаны.
Гидроксимочевинатормозит цикл в фазе G1, более чувствительной к лучевой терапии по сравнению с фазой синтеза, 5-фторурацил - в S-фазе. В результате в фазу митоза одновременно приходит большее число клеток, и за счет этого усиливается повреждающее действие радиоактивного излучения. Другие химиопрепараты, в особенности препараты платины, при сочетании с лучевым воздействием тормозят процессы восстановления повреждений опухолевых клеток. Своеобразной способностью влиять на радиорезистентные клетки в состоянии гипоксии, обладает митомицин С. Применение его в сочетании с лучевой терапией при злокачественных новообразованиях головы и шеи значительно повышает выживаемость больных.
Сочетание ионизирующего излучения с гипертермией. Повышение местной температуры в опухоли до 43-44°С вызывает гибель многих, но не всех, клеток злокачественного новообразования. За счет сохранившихся клеток через некоторое время рост опухоли возобновляется. Сочетание радиоактивного облучения с гипертермией позволяет улучшить результаты лечения по сравнению с самостоятельным воздействием на опухоль каждого из этих способов. Такое сочетание используют при лечении больных меланомой, раком прямой кишки, молочной железы, опухолями головы и шеи, саркомами костей и мягких тканей.
При повышенном содержании кислорода количество делящихся клеток и скорость роста опухоли возрастают. Поэтому при прочих равных условиях хорошо кровоснабжающиеся опухоли более чувствительны к ионизирующему излучению. Злокачественные новообразования небольших размеров лучше кровоснабжаются, чем массивные опухоли. Они легче поддаются лучевому воздействию.
Содержание кислорода в опухоли удается повысить искусственным путем. Для этого применяют облучение больных в барокамере или вводят кислород в окружающие опухоль ткани.
• Такой же эффект получают при использовании лазерного излучения и радиомодификаторов (метронидазол, мизонидазол и др.).
Развитие радиотерапии неразрывно связано с постоянным расширением представлений о количественных и качественных особенностях реакций опухолей и окружающих их нормальных тканей на радиационное воздействие.
Радиобиологические процессы в опухоли, лежат в основе существующих и разрабатываемых методов лучевой терапии.
Физико-химический механизм действия ионизирующего излучения на клетки
Общим для всех видов ионизирующих излучений является первичный процесс переноса относительно больших количеств энергии на биологические структуры. Поглощение энергии сопровождается освобождением вторичных электронов и развитием ионизации среды.
Если энергия поглощается молекулой ДНК или другой специализированной клеточной структурой, то имеет место прямое действие излучения. Однако первичное поглощение энергии может происходить и в других структурах ткани с высвобождением радикалов, которые затем взаимодействуют с неповрежденными молекулами ДНК. В этом случае речь идет о непрямом, или косвенном, действии ионизирующего излучения.
Ведущей радиационно-химической реакцией при облучении является разрыв химических связей и возникновение свободных радикалов Н и ОН в результате первичной ионизации воды, составляющей 2/3 массы человеческого тела. Доказано, что присутствие кислорода в облучаемом объекте значительно активирует многие радиационно-химические реакции и тем самым повышает гибель клеток. Повышенная эффективность излучения в присутствии кислорода известна как кислородный эффект.
Таким образом, биологическое действие ионизирующего излучения реализуется через прямое или опосредованное повреждение ДНК и других структур клетки. При этом возникают летальные, сублетальные и потенциально летальные клеточные повреждения.
Летальные ведут к гибели клеток, сублетальные способствуют их гибели при последующем облучении, потенциально летальные также вызывают гибель клеток, но в определенных условиях они могут быть сепарированы. Вероятность этих процессов пропорциональна величине поглощенной дозы.
Рассматривая действие излучения на клетки, необходимо указать, что степень выраженности лучевого воздействия зависит от того, на какой стадии клеточного цикла произведено облучение. Известно, что большинство пролиферирующих клеток максимально чувствительны к радиации в стадии митоза (М) и в меньшей степени — в стадии синтеза ДНК (S); непролиферирующие клетки (So) обычно обладают низкой радиочувствительностью и еще более низкой — зрелые (дифференцированные) клетки.
Поэтому первым проявлением лучевого повреждения клетки является торможение митотической активности. Такая форма гибели облученных клеток носит название митотической или репродуктивной. При дозах, обычно используемых в лучевой терапии (2-7 Гр). преимущественно имеет место митотическая гибель клеток непосредственно в процессе облучения (гибель под лучом).
Биологические процессы, формирующие терапевтический эффект излучения
Пятым фактором явпяется радиочувствительность данной ткани. Выраженность вышеприведенных реакций на облучение в различных опухолях и нормальных тканях значительно варьирует. Эти различия лежат в основе гипотезы о лучшей постлучевой восстановительной способности нормальных тканей в сравнении с маkигнизированными и объясняют радиотерапевтическое действие фракционного облучения.
Репарация сублетальных и потенциально летальных повреждений оказывает влияние на выживаемость опухолевых клеток и на их исходную радиочувсствительность. Радиобиологические процессы в опухоли, лежат в основе существующих и разрабатываемых методов лучевой терапии.
Физико-химический механизм действия ионизирующего излучения на клетки
Общим для всех видов ионизирующих излучений является первичный процесс переноса относительно больших количеств энергии на биологические структуры. Поглощение энергии сопровождается освобождением вторичных электронов и развитием ионизации среды.
Если энергия поглощается молекулой ДНК или другой специализированной клеточной структурой, то имеет место прямое действие излучения. Однако первичное поглощение энергии может происходить и в других структурах ткани с высвобождением радикалов, которые затем взаимодействуют с неповрежденными молекулами ДНК. В этом случае речь идет о непрямом, или косвенном, действии ионизирующего излучения.
Ведущей радиационно-химической реакцией при облучении является разрыв химических связей и возникновение свободных радикалов Н и ОН в результате первичной ионизации воды, составляющей 2/3 массы человеческого тела. Доказано, что присутствие кислорода в облучаемом объекте значительно активирует многие радиационно-химические реакции и тем самым повышает гибель клеток. Повышенная эффективность излучения в присутствии кислорода известна как кислородный эффект.
Таким образом, биологическое действие ионизирующего излучения реализуется через прямое или опосредованное повреждение ДНК и других структур клетки. При этом возникают летальные, сублетапьные и потенциально летальные клеточные повреждения.
Летальные ведут к гибели клеток, сублетальные способствуют их гибели при последующем облучении, потенциально летальные также вызывают гибель клеток, но в определенных условиях они могут быть сепарированы. Вероятность этих процессов пропорциональна величине поглощенной дозы.
Рассматривая действие излучения на клетки, необходимо указать, что степень выраженности лучевого воздействия зависит от того, на какой стадии клеточного цикла произведено облучение.
Известно, что большинство пролиферирующих клеток максимально чувствительны к радиации в стадии митоза (М) и в меньшей степени — в стадии синтеза ДНК (S); непролиферирующие клетки (So) ооычно обладают низкой радиочувствительностью и еще более низкой — зрелые (дифференцированные) клетки. Поэтому первым проявлением лучевого повреждения клетки является торможение митотической активности.
Такая форма гибели облученных клеток носит название митотической или репродуктивной. При дозах, обычно используемых в лучевой терапии (2-7 Гр). преимущественно имеет место митотическая гибель клеток непосредственно в процессе облучения (гибель под лучом).
Биологические процессы, формирующие терапевтический эффект излучения
Пятым фактором является радиочувствительность данной ткани. Выраженность вышеприведенных реакций на облучение в различных опухолях и нормальных тканях значительно варьирует. Эти различия лежат в основе гипотезы о лучшей постлучевой восстановительной способности нормальных тканей в сравнении с мапигнизированными и объясняют радиотерапевтическое действие фракционного облучения.
Репарация сублетальных и потенциально летальных повреждений оказывает влияние на выживаемость опухолевых клеток и на их исходную радиочувствительность (винкристин, бпеомицин, чаще 5-фторурацил, блокирующий G1) и другими соединениями, вызывая временный блок прохождения клетками митотического цикла в фазе G1 или G2.
При выходе клеток из блока они будут в дальнейшем одновременно переходить из одной фазы цикла в другую. В тоже время предполагается, что синхронизация клеток нормальных тканей повышает их радиорезистентность, что увеличивает радиотерапевтический интервал при фракционном курсе лучевой терапии.
Одним из основных в лучевой терапии является понятие о радиочувствительности и радиорезистентности тканей. Под радиочувствительностью понимают способность клеток, тканей или организмов реагировать на действие излучения. Степень радиочувствительности значительно варьирует у различных видов растительных и животных организмов.
Минимальная доза радиации, вызывающая при общем облучении смерть организма, для простейших будет выражаться сотнями и тысячами грей, а для человека она не превышает 5-6 грей. Радиорезистентность тканей также невелика. Доза порядка 50-60 Гр даже при фракционировании ее вызывает чаще всего необратимые изменения любой из тканей организма.
Чувствительность клеток к лучевой терапии, измеряемая соотношением дозы и эффекта, подчиняется общему закону. В классическом опыте на животных применение дозы в 1Гр оставляет 1 способную делиться клетку из 1000, 30 Гр — 1 клетку из 10 6 , 45 Гр — 1 клетку из 10 9 и 60 Гр — 1 клетку из 10 12 . Для описания клеточных потерь за счет облучения был предложен целый ряд моделей.
Среди них наибольшее признание, в силу своей простоты, получила линейно-квадратичная. Она предполагает, что гибель клетки происходит как за счет одновременного двойного разрушения противолежащих спиралей ДНК, так и в результате совпадения двух независимо образовавшихся одиночных разрывов комплементарных спиралей, оказавшихся напротив друг друга.
Радиочувствительность опухоли зависит от многих факторов — фазы клеточнота цикла, кислородного насыщения клетки, ее способности к восстановлению, степени дифференцировки, гистогенеза и размеров опухоли и т.д. Установлено. что после облучения вымирание клона облученной клетки происходит не сразу, а на уровне нескольких поколений.
В одном случае может погибнуть сама облученная клетка, в другом — ее дочерние клетки и т.д. Задержка в отмирании клеток и соответственно удалении их из опухоли в сочетании с делением части сублетально облученных клеток является причиной продолжения роста новообразований в течение некоторого времени после начала лучевой терапии.
В связи с этим время наступления регрессии опухолей в большей мере является характеристикой клеточной пролиферации, а не радиочувствительности опухолевых клеток.
В большинстве случаев опухоль повторяет свойства той ткани, из которой она развилась, поэтому злокачественные новообразования также отличается друг от друга по радиочувствительности.
В зависимости от чувствительности опухолей к радиации их классифицируют на опухоли высокой, относительно высокой, средней, относительно низкой и низкой радиочувствительности (табл. 9.2).
Таблица 9.2. Радиочувствительность некоторых опухолей и тканей [Rubin Ph., Sieman D., 1993]. 
Однако одно только гистологическое строение не определяет чувствительности нормальной и патологической ткани к излучению. На радиочувствительность влияют функциональное состояние и метаболические процессы, уровень иннервации, кровоснабжения облучаемой ткани и содержание в ее клетках кислорода, характер роста опухоли и соотношение в ней паренхимы и стромы, состояние окружающих опухоль нормальных тканей.
Большое значение для радиочувствительности нормальных и опухолевых тканей имеют также общее состояние организма, сопутствующие заболевания, возраст.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Читайте также:

