Введение химиопрепарата непосредственно в опухоль
В данном случае, в отличие от традиционной методики, химиопрепарат подается по кровеносным сосудам непосредственно в злокачественную опухоль. При традиционном (внутривенном) введении химиопрепарат долго циркулирует по всему большому и малому кругу кровообращения.
Собственно в опухолевый очаг проникает лишь небольшая часть действующего вещества. Для достижения лечебного эффекта необходимо повышать дозу, что приводит к выраженным побочным эффектам.
При интраартериальной химиотерапии такая же концентрация и доза лекарственного средства, что и при традиционной методике, но вводимая непосредственно в опухоль, позволяет достичь значительно большего лечебного эффекта, при меньшей выраженности побочных эффектов.
Интраартериальная химиотерапия наиболее актуальна при злокачественных новообразованиях шеи и головы, суставов конечностей, молочной железы.

Обычно интраартериальная химиотерапия проводится по схеме: 1 инъекция, затем 2-3 недельный перерыв. Под контролем ангиографии производится введение химиопрепарата в опухолевый очаг. Данная схема наиболее приемлема для непродолжительного лечения.
Если пациенту требуется длительное лечение химиопрепаратами, то необходимо отказаться от повторной ангиографии, а установить стационарный артериальный катетер.
Методика установки катетера
Мягкий катетер, изготовленный из специального интактного материала, вводится одним концом в сосуд, ведущий непосредственно в злокачественную опухоль, а другой его конец фиксируется на коже в области паха (так называемый порт).
При помощи этого порта в дальнейшем подается химиопрепарат. Катетер не снимается, поэтому ангиография не проводится. Он может находится внутри сосуда продолжительное время, не забиваясь и не инфицируясь. Нередко такой катетер устанавливается при злокачественном поражении печеночной ткани (гепатикоартериальный катетер).
Экстреминфузия

Изоляционная экстреминфузия является разновидностью интраартериальной химиотерапии. Данная методика используется при локализации злокачественного очага на конечности. Методика изоляционной экстреминфузии заключается в следующем.
В основные сосуды конечности (артерию и вену) устанавливаются катетеры, далее производится своеобразная изоляция конечности путем наложения жгута в подмышечной или паховой области. Из венозного катетера набирается некоторое количество крови, которая смешивается с высокой дозой химиопрепарата и вводится обратно уже через артериальный катетер.
Такая процедура повторяется несколько раз с интервалом 20-30 минут, за счет изоляции верхней или нижней конечности от большого круга кровообращения удается дать пациенту дозу химиотерапии, в 20-100 раз большую обычной (вводимой при традиционной химиотерапии). Как разновидность - кровь подвергается нагреванию до 40°С, что дополнительно усиливает действие химиопрепарата.
Метод изоляционной экстреминфузии применяется для лечения злокачественных процессов кожи (меланома), а также мышечной и костной ткани (различные виды саркомы).
Для подбора эффективного метода лечения вы можете обратиться за
- методы инновационной терапии;
- возможности участия в экспериментальной терапии;
- как получить квоту на бесплатное лечение в онкоцентр;
- организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Книга “Новое в решении проблем онкологии”
Разработка общих вопросов химиотерапии и введение в практику новых противоопухолевых химиопрепаратов позволили в значительной степени поднять эффективность лечения больных злокачественными опухолями. Однако достигнутые результаты в химиотерапии злокачественных опухолей все еще неудовлетворительны, что побуждает к поиску новых, более эффективных препаратов и к отбору их оптимально высоких доз. В настоящее время ведется изучение эффективности использования высоких доз химиопрепаратов в комбинации с пересадкой аллогенного костного мозга и применение многокурсовой адъювантной химиотерапии, позволяющей поддерживать в сыворотке крови предельно высокую концентрацию лекарственного вещества. Последняя достигается также при регионарных методиках химиотерапии: внутриартериальной, внутриплевральной и внутрибрюшинной. Впечатляющий клинический эффект получен в РНИОИ при внутриартериальной химиотерапии раковых опухолей гортани, где цитостатики вводились в верхнюю щитовидную артерию (Чиж Г. П., 1968; Бирина Л. М., 1982). Внутриполостная химиотерапия является эффективной в отношении асцита при раке яичников и специфического выпота в плевральной полости (при диссеминированном раке молочной железы). Назначение высоких доз химиопрепаратов позволяет в ряде случаев получать лучший результат лечения при опухолях, резистентных к химиотерапии стандартными дозами.
Однако при применении высоких доз химиопрепаратов возникает угроза появления тяжелых осложнений, борьба с которыми часто бывает весьма сложной. Для профилактики развития токсических явлений со стороны органов кроветворения и желудочно- кишечного тракта введение высоких доз метотрексата внутривенно или внутриартериально целесообразно сочетать с назначением вовнутрь лейковорина.
Если применять цисплатин в комбинации с тиосульфатом, представляется возможным повысить дозу препарата в 2 раза.
Максимальную концентрацию химиопрепаратов в опухоли можно создавать только тем способом, который позволяет всю дозу химиопрепарата ввести непосредственно в опухолевую ткань.
Внутриопухолевая химиотерапия представляется сложной проблемой в клинической онкологии. Как известно, часть растворов химиопрепаратов относится к разряду хорошо переносимых нормальными тканями, и поэтому их вводят внутримышечно. В эту категорию входят циклофосфан, метотрексат, Тио-ТЭФ, проспидин и др. Другая группа химиопрепаратов плохо резорбирует в нормальных тканях, при введении их подкожно или внутримышечно обязательно образуется болезненный инфильтрат, который в последующем медленно рассасывается, или наступает некроз тканей. Лекарственные инфильтраты затрудняют определение истинных границ опухоли.
Терапевтические возможности внутриопухолевой химиотерапии изучены при визуальных локализациях злокачественных опухолей. Так, прослежен непосредственный эффект у 15 пациентов с верифицированным раком кожи, где лучевая терапия была не показана, а оперативное вмешательство технически неосуществимо. Во II стадии было 2, III — 7, IV — 6 пациентов. В раковую язву инфильтрировали смесь цитостатиков (циклофосфан и 5 – фторурацил) или один из химиопрепаратов (адриабластин или метотрексат). Частичная регрессия первичного очага отмечена в 11 наблюдениях, у 4 пациентов изменения размеров раковой язвы не наступило.
Приводим ряд клинических наблюдений, иллюстрирующих клинический эффект внутриопухолевой химиотерапии.
1. Больной С., 48 лет, на протяжении многих лет страдал многофокусным раком кожи, по поводу чего многократно подвергался оперативному лечению. Неоднократно консультирован в научно-исследовательских институтах Москвы и Ленинграда. При поступлении в клинику института: на коже грудной клетки, спины, верхних и нижних конечностей определяются 38 язв, размеры которых варьируют от 2×2 см до 10×12 см. Язвы глубокие, с валообразными и подрытыми краями, скудным слизисто-гнойным отделяемым. Гистоанализ — плоскоклеточный рак. Проведена внутриопухолевая химиотерапия метотрексатом. В течение месяца под влиянием внутриопухолевой химиотерапии наступило очищение и заживление 37 из 38 язв. Незажившая язва локализовалась на коже спины в верхнем отделе межлопаточного пространства, уменьшилась на половину своего размера.
2. Больной Ф., 78 лет, поступил в клинику по поводу глубокой язвы на тыле правой кисти 5×5 см с валообразными подрытыми краями. Гистологическое исследование — плоскоклеточный ороговевающий рак. Системная химиотерапия положительного эффекта не дала. Проведена внутриопухолевая химиотерапия метотрексатом, под воздействием которой язва очистилась и наступило быстрое ее рубцевание.
3. Больная К., 42 лет, госпитализирована для лечения рака кожи спинки носа с распространением на крылья носа. Анамнез заболевания — 6 мес. На коже спинки носа определяется опухоль 4×4 см, в центре которой глубокая язва со скудным гнойным отделяемым. Гистологическое и цитологическое исследование — плоскоклеточный рак. Проведена внутриопухолевая химиотерапия метотрексатом, под влиянием которой произошла полная резорбция опухоли и заживление язвы.
С меланомой кожи получили внутриопухолевую химиотерапию 5 человек: 1 больная получала адриабластин, 4 больным вводили блеомицин в комбинации с метотрексатом. У всех больных отмечен слабый непосредственный эффект.
Внутриопухолевая химиотерапия применялась у 22 больных с саркоматозными новообразованиями: мужчин было 3, женщин — 19, их возраст составлял от 30 до 70 лет. Гистологическая структура опухоли в данной группе больных: фибросаркома —6, липосаркома — 5, лимфосаркома —^ 2, рабдомиосаркома — 2, ангиосаркома — 2, прочие саркомы — 5. Различную степень регрессии под влиянием внутриопухолевой химиотерапии удалось получить у 20 из 22 пациентов, наиболее выражен клинический эффект при гистиоцитоме и эмбриональной липосаркоме. Более выраженная степень регрессии опухоли отмечается при использовании 4 цитостатиков: метотрексата, циклофосфана, адриабластина и 5-фторурацила.
Большой по объему опыт применения внутриопухолевой химио-терапии относится к местнораспространенному РМЖ, куда включены данные о лечении 90 женщин со степенью распространенности ракового процесса Т3—Т4. 48 из них имели отечно-инфильтративную форму злокачественного роста.
Изучалась эффективность 12 схем внутриопухолевой химиотерапии (включая моно- и поливарианты).
При узловатой форме роста (40 пациенток) в 1 случае имела место резорбция опухолевого узла, в 17 наблюдениях — регрессия его более чем на 50%. Меньшая степень регрессии отмечена нами еще у 20 больных. Лишь в 1 случае использования внутриопухолевой терапии размеры раковой опухоли не претерпели видимых изменений. Более выраженный клинический эффект имел место при введении метотрексата, Тио-ТЭФа и 5-фторурацила (регрессия опухоли во всех 9 наблюдениях).
Применение внутриопухолевой химиотерапии при отечно-инфильтративной форме РМЖ вызвало уменьшение инфильтрации кожи, ее гиперемию, способствовало увеличению смещаемости органа по отношению к окружающим тканям у 44 пациентов.
Регрессия инфильтрации и обретенная смещаемость молочной железы позволили выполнить в дальнейшем ее удаление. В более ранние сроки от начала внутриопухолевой химиотерапии регрессировали периферически расположенные очаги и зоны инфильтрации, а более выраженный клинический эффект отмечался при комбинации 5-фторурацила с циклофосфаном или Тио-ТЭФом.
Изучен терапевтический патоморфоз в саркомах мягких тканей и РМЖ, удаленных после предварительной химиотерапии. Так, в саркомах мягких тканей обнаружены однотипные изменения, степень выраженности которых была различной, что можно объяснить введением различных химиопрепаратов, их дозой, гистоструктурой самой опухоли, её избирательной чувствительностью к химиопрепаратам. В зоне распространения препарата обнаружены обширные бесструктурные участки с полями фибриноидного некроза (рисунок, д). По периферии от них определяются единичные клетки, а местами — полное их отсутствие. Вокруг очагов деструкции встречаются немногочисленные сосуды типа синусоидов. В клеточном компоненте опухоли, прилежащем к вышеописанным участкам деструкции, имелись дистрофические изменения, заключавшиеся в кариопикнозе, кариорексисе, кариолизисе, вакуолизации цитоплазмы вплоть до наличия клеток- теней. При окраске по Ван-ГизоА коллагеновые волокна не выявлены. Аргирофильная сеть выявлялась отчетливо, причем в области, прилегающей к поврежденной части опухоли, но имели место ее фрагментация, утолщение и извитость.

Химиотерапия внутриопухолевая в лечении злокачественных опухолей А. К. Панков, Е. М. Непомнящая 2
При раке молочной железы наблюдаются дистрофические изменения клеток: кариопикноз, кариорексис, в цитоплазме — вакуолизация с переходом в цитолизис (рисунок а, б, в, г).
Встречали обширные очаги коагуляционного некроза. В некоторых случаях имело место отложение солей кальция в виде мелких глыбок. Строма была представлена плотной волокнистой соединительной тканью, наблюдалась ее лимфоплазмоцитарная инфильтрация, степень выраженности которой была различной в каждом случае, что, вероятно, свидетельствует, с одной стороны, об индивидуальной чувствительности опухоли, а с другой — о степени иммунологического ответа всего организма. Наибольшие изменения под действием химиопрепаратов, введенных в опухоль, были выявлены при применении метотрексата в сочетании с адриабластином или циклофосфаном, а также 5-фторурацила с Тио-ТЭФом.
Полученные данные дают основание полагать, что внутри- опухолевое введение химиопрепаратов при саркоме мягких тканей и РМЖ вызывает патоморфоз опухоли.
Резюмируя данные о терапевтических возможностях внутриопухолевой химиотерапии, можно отметить ее несомненную эффективность при РМЖ, кожи, некоторых видах мягкотканных сарком.
Клинически наблюдаемая регрессия опухоли сопровождается наступающими под действием цитостатиков некробиотическими процессами в ней. Эти обстоятельства позволяют не только перевести злокачественный процесс в операбельное состояние, но и надеяться на улучшение ближайших результатов лечения — смещение сроков рецидива заболевания.
ЭФФЕКТИВНАЯ ПОМОЩЬ ПРИ НЕОПЕРАБЕЛЬНЫХ ОПУХОЛЯХ ПЕЧЕНИ!
КАКИМ ОБРАЗОМ ДЕЙСТВУЕТ ХИМИОЭМБОЛИЗАЦИЯ?
Химиоэмболизация действует против опухоли двумя путями:
Во-первых, прицельное введение химиопрепарата в сосуды, которые питают опухолевое образование, позволяет достичь попадания высоких концентраций химиопрепарата непосредственно в опухоль.
Во-вторых, при помощи введения в просвет сосудов, непосредственно питающих опухоль, эмболов (специальных мелких частиц) происходит прекращение кровоснабжения (питания кровью) опухоли. Поскольку кровь переносит кислород и питательные вещества, необходимые для роста опухоли, ограничение (прекращение) притока крови значительно замедляет либо останавливает рост опухоли.
КАКИМ ОБРАЗОМ ПРОИЗВОДИТСЯ ХИМИОЭМБОЛИЗАЦИЯ?
Для пациента операция является не сложнее внутривенного укола. Врач под контролем специальной аппаратуры (ангиографа) вводит маленькую трубочку (катетер) в артерию на руке. Затем внутренний кончик катетера проводят непосредственно в артерию в печени, которая поставляет кровь опухоли. Через этот катетер препараты для химиотерапии вводят прямо в опухоль. После этого вводятся эмболы (мелкие частицы), которые блокируют приток крови к опухоли.
КОМУ ПОКАЗАНО ПРОВЕДЕНИЕ ХИМИОЭМБОЛИЗАЦИИ?
Химиоэмболизация проводятдля лечения пациентов с первичными опухолями и метастазами в печени (опухоли, которые возникли в другой части организма, но распространились в печень - метастазировали). Так же химиоэмболизация проводится при опухолях почек, поджелудочной железы, легких, молочной железы, матки и др.
КОМУ ПРОТИВОПОКАЗАНО ПРОВЕДЕНИЕ ХИМИОЭМБОЛИЗАЦИИ?
Пациентам с некоторыми типами заболевания почек, заболеванием сердца и коронарных артерий, печеночной недостаточностью или аллергией на контрастное вещество.
КАКИЕ РЕЗУЛЬТАТЫ МОЖНО ОЖИДАТЬ ПОСЛЕ ПРОВЕДЕНИЯ ХИМИОЭМБОЛИЗАЦИИ?
Основная задача химиоэмболизации состоит в том, чтобы уменьшить размер опухолей в печени и остановить их дальнейший рост.
Полное выздоровление благодаря химиоэмболизации бывает редко, но иногда это случается. В зависимости от количества и вида опухолей, химиоэмболизация может быть применена как самостоятельный метод лечения, так и в сочетании с другими видами лечения, такими как хирургическое вмешательство (резекция печени), радиочастотная/микроволновая абляция или лучевая терапия.
КАКИМ ОБРАЗОМ НУЖНО ПОДГОТОВИТЬСЯ К ХИМИОЭМБОЛИЗАЦИИ?
После того, как вас направят на химиоэмболизацию, вы придете на прием к врачу, который является интервенционным онкологом (радиологом). Это врач, который выполняет различные операции под контролем УЗИ, комьютерного томографа или рентгена.
В больнице у Вас возьмут анализы крови и мочи. Эти анализы позволят выяснить, как работают ваша печень и почки, нормальная ли у Вас свертываемость крови. Если у Вас в прошлом были заболевания сердца, то вам также проведут кардиологические исследования.
После этого ваш врач подскажет Вам что нужно изменить в вашем приеме лекарств. Обязательно сообщайте всем Вашим врачам, какие лекарства, травы и пищевые добавки вы регулярно принимаете, особенно те, которые влияют на свертываемость крови. Три лекарства из этой группы – это кумадин, плавикс и аспирин.
ЧТО ЧУВСТВУЕТ ПАЦИЕНТ ВО ВРЕМЯ И ПОСЛЕ ХИМИОЭМБОЛИЗАЦИИ?
Перед процедурой вам введут лекарственные препараты, которые позволят предотвратить тошноту, рвоту и боли. Вам также дадут лекарства, благодаря которым вы расслабитесь и будете чувствовать сонливость (во время процедуры, скорее всего, вы будете бодрствовать). Возможно, вы почувствуете легкий дискомфорт, при введении катетеров, но у вас не должно быть сильных неприятных ощущений. После процедуры большинство пациентов остается в больнице на 1-2 дня.
После проведения химиоэмболизации большинство пациентов испытывает прогнозируемые побочные эффекты. Это называется постэмболизационным синдромом. Основными проявлениями этого синдрома являются боли, тошнота, рвота и повышение температуры. Эти симптомы уходят после введения обезболивающих и противорвотных препаратов и проходят в течение суток после процедуры.
Умеренно повышенная температура может сохраняться до двух недель после проведения химиоэмболизации.
Боль возникает вследствие того, что после введения в просвет сосудов эмболов прекращается приток кислорода к опухоли. Недостаток кислорода вызывает боль в любых тканях. В большинстве случаев боли постэмболизационного синдрома можно снять при помощью введения таблетированных или инъекционных обезболивающих средств.
Когда вы выпишитесь из клиники, врач даст вам рекомендации по амбулаторному введению обезболивающих препаратов и препараты от тошноты.
Необходимо сообщить вашему врачу, если боль резко усилится, если произойдет повышение температуры тела выше 38.5ºC или если вы заметите какие-то другие необычные изменения.
В течение 2-х недель часто наблюдаются слабость и потеря аппетита. Большинство пациентов сможет вернуться к своей обычной деятельности через 1 неделю.
КАК ЧАСТО МОЖНО ДЕЛАТЬ ХИМИОЭМБОЛИЗАЦИЮ?
Для достижения хорошего лечебного эффекта, как правило необходимо проведение серии из двух-трех химиоэмболизаций с перерывом в 1 месяц.
Через месяц после проведения химиоэмболизации делают компьютерную томографию с контрастированием, для оценки эффекта от проведенного лечения. После этого рекомендуется проходить компьютерные томографии каждые 3-6 месяцев, чтобы проверить, не появились ли новые опухоли и оценить размеры имеющихся очагов.
Химиоэмболизацию можно повторять много раз на протяжении многих лет, до тех пор, пока ее возможно технически выполнить – другими словами, если к опухоли(ям) есть приток крови и ваша печень функционирует – и ваше состояние здоровья позволяет вам перенести процедуру.
КАКИЕ ХИМИОПРЕПАРАТЫ ПРИМЕНЯЮТСЯ ДЛЯ ХИМИОЭМБОЛИЗАЦИИ?
Тип лекарства для химиотерапии зависит от вида опухоли, на которую направлено лечение. Чаще всего применяется лекарство, которое называется доксорубицин. Так же применяются: иринотекан, оксалиплатин, гемцитабин, митомицин.
КАКИЕ ПОБОЧНЫЕ ЭФФЕКТЫ У ЭТИХ ХИМИОПРЕПАРАТОВ?
Поскольку химиопрепарат вводится непосредственно в опухоль вместе с эмболами (частицами, которые блокируют приток крови), то это уменьшает интенсивность, но не полностью избавляет, от развития кратковременных побочных эффектов, которые часто возникают после проведения химиотерапии. Наиболее часто наблюдаются тошнота и слабость.
Ваш врач может предоставить вам больше информации об этих лекарствах. Поговорите с вашим врачом обо всем, что вас беспокоит.
Химиотерапия в широком смысле — это воздействие токсичными препаратами на причину заболевания, коей могут являться болезнетворные микроорганизмы, паразиты или раковые клетки. Антибиотики и противоглистные препараты — это тоже химиотерапия. Но чаще всего этот термин применяют по отношению к препаратам, предназначенным для борьбы со злокачественными опухолями.
Химиотерапия вместе с хирургией и лучевой терапией входит в классическую тройку лечения онкологических заболеваний.
Как работают химиопрепараты?
Раковые клетки отличаются от здоровых способностью к бесконтрольному делению. Существуют разные группы химиопрепаратов с разными механизмами действия, но суть их работы всегда сводится к тому, что они поражают быстро размножающие клетки — не только раковые, но и здоровые, поэтому для химиотерапии зачастую характерны серьезные побочные эффекты.
Все химиопрепараты делят на две большие группы. Цитостатические (цитостатики) останавливают клеточное деление. Раковые клетки не могут размножаться, в них запускается механизм запрограммированной клеточной гибели — апоптоз. Цитотоксические препараты непосредственно вызывают гибель опухолевых клеток.
Назначением химиотерапии занимается онколог или более узкоспециализированный врач — химиотерапевт. Выбор препаратов зависит от некоторых факторов:
- Тип рака и его молекулярно-генетические характеристики. Разные опухоли чувствительны к разным лекарствам.
- Стадия рака.
- Виды лечения, которые применялись прежде.
- Возраст и общее состояние здоровья больного.
- Наличие сопутствующих заболеваний.
Можно назначать монотерапию одним препаратом, но лучшего эффекта обычно удается достичь, когда пациент получает комбинацию химиопрепаратов с разными механизмами действия. Нередко химиотерапию сочетают с другими видами лечения.
Классификация
Выделяют следующие основные разновидности химиотерапии:
- Неоадъювантная. Проводится до хирургического вмешательства. В данном случае ее основная цель — уменьшить размеры опухоли, чтобы хирургу было проще ее удалить.
- Адъювантная. Проводится после хирургического лечения. Опухоль удалена, но в организме пациента могли остаться раковые клетки. Химиотерапия помогает уничтожить их и предотвратить рецидив.
- В качестве основного вида лечения. Химиопрепараты могут стать основным методом лечения рака, когда операция противопоказана или неэффективна (на поздних стадиях).
- Химиолучевая терапия. Термин, который обозначает сочетание химиотерапии и лучевой терапии. При этом повышается эффективность, но возрастает риск побочных эффектов.
- Химиоэмболизация. Специфическая разновидность лечения, когда в артерию, питающую опухоль, вводят эмболизирующий препарат в сочетании с химиопрепаратом. Частички эмболизирующего препарата перекрывают просвет сосудов, лишая опухоль кислорода и питательных веществ, а химиопрепарат атакует раковые клетки.
Химиотерапия применяется как для радикального (с целью полного уничтожения опухоли и наступления ремиссии), так и для паллиативного (сокращение размеров опухоли, борьба с симптомами, продление жизни пациента) лечения.
Как вводят химиопрепараты?
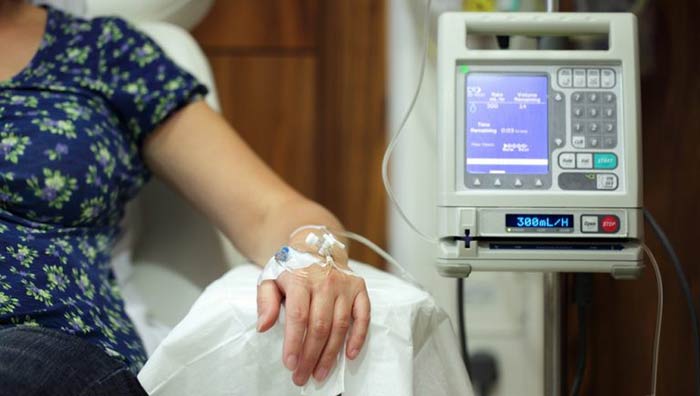
Чаще всего химиопрепараты вводят в виде растворов внутривенно, через иглу, катетер или имплантируемые порт-системы. Иногда их принимают в виде таблеток. Такая химиотерапия называется системной, потому что лекарство поступает в системный кровоток и разносится по всему организму.
В отдельных случаях проводят местную химиотерапию: препарат вводят непосредственно в место, где находится опухоль:
- Интраартериально — в питающую опухоль артерию.
- В брюшную полость.
- В плевральную полость.
- Под оболочки головного и спинного мозга.
- В желудочки головного мозга.
- В мочевой пузырь.
- Существуют препараты для втирания в кожу.
Местное введение препарата помогает предотвратить его воздействие на здоровые органы и избежать серьезных побочных эффектов.
Как подбирают дозировки?
Правильный подбор доз химиопрепаратов — ответственная задача. Если дозировка будет слишком маленькой, это снизит шансы на успешное лечение, а если слишком большой — сильно возрастут риски тяжелых побочных эффектов. Коридор между эффективностью и безопасностью, в котором приходится лавировать врачу-химиотерапевту, зачастую очень узкий.
Существуют два основных метода расчета доз химиопрепаратов: по весу пациента и по площади его тела. Для отдельных групп онкобольных дозировки нужно подбирать индивидуально:
- Пожилые люди.
- Пациенты, у которых нарушено питание, в состоянии истощения.
- Пациенты, имеющие избыточную массу тела или ожирение.
- Пациенты, которые имеют сопутствующие проблемы со здоровьем и, помимо химиопрепаратов, вынуждены принимать другие лекарства.
- Люди, страдающие анемией, иммунодефицитными состояниями, нарушением свертываемости крови, болезнями почек и печени.
- Дети.
- Пациенты, у которых химиотерапия сочетается с лучевой терапией.
Как долго длится курс лечения?
На этот вопрос сложно дать однозначный ответ. Это индивидуально. Курсы могут иметь разную продолжительность. Некоторым больным достаточно одного курса лечения, другим требуется несколько. В первую очередь это определяется типом и стадией рака, его молекулярно-генетическими характеристиками, общим состоянием здоровья пациента, разновидностью химиопрепаратов, которые было решено использовать, протоколами химиотерапии.
Что такое циклы химиотерапии?
Так как химиопрепараты атакуют все быстро размножающиеся клетки без разбора, все они в той или иной степени токсичны для организма. Поэтому их нельзя вводить постоянно в течение длительного времени. Организму нужны передышки, чтобы восстановиться.
Химиотерапию проводят циклами. Лекарство вводят однократно, либо в течение нескольких дней подряд, либо в течение нескольких дней через день, после чего следует перерыв. Продолжительность циклов бывает разной. Обычно она измеряется неделями и составляет 7, 14, 21, 28 дней.
Курс лечения может включать несколько циклов. Врач выбирает оптимальный график введения препаратов, который, с одной стороны, помогает добиться максимальной эффективности, в то же время обеспечивает минимальный риск побочных эффектов.
Что такое протоколы химиотерапии?
Правильный подбор химиопрепаратов, их комбинаций и доз — сложная задача. Для того чтобы ее эффективно решить, опыта одного врача не хватит. По всему миру проведены многочисленные исследования с участием тысяч пациентов, их результаты легли в основу протоколов химиотерапии. В этих документах подробно прописаны все нюансы назначения химиотерапии при разных типах и стадиях рака.
В разных странах врачи могут руководствоваться разными протоколами химиотерапии. Некоторые из них полностью или частично устарели, другие учитывают наиболее современные достижения в области онкологии.

Какими побочными эффектами обладают химиопрепараты?
За счет того, что химиопрепараты атакуют не только опухолевые, но и активно размножающиеся здоровые клетки, они обладают многочисленными побочными эффектами. Пациент может испытывать:
- Боли в разных частях тела.
- Тошноту и рвоту.
- Выпадение волос, изменение ногтей.
- Нарушение аппетита и извращение вкуса.
- Диарею или запоры.
- Повышенную утомляемость.

Химиотерапия может приводить к изменениям со стороны крови: повышенной кровоточивости, анемии, снижению иммунитета, при этом повышается риск инфекционных осложнений. Разные сочетания химиопрепаратов токсичны в разной степени.
Можно ли справиться с побочными эффектами химиотерапии? Существуют некоторые эффективные способы:
- В первую очередь врач даст некоторые рекомендации по поводу образа жизни, питания.
- Для защиты волос и ногтей во время введения препаратов используют охлаждающие шапочки, специальные охлаждающие пакеты для рук и ног.
- Поддерживающая терапия помогает справиться с неприятными симптомами и перенести курс химиотерапии более комфортно.
- Если эти меры не помогают, приходится снижать дозы химиопрепаратов, заменять их более безопасными. Это может негативно повлиять на эффективность лечения.
Выберите химиотерапевта и запишитесь на приём

Главный врач Европейской клиники, онколог, к.м.н.

Химиотерапевтические препараты являются лекарствами, которые используют в онкологии, чтобы противостоять развитию опухолей. Как они классифицируются? Каков механизм действий? И каковы побочные эффекты химиотерапии?
Что такое химиотерапевтические препараты
В общем смысле, термин химиотерапия используется как синоним противоопухолевых препаратов. На самом деле, это не совсем правильно, поскольку противоопухолевые или антибластические агенты, это только один из классов, принадлежащих к этой большой семье. Также сюда входят другие агенты, которые действуют против бактерий (антибиотики), грибков (противогрибковые препараты), вирусов (противовирусные) и вредителей различного рода.

Все химиотерапевтические препараты используются в онкологии с целью противодействия роста новообразований, способствованию ремиссии и сохранению эффекта лечения в течение долгого времени.
Злокачественные опухоли являются аномальными новообразованиями, клетки которых размножаются чрезмерно и несогласовано, несмотря на исчезновение стимулов, приведших к возникновению новообразования.
В частности, эти препараты являются терапией выбора для опухолей небольших размеров (хорошо васкуляризированных и, следовательно, легко доступных препарату). А также используются как поддержка в лечении более обширных опухолей:
- вводят при лучевой терапии для повышения чувствительности злокачественных клеток к радиации;
- вводят перед операцией, чтобы исключить регресс опухоли;
- и, наконец, помогают уничтожить небольшие метастазы опухоли в удаленных от первоначального места.
Как правило, специалист назначает одновременный циклический приём двух или более лекарств, чтобы оптимизировать их эффективность против опухоли (так как препараты действуют в синергии) и, в то же время, уменьшить появление нежелательных эффектов и лекарственной устойчивости (преимуществом синергетического эффекта является возможность использования более низких доз).
Введение химиотерапевтических препаратов осуществляется путем инъекций (внутривенно, внутримышечно) или, как это часто бывает, путём внутривенной инфузии (капельница). По сравнению с инъекциями, последний указанный путь позволяет регулировать количество лекарства, которое поступает за единицу времени, ограничивая повреждения вены и снижая проявления побочных эффектов (тошнота и рвота).
Другой путь введения – полость рта: различные препараты, в том числе капецитабин, гидроксимочевина и мелфалан, могут быть приняты в виде таблеток, так как хорошо всасываются в кишечнике.
Хотя наиболее широко используется капельница, она не всегда является наиболее подходящим путём для введения лекарства; в случае опухолей локализованных на определенных органах лучше прибегнуть к другим путям, вводя препарата непосредственно в орган-мишень:
Подготовка химиотерапии должна быть выполнена в лаборатории, квалифицированным персоналом и с защитой от контакта с препаратом.
Цикл химиотерапии, продолжительность которого может варьироваться от одного до нескольких дней подряд, будет повторяться с промежутком в несколько недель, чтобы дать время здоровым клеткам – также страдающим от лекарств – оправиться.
Классификация противоопухолевых лекарств
Категория химиотерапевтических противоопухолевых лекарств весьма неоднородна, как по химической структуре, так и по механизму действия, но именно на основании последнего обычно классифицируют препараты.
Понимание того, как они действуют, позволяет онкологу определить, какие препараты лучше всего работают против конкретной опухоли, в какой дозировке и время приема, а также прогнозировать негативные последствия.
Принимая во внимание этот критерий, мы можем разделить противоопухолевые препараты на:
- Цитотоксические препараты. Они способны влиять на жизненный цикл клеток, подавляя способность к росту, пролиферации и выживанию.
- Препараты направленного действия. Вещества, которые избирательно действуют на клетки организма.
Традиционные цитотоксические лекарства
Они включает весь ряд классических противоопухолевых лекарств, которые влияют на клеточный цикл: ряд этапов развития, через которые проходят здоровые и раковые клетки.
Мы можем суммировать различные этапы развития клетки следующим образом:
Цитотоксические лекарства действуют на клетки в пролиферативной фазе, которые представляют только часть раковых клеток.
В опухоли, на самом деле, сосуществуют:
Так как в очагах поражения присутствуют миллиарды клеток, а цитотоксические препараты убивают меньше 99%, очень важно вводить эти препараты в несколько циклов, чтобы удалить как можно больше клеток.
Цитотоксические препараты , именно из-за механизма их действия, не в состоянии различать раковые и здоровые клетки. Поэтому важно чередовать химиотерапию с периодами восстановления, чтобы не повредить чрезмерно здоровые ткани.
В отношении клеточного цикла цитотоксические препараты можно классифицировать на:
Нефазные цитотоксические препараты
Фазозависимые цитотоксические препараты
Алкилирующие агенты: азотистый иприт, этилендиамины и метилмеламины, алкилсульфонаты, нитрозубы, триазены.
Платиновые координационные комплексы: цисплатин, оксалиплатин и карбоплатин.
S-зависимые: антиметаболиты, гидроксимочевина, производные подофиллотоксина и камптотецина.
Противоопухолевые антибиотики: антрациклины и дактиномицин.
Препараты алкилирующего типа подразделяются на шесть групп, взависимости от структуры и целей применения:
Этиленимины и метилмеламин : используются в терапии некоторых твердых опухолей (яичников, молочной железы и мочевого пузыря).
Производные метилгидразина . Используется только прокарбазин, который преобразуется в особу активную форму, попав в печень. Поскольку обладает сильной мутагенной и канцерогенной способностью, его использование ограничено лимфомой Ходжкина, в сочетании с меклометамином, винкристином и преднизоном.
Алкилсульфонаты . Бусульфан используется при хроническом миелоидном лейкозе с целью снизить количество белых кровяных клеток.
Нитрозомовая кислота : благодаря своим структурным особенностям, эти препараты проникают через гематоэнцефалический барьер и накапливаются в нервной системе, что делает их важными для лечения опухолей головного мозга.
Триазены : находят применение в лечении меланом, а также лимфомы Ходжкина и злокачественной глиомы.
Цисплатин, карбоплатин и оксалиплатин – противоопухолевые препараты широкого спектра действия. Механизм действия подобен алкилирующим препаратам: проникнув в клетки, они гидратируются и приобретают сильно реактивный вид – связываются с одной или с обеими нитями ДНК; в результате блокируются процессы дублирования и транскрипции нуклеиновой кислоты, возникают ошибки в синтезе белка, и включается механизм, который приводит к апоптозу клетки .
Платиновые координационные комплексы
Антиметаболиты блокируют клетки в S-фазе, то есть репликацию ДНК, подменяя базовые субстраты синтеза этой нуклеиновой кислоты.
Можем классифицировать их на две основные группы:
Аналоги азотистых оснований : они дополнительно делятся на аналоги пиримидинов, эффективных против твердых опухолей, и аналоги пуринов, активных против жидких опухолей.
Аналоги пиримидинов:
- Фторурацил . Используется при метастатической карциономе толстой кишки, желудка и молочной железы. Препарат часто ассоциируется с циклофосфамидом и метотрексатом (рак молочной железы), цисплатино (для опухолей головы и шеи) и иринотеканом (рак толстой кишки), которые увеличивают шансы на успех терапии.
- Флоксуридин . При внутривенном введении флоксуридин находит применение при лечении метастатического рака толстой кишки или после резекции метастазов в печень.
- Капецитабин . Одобрен для лечения устойчивых опухолей молочной железы и метастатического рака толстой и прямой кишки, когда предпочтительнее использовать аналог пиримидина в качестве монотерапии.
- Ситарабин . Это препарат выбора для лечения острого миелоидного лейкова.
- Азацитидин . Препарат одобрен при лечении миелодисплазии, эффективен благодаря антилейкемическому действию и дифференциации стволовых клеток костного мозга.
- Гемцитабин . Используется для лечения твердых опухолей, таких как метастатический рак поджелудочной железы, легких, яичников, мочевого пузыря, пищевода, головы и шеи.
Гидроксимочевина затрудняет получение дезоксинуклеотидов (единиц ДНК) из рибонуклеотидов (единиц РНК), катализируемых ферментами рибонуклеотид дифосфатредуктазы.
Препарат используется в комбинации с лучевой терапией или с другими химиотерапевтическими средствами.
L-аспарагин – это фермент, который расщепляет аспарагин (заменимая аминокислота) до аммиака и аспарагиновой кислоты, использование которых основано на том факте, что раковые клетки поглощают аминокислоты из крови, поскольку не в состоянии производить собственные.
L-аспарагин, таким образом, лишает эти клетки основного компонента для синтеза белков, блокируя их в фазе G1.
Являются антибиотиками природного происхождения, которые – из-за выраженной токсичности – не могут использоваться в качестве бактерицидных средств.
За исключением блеомицина, который активен в зависимости от стадии роста, все остальные имеют действие, независимо от рассматриваемой стадии.
Блеомицин (A2 и B2) . Вырабатываемый стрептококками, блеомицин повреждает ДНК через механизм, который включает образование свободных радикалов (окислительный стресс). Раковые клетки блокируются в фазе G2 с серьезными хромосомными изменениями. Используется в лечении плоскоклеточного рака шейки матки, лимфомы Ходжкина и рака зародышевых клеток яичек.
Дактиномицин . Препарат, продуцируемый Streptomyces parvulus, способен интеркалировать двойную спираль и взаимодействовать с парой цитозин-гуанин; это ведёт к деформации конструкции, что предотвращает дублирование и транскрипцию ДНК, а также ферментативную фрагментацию нитей. Препарат способен вылечить опухоль Вильмса у детей и рабдомиосаркому, когда используется в сочетании с лучевой терапией, хирургией или другими препаратами (винкристин, циклофосфамид).
Антрациклины : Эти лекарства также получают от рода Streptomyces. Они повреждают генетический материал через окислительный стресс (например, блеомицин), деформацию двойной спирали и её фрагментацию (как дактиномицин). Относятся к числу противоопухолевых препаратов, которые могут быть использованы как для лечения твердых опухолей (доксорубицин), так и жидких опухолей (даунорубицин).
Производные камптотецина и подофиллотоксина – останавливают клеточное развитие в S-фазе, путём ингибирования топоизомеразы 1 и 2 (основные ферменты репликации, транскрипции и репарации ДНК).
Связанная с ДНК топоизомераза разрезает одну из двух нитей так, что вторая может пройти через место разрыва. Как только это произойдет, фермент устраняет разрыв и отрывается от нуклеиновой кислоты, позволяя реплицировать две нити отдельно.
Вышеперечисленные препараты связываются с ферментом, не давая восстановить нить, и как следствие – накопление фрагментов ДНК и последующую гибель клеток.
Производные камптотецина – применяются в лечении твердых опухолей:
Производные подофиллотоксина – используются при лимфомах, лейкемии и некоторых твердых опухоляз:
Здесь мы опишем самые современные противораковые препараты, которые влияют на клетки, имеющие особые характеристики: аномальная экспрессия некоторых генов, низкая степень дифференцировки, наличие антигенов или изменений гормональной секреции.
Целевая противопухолевая терапия
Модуляторы биологической реакции: положительно влияют на реакцию организма против опухоли – прямым путём (дифференцирующие агент) или косвенно (иммунотерапия).
Ингибиторы тирозинкиназы: действуют на клетки с измененными тирозинкиназами, вызывая клеточную пролиферацию.
Гормональные препараты: модулируют выработку половых гормонов, участвующих в генезисе некоторых злокачественных новообразований.
Бисфосфонаты: лекарства, обычно используемые при лечении остеопороза, поскольку противодействуют разрушению костной ткани, опосредованного остеокластами. Было показано, что различные бисфосфонаты золедроновой кислоты активны против костных опухолей.
Побочные эффекты противоопухолевой терапии
Для полноты картины о химиотерапии, мы не можем не поговорить о побочных реакциях, связанных с терапией. Они чрезвычайно разнообразны в зависимости от особенностей пациента и применяемого лекарства: как мы уже упоминали, риск побочных эффектов выше в случае цитотоксических препаратов, которые мало избирательны и имеют продленные сроки приема.
Большая часть из этих реакций обусловлена токсичным действием на ткани, такие как костный мозг и эпителий.
- Стоматит . Антиметаболиты и антибиотики могут вызвать раздражение слизистой оболочки полости рта, вызывая появление жжения, покраснение, иногда небольших язв. Это характерная картина стоматита, появляется через 4-5 дней и может длиться до трёх недель, срок, в течение которого пациент должен особо тщательно следить за гигиеной полости рта (использование мягкой щетины и зубной нити) и потреблять свежие продукты, не вызывающие раздражение.
- Потеря вкуса и обоняния из-за повреждений вкусовых и обонятельных рецепторов. Эти симптомы могут появиться уже после первого приема и сохраняются на протяжении всей терапии.
- Тошнота и рвота . Почти все из противоопухолевых препаратов имеют этот побочный эффект, так как раздражают слизистую оболочку желудка или стимулируют центры рвоты, расположенные в продолговатом мозге. Они могут появиться уже через несколько минут после начала терапии (острые симптомы), либо через несколько дней (симптомы задержки), иногда даже до начала химиотерапии у тревожных людей (опережающие симптомы); в любом случае, исчезают в течение двух дней. Противорвотные средства назначают в комбинации с противоопухолевыми препаратами, чтобы предотвратить эти эффекты.
- Понос или запор . Изменения в кишечном транзите могут появляться в результате использования некоторых антиметаболитов и противоопухолевых антибиотиков, которые раздражают слизистую оболочку кишечника. Помимо правильного питания, следует применять антидиарейные или слабительные средства.
- Алопеция и ломкость ногтей . Различные препараты, в том числе циклофосфамид, дакарбазин, винбластин, таксаны и эпиподофиллотоксины, могут оказывать токсические эффекты на уровне прорастающего слоя ногтей и волос, делая их ломкими и склонными к выпадению. Алопеция появляется после одной/двух недель химиотерапи и является обратимой.
- Дерматоз . Сухость и кожные заболевания, может также появиться гиперпигментация и эритема в случае фотосенсибилизирующих препаратов (блеомицин, бусульфан, метотрексат). В этих случаях необходимо использовать кремы с высоким фактором защиты, мягкие моющие средства и увлажняющие и успокаивающие.
- Миелодепрессия . Токсичность для костного мозга является общей для всех противоопухолевых препаратов, хотя эффекты более выраженным в случае алкилирующих агентов: эти препараты снижают количество белых кровяных телец уже через 6 дней, а время восстановления составляет две/три недели. Разрушение стволовых клеток костного мозга может проявляться лейкопенией (снижение лейкоцитов), анемия (снижение эритроцитов в крови) и тромбоцитопения (снижение тромбоцитов).
- Лихорадка . Появляется, как следствие лейкопении, которая повышает восприимчивость организма к инфекциям; если температура тела превышает 38°C и сопровождается ознобом и/или поносом, кашлем, болью в области ввода катетера, нарушениями мочеиспускания, необходимо вызвать врача.
- Усталость . Общий симптом для всех онкологических больных, усталость может быть связана с действием самого препарата, уменьшением числа красных кровяных телец или просто психологическим фактором.
- Кровотечение . Снижение тромбоцитов, циркулирующих в крови, приводит к разжижению крови, увеличивая предрасположенность к кровотечениям. В случае внезапного кровотечения, длящегося более десяти минут, крови в кале, в моче или рвоты с кровью, наличии петехий на пальцах рук и ног, – необходимо обратиться к врачу.
- Кардиомиопатии . Сердечная токсичность типична для препаратов антрациклинового ряда, которые повреждают миокарда через механизм образования свободных радикалов и активации апоптоза. Уже в острой стадии заболевания могут наблюдаться обратимые аритмии, в то время как длительное введение приводит к сердечной недостаточности с уровнем смертности в 50%.
- Нефротоксичность и уротоксичность . Цисплатин и ифосфамид особенно токсичны для почек, так как повреждают его функциональные единицы (нефроны), что приводит к почечной недостаточности у 30-33% пациентов; циклофосфамид имеет выраженную токсичность на уровне мочевого пузыря, вызывая геморрагический цистит (воспаление слизистой оболочки с потерей крови). Эти эффекты могут быть предотвращены хорошей гидратацией (вливание физиологического раствора до, во время и после лечения), при одновременном назначении местных препаратов, которые нейтрализует токсические метаболиты ифосфамида и циклофосфамида.
- Вторичные лейкозы . Кажется парадоксальным, но некоторые антибластические препараты (особенно, прокарбазин и темозоломид) вызывают опухоли. У 5% пациентов в течение четырех лет может появиться лейкоз, которому предшествую изменения костного мозга. Это связано с тем, что лекарства почти незаметно изменяют ДНК и ошибка сохраняется при репликации.
Информация, содержащаяся в данном документе, представлены только для ознакомления и не заменяет отношений между врачом и пациентом.
Читайте также:

