Как опубликовать исследование о раке
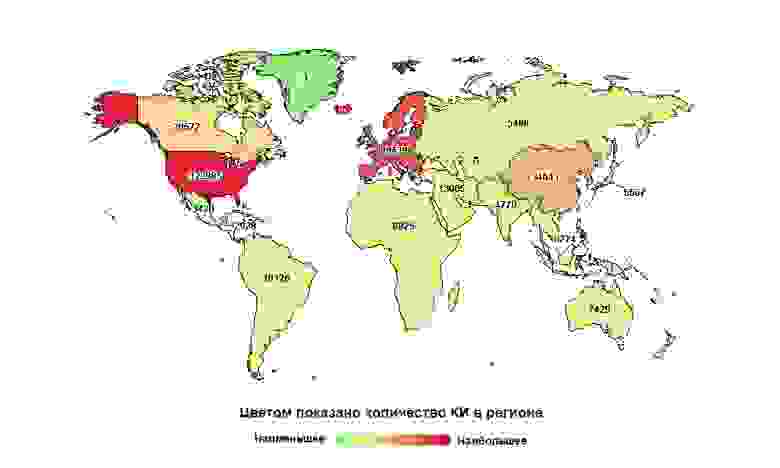
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата – единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Клиническое исследование/испытание (далее – КИ)– научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
И именно клинические исследования – основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996-97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Весь процесс создания препарата можно поделить на 3 крупных фазы.
1. Поиск идеи и доклинические исследования – в пробирках и на животных.
2. Если на этом все не закончилось – то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
3. Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
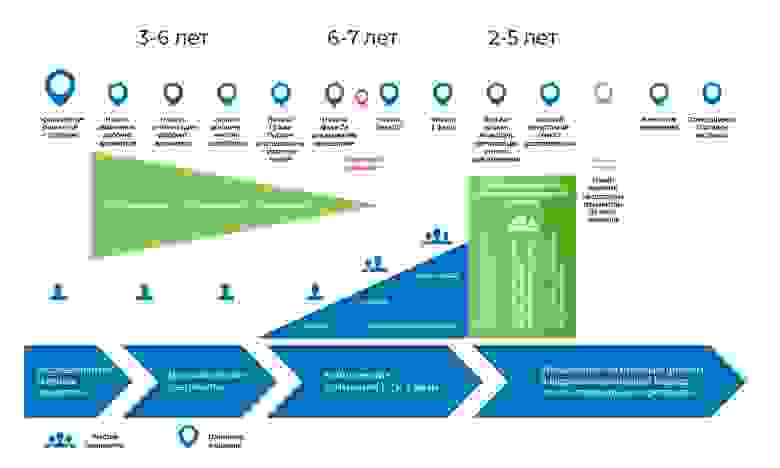
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это кому-нибудь нужно? Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности в лекарствах. По данным Всемирной организации здравоохранения, в 2018 году онкологические заболевания убили 9,6 миллиона человек. Часто опухоли обнаруживают на поздних стадиях, когда остается лишь паллиативное лечение.
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов – одно из самых наукоемких и востребованных направлений медицины.
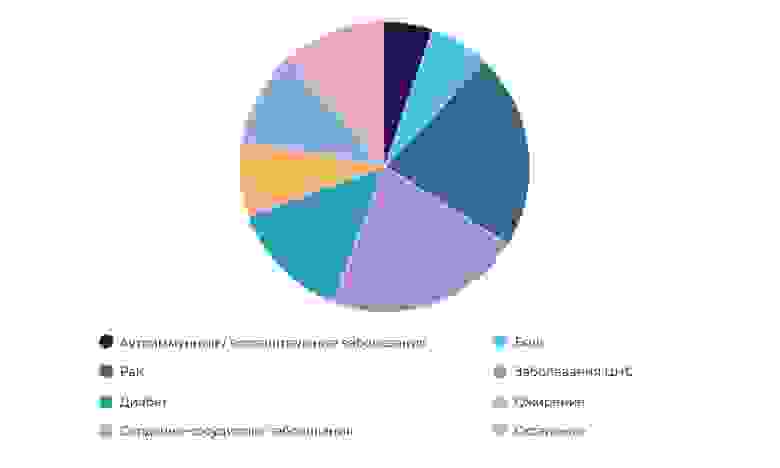
Исследования противораковых препаратов – 23% всех КИ в мире
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.

Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio – то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве – производят по специальным правилам (в России это ГОСТ Р 52249-2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь – двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий – нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
И до сих пор в медицине без опытов на животных – не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода и т.п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма, и т.п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да – то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях – пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности и т.п.
- Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста – получить оценку и заключение комитета по этике.
Комитет по этике – это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний – на людях.
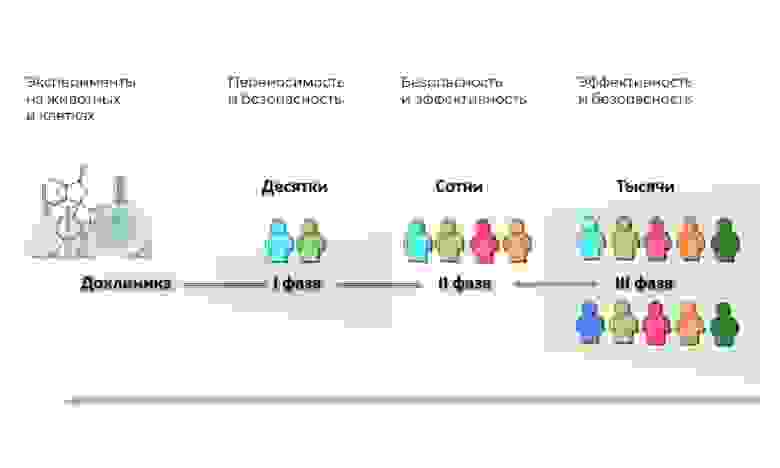
Основные фазы клинических исследований – на людях
Участники: 20 – 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Участники: 100 – 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто – плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом – с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.

Всем – одинаковые на вид, вкус и запах лекарства.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Количество участников: 300 – 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку – и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12-18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25-30% случаев от всех, что были на старте третьей фазы.

Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний – 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2-3 года замедляет пациентам доступ к новым лекарствам.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер – для пациентов. Чтобы запуститься в первый раз – пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.

Для разных препаратов – разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т.п. Все это отражено в особом документе —информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались – для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет – мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике – совсем не то, что в большом НИИ, но обычно 3-4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение – бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике – если это не запрещено дизайном КИ и пациент чувствует себя хорошо – он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами – расширенной возможностью применения новых препаратов – будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
В последние пару лет я часто пишу и рассказываю в телеэфире о прорывах в лечении многих тяжелейших заболеваний. В большинстве своем – онкологических. Речь идет о новейших разработках в медицине, как, например, иммунотерапия и генетическая терапия. Но следует понимать, что данные методы помогают спасти жизнь на поздних стадиях болезни, в случае с онкологией – на четвертой стадии. И это, безусловно, прекрасные новости. Но не стоит забывать, что самым действенным способом все же была и остается ранняя диагностика.
Ранняя диагностика позволяет устранить проблему на той стадии когда вопрос может быть решен простейшей процедурой, еще до того, как болезнь начнет метастатировать и распространяться на другие органы. То есть имеются серьезные шансы предотвратить годы страданий, траты на лечение, а зачастую и на спасение жизни.
Но чтобы обнаружить заболевание на ранней стадии, должны соблюдаться несколько принципов:
- Человек должен быть осведомлен относительно симптоматики, т.е. на какие реакции, либо изменения организма следует обращать внимание.
- Мотивирован на обращение к врачу при первом обнаружении подозрительных симптомов
- Быть в курсе существующих рекомендаций по ранней диагностике, соответствующих возрасту, полу, предрасположенности к заболеваниям, семейной истории (генетика), роду деятельности.
Израильская медицина, представителем которой я являюсь, давно доказала, что государству намного выгоднее предотвращать болезнь, чем ее лечить. По этой причине Минздрав выделяет немалые средства на разъяснительную работу с населением, направленную на раннее обнаружение и предотвращение заболеваний.
Моей целью в этой статье является дать читателям некую схему-памятку, которая поможет в ранней диагностике. А как я уже сказал, ранняя диагностика во многих случаях спасает жизнь.
Итак, как израильский врач, я расскажу о рекомендациях, принятых в израильской медицине. Если у коллег из других стран найдется что добавить – буду только рад.
Для начала опишу принятые стандарты для здоровых людей:
После сорока лет следует раз в год делать обычные анализы крови, которые могут показать наличие проблемы. Например, если снижен гемоглобин, врач начнет искать возможность кровотечения в кишечнике, желудке, или из геморроидальных узлов. Возможно, речь идет о язве, а может быть, об онкологии.
После 40 лет как минимум раз в два года женщины должны делать маммографию, ежегодно посещать гинеколога и маммолога, а также делать мазок ПАПс на вирус папиломы , приводящий к раку шейки матки.
Мужчинам после 50 лет следует проходить исследование ПСА (анализ крови на наличие рака предстательной железы) и раз в год пальцевое исследование простаты.
Начиная с 50 лет и мужчинам и женщинам следует как минимум один раз пройди гастро и колоноскопию, чтобы убедиться в отсутствии полипов, которые имеют свойство со временем преобразовываться в раковые образования, а также рекомендуется проходить раз в год исследование кала на скрытую кровь для раннего обнаружения колоректального рака.
Еще одна важная рекомендация – ежегодно посещать дерматолога с целью исследования кожи на наличие меланомы.
Очень важно обращать внимание на любые подозрительные изменения в организме: запоры, изменение формы стула, следы крови на туалетной бумаге, уплотнение в груди у женщины, появление и быстрый рост родимых пятен на коже – все это симптомы для немедленного обращения к врачу. Лучше потратить час на посещение врача, чем годы жизни и огромные деньги в будущем, когда проблема усугубится. А нередко в своей практике я сталкиваюсь со случаями, когда пациенту уже не помочь.
И еще один очень важный момент:
При наличии подобной семейной истории рекомендуется пройти консультацию у генетика, который, возможно, даст направление на определенные генетические исследования и/или порекомендует чаще проходить ранее упомянутые проверки.
Хочу отметить, что в последнее время появилась возможность пройти достаточно точные и недорогие генетические исследования для обнаружения различных предрасположенностей. Эта тема сейчас весьма популярна, но стоит иметь в виду, что нет смысла тратиться на бессмысленные модные генетические тесты. Только при наличии семейной предрасположенности, и лишь по рекомендации генетика, изучившего семейную историю пациента, подобные исследования будут иметь смысл.
И, кстати говоря, зачем зацикливаться на онкологии? Есть много других тяжелейших заболеваний, в которых ранняя диагностика может спасти жизнь и здоровье. Как пример – исследование плотности костей женщинам с возраста 60 лет, и проверки зрения и слуха начиная с сорокалетнего возраста.
Я абсолютно уверен, что простые рекомендации, описанные выше, спасут жизни некоторых читателей. И если хоть один человек, ознакомившись с этой статьей, задумается и, обнаружив у себя любой из приведенных мною симптомов, забьет тревогу и обратится к врачу, либо начнет следить за своим здоровьем, проходя рекомендованные исследования – могу считать, что статья была написана не зря.
И если вы дочитали этот текст до конца, то мне хотелось бы порекомендовать вам "утащить" его в соцсети. Вполне вероятно, что этим вы сможете спасти жизнь друзей и знакомых.

В 2018 году медики в России выявляли в среднем по 47 000 новых случаев онкологических заболеваний ежемесячно — таковы данные Минздрава, с января по август обнаружено 379 351 новых случаев злокачественных опухолей.
В последние годы данный показатель стабильно рос: если в 2012 году в РФ было зафиксировано около 526 тысяч заболевших раком, то по итогам 2017 года эта цифра составила уже свыше 617 тысяч человек.
Федеральное агентство новостей обратилось в Министерство здравоохранения РФ и в ведущий профильный исследовательский центр, НМИЦ радиологии, с вопросом: когда рак в России перестанет быть непобедимой болезнью? В ответ Минздрав и ученые рассказали о передовых технологиях лечения рака в нашей стране, однако точных дат эксперты не назвали.
Дело в том, что медицина за последнее время изучила десятки тысяч разновидностей злокачественных опухолей. У каждой — своя локализация, сценарии лечения и прогнозы выживаемости — и найти рецепт или изобрести вакцину от всего сразу невозможно. Но ответы все равно получились обнадеживающими. По некоторым из видов рака доля прошедших успешное лечение и вернувшихся к обычной жизни пациентов уже сейчас составляет 99,6%.
Еще пару десятилетий назад в лечении онкологических заболеваний все было относительно просто. Врачи различали виды рака только по органам, в которых он образовался, — например, лечили рак поджелудочной железы, не вдаваясь в подробности, какой вид мутации клеток в какой части органа вызвал опухолевый процесс. Весь спектр способов терапии чаще всего сводился к двум основным: химиотерапии и операции по удалению органа или его части.
Сегодня стало намного легче запутаться: тысячи видов рака, десятки методов воздействия на неправильные клетки, вплоть до редактирования генетического кода, — плюс еще большее количество комбинаций различных технологий, персонифицированных под каждого отдельный случай.
Впрочем, показатель общего числа смертей от рака при этом пока заметно не изменился. Если в 2012 году на 100 тысяч населения России приходился 201 случай смерти от онкологических заболеваний, то в прошлом году он составил в среднем 197,7 летальных исходов на то же число россиян. Получается, что медикам все чаще удается продлевать жизнь больным на несколько лет, но доля полностью выздоровевших пациентов пока ощутимо не выросла.

Протонный ускоритель, гамма-нож и лечение светом
Специалисты не исключают, что в ближайшее время удастся изменить показатели выживаемости и смертности при онкологических заболеваниях. Ведь с учетом современных темпов развития технологий, российская медицина образца января 2018 года уже серьезно отличается даже от нынешнего положения дел.
Важнейшим событием этого года в Минздраве РФ считают открытие в Обнинске Центра высокоточной радиологии Gamma Clinic.
Кроме того, Андрей Каприн отмечает еще одно достижение специалистов на базе Медицинского радиологического центра им. А.Ф. Цыба в Обнинске: там начали применять протонный ускоритель для воздействия на раковые клетки.

Еще одним значимым событием профессор называет начало производства отечественных радиоизотопов на базе одной из разновидностей йода. За эту работу коллектив ученых из НМИЦ радиологии и Физико-энергетического института им. Лейпуновского был удостоен премии правительства РФ в области науки и техники.
Сегодня метод брахитерапии, в котором используются радиоактивные фармпрепараты, применяют на целом ряде злокачественных новообразований: предстательной железы, матки, молочной железы, печени. Впервые в России он начал использоваться и при раке поджелудочной железы.

Кроме того, по словам медика, с помощью протонного ускорителя в России все чаще лечат опухоли головного мозга, легких и молочных желез. Активно развиваются комбинированные и комплексные методы лечения с использованием методик ядерной медицины: это адронная, протонная, нейтронная, радионуклидная терапии.
Российская система здравоохранения берет на вооружение и все последние достижения мировой науки. Одним из по-настоящему прорывных направлений в этой области является таргетная терапия, в том числе с использованием иммунных препаратов.
По мнению Андрея Каприна, проблемы онкозаболеваний нужно решать, объединяя усилия нескольких разнопрофильных специалистов и структур.

Совместно с учеными ИМЕТ РАН и МГУ в НМИЦ радиологии учатся восстанавливать вырезанные вместе с опухолью части органов и тканей, заново отпечатывая на 3D-принтере трехмерные импланты нужных параметров из биоматериалов и насыщая их необходимыми препаратами для лечения и восстановления утраченных функций.
На вопрос о том, когда будет найдено универсальное оружие для победы над раком, все специалисты единогласно отвечают: это невозможно.
Впрочем, по словам представителей ведомства и самих медиков, отсутствие универсального оружия еще не означает, что враг непобедим.
К слову, упомянутая медиком программа предполагает переоснащение около ста региональных учреждений в России для помощи онкобольным, формирование сети протонных центров для развития ядерной медицины, кластеров по подготовке радиохимиков, медицинских физиков, радиофизиков, амбулаторных онкологических служб на межрайонном и межмуниципальном уровнях.
Наиболее перспективной стратегией, по мнению специалистов Минздрава РФ, станет соединение различных подходов к лечению: от таргетной терапии до радиолучевого воздействия, а также персонализация лечения — выявление наиболее эффективных методов воздействия для каждого отдельного пациента.
Если с вектором движения и даже первыми успехами на этом пути в целом уже понятно, то с ответом на вопрос, когда рак больше не будет приговором, все сложнее. Впрочем, и здесь есть ориентиры, которые Министерство здравоохранения обозначило в своем ответе ФАН.
Есть шанс, что статистика следующих пяти лет будет заметно отличаться от нынешней в лучшую сторону. С точки зрения современного развития технологий, 2019 год может ознаменоваться переходом к новой эре оказания медицинской помощи онкобольным: каждый месяц практикующие врачи, ученые, фармацевты, инновационные предприниматели всего мира делают пусть незначительный, но шаг вперед к одной общей цели — победе человечества над раком.
Читайте также:

