Введение цитостатиков непосредственно в опухоль
Системная химиотерапия подразумевает введение цитостати- ков одним из способов общего, системного (резорбтивного) противоопухолевого воздействия (внутрь, внутривенно, внутримышечно, подкожно) в зависимости от их метаболизма и других особенностей фармакокинетики в организме.
Регионарная химиотерапия воздействие на злокачественные клетки цитостатика в высоких концентрациях с ограничением его поступления в другие органы путем подведения к опухоли через изолированный полностью или частично кровоток или по лимфатическим путям.
Инфузионная терапия предусматривает введение цитостатика через катетер в артериальный сосуд, питающий зону новообразования (рис. 11.8). Регионарная инфузионная терапия может быть выполнена при любых локализациях опухолей, но наиболее часто

Рис. 11.8. Инфузионная химиотерапия при раке языка (катетер введен в язычную артерию)
инфузии производятся в артерии: печеночную (метастазы в печень), внутреннюю подвздошную (опухоли тазовых органов), наружную и внутреннюю сонные (опухоли головы и шеи), верхних и нижних конечностей.
Преимущество внутриартериальных инфузий — подведение цитостатика к опухоли в повышенной концентрации, недостижимой при системной химиотерапии.
Перфузионная терапия — способ изолированной артериовенозной перфузии цитостатиков. Метод проводится только при локализации опухолей на конечностях, требует специальных технических приспособлений (сосудистые насосы, оксигенатор и др.).
Лимфохимиотерапия — способ лечения новообразований путем эндолимфатического введения цитостатиков. Из различных вариантов его наиболее перспективным является аутолимфохимио- терапия. При этом дренируется грудной лимфатический проток, забирается лимфа (около 500 мл), к ней добавляются химиопрепараты, смесь инкубируется в термостате (37 °С, 30 мин) и вводится через катетер в грудной проток (всего 3-5 введений). В основе метода лежит эффект стимуляции химиопрепаратами продукции цитокинов клетками лимфы с увеличением их цитотоксичности.
В основе местного воздействия используется идея ограниченного, недостижимого при системном введении, воздействия высоких концентраций цитостатиков непосредственно на опухоль.
Разновидности локальной химиотерапии:
- ? наружные аппликации препаратов в мазях, растворах или электрофорез цитостатиков непосредственно на поверхностные опухолевые очаги (однако очень немногие цитостатики обладают контактным действием и могут применяться наружно (эпикутан- но); в их числе — эмбихин, 5-ФУ, колхамин и проспидип);
- ? введение химиопрепаратов в серозные полости (внутриплев- ралыю, внутрибрюшиино и внутриперикардиально) при метастатических выпотах, устойчивых к системному лечению;
- ? иптратекальное (в ликворное пространство) введение цитостатиков строго ограничено случаями поражения мозговых оболочек у больных лейкозами и лимфомами;
- ? интравезикалыюе (в мочевой пузырь) введение цитостатиков проводится по специальным показаниям при раке мочевого пузыря.


- Что такое цитостатики?
- Классификация цитостатиков
- Как действуют цитостатики?
- Область применения цитостатиков
- Показания и противопоказания к применению цитостатиков
- Побочные эффекты цитостатиков
- Механизм действия цитостатиков
- Какие цитостатики назначают чаще всего?
Что такое цитостатики?
Цитостатики повреждают все быстро делящиеся клетки — любые злокачественные и нормальные клетки крови, костного мозга и половых желез. Со временем клеточные клоны вырабатывают устойчивость к цитостатикам, снижая результативность химиотерапии.
Классификация цитостатиков
Все цитостатические препараты разделены на 4 больших группы по механизму действия или происхождению:
- алкилирующие цитостатики, которые запутывают нити ДНК образованием внеплановых связок с ними;
- антиметаболиты внешне очень схожи с человеческими белковыми веществами, участвующими в клеточной жизнедеятельности, но в отличии от естественных, вмешательством своим приводят к клеточной гибели;
- противоопухолевые антибиотики по химическому происхождению такие же антибактериальные препараты, что мы используем для борьбы с воспалением и инфекциями, но на бактериальную флору они не влияют, зато убивают раковые клетки;
- цитостатики растительного происхождения имеют схожесть механизмов повреждения клеточных структур, но главное объединяющее начало — первоначальное их получение из растительного сырья, теперь большинство лабораторно синтезируется.
Гормоны никакого отношения к цитостатикам не имеют, поскольку их действие заключается в антагонизме с натуральными половыми гормонами либо в прямой или косвенной блокаде их выработки. Недостаток гормонов или подмена их антигормоном тоже приводит к клеточной гибели.
Как действуют цитостатики?
В конечном итоге все способы цитостатического воздействия приводят к одному — клеточному апоптозу. Апоптоз закономерный этап клеточной жизни, в отличии гибели при воспалении, инфицировании, некрозе. Это запрограммированная гибель, к ней приходит в своё время каждая клетка, а цитостатики приводят к ней вне программы. Каждый день в организме человека апоптозу подвергается 100 миллиардов клеток, можно считать, что каждые два года клеточный состав организма полностью обновляется. В упрощенном виде апоптоз представляется так:
Область применения цитостатиков
Цитостатики применяются при всех злокачественных опухолях, не исключая заболевания крови и лимфатической ткани, опухоли мозга и половых желез. Циклофосфан и антиметаболиты в несоизмеримо меньших дозах, нежели в онкологии, используются в ревматологии.
У каждого цитостатического препарата свой спектр противоопухолевой активности, к примеру, доксорубицин и фторурацил отлично работают при раке молочной железы, но неэффективны при мелкоклеточном раке легкого. Без фторурацила не обходится химиотерапия карцином кишечника, а доксорубицин бесполезен при них.
Показания и противопоказания к применению цитостатиков
Нельзя применять препараты при заведомой их неэффективности — вне спектра активности.
Временное противопоказание: воспалительные и инфекционные заболевания, остаточные осложнения после предыдущего курса лечения.
Сегодня выбор противоопухолевых средств настолько широк, что не составляет большого труда подобрать оптимальный препарат и даже комбинацию. Тем не менее, при неэффективности, как минимум, двух линий терапии и прогрессивном ухудшении состояния третий вариант химиотерапии не всегда целесообразен.
Побочные эффекты цитостатиков
Токсические реакции обусловлены повреждением нормальных тканей, как правило, очень чувствительны к цитостатикам:
- клетки крови, что клинически проявляется изменением в анализах, чаще всего лейкопенией и нейтропенией, тромбоцитопенией и много реже — анемией;
- костный мозг постепенно замедляет скорость восстановления ростков кроветворения, активная ткань замещается соединительной и жировой, а в анализах крови снижается уровень всех форменных элементов;
- слизистые оболочки реагируют некрозом с отторжением, что проявляется стоматитом, колитом, энтеритом, пневмонитом и воспалением венозного эндотелия;
- половые железы отвечают нарушением сперматогенеза и прекращением менструаций;
- придатки кожи — волосы выпадают, ногти грубеют и меняют свою структуру.
У препарата могут быть не только общие, но и индивидуальные токсические проявления, при которых избирательно погибают нервные клетки или почечные канальцы, гепатоциты или мышечные волокна сердца. Чувствительность к лекарствам очень индивидуальна, спектр и выраженность побочных реакций тоже разняться.
Механизм действия цитостатиков
Два ведущих механизма:
- изменение строения ДНК, в том числе аномальные скручивания, мешающие расходится нитям во время деления, а также нарушения репарации — восстановления непрерывности нити при повреждении;
- разлад клеточного деления — типичное для растительных препаратов нарушение формирования клеточного веретена, разводящего хромосомы в дочерние клетки.
Не только каждая группа, но и каждый цитостатик имеет собственный механизм противоопухолевого действия, а вернее, несколько механизмов повреждения, большая часть из которых неизвестна.
Какие цитостатики назначают чаще всего?
Назначаются только активно работающие при этой злокачественной нозологии и оптимальные в конкретном клиническом случае. Самый широкий диапазон активности у антибиотика доксорубицина, алкилирующих платиновых производных и циклофосфана, растительных таксанов и антиметаболитов фторурацила и метотрексата.
Клинические рекомендации предлагают использовать самые эффективные комбинации лекарств с оптимальным соотношением эффективности и токсичности. В нашей клинике мы подбираем цитостатическую терапию индивидуально — по чувствительности раковой опухоли. Мы не гарантируем отсутствия токсичности, но умеем минимизировать её проявления и ускорять восстановление нормальных тканей.
Книга “Новое в решении проблем онкологии”
Разработка общих вопросов химиотерапии и введение в практику новых противоопухолевых химиопрепаратов позволили в значительной степени поднять эффективность лечения больных злокачественными опухолями. Однако достигнутые результаты в химиотерапии злокачественных опухолей все еще неудовлетворительны, что побуждает к поиску новых, более эффективных препаратов и к отбору их оптимально высоких доз. В настоящее время ведется изучение эффективности использования высоких доз химиопрепаратов в комбинации с пересадкой аллогенного костного мозга и применение многокурсовой адъювантной химиотерапии, позволяющей поддерживать в сыворотке крови предельно высокую концентрацию лекарственного вещества. Последняя достигается также при регионарных методиках химиотерапии: внутриартериальной, внутриплевральной и внутрибрюшинной. Впечатляющий клинический эффект получен в РНИОИ при внутриартериальной химиотерапии раковых опухолей гортани, где цитостатики вводились в верхнюю щитовидную артерию (Чиж Г. П., 1968; Бирина Л. М., 1982). Внутриполостная химиотерапия является эффективной в отношении асцита при раке яичников и специфического выпота в плевральной полости (при диссеминированном раке молочной железы). Назначение высоких доз химиопрепаратов позволяет в ряде случаев получать лучший результат лечения при опухолях, резистентных к химиотерапии стандартными дозами.
Однако при применении высоких доз химиопрепаратов возникает угроза появления тяжелых осложнений, борьба с которыми часто бывает весьма сложной. Для профилактики развития токсических явлений со стороны органов кроветворения и желудочно- кишечного тракта введение высоких доз метотрексата внутривенно или внутриартериально целесообразно сочетать с назначением вовнутрь лейковорина.
Если применять цисплатин в комбинации с тиосульфатом, представляется возможным повысить дозу препарата в 2 раза.
Максимальную концентрацию химиопрепаратов в опухоли можно создавать только тем способом, который позволяет всю дозу химиопрепарата ввести непосредственно в опухолевую ткань.
Внутриопухолевая химиотерапия представляется сложной проблемой в клинической онкологии. Как известно, часть растворов химиопрепаратов относится к разряду хорошо переносимых нормальными тканями, и поэтому их вводят внутримышечно. В эту категорию входят циклофосфан, метотрексат, Тио-ТЭФ, проспидин и др. Другая группа химиопрепаратов плохо резорбирует в нормальных тканях, при введении их подкожно или внутримышечно обязательно образуется болезненный инфильтрат, который в последующем медленно рассасывается, или наступает некроз тканей. Лекарственные инфильтраты затрудняют определение истинных границ опухоли.
Терапевтические возможности внутриопухолевой химиотерапии изучены при визуальных локализациях злокачественных опухолей. Так, прослежен непосредственный эффект у 15 пациентов с верифицированным раком кожи, где лучевая терапия была не показана, а оперативное вмешательство технически неосуществимо. Во II стадии было 2, III — 7, IV — 6 пациентов. В раковую язву инфильтрировали смесь цитостатиков (циклофосфан и 5 – фторурацил) или один из химиопрепаратов (адриабластин или метотрексат). Частичная регрессия первичного очага отмечена в 11 наблюдениях, у 4 пациентов изменения размеров раковой язвы не наступило.
Приводим ряд клинических наблюдений, иллюстрирующих клинический эффект внутриопухолевой химиотерапии.
1. Больной С., 48 лет, на протяжении многих лет страдал многофокусным раком кожи, по поводу чего многократно подвергался оперативному лечению. Неоднократно консультирован в научно-исследовательских институтах Москвы и Ленинграда. При поступлении в клинику института: на коже грудной клетки, спины, верхних и нижних конечностей определяются 38 язв, размеры которых варьируют от 2×2 см до 10×12 см. Язвы глубокие, с валообразными и подрытыми краями, скудным слизисто-гнойным отделяемым. Гистоанализ — плоскоклеточный рак. Проведена внутриопухолевая химиотерапия метотрексатом. В течение месяца под влиянием внутриопухолевой химиотерапии наступило очищение и заживление 37 из 38 язв. Незажившая язва локализовалась на коже спины в верхнем отделе межлопаточного пространства, уменьшилась на половину своего размера.
2. Больной Ф., 78 лет, поступил в клинику по поводу глубокой язвы на тыле правой кисти 5×5 см с валообразными подрытыми краями. Гистологическое исследование — плоскоклеточный ороговевающий рак. Системная химиотерапия положительного эффекта не дала. Проведена внутриопухолевая химиотерапия метотрексатом, под воздействием которой язва очистилась и наступило быстрое ее рубцевание.
3. Больная К., 42 лет, госпитализирована для лечения рака кожи спинки носа с распространением на крылья носа. Анамнез заболевания — 6 мес. На коже спинки носа определяется опухоль 4×4 см, в центре которой глубокая язва со скудным гнойным отделяемым. Гистологическое и цитологическое исследование — плоскоклеточный рак. Проведена внутриопухолевая химиотерапия метотрексатом, под влиянием которой произошла полная резорбция опухоли и заживление язвы.
С меланомой кожи получили внутриопухолевую химиотерапию 5 человек: 1 больная получала адриабластин, 4 больным вводили блеомицин в комбинации с метотрексатом. У всех больных отмечен слабый непосредственный эффект.
Внутриопухолевая химиотерапия применялась у 22 больных с саркоматозными новообразованиями: мужчин было 3, женщин — 19, их возраст составлял от 30 до 70 лет. Гистологическая структура опухоли в данной группе больных: фибросаркома —6, липосаркома — 5, лимфосаркома —^ 2, рабдомиосаркома — 2, ангиосаркома — 2, прочие саркомы — 5. Различную степень регрессии под влиянием внутриопухолевой химиотерапии удалось получить у 20 из 22 пациентов, наиболее выражен клинический эффект при гистиоцитоме и эмбриональной липосаркоме. Более выраженная степень регрессии опухоли отмечается при использовании 4 цитостатиков: метотрексата, циклофосфана, адриабластина и 5-фторурацила.
Большой по объему опыт применения внутриопухолевой химио-терапии относится к местнораспространенному РМЖ, куда включены данные о лечении 90 женщин со степенью распространенности ракового процесса Т3—Т4. 48 из них имели отечно-инфильтративную форму злокачественного роста.
Изучалась эффективность 12 схем внутриопухолевой химиотерапии (включая моно- и поливарианты).
При узловатой форме роста (40 пациенток) в 1 случае имела место резорбция опухолевого узла, в 17 наблюдениях — регрессия его более чем на 50%. Меньшая степень регрессии отмечена нами еще у 20 больных. Лишь в 1 случае использования внутриопухолевой терапии размеры раковой опухоли не претерпели видимых изменений. Более выраженный клинический эффект имел место при введении метотрексата, Тио-ТЭФа и 5-фторурацила (регрессия опухоли во всех 9 наблюдениях).
Применение внутриопухолевой химиотерапии при отечно-инфильтративной форме РМЖ вызвало уменьшение инфильтрации кожи, ее гиперемию, способствовало увеличению смещаемости органа по отношению к окружающим тканям у 44 пациентов.
Регрессия инфильтрации и обретенная смещаемость молочной железы позволили выполнить в дальнейшем ее удаление. В более ранние сроки от начала внутриопухолевой химиотерапии регрессировали периферически расположенные очаги и зоны инфильтрации, а более выраженный клинический эффект отмечался при комбинации 5-фторурацила с циклофосфаном или Тио-ТЭФом.
Изучен терапевтический патоморфоз в саркомах мягких тканей и РМЖ, удаленных после предварительной химиотерапии. Так, в саркомах мягких тканей обнаружены однотипные изменения, степень выраженности которых была различной, что можно объяснить введением различных химиопрепаратов, их дозой, гистоструктурой самой опухоли, её избирательной чувствительностью к химиопрепаратам. В зоне распространения препарата обнаружены обширные бесструктурные участки с полями фибриноидного некроза (рисунок, д). По периферии от них определяются единичные клетки, а местами — полное их отсутствие. Вокруг очагов деструкции встречаются немногочисленные сосуды типа синусоидов. В клеточном компоненте опухоли, прилежащем к вышеописанным участкам деструкции, имелись дистрофические изменения, заключавшиеся в кариопикнозе, кариорексисе, кариолизисе, вакуолизации цитоплазмы вплоть до наличия клеток- теней. При окраске по Ван-ГизоА коллагеновые волокна не выявлены. Аргирофильная сеть выявлялась отчетливо, причем в области, прилегающей к поврежденной части опухоли, но имели место ее фрагментация, утолщение и извитость.

Химиотерапия внутриопухолевая в лечении злокачественных опухолей А. К. Панков, Е. М. Непомнящая 2
При раке молочной железы наблюдаются дистрофические изменения клеток: кариопикноз, кариорексис, в цитоплазме — вакуолизация с переходом в цитолизис (рисунок а, б, в, г).
Встречали обширные очаги коагуляционного некроза. В некоторых случаях имело место отложение солей кальция в виде мелких глыбок. Строма была представлена плотной волокнистой соединительной тканью, наблюдалась ее лимфоплазмоцитарная инфильтрация, степень выраженности которой была различной в каждом случае, что, вероятно, свидетельствует, с одной стороны, об индивидуальной чувствительности опухоли, а с другой — о степени иммунологического ответа всего организма. Наибольшие изменения под действием химиопрепаратов, введенных в опухоль, были выявлены при применении метотрексата в сочетании с адриабластином или циклофосфаном, а также 5-фторурацила с Тио-ТЭФом.
Полученные данные дают основание полагать, что внутри- опухолевое введение химиопрепаратов при саркоме мягких тканей и РМЖ вызывает патоморфоз опухоли.
Резюмируя данные о терапевтических возможностях внутриопухолевой химиотерапии, можно отметить ее несомненную эффективность при РМЖ, кожи, некоторых видах мягкотканных сарком.
Клинически наблюдаемая регрессия опухоли сопровождается наступающими под действием цитостатиков некробиотическими процессами в ней. Эти обстоятельства позволяют не только перевести злокачественный процесс в операбельное состояние, но и надеяться на улучшение ближайших результатов лечения — смещение сроков рецидива заболевания.
Лечение рака химиотерапией стоит на одном уровне с хирургическим методом лечения. На данный момент этот метод не ограничивается введением лишь лекарственных препаратов, внедряется иммунотерапия (введение Интерферона, вакцин, моноклональных антител) и генная инженерия.
- цитостатики воздействуют исключительно на опухоль, не повреждая здоровые клетки.
- лекарство поступает в необходимом количестве и концентрациях, необходимых для борьбы с опухолью.
- исключается токсическое действие химиопрепаратов на весь организм, минимальные побочные эффекты, связанные с распадом опухолевой ткани.
- может использоваться как самостоятельный метод лечения онкологических заболеваний, так и в комбинации с другими методами. Применяется в случаях неоперабельного рака.
Химиотерапия подразумевает использование природных и синтетических лекарственных средств, которые в свою очередь необратимо разрушают раковые клетки.

Химиопрепараты называют цитостатиками или цитостатическими лекарственными средствами. Цитостатики – это группа лекарственных препаратов, которые останавливают рост и деление раковых клеток, нарушая эти процессы, инициируют гибель раковых клеток. В зависимости от вида опухоли, наличия метастаз врач назначает либо один цитостатик (и тогда лечение называется монохимиотерпия) либо несколько (комбинированное лечение или полихимиотерпия). Полихимиотерапия имеет ряд преимуществ и успешно применяется в лечении лейкозов и лимфом. Полихимиотерапия используется при адъювантной и неадъювантной химиотерапии.
Неадъювантная – это использование цитостатиков до проведения хирургической операции с целью уменьшения размеров первичной опухоли и метастаз, расположенных в рядом примыкающих к оперируемой опухоли лимфатических узлах. Это сокращает объем операции.
Адъювантная - проводиться после радикальной операции по удалению первичного очага и служит своего рода методом профилактики возникновения рецидива.
С какой целью проводиться химиотерапия?
1. Использование химиотерапии в комбинированном лечении (вместе с хирургическим, лучевым) с целью достижения лучших результатов в лечении злокачественных опухолей.
2. Излечение. Достигается при полном разрушении раковых клеток.
3. При отказе пациента от искалечивающих хирургических операций.
4. С паллиативной (улучшение качества жизни) целью при быстро прогрессирующих операциях.
5. Для уменьшения или прекращения роста опухоли перед операцией.
При каких заболеваниях химиотерапия дает лучшие результаты?
Химиотерапия дает шанс на излечение пациентам с герминогенными опухолями и острым лимфобластным лейкозом (хориокарцинома матки, лимфома Беркитта, лимфогранулематоз, острый лимфобластный лейкоз у детей).

Химиопрепарат можно вводить в организм пациента по-разному, при обширном опухолевом процессе с метастатическим поражением органов используют системную химиотерапию. Цитостатики вводятся в внутривенно, внутримышечно, внутрь и лекарство воздействует на весь организм, так как попадает в общий кровоток. При регионарной химиотерапии цитостатики вводят непосредственно в артерию, кровоснабжающую опухоль. Локальная химиотерапия подразумевает нанесение цитостатика на поверхность кожи, введение в серозные полости (плевральную, брюшную).
После каждого курса химиотерапии врач назначает пациенту необходимые анализы и обследования, чтобы наблюдать за эффективностью проводимого лечения. Как правило, только после нескольких курсов химиотерапии можно судить о положительной или отрицательной динамике опухолевого процесса. Ни в коем случае не ориентируйтесь на свое общее состояния после курса цитостатиков, так как токсическое воздействие лекарства направлено не только на пораженные онкологией клетки, но и на здоровые, обладающие свойствами быстрого деления (волосяные фолликулы, слизистые прямой кишки и ротовой полости, красный костный мозг).
Бесплатно подобрать схему химиотерапии
Данная база по препаратам химиотерапии является известным Справочным руководством по противоопухолевой терапии.
Для поиска схемы химиотерапии выберите название заболевания и/или название одного или нескольких препаратов. Результат поиска выдаст подходящие схемы. Чтобы уточнить режимы приема препаратов, дозы и т.д., перейдите по ссылке "Смотреть подробнее".
Информация предназначена для практикующих врачей-онкологов и фармакологов.
Пациенту необходима дополнительная консультация онколога.
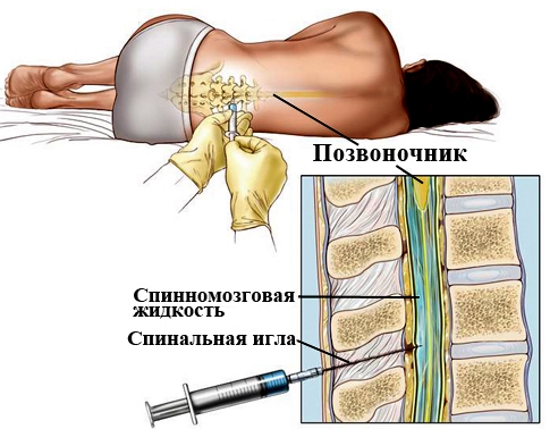
На сегодняшний день в медицине применяется несколько способов введения лекарственных препаратов в организм пациента. Один из них – это интратекальное введение. Второе название этой манипуляции – эндолюмбальное вливание. В отличие от парентеральной инфузии, данный метод предполагает доставку лекарственного препарата прямо в подоболочечное пространство головного мозга. Что такое – интратекальное введение препарата? В чем особенность данного метода вливания лекарств и как его осуществляют в больницах?
Зачем вводить препараты эндолюмбально
Лекарственные средства вводят в субарахноидальное пространство после прокола твердой оболочки головного мозга. Правом совершать данную манипуляцию наделен только нейрохирург. Изначально интратекальное введение медикаментов было вызвано необходимостью продолжительного обезболивания и эффективной гормональной терапии. Анестетики и кортикостероидные препараты вводят также в эпидуральное пространство.
Главные достоинства и недостатки интратекального метода
Основными преимуществами данного способа введения медикаментов нейрохирурги считают возможность обеспечить максимальную концентрацию действующего вещества в мозговых тканях и ликворе. Кроме того, интратекально можно ввести лекарства, которые не проникнут через гематоэнцефалическую перегородку. Благодаря вливанию лекарства непосредственно в концевую цистерну удается сократить дозировку активных компонентов и свести к минимуму их системное небезопасное воздействие.

Среди недостатков метода особое значение имеет сложная техника введения препаратов, которой обладают только опытные и высококвалифицированные нейрохирурги. В ходе проведения процедуры учитывается риск возможного перепада внутричерепного давления. Интратекальный путь введения – это способ доставить непосредственно к головному мозгу жидкие растворы. Эмульсии и суспензии невозможно ввести в ликвор данным методом. Еще одним недостатком можно отметить вероятность повреждения мозга, но при соблюдении правил проведения люмбальной пункции риск минимален.
При менингите
Наиболее распространенным поводом для проведения манипуляции является бактериальный менингит. Это опасное состояние, для которого свойственно воспаление мозговых оболочек. Если пациенту показано интратекальное введение, что это значит? Вероятнее всего, имеется острая необходимость в срочном применении антибактериальных средств. Чтобы ускорить действие антибиотиков и усилить терапевтический эффект, препараты вводят непосредственно в ликвор посредством пунктирования люмбального пространства.
Данную процедуру рекомендуется проводить только в том случае, если с момента парентеральной инфузии антибиотиков прошло более 72 часов, но улучшение состояния больного так и не наступило. Если в течение данного промежутка времени ни разу не проводилась санация цереброспинальной жидкости на фоне осуществляемой терапии, интратекальное введение противомикробных лекарств – обязательный шаг.
Какие антибиотики можно вводить прямо в ликвор
Подбор антибактериальных препаратов для эндолюмбального введения под субарахноидальную оболочку осуществляется исходя из разновидности возбудителя, его устойчивости к антибиотикам данной группы. При бактериальном менингите используют несколько антибактериальных препаратов в форме раствора для интратекального введения. Что это за медикаменты? В перечень самых эффективных входят:
Один из этих препаратов могут назначить до получения результатов бактериологического исследования. В случае появления симптомов токсического воздействия и снижения уровня белка в цереброспинальной жидкости антибиотик отменяют и назначают другой.
Растворы, которые нельзя вводить в субарахноидальное пространство
Кроме того, эндолюмбальное введение антибиотиков не отменяет необходимости проведения этиотропного лечения, которое больной получает внутривенно или внутримышечно. При подборе лекарственных средств обязательно учитывается склонность к аллергическим реакциям, особенности конкретных препаратов.
Прежде чем выполнить люмбальную пункцию, нейрохирург должен оценить степень отека головного мозга у пациента по результатам проведенной офтальмоскопии. Если отечность явно выражена, интратекальное введение в концевую цистерну не принесет значительных результатов. Более того, при отеке возрастает риск повреждения тканей головного мозга.
Введение цитостатиков при опухолях мозга
В цереброспинальную жидкость допускается эндолюмбальное введение химиопрепаратов при наличии у пациентов ряда онкологических заболеваний. К ним относят менингеальный карциноматоз, менингеальную лимфому, нейролейкоз и метастазы опухолей отдаленных органов.
При этом нельзя забывать, что интратекальное введение химиотерапии иногда приводит к осложнениям. Некоторые цитостатики, попав в субарахноидальное пространство, могут спровоцировать менингеальную реакцию различной степени выраженности. Ее подтверждением считают повышенное содержание белка при нормальном количестве глюкозы. Данное нарушение быстро проходит, но в некоторых случаях приводит к арахноидиту или миелиту. Точных сведений о частоте осложнений нет.
Подготовка к процедуре
Прежде чем вводить препараты эндолюмбально, врач должен оценить проходимость ликворного пространства после прокола твердой оболочки. С этой целью нейрохирурги проводят ликвородинамические пробы. Данный подготовительный этап имеет особое значение, если у пациента диагностированы опухолевые или метастатические поражения спинномозговых оболочек. Если ликворопроводящие пути заблокированы, медикаменты не смогут проникнуть к очагам поражения эндолюмбальным путем. К тому же миелотоксическое действие препарата может возрасти из-за невозможности равномерного распределения по ликвору.
Как правильно вводить препараты интратекально?
Методика применения лекарственных препаратов путем их вливания в субарахноидальное пространство заключается в выполнении нескольких этапов:
- Дозу основного действующего препарата необходимо развести в 2-3 мл физраствора (0,9%-го натрия хлорида).
- По завершении люмбальной пункции, проводимой на уровне позвонков L3-S1 (игла прокалывает эпидермис, межостистые и желтые связки позвоночных отростков и твердую спинномозговую оболочку), канюля шприца переставляется в павильон пункционной иглы.
- В шприц необходимо набрать 5-6 мл цереброспинальной жидкости, затем ввести в ликвор 2-3 мл препарата.
- Затем шприц повторно наполняют спинномозговой жидкостью и медленно вводят оставшееся содержимое.
- Пункционную иглу извлекают.
- Если состояние пациента является удовлетворительным, ему рекомендовано не вставать с постели в течение последующего получаса.
Системы для введения препаратов интратекальным путем
Система для интратекального введения была разработана несколько лет назад ростовскими нейрохирургами. Их изобретение оценили по достоинству ведущие российские специалисты в области нейроонкологии. Благодаря разработке пациенты с выраженным спастическим синдромом, возникающим на фоне злокачественных поражений головного и спинного мозга, различных травм, рассеянного склероза, инсульта, менингита, имеют возможность купировать боль и улучшить качество жизни. Из-за выраженного болевого синдрома у пациентов возникали тяжелые нарушения опорно-двигательного аппарата, вторичные необратимые фиброзные изменения в суставах.
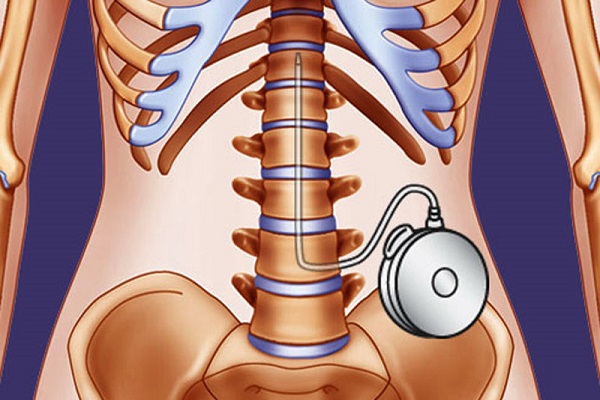
До применения интратекальных имплантируемых систем в лечении использовались методы физиотерапии, применялись пероральные миорелаксанты, которые оказывали лишь частичный терапевтический эффект.
Лечение хронического болевого синдрома опиатами
Операция выполняется следующим образом:
Устройство нуждается в перезаправке приблизительно один раз в несколько месяцев, о чем пациент будет уведомлен: если препарат закончился, помпа для интратекального введения пищит. Химиотерапия с помощью данной системы пока не проводится, но нейроонкологи уже работают над этим вопросом.
Читайте также:

