Вода в раковой опухоли какая структура
Вопрос: Скажите пожалуйста, какую воду лучше пить людям больным раком. Хотела приготовить с помощью шунгита, но в статье об этом минерале прочитала, что нельзя. Теперь не знаю что делать.
Вода – основа жизни. Вода образует в организме ту жизненно-важную среду, в которой протекают все биохимические реакции с участием ферментов, ионов металлов, растворённых питательных веществ, неорганическим солей и витаминов. С помощью воды из организма выводятся и вредные примеси. Подсчитано, что в течение всей жизни человек выпивает около 70 тонн воды. Врачи советуют в день потреблять не менее 2,5 – 3 литров воды, чтобы избавить организм от вредных примесей. Американские врачи недавно обследовали почти 50000 человек и обнаружили, что у мужчин, которые выпивали в среднем более 2,5 литра воды в сутки, риск заболевания раком мочевого пузыря был вполовину меньше, чем у тех, кто ограничивался всего литром жидкости. Получается, что каждый выпиваемый в день стакан воды снижает риск заболевания на 7%.
Однако, при определенных заболеваниях потреблять слишком много воды вредно. В первую очередь, это болезни, при которых пациент принимает лекарства-диуретики, которые заставляют почки выделять больше жидкости и соли: если такой больной будет бессистемно заливать в себя жидкость, у него может развиться гипонатриемия - состояние, когда концентрация натрия в крови понижена до опасного уровня. То же самое относится к людям, у которых из-за различных заболеваний повышен уровень андидиуретического гормона - вазопрессина.
Именно поэтому очень важно какую воду должен пить человек. Например, в населенных пунктах, где употребляется жесткая вода, содержащая много кальция и магния, люди чаще страдают болезнями сердца, инсультами, артритом, атеросклерозом и прочими недугами, обусловленными отложением солей.
Еще одна важная характеристика воды – кислотно-щелочной баланс (pH). Практически все жидкости, находящиеся в системе человеческого организма, являются либо нейтральными, либо слабощелочными, за исключением желудочного сока: рН желудочного сока составляет - 1,0; здоровой крови - 7,43; здоровой лимфы - 7,5; слюны - 7,4. Сдвиг равновесия в сторону повышения кислотности системы является одной из причин многих заболеваний. При этом отмечается заболевания крови, нарушения иммунной системы, быстро размножаются вирусы и бактерии, попавшие в кровь, плохо усваиваются витамины и микроэлементы, возникают заболевания сосудов, сердца, суставов, крови и многие другие патологические состояния организма, в том числе онкологические. Когда система организма ощелачивается и возвращается нормальный кислотно-щелочной баланс, человек начинает обретать здоровье. Организм постоянно ищет резерв щелочи для нейтрализации лишних кислот. Резерв этот только один - кости. Кальций, помещенный в любую жидкость, нейтрализует избыточную кислотность. Но сам по себе кальций из продуктов питания очень трудно усваивается организмом и на определенном этапе организм начинает брать его из костей, вызывая размягчение костей - остеопороз.
Если мы постоянно принимаем кислотообразующие продукты, это постепенно приводит к развитию ацидоза, т.е. происходит "закисление" крови, лимфы, межклеточной жидкости. Нарушается работа различных ферментов и обмен веществ в целом. Организм, пытаясь исправить положение, начинает активно забирать кальций из костей, но при нарушенном обмене веществ, он откладывается в различных местах (желчный пузырь, почки, позвоночник, суставы). Сотояние ацидоза нарушает, в том числе, процессы оксигенации. Поэтому значение рН имеет большое значение для воды.
Живая вода имеет щелочную реакцию, у нее pH>7. Реакция мертвой воды – кислая, pH 19 сентября 2009 15 января 2020
Много рекламы шунгита, а есть ли доказательства (исследования, сертификаты и тп) безопасности и пользы?
Словно вновь возникший орган. Вначале строение опухоли очень похоже на нормальную анатомическую структуру, но – не там, где надо, и не такое, какое должно быть.
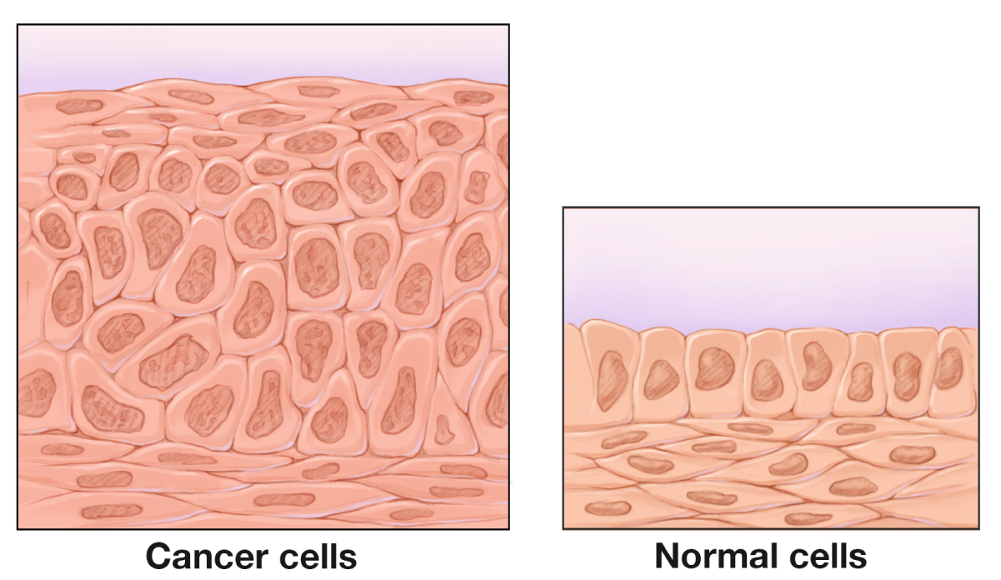
Слева – клеточная атипия, справа – норма
Строение опухоли
Возникшее и растущее в организме человека злокачественное новообразование внешне смахивает на необычный и неведомый орган, вдруг появившийся в нетипичном месте. В большинстве случаев на начальных этапах формирования строение опухоли – это 2 основные части:
- Паренхима (масса опухолевых клеток, как основа Карциномы);
- Строма (наружная оболочка, как граница между злом и добром).
У разных видов злокачественных новообразований могут быть внешние отличия и анатомические нюансы, но – общее строение опухоли практически во всех случаях одинаково: паразитирующий многоклеточный организм, окруженный со всех сторон капсулой.
Раковая опухоль
Основная часть опухолевого очага представлена множеством клеточных структур, которые с разной степенью выраженности отличаются от нормы. В лучшем случае – высокодифференцированные (очень похожие на исходную ткань). В худшем случае – низкодифференцированные клетки, которые сильно отличаются от нормальных клеточных структур организма.
Главный отличительный признак рака при гистологическом исследовании – атипичность, которая может быть:
- Клеточной (опухолевые клетки отличаются от нормы размерами, формой и внутренним содержанием);
- Тканевой (разруха, безумие и хаос в клеточных структурах, когда крайне сложно понять, какой была исходная ткань до возникновения раковой опухоли).
Важнейший признак злокачественности – инвазивный рост, когда опухолевая ткань преодолевает защитный барьер и начинает разрушать здоровые ткани организма. С того момента, как начинается прогрессирующее инфильтративное разрастание злокачественного новообразования, крайне сложно оценивать строение опухоли с точки зрения какой-либо нормальности.
Внешняя капсула
Строма практически всегда состоит из нормальных клеток. По сути, это баррикады и редуты, возведенные организмом для защиты от паразита. Ткань стромы – это фиброзные, соединительнотканные, мышечные и эндотелиальные структуры, разрастающиеся в ответ на негативное влияние опухоли.
Важный признак неустанно ведущейся битвы с паразитом – наличие в строме большого количества лейкоцитов.
В зависимости от толщины и размеров стромальной капсулы выделяют 3 варианта рака:
- Солидный (минимум защитных структур);
- Простой (средняя толщина – ни много, ни мало);
- Фиброзный (максимум стромального компонента вокруг опухолевой ткани).
Толщина стромы напрямую зависит от скорости роста опухоли и агрессивности рака. Солидное злокачественное новообразование – это быстрорастущие опухоли с неблагоприятным прогнозом, фиброзные – медленные виды карцином, в борьбе с которыми есть надежда на благоприятный исход.
На начальных стадиях формирования всё, как у других – паренхима + строма. Вначале строение опухоли похоже на хоть и странный, но обычный орган, неожиданно появившийся в нетипичном месте, но как только рак начинает активно прогрессировать, об анатомических сходствах можно забыть: зародившись изнутри из собственных клеток организма хозяина, со временем Карцинома превращается в чужеродного и хищного зверя с определенной степенью разумности.

Доктор медицинских наук В. ПРОЗОРОВСКИЙ.
В 1628 году английский врач Уильям Гарвей открыл кровообращение, а спустя некоторое время, в 1661 году, итальянский медик Марчелло Мальпиги — мельчайшие сосудики, капилляры, соединяющие артерии и вены у животных и человека. Сегодня наука о сердечно-сосудистой системе, ее функциях, заболеваниях — одна из ключевых в медицине, однако лишь недавно, в конце ХХ века, ученым пришло в голову, что кровеносные сосуды играют важную роль и в опухолевом росте. Теперь уже никто из медиков не сомневается, что раковая опухоль не может расти без постоянно образующихся вокруг нее новых сосудов.
Хотя post factum многое представляется само собой разумеющимся, но прошло немало лет, прежде чем медики догадались, что для интенсивного размножения опухолевых клеток нужны кислород и питательные вещества, поэтому быстрорастущая злокачественная опухоль требует крови больше, чем, скажем, липома, доброкачественная опухоль из жировой ткани. А значит, по мере развития раковая опухоль должна прорастать новыми кровеносными сосудами.
В 1971 году появилась статья американского хирурга Джуды Фолкмана, в которой впервые было высказано предположение, что рост опухолей, превышающих в диаметре несколько миллиметров, возможен только в случае формирования и прорастания в них мелких капилляров. В 1982 году американские ученые Ваупель, Каллиновски и Окуниефф показали, что во всех злокачественных опухолях действительно идет интенсивное новообразование сосудов. Верно и обратное — если образование новых сосудов прекращается, то дальнейший рост опухоли становится невозможен.
Открытие Фолкмана послужило началом целой череды научных достижений, в результате которых на свет явилась стройная теория ангиогенеза. Согласно ей образование сосудов в раковой опухоли, так же как и в любой поврежденной ткани, протекает в несколько стадий. Что же побуждает организм образовывать новые капилляры?
АКТИВАТОРЫ РОСТА НОВЫХ СОСУДОВ
Факторы роста совершенно необходимы здоровому организму для восстановления кровотока при различных повреждениях, но их избыток может стать роковым для онкологического больного. Повышение синтеза ФРЭС стимулирует метастазирование опухолей — под воздействием этого вещества раковые клетки выходят в кровяное русло и распространяются по всему организму. С другой стороны, ФРЭС играет и положительную роль — прорастающие в опухоли сосуды формируют в ней своеобразный мягкий скелет, который удерживает клетки на месте, не давая им метастазировать.
Кстати, при недостатке кислорода выработка ФРЭС и других факторов роста усиливается — ведь организму нужно скомпенсировать гипоксию увеличением кровотока. Отсюда можно сделать вывод об увеличении риска онкологических заболеваний при снижении концентрации кислорода в воздухе из-за уничтожения зеленых насаждений, загрязнения окружающей среды и т.д. Также доказано, что молекулы, вырабатывающиеся в организме человека при стрессе, одновременно стимулируют синтез ФРЭС. Этот факт наводит на мысли о пагубной роли нер-вного напряжения в возникновении раковых опухолей.
ВЕЩЕСТВА, ПРЕПЯТСТВУЮЩИЕ РОСТУ НОВЫХ СОСУДОВ
По счастью, помимо молекул, способствующих прорастанию опухоли сосудами, в организме синтезируются и собственные факторы, препятствующие росту сосудов (ингибиторы). В здоровом организме существует баланс между активаторами и ингибиторами роста новых кровеносных сосудов. При многих серьезных заболеваниях организм как бы теряет контроль над поддержанием этого равновесия. Смещение равновесия в сторону избыточного формирования новых сосудов происходит при онкологических заболеваниях, диабете, ревматоидном артрите и т.д. При таких опасных недугах, как заболевания коронарных артерий, инсульт, напротив, скорость роста новых сосудов явно ниже нормы.
Первым известным природным веществом, тормозящим рост новых сосудов, стал гликопротеин тромбоспондин, вырабатываемый различными клетками, в том числе и клетками стенок кровеносных сосудов. Тромбоспондин тормозит размножение и прикрепляемость эндотелиальных клеток, сдерживая таким путем рост капилляров.
В 1997 году тот же О’Рейли при исследовании культуры клеток злокачественной опухоли гемангиоэндотелиомы выделил еще один мощный блокатор формирования кровеносных сосудов — эндостатин. Это вещество является частью молекулы полипептида коллагена. Эндостатин активирует программируемую гибель эндотелиальных клеток и, вероятно, тормозит процесс их активации, размножения и миграции.
Помимо тромбоспондина, ангиостатина и эндостатина в органах и тканях животных исследователи обнаружили множество веществ, которые подавляют рост капилляров. К таким веществам относятся некоторые гормоны, фрагменты гепарина и др. Из известных природных ингибиторов можно назвать интерфероны, которые, кстати, борются и с вирусами. Однако как названные вещества, так и многие другие свойственные организму продукты обмена веществ обладают многофункциональным действием и из-за побочных эффектов не могут быть использованы в качестве лекарственных препаратов. Тем не менее интерес ученых к этой группе соединений не ослабевает.
"СОСУДИСТЫЙ" ПОДХОД К ЛЕЧЕНИЮ РАКА
Долгое время противораковая терапия была направлена лишь на подавление роста опухолевых клеток и усиление иммунного ответа. Сейчас уже ясно, что без формирования новых сосудов не может быть роста злокачественных опухолей. Лишенные возможности стимулировать образование новых капилляров, первичные и метастатические опухоли перестают расти. Поэтому появился новый класс ангиостатиков, то есть лекарств, тормозящих прорастание новых кровеносных сосудов. Такие соединения очень перспективны для борьбы со злокачественными опухолями на любой стадии их развития. Более того, существующие сейчас препараты эффективны по отношению к определенным опухолям, а блокаторы роста сосудов могут стать универсальным средством противораковой терапии, причем тем более эффективными, чем злокачественнее опухоль.
По противоопухолевой активности другой природный ингибитор — эндостатин сильнее, чем ангиостатин. Уже в малых дозах он предотвращает метастазирование крупных опухолей, а в больших — оказывает мощное тормозящее действие на рост первичных опухолей, таких, как карциномы, саркомы и меланома, вызывая в некоторых случаях их полную гибель. Очевидно, после разработки методов получения ангиостатина и эндостатина в промышленных масштабах эти препараты получат широкое клиническое применение, поскольку существенных побочных реакций при их использовании даже в больших дозах пока не выявлено.
Первый класс веществ, которые сейчас испытываются в качестве противоопухолевых препаратов, — соединения, непосредственно блокирующие рост эндотелиальных клеток. К этой категории веществ относится уже упомянутый природный белок эндостатин. Его синтетический аналог комбрестатин А4 — химическая модификация соединения, содержащегося в древесине южноафриканского дерева Combretum caffrum, — проходит клинические испытания. Препарат также проявляет способность подавлять размножение клеток сосудов, стимулируя клеточный апоптоз. В настоящее время большое внимание уделяется созданию веществ, блокирующих размножение уже активированных клеток эндотелия. Из них наиболее удачным по активности и малой токсичности является синтетический препарат TNP-470, прошедший клинические испытания при раке почек, шейки матки и саркоме Капоши.
Ко второй группе препаратов, тормозящих рост сосудов, относятся природные или синтетические вещества, так или иначе блокирующие передачу сигнала на рецепторы факторов роста. Как уже было сказано, ФРЭС взаимодействует с эндотелиальными клетками посредством специальных белковых структур — рецепторов. Клетки здорового организма к этим веществам — блокаторам рецепторов нечувствительны. Клинические испытания проходят препараты антител к ФРЭС, которые эффективно блокируют рецепторы ФРЭС, не давая молекуле фактора роста запустить биохимический каскад, приводящий к прорастанию новых сосудов. Уже понятно, что лекарственные препараты на основе антител замедляют опухолевый рост и продлевают жизнь пациентам. Фактически антитела к ФРЭС — пока единственное антиангиогенное лекарство, уже появившееся на мировом фармацевтическом рынке. Ученые также синтезировали несколько молекул — аналогов ФРЭС, блокирующих рецепторы. Эти вещества тестируются в онкологических клиниках.
На стадии клинических испытаний находится и печально известный препарат талидомид. Почти полвека тому назад он применялся в качестве снотворного, но вызывал уродства плода у беременных женщин. Как случайно выяснилось впоследствии, это было связано с нарушением образования необходимых для роста плода сосудов, хотя механизм действия соединения так и остался до конца не выясненным. Талидомид оказался эффективным при лечении больных миеломой, раком простаты и легких, саркомой и ганглиобластомой.
К третьей группе веществ, подавляющих прорастание сосудов, а следовательно, и рост опухоли, относятся блокаторы (ингибиторы) активности опухолевых ферментов — металлопротеаз, которые разрушают внеклеточный матрикс и оболочку сосуда, давая клеткам эндотелия возможность мигрировать в сторону опухоли. В недавнее время созданы вещества, которые блокируют ионы металлов, входящих в активный центр ферментов, выводя ферменты опухоли из строя и тем лишая ее способности расти. Разработка препаратов такого типа действия — приномастата, маримастата и СOL-3 — находится на стадии клинических испытаний.
Вопрос ранней диагностики онкологических заболеваний — принципиально важный. Ведь от этого зависит и успех лечения. Известно, что опухоли, обнаруженные на ранних этапах, более успешно устраняются, а выживаемость пациентов в этом случае существенно вырастает. Причем прогнозы по дальнейшей жизни в ремиссии достаточно высокие, если заболевание рано обнаружено и быстро ликвидировано доступными современным онкологам методами.

Отвечает главный врач медицинского центра, эндокринолог, онколог, хирург Вадим Колосюк:
— Тут однозначного ответа нет. Наверное, вопрос о том, какой рак диагностировать сложнее всего, звучит не совсем корректно. Тут, скорее, надо говорить о том, какие опухоли труднее распознать на ранних стадиях, начальных этапах, когда лечение было бы более успешным.
Вообще опухоли делятся на две группы — наружной и скрытой локализации. К скрытой относятся очень часто опухоли, которые трудно, практически невозможно диагностировать на ранних этапах. Это рак легкого, желудка и толстой кишки. Они лидируют в структуре заболеваемости, их рано найти сложно. Как правило, такие онкологические заболевания обнаруживаются лишь на поздних стадиях, когда уже есть какие-то симптомы. Для легкого, например, есть такой вариант скрининга, как флюорография. Но опухоли легкого делятся на центральные и периферические. Вторые встречаются, к сожалению, реже, при этом они легко диагностируются на флюорографии. А вот если говорить про центральные, то тут сложнее, так как они ползут по большим бронхам и их практически не видно при обследовании, соответственно, диагностировать тяжело. Для рака желудка и кишки также нет ранних методов. Потому что желудок мы обследуем преимущественно методом ФГДС (гастроскопии), а кишечник — посредством колоноскопии. Но всем подряд такие исследования не назначают и не делают. Поэтому такие варианты рака либо случайно выявляют, либо когда уже появились свои характерные симптомы — боли, кровянистые выделения, потеря веса и прочие признаки.

Есть сомнения у людей по поводу простой диагностики рака крови. Строго говоря, по терминологии это не рак, потому что рак — это образование из эпителиальных клеток. Раки крови называют лейкозами, это системное заболевание, когда самой собственно опухоли нет. При этом я бы тоже не сказал, что лейкозы сложно диагностировать. Во-первых, банальный анализ крови дает диагноз, а во-вторых, эти опухоли весьма агрессивны, они бурно развиваются, довольно быстро проявляют себя. Допустим, в качестве симптомов могут быть резкое снижение иммунитета, очень сильная анемия.
Если говорить про опухоли наружной локализации, их обнаруживать проще. Самыми распространенными называют рак молочной железы у женщин и простаты у мужчин. Здесь проще, потому что женщинам назначают ежегодно маммографию, мужчины простату также обследуют относительно часто. Так что в этих случаях вполне возможно на ранних стадиях выявить заболевание.
Пусть рак попятится



Корни уходят в древность
Подобный метод упоминался еще в индийских трактатах X — VIII веков до н.э. — опухоли брюшной полости тогда лечили прикладыванием нагретого камня. Практиковали такое и древние греки. Однако серьезные исследования в этом направлении стали проводить только во второй половине прошлого столетия. В Беларуси разработки в области гипертермии начались в 1960‑х годах под руководством члена‑корреспондента АМН СССР профессора Николая Александрова и профессора Семена Фрадкина.
Сейчас, когда счет пролеченных с помощью гипертермии пациентов идет на тысячи, можно с уверенностью утверждать: это работает, ведь эффективность лечения рака III — IV стадий возросла в 1,5 — 2 раза. Кстати, за разработку и внедрение методов лечения злокачественных опухолей с использованием гипертермии и искусственной гипергликемии в 1988 году коллектив сотрудников НИИ онкологии и медицинской радиологии им. Н.Н.Александрова получил Государственную премию БССР.
Общая и локальная

— Установка позволяет нагревать тело до 41 — 42,5 градуса и поддерживает нужную температуру во время всего сеанса, — отмечает заведующий лабораторией фотодинамической терапии и гипертермии с группой химиотерапии Дмитрий Церковский. — В среднем сеанс длится 4 — 5 часов. Глубина проникновения тепла достаточно большая — несколько десятков сантиметров, что позволяет повлиять на патологические процессы в организме.
При этом с пациентом все время находится целая команда врачей, которые наблюдают за его состоянием: онколог, анестезиолог, анестезистка и медсестра плюс инженер, ответственный за работу установки. После завершения сеанса общей гипертермии еще сутки человек наблюдается в специальной процедурной палате. Все‑таки нагрев происходит под общим наркозом, нужно проследить, чтобы не возникло осложнений. Хотя они иногда и возникают (к примеру, незначительные повреждения кожи и подкожной жировой клетчатки, тошнота, рвота, обострение хронических инфекций), в основном лечение переносится хорошо, метод безопасен.
Наши врачи накопили немалый опыт эффективного применения общей гипертермии в лечении сарком мягких тканей, меланомы кожи, почечно‑клеточного рака, неорганных опухолей забрюшинного пространства, нерезектабельного рака шейки матки, а также устойчивых к химиотерапии опухолей яичников.
А вот при проведении сеанса локальной гипертермии нагревается не все тело, а лишь та часть, где находится опухоль. Причем пациент все время находится в сознании. В этом случае используется немецкая гипертермическая установка Celsius TCS. Такой подход повышает эффективность химиотерапии и лучевой терапии и помогает перевести неоперабельные опухоли в операбельное состояние, чтобы уменьшить объем операции.
Как при общей, так и при локальной гипертермии одним сеансом не обойтись. В среднем это 4 — 6 процедур в зависимости от вида рака и его стадии, с интервалами в 3 — 4 недели.
— Максимальное количество сеансов, которые мы проводили для одной пациентки, — 12, — рассказывает онколог первой квалификационной категории Александр Мазуренко. — Это был очень сложный случай меланомы кожи с метастазами во все органы и ткани. Лечение с применением общей гипертермии проводилось с интервалами в 1,5 месяца. Таким образом мы продлили пациентке жизнь более чем на год. К сожалению, пока не существует никаких маркеров, чтобы с уверенностью сказать, будет ли эффективна гипертермия в отношении каждого конкретного случая. Каждый организм отвечает на терапию индивидуально.
Только комплексом
♦ Далеко зашедшие и распространенные формы злокачественных новообразований, когда традиционные методы лечения малоэффективны.
♦ Неоперабельные формы опухолей.
♦ Злокачественные опухоли, устойчивые к химио‑ и лучевой терапии.
♦ повысить противоопухолевую эффективность химиотерапии и лучевой терапии;
♦ перевести неоперабельные опухоли в операбельное состояние и уменьшить объем операции;
♦ увеличить продолжительность жизни пациентов и повысить ее качество;
♦ снизить частоту местных рецидивов и риск появления отдаленных метастазов;
♦ достигнуть клинической ремиссии на поздних стадиях заболевания.
О раке так или иначе слышали все. Кто-то видел сообщения в социальных сетях, кто-то помогал пережить эту болезнь родным и близким, а кто-то столкнулся с ней лицом к лицу.
В любом случае рак пугает. Большая часть страхов рождается из-за неправильных представлений о заболевании или просто неведения. Мы в Атласе верим, что знание — сила, поэтому подготовили серию статей, где расскажем о раке: как он образуется, можно ли его предотвратить, и как выстроить процесс лечения.
Сегодня рассказываем, что такое рак, как он развивается и почему его так трудно победить.

Автор иллюстраций Майкл Ковальски
Перед тем как рассказать о механизме образования опухолей, разберемся немного с терминологией и вспомним, как обновляются здоровые клетки и ткани организма.
Почему рак так называется
То что пациенты называют раком, на языке медицины означает онкологическое заболевание или злокачественную опухоль. Опухоль, неоплазия или новообразование — это скопление атипичных клеток, которые бесконтрольно делятся и отказываются умирать.
Помимо карциномы к злокачественным опухолям относится саркома, меланома, лейкоз и лимфома. Саркома — злокачественная опухоль из соединительной ткани. К соединительной ткани относятся мышцы, связки, хрящи, суставы, кости, сухожилия, глубокие слои кожи. Меланома — злокачественная опухоль из меланоцитов (клеток кожи). Лейкоз или лейкемия — злокачественное новообразование кроветворной ткани, а лимфома — лимфатической.
Как обновляются здоровые клетки и ткани
Все органы и ткани человека состоят из клеток. Они имеют одинаковую ДНК, но принимают разные формы и выполняют разные функции. Одни клетки воюют с бактериями, вторые переносят питательные вещества, третьи защищают нас от воздействия внешней среды, из других состоят органы и ткани. При этом почти все клетки обновляются, чтобы организм человека рос, функционировал и восстанавливался после повреждений.
Обновление клеток регулируют факторы роста. Это белки, которые соединяются с рецепторами на мембране клетки и стимулируют процесс деления. Когда новая клетка отделяется от родительской, в ней запускается каскад реакций, и она получает специализацию — дифференцируется. После дифференцировки в клетке активны только те гены, которые определяют ее форму и предназначение. Можно сказать, что теперь у клетки есть персональная инструкция, что и как делать.
Все ткани обновляются с разной скоростью. Клетки центральной нервной системы и хрусталика глаза не делятся совсем, а клетки эпителия тонкого кишечника полностью меняются каждые 4–5 дней. Ткани, которые постоянно обновляются, содержат слой стволовых клеток. Эти клетки не имеют специализации, а могут только делится и создавать либо свою копию без специализации, либо дифференцированную клетку той ткани, в которой они находятся.

Как клетка становится злокачественной
Во время деления или из-за воздействия повреждающих ДНК соединений, в геноме клетки происходит примерно 10 тысяч ошибок в день. Но наш организм умеет с ними справляться. Специальные ферменты ремонтируют поломки или запускают программу апоптоза. Если изменение осталось без починки, в цепочке ДНК сохраняется мутация.
Мутация — это изменение в ДНК, которое передается другим клеткам. Мутации бывают наследственными и соматическими. Наследственные мутации случаются только в половых клетках и передаются следующему поколению.
Гораздо чаще мутации происходят в остальных клетках. Соматические мутации случаются независимо друг от друга в разных клетках организма и не передаются по наследству. Некоторые факторы заметно увеличивают частоту соматических мутации. Сигаретный дым, ультрафиолет, радиационное излучение и ретровирусы — мощные мутагены, которые могут привести к мутациям в ДНК.
Когда клетка с мутацией делится, дефективная ДНК удваивается и передается новой клетке. Если в ней происходит еще одна мутация, она добавляется к уже имеющейся. Таким образом соматические мутации накапливаются в разных клетках тела на протяжении всей жизни. Этим объясняется старение человека и образование злокачественных опухолей. Кстати, они тесно связаны между собой: с возрастом риск развития злокачественной опухоли увеличивается.
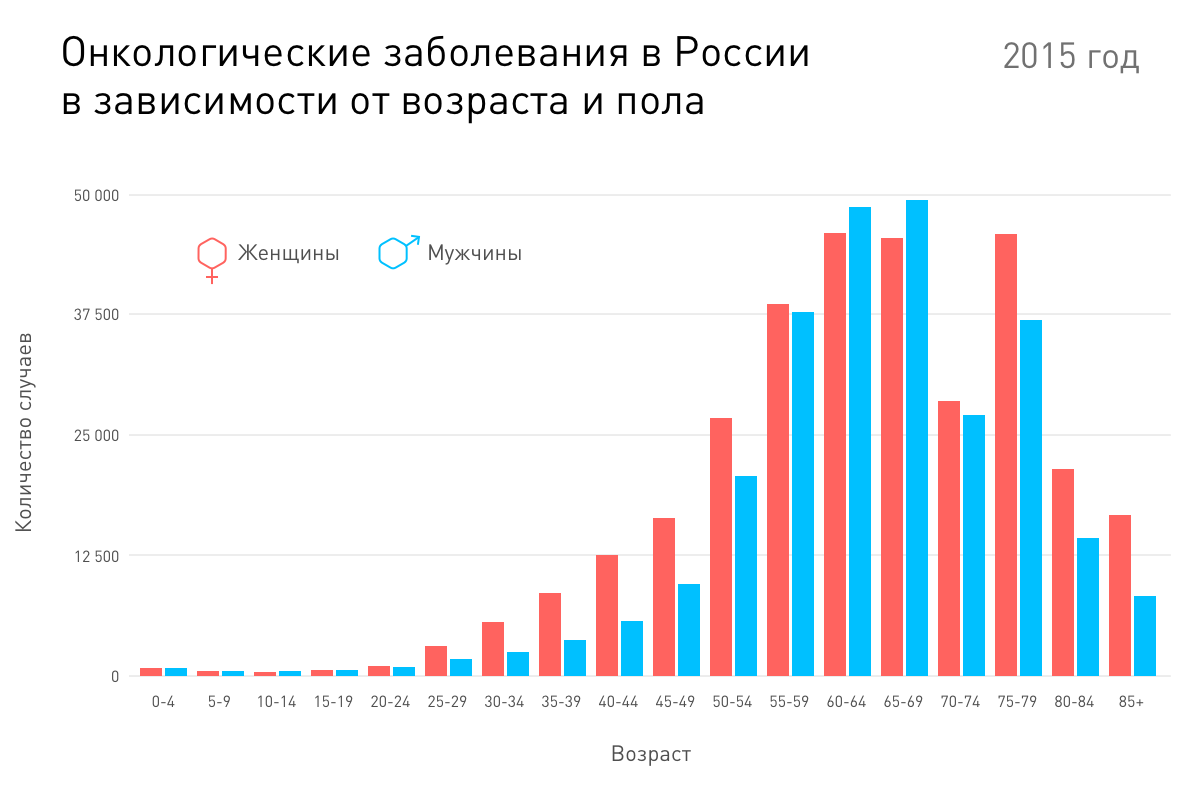
Статистика МНИОИ им. П.А. Герцена.
Какие мутации приводят к раку
Представьте, что в одной клетке случилось несколько мутаций. Первая затронула гены, которые отвечают за деление, а вторая — нарушила механизм запуска апоптоза. Если эти две мутации встретятся, то мы получим клетку, которая постоянно делится и отказывается умирать.
Гены-супрессоры опухолевого роста и протоонкогены — это гены, которые регулируют деление, дифференцировку и апоптоз. Здоровая клетка использует эти гены, чтобы определить, чем ей стать, какие функции выполнять и когда умирать. Когда эти гены повреждены, у клетки нет доступа к инструкции, и она становится неуправляемой.

Сегодня известно около 40 протоонкогенов, и 14 из них связаны с высоким риском развития опухоли. Как пример, ERBB2 (HER-2) часто мутируют при раке молочной железы, KRAS — при раке поджелудочной железы и толстой кишки, BRAF — при меланоме.
Самый известный ген опухолевой супрессии — BRCA1. Мутации этого гена повышают риск развития рака молочной железы и рака яичников. Другой известный ген-супрессор TP53: мутации в нем выявляют в половине случаев рака.
Как развивается злокачественная опухоль
Бессмертные клетки продолжают делится — и опухоль растет. Скопление клеток перерастает в дисплазию — нетипичное для ткани новообразование. Неинвазивная опухоль или рак in situ означает, что новообразование еще не проросло через тонкую границу между эпителиальной и соединительной тканью (базальную мембрану). Для этой стадии характерно равновесие, о котором мы подробнее расскажем позже. Нарушение базальной мембраны — первый признак злокачественного процесса.
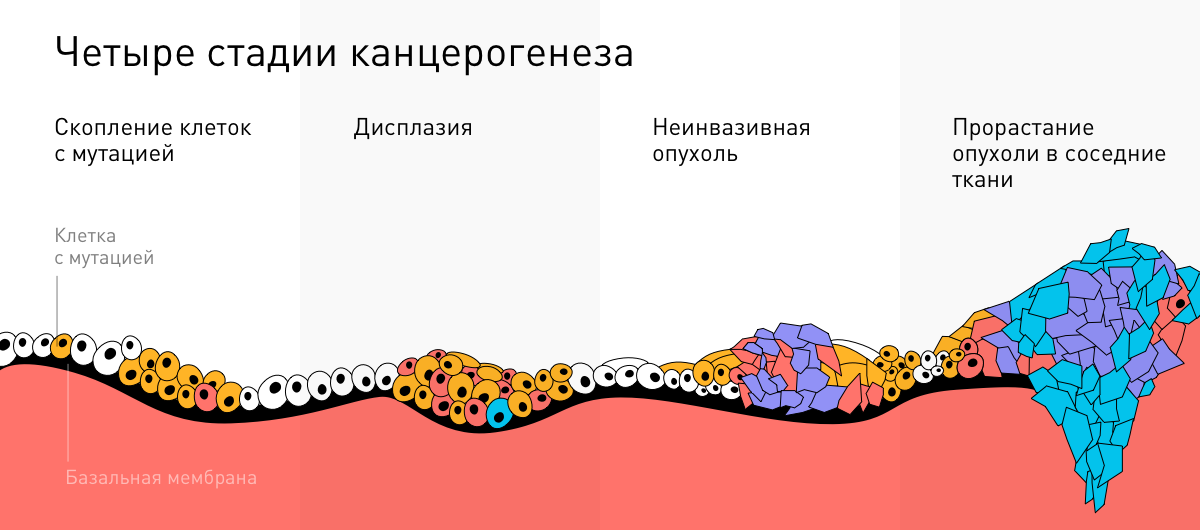
nccs.com
Злокачественная опухоль не может расти дальше, пока не получит доступ к питательным веществам. Поэтому клетки опухоли выделяют различные факторы роста, но самый важный из них — фактор роста эндотелия сосудов (VEGF). Он стимулирует образование сети капилляров, через которые клетки получают доступ к питательным веществам. Теперь опухоль может прорастать в окружающие ткани и разрушать их.
В злокачественной клетке продолжают происходить повреждения ДНК, но они не восстанавливаются. Клетка тратит все ресурсы на бесконечное деление. Из-за постоянных мутаций в опухоли появляются клетки с самыми разными формами и свойствами.

Организм пытается бороться с опухолью, и условия среды для злокачественных клеток постоянно меняются. Выживают и делятся дальше только те злокачественные клетки, которые могут противостоять переменам. Можно сказать, что среди клеток злокачественной опухоли происходит естественный отбор.
По мере деления в новообразовании появляются стволовые клетки опухоли. Они могут копировать сами себя и производить обычные клетки злокачественного новообразования. Опухолевые стволовые клетки трудно поддаются уничтожению во время лечения, что приводит к рецидивам.
Со временем в результате отбора появляется клетка способная открепиться от опухоли, найти подходящее место для вторичного очага, чтобы начать делиться в новой среде. Так формируется метастаз.
Не все опухоли состоят из злокачественных клеток. Доброкачественные клетки отличаются тем, что частично или полностью сохраняют свою специализацию. Они медленно делятся, точно копируют ДНК и остаются похожими на клетки исходной ткани. В доброкачественной опухоли продолжает работать репарация ДНК, не происходит такого количества мутаций и естественного отбора, поэтому такая опухоль легко поддается хирургическому лечению. Но из-за дополнительных мутаций клетки доброкачественных образований могут превратиться в злокачественные. Например, из-за воздействия ультрафиолета родинки могут переродиться в меланому (злокачественное новообразование кожи).
Почему иммунитет не справляется со злокачественной опухолью
Еще одна особенность злокачественных опухолей — реакция на них иммунной системы. Различают три стадии ответа иммунной системы:
Устранение. Поврежденные клетки экспрессируют на своей поверхности опухолевые антигены, на которые реагируют главные стражи иммунной системы — макрофаги и лимфоциты. Они находят и уничтожают врага. На этой стадии опухоль не может прорасти в окружающие ткани, потому она называется неинвазивной или опухолью in situ (на месте).
Равновесие. Некоторые клетки начинают маскироваться — синтезировать меньшее количество антигенов. Иммунная система не может их найти и уничтожить, но распознает остальные злокачественные клетки. В стадии равновесия иммунитет не может справиться с опухолью полностью, но ограничивает ее рост. Это состояние может длиться годами и никак себя не проявлять.
Бессилие. Из-за генетической нестабильности в опухоли постоянно рождаются клетки с разными мутациями. Поэтому рано или поздно появляются клетки-иммуносупрессоры, которые отражают атаку клеток иммунной системы и подавляют иммунитет.

Как появляется метастаз
Вторичный очаг роста злокачественной опухоли называется метастазом. Метастазирование — это сверхспособность злокачественной опухоли; сложный процесс, к которому опухоль долго готовится.
Сначала злокачественные клетки выделяют специальные пузырьки — экзосомы. Они путешествуют по всему организму, находят подходящую для метастаза ткань и готовят ее к приходу раковых клеток. Так в нормальной ткани образуется привлекательная ниша, где злокачественные клетки могут осесть и начать делиться. Иногда раковые клетки напоминают самообучающийся исскусственный интеллект, но это не так.

Также некоторые клетки способны выделять специальные сигнальные молекулы, которые перепрограммируют макрофаги. Часть из них перестает бороться и начинает воспринимать опухоль как поврежденную ткань. Такие макрофаги выделяют разные факторы роста, которые помогают клеткам опухоли делиться. В этой стадии иммунные клетки разделяются на два противоположных лагеря: одни продолжают разрушать опухоль, а другие помогают ей расти. Это переломный момент, после которого опухоль начинает увеличиваться и метастазировать.
Злокачественная клетка не может просто открепиться от опухоли и начать путешествовать по организму. Она должна уметь отсоединяться от других клеток, проникать в глубину окружающих тканей, выживать после попадания в кровеносные и лимфатические сосуды. Для этого злокачественные клетки выделяют специальные вещества, которые позволяют им двигаться, разрушать клетки других тканей и прятаться от иммунной системы.
Вместе с лимфой злокачественные клетки попадают в лимфатические узлы. Лимфоциты в них пытаются остановить и уничтожить врага, чтобы он не прошел дальше. Из-за воспалительного процесса, лимфоузлы увеличиваются, а большинство раковых клеток погибает. Выжившие клетки могут осесть в ткани лимфоузла и дать метастаз. Как правило, клетки злокачественной опухоли сначала поражают ближайшие лимфоузлы и только затем добираются до отдаленных.
Злокачественные клетки продолжают искать подготовленную ткань по мере продвижения по организму. Большинство из них погибает в непривычной среде, поэтому поиски могут идти долго. Но рано или поздно появляется клетка способная выйти из кровеносного или лимфатического сосуда, прикрепиться к подготовленной ткани и начать делиться на новом месте. Так образуется вторичный очаг или метастаз.
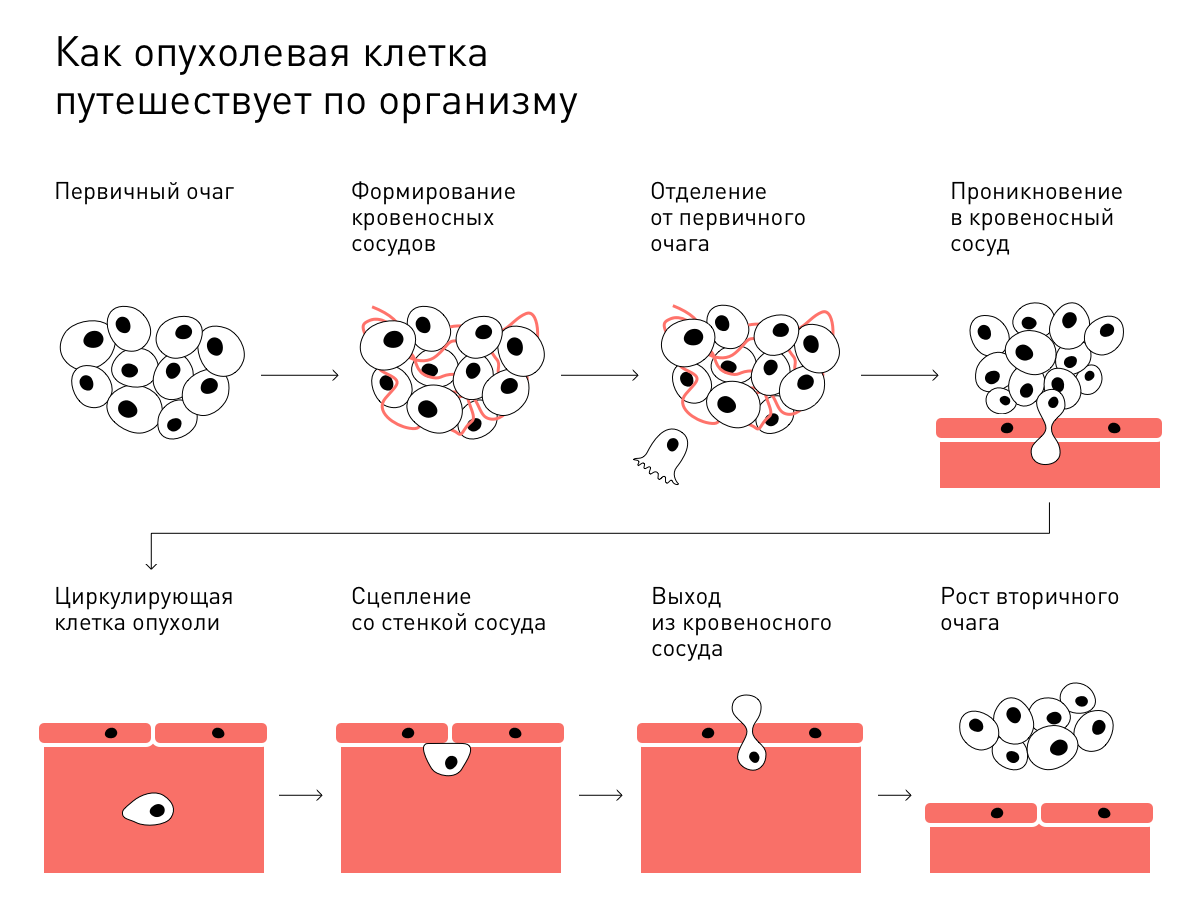
Схематичное изображение клетки злокачественной опухоли, которая может дать метастаз.
Researchgate.net
У разных видов злокачественных опухолей есть любимые места для метастазирования. Например, рак молочной железы часто метастазирует в легкие, печень, кости и головной мозг. Название болезни всегда связано с первичной опухолью и не зависит от мест метастазирования.
Что значит четвертая стадия рака и почему она самая опасная
Для диагностики крайне важно оценить тип, степень распространенности, дифференцировки и скорость роста злокачественной опухоли. Для этого существует международная классификация TNM.
T — tumor (опухоль). Рядом с буквой Т может стоять число от 0 до 4, которое характеризует распространенность первичной опухоли. T0 — опухоль нельзя определить. Чем выше число, тем больше размер опухоли и вероятность прорастания в окружающие ткани. Tis — обозначение для неинвазивной опухоли.
N — nodes (узлы). От 0 до 3. Говорит об отсутствии, наличии или степени распространенности метастазов в региональных лимфатических узлах. Если метастаз появился в отдаленном лимфоузле, он относится к критерию M.
M — metastases (метастазы). Отдаленные метастазы либо есть — M1, либо их нет — M0.
Если какой-то из компонентов системы нельзя измерить, то рядом с буквой ставится символ X.

Epomedicine.com
Классификация TNM позволяет определить стадию опухолевого процесса.
Первая стадия — небольшая опухоль в месте возникновения. Вторая стадия — увеличенная опухоль, которая проросла в окружающие ткани и возможно метастазировала в ближайшие лимфатические узлы. Третья стадия — довольно большая опухоль, которая метастазировала в ближайшие лимфатические узлы. Четвертая стадия — опухоль с метастазами в других органах и тканях.
Как правило, невозможно полностью вылечить опухоль на четвертой стадии: лекарственная терапия позволяет только замедлить течение болезни. Таким больным оказывают паллиативную помощь, ее задача — повысить качество жизни пациента.
Как бороться с раком
Злокачественная опухоль кажется монстром, который использует все силы и функции организма себе во благо. Но не стоит забывать, что появление этого монстра можно предотвратить, если знать о своих рисках и мерах профилактики.

Кроме профилактики важно проходить регулярные обследования, чтобы диагностировать злокачественное новообразование на ранней стадии. Пока опухоль не успела распространиться в другие ткани и органы, она поддается лечению.
В следующей статье Атлас подробно расскажет, как снизить риски развития злокачественных новообразований, а также даст инструкцию, когда и какие обследования проходить, чтобы обезопасить себя.
А пока предлагаем пройти тест от Фонда профилактики рака. По его результатам можно примерно оценить риски развития злокачественных опухолей.
Читайте также:

