Виферон при раке шейки матки
Зинченко М.В, Жиганова Н.В.
Применение иммунокорригирующих препаратов Ликопида и Виферона
в процессе лучевого лечения рака шейки и тела матки.
Тверской областной клинический онкологический диспансер.
В настоящее время во всем мире отмечается отчетливая тенденция к увеличению заболеваемости злокачественными новообразованиями. За последние 10 лет почти вдвое возросла заболеваемость злокачественными новообразо ваниями женской половой сферы. В настоящее время лучевая терапия в качестве самостоятельного метода или в сочетании с операцией назначается большинству онкогинекологических больных. Лучевое лечение опухоли любой локализации оказывает угнетающее воздействие на Т-систему иммунитета, состояние естественной реактивности организма и гормональный гомеостаз.
Целью настоящей работы является оценка применения комбинации отечественных иммунокорригирующих препаратов (ИП) Ликопида и Виферона в процессе лучевого лечения рака шейки и тела матки. Было изучено влияние препаратов на качество жизни и наличие лучевых реакций у больных раком шейки и тела матки.
Обследовано 20 больных раком эндометрия: I - II стадия – 15 больных , III стадия – 5 больных; и 20 больных раком шейки матки: II стадия – 10 больных, III – 10 больных, проходивших лечение в Тверском областном онкологическом диспансере и дальнейшее наблюдение в Тверском областном онкологическом диспансере в период 2008-2009 гг. В контрольную группу вошли 20 больных раком эндометрия и шейки матки не получавших ИП.
В зависимости от избранного метода лечения 60 больных разделили на две основные группы: I - ая группа – группа контроля, состоит из 20 пациенток; в этой группе проведено лечение по общепринятой методике, без включения в программу ИП; II - ая группа – состоит из 20 больных раком шейки матки, которым проведено лечение по той же стандартной схеме в сопровождении ИП; III группу – составляли 20 больных раком эндометрия, которым проведено лечение по той же стандартной схеме в сопровождении ИП.
Пациентки II и III групп с 1-го дня лучевого лечения получали Ликопид по 10мг 1 раз в день 10 дней и виферон (500000 МЕ в одной свече) по 1 свече 2 раза в день 10 дней per rectum , повторный курс иммунокоррегирующего лечения больным проводился за 10 дней до окончания лучевой терапии в том же режиме. Качество жизни нами оценивалось с учетом шкалы Карновского . Оценка качества жизни больных проводилась до начала лечения, в процессе лечения и дальнейшего диспансерного наблюдения.
Было показано, что до начала лечения в ТОКОД качество жизни у 75% пациенток группы контроля составило по шкале Карновского 80 % и выше, у 20 % этот показатель был равен 70 %, у 5 % женщин качество жизни было оценено как 60 % и ниже.
После проведения лечения по общепринятой программе, у 3 (15 %) из 20 обследованных пациенток группы контроля качество жизни составило по шкале Карновского 100 % (отсутствовали жалобы и признаки заболевания), у 5 женщин ( 25%) эт от показатель был равен 90 %, у 2 больных (10 %) – 80 %, у 5 женщин – 70 %. У 5 пациенток этот показатель был 60% и ниже. Во II группе качество жизни 10-90% имели 50% пациенток, 80% – 15 %, 70% – 25%, 60% и ниже – 10%. В III группе соответственно 50%, 10 %, 20% и 20%. Таким образом, после проведения лучевой терапии на фоне иммунокоррегирующего лечения по сравнению со стандартной терапией без иммунокоррекции количество женщин, имевших качество жизни по шкале Карновского 80% и более, увеличилось в среднем на 12,5%.
Лучевые реакции в процессе лучевого лечения не носили выраженного характера, однако у отдельных пациенток развитие осложнений требовало использования средств сопроводительной терапии и изменения объема и сроков проведения лечения. Было выявлено, что применение ликопида и виферона во время проведения лучевой терапии уменьшало тяжесть и частоту возникновения лучевых осложнений. Явления общей вегетативной лучевой реакции, выражавшиеся в снижении аппетита, головной боли, тошноте, общей слабости, недомогании и субфебрильной температуре тела, наблюдались у больных, получавших ИП на 5 % реже, чем в контроле. Одновременно отмечено, что при использовании ИП снижались частота абактериальных циститов на 10 %, катаральных циститов на 10 %, поздних лучевых реакций мочевого пузыря на 5 %.
В процессе лучевой терапии с включением ИП, число пациенток с нарушением аппетита снизилось на 30 %; вкусовыми извращениями - на 10 %; тошнотой - на 20 %; болями в животе - на 10 %. Частота ранних лучевых осложнений со стороны желудочно-кишечного тракта при назначении ИП в период проведения лучевой терапии снижалась на 5 %. Применение ИП позволило уменьшить число пациенток, у которых появлялись катаральные ректиты в среднем на 5 %, избежать развития эрозивных ректитов .
Проведенное нами исследование показало, что включение иммуномодуляторов в комплексную терапию рака шейки матки и эндометрия существенно повышает качество жизни больных. Применение комбинации препаратов Ликопид + Виферон позволило снизить количество осложнений лучевой терапии.
Данные работы демонстрируют целесообразность применения комбинации отечественных иммунокорригирующих препаратов Ликопида и Виферона в процессе сочетанного лучевого лечения рака шейки и тела матки.
Изобретение относится к медицине, в частности к онкологии, и может быть использовано для лечения рецидивов рака шейки матки. Для этого в течение 10 дней за 10 часов до проведения ежедневного сеанса облучения промежностным полем вводят во влагалище тампоны с лечебным составом, содержащим 2,5 мл мази виферона, 2,5 мл льняного масла, 15 мг доксорубицина, 30 мг метотрексата и 500 мг гидроксимочевины. Способ обеспечивает повышение местной концентрации химиопрепаратов, активизацию местного звена иммунитета при уменьшении побочных эффектов химиопрепаратов и лучевой терапии.
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения больных раком шейки матки с рецидивным процессом.
Известным традиционным способом лечения рецидивов рака шейки матки являются хирургическое вмешательство, повторная лучевая терапия, химиотерапия.
Однако применение хирургического метода лечения при рецидиве рака шейки матки центральной локализации ограничено в силу большого числа противопоказаний. К ним относятся: 1) боли в области седалищного сплетения, которые обусловлены сдавлением его опухолевым инфильтратом; 2) прогрессирующий отек нижних конечностей из-за сдавления наружной или общей подвздошной вены; 3) сдавление мочеточников, гидронефроз; 4) отдаленные метастазы, в том числе в поясничных лимфатических узлах; 5) ожирение, в связи с повышением хирургического риска и техническими трудностями операции.
При выборе метода лучевой терапии рецидивов рака шейки матки наибольшее значение имеют предшествующие лечения, а также локализация и степень распространенности процесса. Лучевое лечение возможно в тех случаях, когда оно ранее не применялось либо было заведомо неадекватным по дозовой нaгрузке.
Вместе с тем, у больных с центральной локализацией местного рецидива после лучевого лечения, ограниченного шейкой матки и влагалищными сводами, повторное облучение малоэффективно, связано с высоким риском образования пузырно-влагалищных и прямокишечно-влагалищных свищей, а к длительному излечению может приводить лишь использование достаточно больших поглощенных доз, подводимых к рецидивному узлу.
Известен способ лечения местных рецидивов рака шейки матки, включающий дистанционную гамма-терапию в СОД до 40 Гр. при динамическом фракционировании разовой дозы, на фоне которого осуществляют внутривенное введение:
цисплатин — суммарная доза 90 мг/м 2 за 3 дня на фоне гипергидратации;
5-фторурацил — суммарная доза 250-3750 мг за 5 дней (Дунаева Е.А… Авт. дисс….докт.мед.наук.Томск, 1999).
Однако эффективность использования указанной схемы при рецидиве рака шейки матки не превышает 30-40% по данным авторов, а процент полной регрессии составляет 25%. Применение дополнительно 1-3 курсов полихимиотерапии обеспечивает 1, 2 и 3-х летнюю выживаемость соответственно у 41, 33 и 18% пациенток. Три года прожили 3 из 17 больных с рецидивами рака шейки матки.
Вторым существенным недостатком применения схем полихимиотерапии, включающих препараты платины, является высокая токсичность: лейкопения отмечается у 50%, анемия — у 40% больных. Нефро- и ототоксичность при лечении препаратами платины имеет место у 30% больных. Терапия этих осложнений трудоемка, длительна по времени и дорогостоящая.
Целью настоящего изобретения является улучшение результатов лечения больных с местными рецидивами рака шейки матки.
Поставленная цель достигалась тем, что больным с местными рецидивами рака шейки матки ежедневно в течение 10 дней за 10 часов до проведения сеанса облучения промежностным полем во влагалище непосредственно к очагу подводят тампон с лечебным составом, содержащим:
2,5 мг мази виферона; 2-5 мл льняного масла; 15 мг доксорубицина;
30 мг метотрексата, 500 мг гидроксимочевины.
Затем осуществляют лучевую терапию. При дистанционной гамма-терапии, осуществляемой через промежностное поле под углом 45°, размерами 5-6×6-8 см, с ежедневным фракционированием разовой дозы 2 Гр, СОД облучения составила 20 Гр.
Применение виферона в качестве среды для введения химиопрепаратов обусловливает комбинирование их специфического противоопухолевого действия с дополнительной неспецифической стимуляцией местного иммунитета.
В доступных источниках информации России, стран СНГ и за рубежом указаний на подобный способ улучшения непосредственных результатов лечения местных рецидивов рака шейки матки при одновременном объективном снижении побочных токсических проявлений химиопрепаратов не обнаружено.
Предлагаемый способ явным образом не следует из уровня развития медицины в данной области и обладает новизной. Новизна способа заключается в ежедневном введении во влагалище в течение 10 дней за 10 часов до проведения лучевого лечения тампонов, содержащих 2,5 мл льняного масла, 2,5 мг мази виферона, 15 мг доксорубицина, 30 мг метотрексата и 500 мг гидроксимочевины.
Изобретение является промышленно применимым, так как может быть многократно воспроизведено и применено в здравоохранении, в лечебных учреждениях специализированного и терапевтического профиля.
Для доказательства приводим выписку из истории болезни, подтверждающую клинический эффект лечения предлагаемым способом.
Пример клинического применения.
1. Больная Б., 1957 г.р., ист. болезни №3571/м, находится под наблюдением РНИОИ с 14.01.98. Диагноз: рак шейки матки T2Nx×Mo, эндофитная форма, вагинально-параметральный вариант. Гистоанализ №12778 от 14.01.98 -плоскоклеточный рак без ороговения.
В период с 14.01.98 до 20.03.98 получила сочетанное лучевое лечение. Дистанционная гамматерапия на область малого таза разовой очаговой дозой 2 Гр проведена в статическом режиме до суммарной дозы в точке А — 20 Гр, в точке В — 20 Гр, затем 2-х осевой секторной ротацией (полями 6×17 см, расстояние между осями ротации 6 см, РИО 75 см, угол качания 180°) до дозы в точке А 26,5 Гр и в точке В 40 Гр. Внутриполостная Со 60 терапия осуществлялась на AГАТ-В разовой дозой 5 Гр при ритме облучения 2 раза в неделю до суммарной дозы в точке А 50 Гр и в точке В 18 Гр. Лечение закончено с первичным клиническим выздоровлением. В процессе лечения имели место явления лучевого ректита, купированные общепринятой консервативной терапией.
При явке 04.11.98 на осмотр в период динамического наблюдения жалобы на кровянистые выделения из половых путей, тянущие боли внизу живота.
Локальный статус. Во влагалище сукровично-кровянистые выделения со зловонным запахом, цвета мясных помоев. Слипчивый процесс разрушен, ткани гиперемированы. Инфильтрация сводов и верхней трети влагалища. Шейка матки деформирована, плотная, с трудом выводится зеркалами. Слизистая шейки матки шероховатая с мелкими папиллярными разрастаниями, участки некротической ткани темного цвета. Матка нормальной величины, плотная, безболезненная. Придатки не определяются. В параметральных пространствах умеренно выраженная рубцовая тяжистость.
Цитологическое исследование соскоба с поверхности шейки матки №17682-83 от 04.11.98 — эритроциты, среди полиморфных клеток воспаления с дискариозом и атипией, обнаружены клетки плоскоклеточного рака.
При стандартном обследовании, включавшем флюорограмму органов грудной клетки, УЗИ органов и лимфатической системы таза, печени, почек признаков отдаленного метастазирования выявлено не было.
Клинический диагноз — Рак шейки матки T2NxMo, кл. гр. II. Состояние после сочетанной лучевой терапии. Локальный рецидив рака шейки матки.
Начато противорецидивное лечение.
Дистанционная гамматерапия на АГАТ-Р осуществлялась с промежностного поля размером 6×8 см, под утлом 45°, с ежедневным фракционированием разовой очаговой дозы 2 Гр. За 10-12 часов до каждого сеанса облучения после обработки влагалища раствором фурациллина 1:5000 и высушивания тканей, к шейке матки подводилось на стандартном влагалищном тампоне по 5 мг следующей смеси: 30 мг метотрексата, 15 мг доксорубицина, 500 мг гидроксимочевины, введенных в смесь 2,5 мл мази виферона и 2,5 мл льняного масла. Всего проведено 10 аппликаций и 10 сеансов наружного облучения.
Общая суммарная доза цитостатиков на курс лечения составила по 300 мг метотрексата и 150 мг доксорубицина. Суммарная очаговая доза на зону локального рецидива составила 20 Гр.
Необходимо отметить, что очищение тканей слипчивого процесса и шейки матки наступило после 3-х аппликаций смеси препаратов, полностью исчезли участки некроза и выделения из влагалища имели слизистый характер.
В процессе лечения общетоксических реакций и гематотологических осложнений не установлено.
Общий анализ крови от 04.11.98.
Нв 104 г/л, Эр — 3,7×10 12 /л, Цп 0,8; Лейк. — 6,2×10 9 /л, эоз. — 1%, пал. 9%, сегм. — 57%, лимф. — 22% (абс. лимф.) 1,36×10 9 /л), мон. 11% (абс.мон. 0,68×10 9 /л), СОЭ 15 мм/час.
Общий анализ крови от 20.11.98.
Нв 96 г/л, Эр — 3,9×10 12 /л, Цп 0,9; Лейк. — 3,7×10 9 /л, эоз. — 3%, пал. — 4%, сегм. — 51%, лимф. — 34% (абс. лимф.) 1,26×10 9 /л), мон. 8% (абс.мон. 0,29×10 9 /л), СОЭ 15 мм/час.
Цитологическое исследование соскоба цервикального канала №19887-88 от 19.11.98 — кровь, клетки хронического воспаления, раковых клеток не обнаружено.
Локальный статус при выписке. Стенки влагалища гиперемированы, отечны, мягкие, без инфильтрации тканей влагалища и сводов. Шейка матки сформирована, гиперемирована, пленки эпителиита.
При осмотре через 1 месяц жалоб нет.
Локальный статус. Влагалище сужено. Ткани чистые, мягкие, слизистая слегка атрофична. Шейка матки сформирована, слизистая ее блестящая, нормальной консистенции, без патологических разрастаний. Матка нормальной величины, плотная, безболезненная. Придатки не определяются. В параметральных пространствах умеренно выраженная рубцовая тяжистость.
Цитологическое исследование цервикального канала №29665-66 от 21.12.98 — и с поверхности шейки матки №29667-68 от 21.12.98 — кровь клетки плоского эпителия без атипии.
С клиническим диагнозом — Рак шейки матки T2N×Mo, кл. гр. III. Состояние после сочетанной лучевой терапии. Химиолучевого лечения локального рецидива рака шейки матки в 1998 году. Наблюдается до января 2003 года, т.е. в течение 48 месяцев, без признаков рецидива и метастазов.

Предлагаемым способом было осуществлено лечение 32 больных с местными рецидивами рака шейки матки. До начала лечения и после его окончания всем больным проводился осмотр в зеркалах, ректовагинальное исследование, общие и биохимические анализы крови, рентгенография грудной клетки и экскреторная урография, радиоизотопное исследование функции почек, ультразвуковое исследование органов малого таза, состояние лимфатической системы таза и парааортальных отделов, биопсия с цитологическим исследованием.
Эффективность предлагаемого метода лечения составила 81,2%, из них в 50% случаев имела место полная регрессия и в 31,2% — частичная регрессия рецидива опухоли. Стабилизация процесса зарегистрирована в 18,8%. Прогрессия процесса не обнаружена ни в одном случае. Выживаемость больных составила 42-46 месяцев.
Улучшение результатов лечения нам представляется как сочетание различных положительных факторов, заключающихся в повышении местной концентрации химиопрепаратов, доставка которых к опухолевым клеткам усиливается, по-видимому, за счет введения в состав смеси льняного масла как источника омега-3 жирной кислоты. Активация под действием виферона клеток местного звена иммунокомпетентной системы организма обуславливает в том числе и объективное снижение показателей общего токсического действия цитостатиков.
Способ лечения местных рецидивов рака шейки матки, включающий местное использование химиопрепаратов и наружное облучение промежностным полем, отличающийся тем, что ежедневно в течение 10 дней во влагалище к очагу рецидива подводят тампон, пропитанный смесью, содержащей 2,5 мг виферона, 2,5 мл льняного масла, 30 мг метотрексата, 15 мг доксорубицина и 500 мг гидроксимочевины, а через 10 ч проводят лучевую терапию по стандартной методике.
Представлены результаты, полученные в процессе применения комплексной терапии, включающей суппозитории Виферона 1 млн МЕ и радиохирургический метод для лечения кондиломатозных образований аногенитальной области вызванных вирусом папилломы человека.
Вирусы папилломы человека (ВПЧ), поражающие аногенитальную область, относятся к разряду возбудителей ИППП, но в отличие от других микроорганизмов, вызывающих генитальные инфекции, могут приводить к развитию различных опухолей как доброкачественных, так и некоторых форм рака половых органов (наиболее часто - рака шейки матки) (3). Можно считать доказанной причинную связь рака шейки матки с определенными типами вируса папилломы человека. Ряд исследователей полагает, что 10-15% всех неоплазм у человека напрямую связаны с наличием папилломавирусной инфекции (2). Поэтому понятен не только биологический и медицинский аспект этой проблемы, но и необходимость разработки новых эффективных методов лечения данной патологии.
Максимальная заболеваемость, обусловленная ВПЧ, наблюдается в возрасте от 18 до 29 лет. Однако и в более зрелом возрасте в силу возрастных изменений иммунитета часто наблюдаются клинические проявления папилломавирусной инфекции и клеточная трансформация ракового характера (8).
Незащищенный половой акт остаётся определяющей причиной инфицирования вирусом папилломы человека, причём ведущим фактором на сегодняшний день является большое количество беспорядочных половых контактов, как у женщин, так и у мужчин. При массовых исследованиях вирус папилломы человека обнаруживается у 40-50% молодых женщин, вызывая хроническую инфекцию шейки матки, вульвы и влагалища. Наиболее часто ВПЧ-инфекция протекает субклинически, обычно на фоне различных гинекологических заболеваний, таких как вульвовагинит, псевдоэрозия шейки матки, эндоцервицит. Почти закономерно сочетание ВПЧ-инфекции с другими ИППП - сифилисом, гонореей, хламидиозом, генитальным герпесом, трихомониазом.
Клинические проявления ВПЧ-инфекции весьма разнообразны (7). В настоящее время их подразделяют на остроконечные кондиломы, папиллярные разновидности кондилом (с выраженным экзофитным ростом), а также плоские и инвертированные (внутриэпителиальные) кондиломы с эндофитным ростом, подошвенные бородавки, обычные бородавки, плоские бородавки и бородавчатая эпидермодисплазия.
Целью настоящего исследования явилось изучение клинической эффективности препарата Виферон 1 млн МЕ в комплексе с радиохирургическим лечением поражений аногенитальной области ВПЧ. Основанием для применения радиохирургического лечения явился тот факт, что оно является безопасным, доступным для практикующих специалистов методом, не оставляющим рубцовых изменений и не приводящим к образованию келоидов(1). Поскольку полного излечения от ВПЧ-инфекции во многих случаях достигнуть невозможно, основной задачей лечения являлось удаление кондиломатозных образований, а не элиминация возбудителя.
Под нашим наблюдением находились 32 больные женщины в возрасте от 18 до 45 лет. Клинически проявления ВПЧ протекали у них в виде:
1.остроконечных кондилом (25 пациенток). Кольпоскопически остроконечные кондиломы представляют собой пальцевидные выросты эпителия с хорошо васкуляризированной соединительнотканной стромой с тонкой ножкой, или широким основанием в виде единичного узелка, или множественных эпителиальных выростов, напоминающих петушиный гребень или цветную капусту, расположенные на больших половых губах, лобке, промежности, перианальной области, преддверия влагалища. Диагностика типичных крупных и мелких остроконечных кондилом затруднений не вызывала, поэтому прицельная биопсия не проводилась.
2.папиллярных кондилом, напоминающих бородавку-опухоль ( 3 пациентки), все с выраженным экзофитным ростом. Кольпоскопическая картина характеризуется наличием отдельных сосочков, образующих розетки на фоне почти гладкой окружающей поверхности кондиломы со своеобразной сосудистой картиной: в каждом сосочке пролифирирующего МПЭ определяется расширенная сосудистая петля почковидной формы. Эти почковидные разнокалиберные сосуды равномерно располагаются на поверхности кондиломы и образуют повторяющийся рисунок. Поверхность кондиломы покрыта белым налётом, при пальпации плотноэластической консистенции. Всем пациенткам была проведена проба Хробака для дифференциальной диагностики со злокачественной опухолью, которая при дотрагивании инструментом хрупка и неэластична. Всем пациенткам проводилась прицельная биопсия, гистологическое исследование, подтверждающее доброкачественность поражения.
3.бородавок в виде папул, расположенных на эпителии малых и больших половых губ, коже перианальной области (2 пациентки). Кольпоскопически представляют собой отдельно расположенные папулёзные образования 3-7 мм в диаметре, с выраженной пигментацией, гиперкератозом, отсутствуют пальцевидные выпячивания, характерные для остроконечных папиллом, в связи с чем дифференциальный диагноз представляет значительные трудности. Все пациентки консультированы дерматологом, онкологом. Проводилась прицельная биопсия с гистологическим исследованием.
3.поражений в виде пятен (macules) (2 пациентки). Клинически проявляющихся изменением цвета кожи и слизистых оболочек в виде серовато-белых, розовато-красных пятен, представляющих промежуточную форму ПВИ, экзофитную кондилому в ранней стадии развития. Кольпоскопически кондиломы в идее пятен представляют собой чётко ограниченные от окружающего нормального эпителия ацетобелые участки, содержащие хорошо определяемые петли капилляров.
Кроме того, у 15 пациенток отмечались жалобы на зуд, жжение в области гениталий, обильные выделения из влагалища, дизурические явления, связанные с нарушением микробиоценоза влагалища, резким дефицитом лактобацилл и избытком условно патогенной микрофлоры (6). В связи с чем, этим пациенткам проводилась коррекция микробиоценоза влагалища назначением симбиотика Бифиформ по одной капсуле × 3 раза в день, вагинальных свечей Ацилакт два раза в день в течение 14 суток. Проводился курс комплексной противовоспалительной антибактериальной терапии вульвита, вагинита: Вильпрафен 500мг × 2 раза в день 10 дней, Румикоз 2 таблетки × 1 раз в день 3 дня, Вобэнзим 2 драже × 3 раза в день 14 дней, во влагалище – Тержинан – влагалищные таблетки по 1 таблетке × 2 раза в день 10 дней.
При проведении ПЦР диагностики (4) у всех больных были выявлены вирусы папилломы человека 6 и 11 типов (низкого онкогенного риска), наряду с которыми у пяти пациенток определялись ВПЧ 31, 33 типов (среднего онкогенного риска) и у двух женщин ВПЧ 16, 18 типа (высокого онкогенного риска).
В процессе применения первого десятидневного курса свечей Виферон у всех больных удалось добиться стабилизации патологического процесса. Отмечалось прекращение появления свежих кондилом, периферического и экзофитного роста имеющихся кондиломатозных образований, а также значительно снизилась острота воспалительной реакции. После проведения радиохирургического лечения ни в одном случае не было грубых ожоговых струпов, заживление происходило под фибриновой плёнкой, отторгавшейся во время первой после операции менструации. Семь пациенток отмечали после операции приходящее чувство жжения и лёгкой болезненности, которые эффективно купировались после введения Виферона при локализации патологических элементов на слизистой влагалища и в области анального отверстия. В процессе проведения второго десятидневного курса Виферона (17-20-е сутки от начала лечения) на месте бывших кондиломатозных образований возникали явления лёгкой рубцовой атрофии. В ряде случаев обратная эволюция экзофитных элементов не сопровождалась проявлением стойких вторичных изменений.
Динамическое наблюдение в сроках от трёх до восьми месяцев показало, что стойкое клиническое выздоровление было достигнуто у 28 пациенток (82, 8 %). У одной больной рецидив заболевания возник спустя 30 дней после проведённого лечения, у двух пациенток - через три месяца и у двух - через семь месяцев. Рецидивы заболевания протекали в виде единичных, небольших по размеру остроконечных кондилом. При повторном применении комплексного метода, у двух больных кондиломы полностью регрессировали на 7-8 день лечения Вифероном и проведения радиохирургического лечения не потребовалось.
Результаты повторных лабораторных исследований (ПЦР) показали, что у 25 больных после проведённой терапии удалось добиться элиминации ВПЧ.
Полученные в ходе лечения данные убедительно свидетельствуют об отсутствии каких-либо побочных действий и осложнений, а также о высокой клинической эффективности комплекса терапевтических мероприятий, включающих применение препарата Виферон. На основании полученных отдалённых результатов лечения, мы считаем целесообразным с целью предотвращения рецидивов заболевания, рекомендовать назначение повторных курсов Виферона 1 млн МЕ один раз в три месяца на протяжении года.

- Симптомы рака шейки матки
- Причины возникновения
- Разновидности рака шейки матки
- Распространение рака шейки матки в организме
- Диагностика рака шейки матки
- Лечение рака шейки матки
- Профилактика
- Прогноз при плоскоклеточном раке шейки матки
- Цены на лечение рака шейки матки
Симптомы рака шейки матки

Проявления заболевания неспецифичны и могут встречаться при других патологиях, например, урогенитальных инфекциях :
- Обильные, длительные месячные. Этот симптом имеет значение, если месячные изменились недавно, если прежде они были нормальными.
- Вагинальные кровотечения в промежутках между месячными, после полового акта, после наступления менопаузы.
- Необычные выделения из влагалища: обильные, розового цвета, с неприятным запахом.
- Тазовые боли во время полового акта.
В большинстве случаев эти проявления вызваны не онкологическим заболеванием. Но риск, пусть и небольшой, есть всегда, поэтому при возникновении первых симптомов нужно посетить врача.
На более поздних стадиях к перечисленным симптомам присоединяются такие признаки, как резкая беспричинная потеря веса, боли в пояснице и в ногах, постоянное чувство усталости, патологические переломы костей (признак костных метастазов), подтекание мочи из влагалища.
Причины возникновения
Точные причины рака шейки матки назвать сложно. Но известны факторы риска, которые повышают вероятность возникновения рака шейки матки.
Наиболее значимый фактор риска – папилломавирусная инфекция. По разным данным, до 99% случаев рака шейки матки связаны с вирусами папилломы человека (ВПЧ). До 80% женщин в течение жизни оказываются инфицированы этим возбудителем. Всего существует около 100 типов ВПЧ, из них 30–40 передаются половым путем, лишь 165 повышают риск рака. Но это не значит, что они гарантированно вызовут рак. Типы вируса 16, 18, 31, 33, 35, 39, 45, 51, 52, 56 и 58 относят к высокоонкогенным, 6, 11, 42, 43 и 44 – к низкоонкогенным. Чаще всего виновниками рака шейки матки становятся ВПЧ 16 и 18 типов. Наиболее уязвима к ним зона трансформации (см. ниже). Помимо рака шейки матки, ВПЧ вызывают злокачественные опухоли других органов репродуктивной системы, глотки, ротовой полости, анального канала.
Другие факторы риска:
- Ослабленная иммунная система. Если иммунитет женщины работает нормально, ее организм избавляется от вируса папилломы в течение 12–18 месяцев. Но если защитные силы ослаблены, инфекция сохраняется дольше и повышает риск рака.
- Беспорядочные половые связи. Частая смена партнеров повышает вероятность заражения ВПЧ.
- Акушерский анамнез. Если у женщины было три или более беременностей, либо если первая беременность была до 17 лет, риски повышены в два раза.
- Наследственность. Если у матери или родной сестры женщины диагностирован рак шейки матки, ее риски повышены в 2–3 раза.
- Курение. Вредная привычка также повышает риски вдвое.
- Применение оральных контрацептивов в течение 5 лет и дольше. После прекращения их приема риски снижаются в течение нескольких лет.
Разновидности рака шейки матки
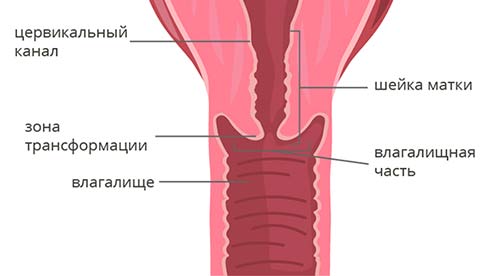
Чтобы понять классификацию рака шейки матки, в первую очередь нужно немного разобраться в ее анатомическом и гистологическом строении. Шейка матки имеет длину 2–3 см и состоит из двух частей:
- Влагалищная часть (экзоцервикс) выступает во влагалище, это то, что гинеколог видит во время осмотра на зеркалах. Слизистая оболочка эндоцервикса состоит из многослойного плоского эпителия .
- Цервикальный канал (эндоцервикс) находится внутри и соединяет влагалище с маткой. Он выстлан цилиндрическим эпителием .
Граница между влагалищной частью и цервикальным каналом называется зоной трансформации.
В 70–90% случаев злокачественные опухоли шейки матки представлены плоскоклеточным раком. Он развивается из многослойного плоского эпителия. Чаще всего злокачественное перерождение происходит в зоне трансформации. В зависимости от того, как выглядит опухолевая ткань под микроскопом, плоскоклеточный рак шейки матки делят на ороговевающий и неороговевающий:
- Ороговевающий плоскоклеточный рак шейки матки называется так потому, что клетки, из которых он состоит, склонны к ороговению. Они крупные, имеют неправильную форму, относительно низкую интенсивность деления. При микроскопическом исследовании обнаруживаются образования, которые называются кератогиалиновыми гранулами и “раковыми жемчужинами”.
- При неороговевающем плоскоклеточном раке шейки матки клетки не склонны к ороговению. Они крупные, имеют форму овала или многоугольника, размножаются более интенсивно.
В зависимости от того, насколько раковые клетки отличаются от нормальных, злокачественные опухоли шейки матки делят на высоко-, умеренно- и низкодифференцированные. Последние ведут себя наиболее агрессивно. Плоскоклеточный ороговевающий рак относят к зрелым формам, он встречается примерно в 20% случаев. Неороговевающий рак - это опухоли средней степени зрелости, они составляют 60-70%. Незрелая форма - это низкодифференцированный рак.
В остальных случаях рак шейки матки представлен аденокарциномой. Она развивается из железистых клеток, продуцирующих слизь. За последние 20–30 лет этот тип злокачественных опухолей стал более распространенным.
Намного реже встречаются аденосквамозные карциномы. Эти опухоли сочетают в себе черты плоскоклеточного рака и аденокарциномы. Чтобы определить тип злокачественной опухоли, нужно провести биопсию.
Распространение рака шейки матки в организме
По мере роста, рак шейки матки распространяется на соседние органы. В первую очередь поражаются регионарные лимфатические узлы, окружающая клетчатка (параметрий).
Часто отмечается поражение верхней трети влагалища, что неудивительно, так как оно находится в непосредственном контакте с шейкой матки. Распространение раковых клеток происходит прямым путем при прорастании опухоли во влагалище, лимфогенно (через лимфатические сосуды), путем контактной имплантации – там, где стенка влагалища соприкасается с опухолью. Также вовлекается тело матки.
Распространение опухолевых клеток в прямую кишку, мочевой пузырь и мочеточники, как правило, происходит контактным путем.
Отдаленные метастазы чаще всего встречаются в забрюшинных лимфатических узлах, легких, костях, печени. Менее чем в 1% случаев метастазирование происходит в селезенку, почки, головной мозг.
Диагностика рака шейки матки
Высокие показатели смертности от рака шейки матки связаны с поздним выявлением заболевания: в 35–40% случаев в России диагноз впервые ставится пациенткам с III–IV стадиями болезни.
Так как рак шейки матки может долго протекать бессимптомно, своевременная диагностика возможно только при регулярном прохождении специальных обследований у гинеколога.
Но даже выявление ВПЧ высокого онкогенного риска не превращает рак шейки матки в нечто фатальное.Во-первых, болезнь может вообще не развиться.Во-вторых, современные технологии позволяют выявлять данную форму рака на самых ранних стадиях и с успехом лечить его, не допуская превращения предраковых изменений в собственно онкологическое заболевание. Следовательно, положительные результаты анализа на ВПЧ должны рассматриваться только как основание для регулярного наблюдения у гинеколога, знакомого с эффективными алгоритмами ведения пациенток из групп риска.
Иногда рак шейки матки выявляется непосредственно во время осмотра на гинекологическом кресле. Однако так определяется, как правило, запущенный онкологический процесс. И напротив, ранние стадии заболевания обычно проходят без каких-либо заметных изменений, поэтому для своевременной диагностики рака шейки матки используются дополнительные исследования. Во время кольпоскопии влагалищную часть шейки матки осматривают с помощью кольпоскопа – прибора, напоминающего бинокль с источником освещения.
Также полученный в ходе этого анализа материал может быть использован для определения активности ВПЧ, которая является важным фактором прогноза и может влиять на тактику лечения. И, наконец, раствор с находящимися в нем клетками пригоден для проведения анализа на определение особого белка (Р16ink4a), появляющегося в клетках еще до начала непосредственно онкологического процесса. Таким образом, метод жидкостной цитологии способен не только выявить рак шейки матки, но и предупредить о повышении риска его развития. После одной-единственной процедуры в распоряжении врача появляются результаты трех точных и информативных анализов, позволяющих определить тактику и стратегию ведения конкретной пациентки.
В профилактических целях (при отсутствии жалоб) данные анализы рекомендуется проводить 1 раз в год.
Прогноз при первичной диагностике рака шейки матки определяется степенью запущенности процесса. К сожалению, в нашей стране на протяжении последних десятилетий сохраняется очень высокая доля женщин, впервые обращающихся за медицинской помощью на поздних стадиях заболевания. При своевременно поставленном диагнозе у пациентов на 1-й стадии рака шейки матки показатель 5-летней выживаемости составляет 75-80%, для 2-й стадии — 50-55%. Напротив, при выявлении на 4-й стадии рака шейки матки большинство пациенток не доживает до пятилетнего рубежа, умирая от распространения опухоли или осложнений.
Лечение рака шейки матки
Исходя из опыта клиники, сохранить матку и возможность деторождения возможно при предраковых изменениях шейки матки. При раке шейки матки одинаково широко используют лучевую терапию и хирургическое лечение — расширенная экстирпация матки с придатками.
Лечение зависит от стадии заболевания. При ранних стадиях рака шейки матки проводится преимущественно хирургическое лечение. Во время операции производится удаление матки. Иногда операцию необходимо дополнять удалением лимфатических узлов малого таза. Вопрос об удалении яичников решается индивидуально, при ранней стадии опухоли у молодых женщин возможно оставление яичников. Не менее значимым является лучевое лечение. Лучевая терапия может как дополнять хирургическое лечение, так и являться самостоятельным методом. При ранних стадиях рака шейки матки результаты хирургического и лучевого лечения практически одинаковы. В лечении рака шейки матки может применяться химиотерапия, но к сожалению, возможности химиотерапии при этом заболевании значительно ограничены.
При 0 стадии раковые клетки не распространяются за пределы поверхностного слоя шейки матки. Иногда эту стадию даже рассматривают как предраковое состояние. Такая опухоль может быть удалена разными способами, но при органосохраняющих вмешательствах в дальнейшем сохраняется риск рецидива, поэтому после операции показаны регулярные сдачи цитологических мазков.
Методы лечения плоскоклеточного рака шейки матки, стадия 0:
- Криохирургия – уничтожение опухоли с помощью низкой температуры.
- Лазерная хирургия.
- Конизация шейки матки – иссечение участка в виде конуса.
- Петлевая электроконизация шейки матки.
- Гистерэктомия. К ней прибегают в том числе при рецидиве злокачественной опухоли после вышеперечисленных вмешательств.
Методы лечения аденокарциномы шейки матки, стадия 0:
- Гистерэктомия.
- В некоторых случаях, если женщина планирует иметь детей, может быть выполнена конизация. При этом важным условием является негативный край резекции по данным биопсии. Впоследствии женщина должна наблюдаться у гинеколога, после родов выполняют гистерэктомию.
Выбор метода лечения всегда осуществляется индивидуально лечащим врачом.
При 1а стадии — микроинвазивный рак шейки матки — выполняют экстирпацию матки с придатками. В случаях, когда опухоль прорастает в кровеносные и лимфатические сосуды, также показано удаление тазовых лимфатических узлов. Если женщина планирует иметь детей, возможны органосохраняющие операции. При стадии Iб — рак ограничен шейкой матки — проводят дистанционное или внутриполостное облучение (брахитерапию) с последующей расширенной экстирпацией матки с придатками. В ряде случаев первоначально проводят операцию, а затем дистанционную гамма-радиотерапию.
При 2-й стадии рака шейки матки — вовлечение верхней части влагалища, возможен переход на тело матки и инфильтрация параметрия без перехода на стенки таза — основным методом лечения является лучевая терапия. Также может быть назначена химиотерапия, обычно препаратом цисплатином или его сочетанием с фторурацилом. В этом случае хирургическое лечение проводится редко.
При 3-й стадии рака шейки матки — переход на нижнюю часть влагалища, инфильтрация параметрия с переходом на кости таза — показана лучевая терапия.

Профилактика
Один из главных факторов риска рака шейки матки — вирус папилломы человека. Поэтому меры профилактики в первую очередь должны быть направлены на предотвращение заражения:
- Беспорядочные половые связи нежелательны, особенно с мужчинами, у которых было много партнерш. Это не защищает от заражения на 100%, но все же помогает сильно снизить риски.
- Презервативы помогут защититься не только от ВПЧ, но и от ВИЧ-инфекции. Стопроцентную защиту они тоже не обеспечивают, потому что не могут полностью исключить контакт с инфицированной кожей.
- Вакцины против ВПЧ — хорошее средство профилактики, но они работают лишь в случае, если женщина пока еще не инфицирована. Если вирус уже проник в организм, вакцина не поможет. Девочек начинают прививать с 9–12 лет.
Второй фактор риска, который связан с образом жизни, и на который можно повлиять — курение. Если вы страдаете этой вредной привычкой, от нее лучше отказаться.
Огромное значение имеет скрининг — он помогает вовремя выявить предраковые изменения и рак шейки матки на ранних стадиях. Нужно регулярно являться на осмотры к гинекологу, проходить PAP-тест и сдавать анализы на ВПЧ.
Основным прогностическим фактором выживаемости пациенток при раке шейки является степень распространенности процесса. Поэтому самым эффективным средством против развития рака являются регулярные профилактические осмотры у специалистов.
Прогноз при плоскоклеточном раке шейки матки
Ориентировочный прогноз определяют на основании статистики. Среди женщин, у которых был диагностирован рак шейки матки, подсчитывают процент выживших в течение определенного времени, как правило, пяти лет. Этот показатель называют пятилетней выживаемостью. Он зависит от того, на какой стадии было выявлено онкологическое заболевание. Чем раньше диагностирован рак и начато лечение — тем лучше прогноз:
- При локализованных опухолях (рак не распространяется за пределы шейки матки, соответствует I стадии) пятилетняя выживаемость составляет 92%.
- При опухолях, которые распространились на близлежащие структуры (стадии II, III и IVA) — 56%.
- При метастатическом раке (стадия IVB) — 17%.
- Средняя пятилетняя выживаемость при всех стадиях рака шейки матки — 66%.
Несмотря на низкие показатели пятилетней выживаемости, рак с метастазами — это не повод опускать руки. Существуют методы лечения, которые помогают затормозить прогрессирование заболевания, продлить жизнь, справиться с мучительными симптомами. Врачи в Европейской клинике знают, как помочь.
Читайте также:

