У донцовы рак с метастазами
Как выглядит реальная картина заболеваемости, лечения и выживания при раке? Что важно знать пациентам, их близким и всем нам, чтобы адекватно воспринимать болезнь? Об этом мы поговорили с руководителем отдела Национального медицинского исследовательского центра им. Дмитрия Рогачева, членом правления Российского общества клинической онкологии (RUSSCO), доктором медицинских наук Николаем Жуковым.
- Простой ответ на этот вопрос невозможен. Если пациент пережил 5-летний срок и продолжает жить, это может свидетельствовать, что он излечен. А может быть и так, что он прожил эти 5 лет с болезнью. Много нюансов. Но в целом в нашей стране более 50% онкологических больных имеют шанс на излечение или длительный контроль заболевания на фоне проводимого лечения.
- Андрей Павленко в одном из ранних интервью говорил, что шансы на 5-летнюю выживаемость у него будут 50%, если сработает химиотерапия.
Увы, получилось, что он попал в несчастливый процент. Мне очень его жаль, он был одним из немногих людей в России , кто смог вынести свою болезнь в публичную плоскость. И старался делать это в позитивном ключе – давая надежду другим больным, а не отбирая ее. Несмотря на неблагоприятный исход в его конкретном случае, что является личной трагедией его и его семьи, это не должно быть поводом для того, чтобы остальные опустили руки.
Это было бы как минимум нечестно по отношению к человеку, который сделал все, чтобы получилось наоборот. Если посмотреть здравым взглядом, его смерть ничуть не перечеркивает тот сигнал, который он хотел донести до общества.
ВЫЖИВШИХ ГОРАЗДО БОЛЬШЕ, НО МЫ О НИХ НЕ ЗНАЕМ
- Многие сейчас, будучи в отчаянии, пишут в соцсетях, что опускаются руки, если не смог вылечиться доктор Павленко, то у нас, простых смертных, и подавно шансов нет. Что вы, как врач-онколог, сказали бы таким людям?
- Прежде всего хочу сказать, что у врачей-онкологов нет какого-то тайного лечения, которое они приберегли только для себя. Мы такие же люди, как и вы. У нас развивается такой же рак, его иногда так же бывает сложно выявить рано. Мы получаем такое же лечение (чуть лучше или чуть хуже – но в целом такое же, как и обычные люди). И столкнувшись с болезнью, которую ранее лечили у других, стоим перед таким же бинарным выбором – удастся вылечить или нет, умрем или будем жить. И точно так же, как у обычных людей, это зависит от правильности диагноза, лечения, стадии, вида опухоли и еще от судьбы (или господа бога, как кому хочется думать).
Так что для начала неплохо было бы поговорить о тех, кто вылечился. Таких немало, в том числе среди публичных людей. Жаль только, что в нашей стране в силу особенностей менталитета известные личности редко рассказывают о болезнях, от которых они вылечились. Я знаю очень многих публичных людей, победивших рак или успешно борющихся с ним многие годы. Но, поверьте, мне пришлось лезть в интернет, чтобы найти тех, кто отважился сообщить об этом публично (в силу закона о защите персональных данных я не могу разглашать известные мне сведения о пациентах). Увы, если известный человек погибает от рака, то об этом становится известно всем, но если он выздоравливает, то… Об этом сообщают единицы. Более того, даже если так происходит, об этом в отличие от смертей быстро забывают.
Если вернуться к статистике, то чуть больше 5 лет назад в нашей стране было около 2 миллионов пациентов, излеченных от рака или успешно борющихся с ним. А сейчас — почти 3,5 млн. Добавившиеся полтора миллиона — это не страшный скачок заболеваемости (заболеваемость увеличилась, но гораздо меньше). Это те, кому удалось сохранить жизнь за счет лечения. Их становится все больше. Растущее количество таких пациентов убедительный показатель того, что увеличивается эффективность лечения рака. Все больше людей остается в живых, столкнувшись с онкологическими заболеваниями.
- Есть такое представление: если у человека был рак и лечение оказалось успешным, то все равно нужно быть начеку до конца жизни. Потому что рак это некая поломка в организме, которая непоправима. Действительно так?
- На самом деле все мы должны быть начеку. Потенциально у каждого из нас в любой момент что-то может сломаться. Поэтому и существуют, например, различные виды онкологического скрининга. То есть регулярные обследования, проводимые у людей, не имеющих симптомов заболевания, с целью раннего выявления опухолей. Есть такие обследования и для тех, кто уже столкнулся с онкологическим диагнозом и был успешно пролечен.

Николай Владимирович Жуков. Фото: raklechitsya.ru
РЕАЛЬНО ЛИ ПОЙМАТЬ БОЛЕЗНЬ НА РАННЕЙ СТАДИИ
- Доктор Павленко говорил, что его опухоль развивалась под слизистой оболочкой желудка. Поэтому на ранних стадиях ее нельзя было обнаружить с помощью гастроскопии. Насколько вообще эффективна сейчас ранняя диагностика рака?
Да, у многих больных однозначные симптомы болезни появляются только тогда, когда опухоль уже достигает больших размеров или дает отдаленные метастазы. Однако, как показывают исследования, очень многие больные, самостоятельно обратившиеся к врачу по поводу симптомов, имели рак на ранних стадиях. Так что знания и активная позиция могут сохранить жизнь.
Да, идеальных вариантов ранней диагностики рака пока нет. Утверждать обратное было бы неправдой. Но и те, что есть, могут спасать жизни. Знание симптомов и своевременное обращение к врачу, прохождение доступных видов скрининга не сведет ваш шанс на неблагоприятный исход к нулю, но снизит его точно. А дальше – см. выше, главное сделать правильно все, что зависит от тебя, а остальное уже судьба. Но если просто положиться на судьбу (будь, что будет), то и шансов будет меньше.
ВОПРОС-РЕБРОМ
Четвертая стадия — приговор или нет?
- Здесь мы снова возвращаемся к вопросу о шансах того или иного пациента, которые зависят от особенностей его опухоли, - говорит Николай Жуков . - Есть виды онкологических заболеваний, при которых мы можем излечить или как минимум серьезно продлить жизнь пациентам с 4-й стадией рака. Более того, во втором случае человек может долго жить с болезнью, в том числе дожить до появления препаратов, которые еще больше продлят его жизнь или даже излечат. И примеров тому немало.
СОВЕТЫ ДОКТОРА ЖУКОВА
1. Важно знать о симптомах, которые могут сигналить об опухоли.
Подчеркнем: вовсе не обязательно, что они говорят о раке. Но это повод обязательно обратиться к врачу и пройти обследование. Вот список некоторых симптомов, на которые нужно обращать внимание, составленный международными экспертами.
- Появление припухлости, узлов и других новообразований на любых участках тела.
- Кашель, изменение голоса, осиплость, одышка, не проходящие более 3 недель.
- Появление крови в мокроте, моче, стуле, в перерыве между менструациями или после менопаузы.
- Ранки и повреждения на коже и слизистых, которые не заживают более 3 недель.
- Новые родинки или изменения старых (потемнение, деформация, рост).
- Нарушения работы кишечника (запоры, диарея) или мочевого пузыря.
2. Не ленитесь и не бойтесь идти к врачу.
3. Помните: есть этап, когда от самого пациента зависит больше, чем от врача.
Речь об образе жизни для профилактики рака: отказ от курения, избавление от лишнего веса, защита от ультрафиолетового излучения. Кто бы что ни говорил, многочисленные исследования однозначно подтверждают: люди, не заботящиеся о своем здоровье, заболевают раком чаще.
ПЕРСПЕКТИВЫ
В каких направлениях борьбы против рака врачи ожидают прорывов
- Во-первых, это индивидуализация лечения, - рассказывает Николай Жуков. - Уже существует очень большое количество лекарств. Вызов для онкологов заключается в том, чтобы правильно подбирать препараты, достоверно прогнозируя ответ опухоли на лечение. Для этого сейчас изучается и начинает применяться все больше показателей, характеризующих индивидуальные особенности организма пациента и его опухоли. На уровне генов, белков, различных особенностей метаболизма.
В-третьих, совершенствование и отладка уже имеющихся вариантов лечения. Например, продолжит развиваться иммунотерапия. Эта технология выстрелила, совершила буквально революцию в лечении ряда видов рака. Сейчас иммунотерапия вышла на плато, новых прорывов в этой области нет, но то, что достигнуто, начинает входить в широкую практику и помогать все большему количеству пациентов.
Кости, легкие и печень — органы, в которые чаще всего распространяются метастазы при четвертой стадии рака. Метастазы в костях при раке встречаются намного чаще, чем первичные опухоли.

Чаще всего костные метастазы возникают при раке молочной, предстательной железы и легкого. Одна из самых частых локализаций — позвоночник. Ремиссия при раке с вторичными очагами в костях практически невозможна, но существуют методы лечения, которые помогают замедлить прогрессирование опухоли и увеличить продолжительность жизни пациента.

Какие виды рака чаще всего метастазируют в кости?
Вероятность обнаружения костных метастазов при злокачественных опухолях четвертой стадии в разных органах составляет:
- При раке молочной железы: 65–75%.
- При раке простаты: 65–75%.
- При раке щитовидной железы: 60%.
- При раке легких: 30–40%.
- При раке мочевого пузыря: 40%.
- При раке почек: 20–25%.
- При меланоме: 14–45%.
Почему возникают метастазы в костях?
Метастазирование — сложный процесс, его механизмы изучены не до конца. По мере того, как первичная опухоль прорастает в окружающие ткани, некоторые клетки могут от нее отрываться и проникать в просвет кровеносных или лимфатических сосудов. Они мигрируют с током крови или лимфы, затем, достигнув мелких сосудов в кости, выходят в ткани и дают начало новым очагам. По мере роста метастаза раковые клетки выделяют вещества, которые стимулируют образование новых кровеносных сосудов.
Чаще всего раковые клетки оседают в костях, имеющих богатое кровоснабжение. В большинстве случаев их обнаруживают в позвонках, тазовых, бедренных костях, ребрах, костях рук.
Какие симптомы беспокоят при костных метастазах?
Основной симптом — боли в костях. Если они стали беспокоить пациента, страдающего раком, подозрение в первую очередь должно пасть именно на костные метастазы. В зависимости от того, какая часть скелета поражена, могут беспокоить боли в спине, в области таза, в руках, ногах. Нередко они усиливаются по ночам, во время физических нагрузок. Выделяют две причины болей в костях, пораженных метастазами: во-первых, опухоль сдавливает сосуды и нервы, во-вторых, в ответ на нее развивается воспалительная реакция.
Ослабление костей приводит к патологическим переломам — они встречаются у 10–30% всех пациентов, страдающих раком. Более чем в половине случаев страдает бедренная кость. Часто происходят переломы ребер и позвонков — из-за этого нарушается работа легких, может произойти сдавление спинного мозга.
Из-за разрушения костной ткани в кровь поступает много кальция, развивается гиперкальциемия. Это приводит к нарушению работы нервной, пищеварительной системы, почек. Пациента беспокоят запоры, постоянная жажда, повышенная утомляемость, увеличивается количество мочи. Если уровень кальция в крови очень высок, это грозит нарушением сердечного ритма, острой почечной недостаточностью.
Грозное осложнение метастазов в позвоночнике — сдавление спинного мозга. При этом основным симптомом является нарушение движения и чувствительность ниже места сдавления, беспокоят боли в спине, в пояснице, нарушается контроль над мочеиспусканием и дефекацией. Если не устранить сдавление в течение 1–2 суток, нормальная работа спинного мозга уже навряд ли восстановится.
Актуальные вопросы о костных метастазах
Это беда нашей страны. Врачи не знают, что ликвидация периферических метастазов резко повышает чувствительность опухоли к химиотерапии. Они не знают, что стандартные препараты ПХТ практически не проникают в костную ткань, поэтому на метастазы в кости они не действуют. Они не знают, что бисфосфонаты не убивают опухолевые клетки в кости. Но самое важное, они не осознают, что при наличии костных метастазов пациент станет лежачим в любой момент времени из-за патологического перелома.
Комплекс качественной терапии у пациента с метастазами в кости скелета может позволить прожить больному больше на 5 и более лет. Но, к сожалению, срок жизни большинства больных не превышает 1-2 года по причине несвоевременного диагноза или неадекватного лечения.
Все ли метастазы в кости одинаковы?
Все кости нашего организма живые — они постоянно обновляются за счет динамического равновесия процессов остеорезорбции (разрушения) и костеобразования. Раковые клетки в области метастаза могут нарушать оба процесса, излишне активизируя или остеобласты (молодые клетки новой костной ткани), или остеокласты (клетки, разрушающие костную ткань). Поэтому выделяют два типа метастазов рака в кости — остеолитические, при которых преобладает разрушение костной ткани и остеопластические, при которых наблюдается уплотнение участка кости.
В каких костях чаще всего развиваются метастазы?
Чаще всего поражаются обильно кровоснабжаемые кости — позвоночный столб, ребра, кости таза, черепа, а также бедренные и плечевые кости.
Почему кости болят при раке?
Первоначально метастазы в кости себя не проявляют. При их росте появляются сначала тянущие, а потом они превращаются в ноющие боли и нарастает их интенсивность. Механизмом развития болевого синдрома являются механическая (за счет сдавления или растяжения), так и химическая (в результате выделения большого количества простагландинов) стимуляция болевых рецепторов, расположенных в области надкостницы. Важно знать, что болевой синдром при метастазах рака усиливается во второй половине дня, максимума достигает ночью, провоцируется физическими нагрузками. Со временем боли становятся мучительными, непереносимыми, купируемыми только применением наркотических анальгетиков.
Чем опасны метастазы в кости?
Достаточно крупные метастазы в кости могут вызывать видимую деформацию, выявляться при пальпации в виде опухолевидного образования либо просматриваться на рентгенограммах в виде участка деструкции. Серьезным осложнением метастазов в кости являются патологические переломы. в 15-25% случаев возникающие в области трубчатых костей, почти в половине случаев — в области позвонков. Иногда в процессе роста метастазы в кости сдавливают близлежащие крупные сосуды или нервы.
В первом случае возникают нарушения кровообращения, во втором — неврологические расстройства. К числу тяжелых осложнений данной патологии также относятся компрессия спинного мозга и гиперкальциемия. Локальные симптомы метастазов в кости сочетаются с общими проявлениями онкологического заболевания: слабостью, потерей аппетита, снижением массы тела, тошнотой, апатией, быстрой утомляемостью, анемией и повышением температуры тела.
О методе РЧА (радиочастотная аблация) костных метастазов
Процедура радиочастотной абляции костных метастазов необходима в случаях развития болевого синдрома, вызванного разрушением самой костной ткани и компрессией нервных корешков и узлов. У большинства пациентов за очень короткий период времени боль, вызванная такой патологией, постепенно становится невыносимой и невосприимчивой к медикаментозной терапии. В таких случаях, процедура РЧА является единственным способом вернуть пациенту комфортную жизнь.
При наличии труднодоступных опухолей, особенно в позвоночном столбе и костях таза, когда выполнение традиционной операции сопряжено с высоким риском смерти, мы проводим РЧА с 3D-навигацией, то есть, после создания 3D-модели пораженного органа по специальным координатам производится поэтапное КТ-контролируемое введение иглы, минуя важные органы и ткани. В результате риск возможных осложнений сводится к нулю, и процедура для пациента становится практически безболезненной.
Видео из операционной. Посмотрите как проходит радиочастотная аблация костного метастаза. Оперирующий хирург - Сергеев П.С., к.м.н
Проблемы в ограниченности мышления по поводу операций при метастазах рака в позвоночник у большинства отечественных онкологов наглядно иллюстрирует следующая статистика, которую приводят как обоснование в отказе от хирургического лечения метастазов в кости скелета:
- При раке легких метастазирование наблюдается в 30-40% случаев, при этом выживаемость пациентов после обнаружения метастазов составляет около полугода;
- При раке молочной железы метастазы выявляются в 60-70% случаев, при этом продолжительность жизни после выявления метастазов составляет от полутора до двух лет;
- При раке предстательной железы частота метастазирования по данным различных исследователей варьирует от 50 до 70% случаев, а продолжительность жизни в среднем около трех лет.
- При раке почек частота образования метастаз составляет 20-25%, медиана выживаемости около 1 года;
- При раке щитовидной железы в 60-70% случаев, медиана выживаемости — четыре года;
- При меланоме образование метастаз составляет 15-45%, продолжительность жизни в среднем около полугода.
Услышав такие цифры, даже здоровый человек впадает в панику. Надо помнить, что это данные БЕЗ лечения основного заболевания. При успешно проведенной операции и последующей противорецидивной терапии, пациенты будут жить долго!
Самое сложное в онкологии – когда диагностируют метастазы рака в разных органах, а первичного очага не находят. Обратился больной, метастазы рака в легких, в позвонках, в надпочечниках – в одном 10 см, в другом – 4. А где первичная опухоль – неизвестно.
Лечение надо проводить? Надо! А какое лечение? Какая опухоль?
Опухоли сейчас настолько изменились, что даже при иммуногистохимическом исследовании метастазов трудно сказать где очаг. На КТ, МРТ всего тела также не всегда удается его найти, т.к. при шаге срезов в 1,5-2 см легко пропустить большинство начальных опухолей.
Лечение недопустимо затягивается и упускается шанс для направленного противоопухолевого лечения. Таких больных становится все больше…
В таких случаях действовать нужно путем исключения, перебирая все варианты. А чтобы не уходило время, можно, сдерживать рост метастазирования общей электромагнитной гипертермией, и уже параллельно проводить дополнительные обследования, пытаясь найти очаг.
Метастазы рака нужно начинать лечить
Общая электромагнитная гипертермия – универсальное средство лечения онкологии: температурный фактор работает как при высоко- так и при низкодифференцируемых опухолях, независимо от локализации очага и метастаз. Но, его надо стараться дополнить химиотерапией, иммунотерапией для усиления эффекта и получения устойчивого результата.
Химиотерапия в условиях общей гипертермии эффективнее обычной. Принципиальная разница, что действующих фактора при гипертермии два – температура и химиопрепараты. Разогрев больного в температурных интервалах 42,5–43 °С приводит к прямой гибели опухолевых клеток. Вводимые в момент нагрева химиопрепараты дают больший противоопухолевый эффект и снижение токсического действия. В ходе общей гипертермии стимулируется иммунная система организма, которая и сама начинает оказывать сопротивление раку.
Выживаемость при лечении рака с метастазами методом общей гипертермии:
| Диагноз | 1 год | 3 года | 5 лет |
| Рак желудка, 4-я стадия | 57,0 | 26,3 | 21,5 |
| Рак ободочной кишки, 4-я стадия | 64,5 | 15,2 | 15,2 |
| Рак прямой кишки, 4-я стадия | 61,3 | 52,5 | 27,3 |
| Рак молочной железы (с обширными метастазами), 4-я стадия | 86,6 | 50,9 | 49,3 |
| Саркомы мягких тканей, 4-я стадия | 94,2 | 68,2 | 49,8 |
Расчет произведен с даты первого сеанса общей гипертермии для больных, у которых в результате лечения был получен клинический эффект (полная регрессия, частичная регрессия, стабилизация).
Подсчет показателей выживаемости проводился по методу Каплана — Майера. Результаты достоверны (P Рубрики
- Блог профессора Карева И.Д.
- Истории пациентов
- Новости клиники
- СМИ о клинике
- Услуги
Раковые клетки не реагируют на сигналы о том, что пора умирать.
Наши тела состоят из триллионов клеток. Обычно новые клетки заменяют старые или поврежденные клетки, когда они отмирают. Иногда ДНК клетки повреждается. Иммунная система обычно может контролировать небольшое количество аномальных клеток от дальнейшего повреждения нашего тела.
Рак возникает, когда есть больше ненормальных клеток, чем иммунная система может выдержать. Вместо того, чтобы умирать, аномальные клетки продолжают расти и делиться, накапливаясь в виде опухолей. В конце концов, этот неконтролируемый рост заставляет аномальные клетки проникать в окружающие ткани.
Существует более 100 типов злокачественных опухолей, названных в честь тканей или органов, из которых они происходят. У всех есть способность распространяться, но некоторые более агрессивны, чем другие.
Природа рака и метастазирования
Почему рак распространяется
Раковые клетки не реагируют на сигналы о том, что пора умирать, поэтому они продолжают быстро делиться и размножаться. И они очень хорошо прячутся от иммунной системы.
Когда раковые клетки все еще содержатся в ткани, в которой они развивались, это называется карциномой in situ (CIS). Когда эти клетки разрушаются вне мембраны ткани, это называется инвазивным раком.
Распространение рака от того места, откуда он начался, называется метастазированием. Независимо от того, где еще в теле болезнь распространяется, рак все еще назван в честь места, где он возник. Например, рак предстательной железы, который распространился на печень, все еще является раком простаты, а не раком печени, и лечение будет направлено на место зарождения опухоли.
Хотя солидные опухоли являются особенностью многих видов рака, это не всегда так. Например, лейкемии - это рак крови, который врачи называют "жидкими опухолями".
Как рак распространяется
Точно, где раковые клетки будут распространяться дальше, зависит от их расположения в организме, но, скорее всего, сначала они будут распространяться поблизости. Рак может распространяться через:
- Ткань. Растущая опухоль может проникать через окружающие ткани или в органы. Раковые клетки от первичной опухоли могут отделиться и образовать новые опухоли поблизости.
- Лимфатическая система. Раковые клетки из опухоли могут проникать в близлежащие лимфатические узлы. Оттуда они могут путешествовать по всей лимфатической системе и вызывать новые опухоли в других частях тела.
- Кровоток. Твердые опухоли нуждаются в кислороде и других питательных веществах для роста. Через процесс, называемый ангиогенезом, опухоли могут спровоцировать образование новых кровеносных сосудов, чтобы обеспечить свое выживание. Клетки также могут попадать в кровоток и перемещаться в отдаленные места.
Самый быстрый и самый медленный рак
Раковые клетки с большим генетическим повреждением (плохо дифференцированные) обычно растут быстрее, чем раковые клетки с меньшим генетическим повреждением (хорошо дифференцированные). Основываясь на том, как ненормально они появляются под микроскопом, опухоли классифицируются следующим образом:
- GX: не определено
- G1: хорошо дифференцированный или низкосортный
- G2: умеренно дифференцированный или средний класс
- G3: плохо дифференцированный или полноценный
- G4: недифференцированный или полноценный
Виды рака, которые обычно медленнее растут:
- рак молочной железы
- хронический лимфолейкоз (ХЛЛ)
- рак толстой кишки и прямой кишки
- большинство видов рака простаты
Некоторые виды рака, такие как рак предстательной железы, могут развиваться настолько медленно, что ваш врач может порекомендовать подход "бдительного ожидания", а не немедленное лечение. Некоторые могут никогда не потребовать лечения.
Примеры быстрорастущих видов рака включают в себя:
- острый лимфобластный лейкоз (ОЛЛ) и острый миелоидный лейкоз (ОМЛ)
- некоторые виды рака молочной железы, такие как воспалительный рак молочной железы (IBC) и тройной негативный рак молочной железы (TNBC)
- большая В-клеточная лимфома
- рак легких
- редкие виды рака предстательной железы, такие как мелкоклеточный рак или лимфомы
Наличие быстрорастущего рака не обязательно означает, что у вас плохой прогноз. Многие из этих видов рака можно эффективно лечить. И некоторые виды рака не обязательно растут быстрее, но менее вероятно, будут обнаружены, пока они не метастазировали.
Рост и распространение опухоли
Доброкачественные опухоли
Доброкачественные опухоли не являются раковыми. Они покрыты нормальными клетками и не способны проникать в близлежащие ткани или другие органы. Доброкачественные опухоли могут вызвать несколько проблем, если они:
- достаточно велики, чтобы давить на органы, вызывать боль или раздражать
- расположены в мозге
- выделяют гормоны, которые влияют на системы организма
Доброкачественные опухоли обычно могут быть удалены хирургическим путем и вряд ли вырастут снова.
Злокачественные опухоли
Раковые опухоли называются злокачественными. Раковые клетки образуются, когда нарушения ДНК приводят к тому, что ген ведет себя не так, как следовало бы. Они могут врастать в близлежащие ткани, распространяться через кровоток или лимфатическую систему и распространяться по всему организму. Злокачественные опухоли имеют тенденцию расти быстрее, чем доброкачественные опухоли.
- 25228
- 20,5
- 0
- 11
Метастазы в цельном мозге мыши, обработанном по специальной методике. Красный — MDA-231-D клетки, экспрессирующие mCherry; зеленый — сосуды, помеченные антителами к α-SMA, альфа-актинам гладких мышц [1].
![]()
Мария Рафаева
![]()
Светлана Ястребова![]()
Андрей Панов




Революция в понимании природы метастазирования
Усилия многих онкологов на протяжении последних десятилетий были направлены на установление деталей возникновения и развития рака — механизмов зарождения опухоли и регуляции ее активного роста, формирования благоприятного микроокружения из клеток стромы [2]. Эти знания несомненно привели к разработке новых подходов в терапии онкозаболеваний. Со временем стало понятно, что основная угроза рака заключена в способности к распространению по организму. Так, некоторые раковые клетки первичной опухоли (то есть развившейся изначально) отделяются от нее за счет эпителиально-мезенхимального перехода или других механизмов [3] и, попадая в кровоток или лимфоток, по маленьким капиллярам путешествуют в главные магистрали сосудистой системы. Они покидают ее за счет задержки в узких капиллярах органов, адгезии к их эндотелиальной стенке и выхода из просвета сосуда в строму органа (рис. 1). Лишь небольшой процент раковых клеток, покинувших первичную опухоль, преуспевает в этом процессе и выживает в новой среде. Эти клетки формируют будущие очаги роста опухоли в новых органах — метастазы.
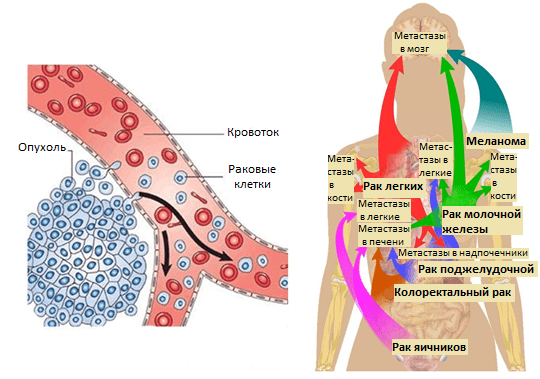
Рисунок 1. Метастазирование и пути рассеивания раковых клеток.
Рисунок 2. Основоположники учений о метастазировании: английский хирург Стивен Педжет (слева) и американский патолог Джеймс Юинг (справа).
Наконец в 1970-е годы в ходе нескольких экспериментов по инъекции радиоактивно меченных раковых клеток мышам Исаак Фидлер смог доказать, что результат метастазирования также зависит от природы раковых клеток. В этом случае клетки меланомы развивали метастазы только в легких, но не в печени, в сосудах которой они также задерживались, но позже не выживали [5].
Позднее было установлено еще больше фактов, подтверждающих, что раковые клетки разной природы метастазируют преимущественно в определенные органы и иногда даже в заданной последовательности. Например, клетки рака молочной железы — сначала в кости, печень, лимфатические узлы, легкие, а потом уже в мозг; клетки рака желудочно-кишечного тракта и яичников — в печень и легкие; рака простаты — в основном, в кости (рис. 1). Явление специфичного распределения метастазов по организму назвали органотропией метастазирования. Чаще всего метастазы встречаются в легких, печени и костях.
Несмотря на активные исследования, в онкологии все еще остается много вопросов без ответа. Отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? Как метастазам удается выжить после удаления первичной опухоли и проведенной химиотерапии?
Генетическая и эпигенетическая гетерогенность при метастазировании
Генетическая информация лежит в основе программирования поведения клетки. Перерождение нормальных клеток организма в раковые (злокачественная трансформация) обусловлено мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Помимо таких выгодных для опухолевых клеток мутаций, также происходят мутации в генах-пассажирах, то есть тех, что изначально не имеют влияния на рост опухоли. С каждым поколением, новым клоном внутри опухоли, накапливаются эти генетические изменения, и некоторые клоны преуспевают больше остальных, что стало основой для формирования представления об эволюции внутри опухоли. Одна из предложенных гипотез, почему некоторые клетки опухоли приобретают способность к метастазированию, основана на схожем со злокачественной трансформацией принципе. По всей видимости, у них тоже накапливаются мутации в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения она так и не нашла, ученые сходятся во мнении, что большинство клеток первичной опухоли способны метастазировать. А вот что происходит позже с геномами метастазных клеток?
В результате сравнения геномов клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов (в печени, легких, дальних лимфатических узлах) было установлено, что геномы метастазов продолжают эволюционировать в своих очагах роста независимо от первичной опухоли [6]. Интересно, что паттерн мутаций схож между метастазами в одном органе, но различен между метастазами в разных органах. Это означает, что раковые клетки на самом глубоком уровне адаптируются к новому микроокружению в зависимости от занятой ими ниши. Изучение генетических изменений при метастазировании рака поджелудочной железы выявило наличие разных субклонов (новых поколений клона), которые формируют метастазы. Однако различия между ними оказались не больше, чем между двумя случайно взятыми клетками одного организма [7].
Интересно, что обнаружили как минимум один ген, FBXW7, мутации в котором противодействуют метастазированию [8]. Происходит это за счет усиления провоспалительной реакции, пролиферации и активности T-лимфоцитов, которые стимулируют формирование адаптивного иммунитета к опухолевым клеткам. Таким образом, мутации в гене FBXW7 противодействуют опухолевой иммунносупрессии. Ее проявления, такие как уменьшение количества лимфатических сосудов и эффекторных T-лимфоцитов в первичной опухоли, связаны с лицензированием метастазирования [8].
Следующую ступень в регуляции экспрессии генов после непосредственных изменений в ДНК (мутаций, вариаций числа копий и т.д.) занимают эпигенетические изменения (метилирование гистонов, ДНК и др.) (рис. 3). По своей природе они более пластичны, более переменчивы по сравнению с генетическими изменениями и подвластны влиянию клеточной сигнализации, которая подстраивается под воздействие внешних факторов. Оказалось, что эпигенетический код значительно отличается в клетках метастазов по сравнению с первичной опухолью. При раке поджелудочной железы потеря большого количества меток неактивного хроматина (гетерохроматина) — метилирования гистонов (H3K9, H4K20) — и ослабление метилирования ДНК связаны с метастазированием. Эти модификации в раковых клетках переводят участки гетерохроматина в активное состояние, доступное для транскрипционных факторов, и в результате усиливают экспрессию генов онкогенеза, таких как регуляторы мезенхимального фенотипа, KRAS-сигнализации и метаболизма [9].
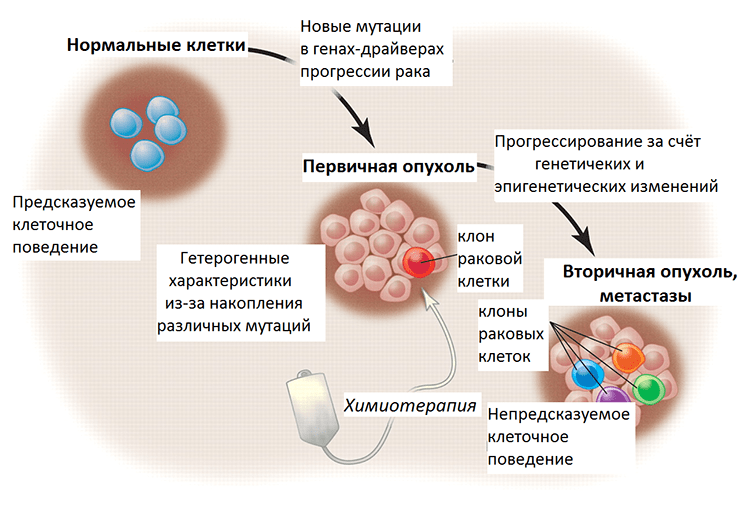
Рисунок 3. Злокачественная трансформация и прогрессирование рака в перспективе генетических и эпигенетических изменений. Нормальные клетки ткани имеют предсказуемое поведение — темпы пролиферации, срок жизни, характер взаимодействия с другими клетками. При злокачественной трансформации накапливаются мутации, и постепенно опухоль становится генетически гетерогенной (состоит из нескольких клонов, поколений раковых клеток). Химиотерапия уничтожает некоторые клоны, тогда как другие, с выгодными в новых условиях мутациями, выживают и создают новых клонов. Их поведение уже непредсказуемо, так как генетические и эпигенетические изменения этих раковых клеток привели к приобретению ими новых свойств.
Метаболическая пластичность при метастазировании
Эпигенетическая регуляция является одним из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области с недостаточным снабжением кислородом (гипоксией), так как до них не доходят кровеносные сосуды. Это вызывает в раковых клетках активацию гена фактора, индуцируемого гипоксией (HIF-1α). Происходит это за счет эпигенетического освобождения, деметилирования промотора гена, который становится доступным для транскрипционных факторов. Усиленное образование и активность белка HIF-1α, в свою очередь, регулирует экспрессию генов множества метаболических ферментов и транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток и поддерживает их потребности.
Клеточный метаболизм разделен на процессы расщепления с выделением энергии (катаболизм) и образования соединений с использованием энергии (анаболизм). Энергетический обмен клетки протекает за счет этапов клеточного дыхания — гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования. Раковые клетки по-своему приспосабливаются к сохранению продуктивности энергетического обмена в условиях недостатка кислорода. В первичной опухоли они, в основном, используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение глюкозы с преобразованием до лактата, выделяемого раковыми клетками, названо эффектом Варбурга. Он позволяет им выжить при гипоксии и активно пролиферировать за счет использования промежуточных соединений для биосинтеза и выделения энергии [10].
Преимущественный способ генерирования энергии у метастазов, однако, до сих пор мало изучен. Используя клетки рака молочной железы, обладающие широкой или специфической органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, активировали использование окислительного фосфорилирования, колонизировавшие печень — гликолиз. Когда раковые клетки колонизировали все вышеперечисленные очаги, они активировали сразу оба метаболических пути (рис. 4) [11]. Похоже, что такая пластичность помогает раковым клеткам освоить новые ниши для колонизации. Например, в печени гликолитический фенотип поддерживается при росте метастазов за счет активности упомянутого ранее фактора HIF-1α, а также повышенной экспрессии белка PDK1. Это фермент, который ингибирует формирование соединения ацетил-КоА. И так как его поток на развилке с гликолитическим путем в цикл трикарбоновых кислот уменьшается, усиливается образование конечного продукта гликолиза — лактата [12].
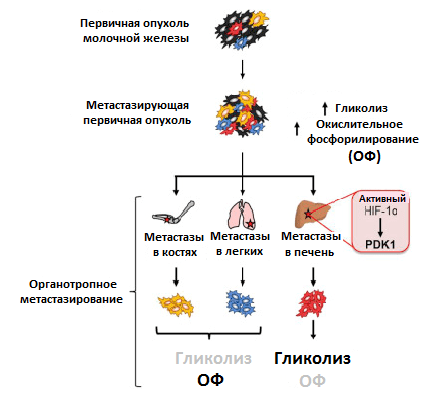
Рисунок 4. Различия в метаболизме первичной опухоли и метастазов в разных органах. Условные обозначения: ОФ — окислительное фосфорилирование; HIF-1α — индуцируемый гипоксией фактор 1; PDK1 — пируватдегидрогеназный комплекс 1.
Почему же для метастазов в одном органе выгоднее использовать преимущественно один вид метаболизма, чем другой? Ответ на этот вопрос и роль различных факторов в регуляции метаболической пластичности раковых клеток еще только предстоит узнать.
Понятие о преметастазных нишах
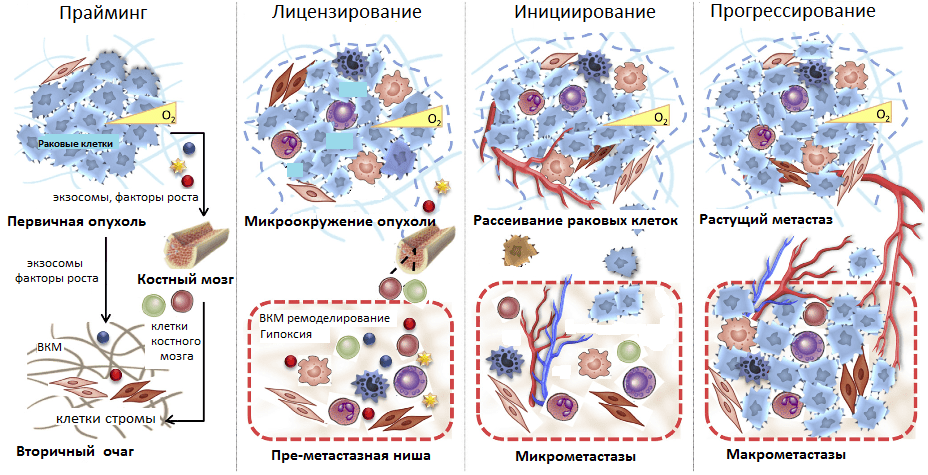
Рисунок 5. Стадии развития метастазов. Прайминг, или обучение, будущего вторичного очага роста первичной опухолью; лицензирование — иммуносупрессия первичной опухоли, создание благоприятного микроокружения в преметастазных нишах; инициирование — начало метастазирования и освоения преметастазной ниши; прогрессирование — рост метастазов во вторичном очаге.
Таким образом, в текущем представлении формирование метастазов происходит в несколько стадий. Начиная с раннего роста первичной опухоли происходит прайминг — обучение будущих ниш развития метастазов с помощью выделения различных факторов раковыми клетками, привлечения клеток из костного мозга. Затем клетки стромы первичной опухоли и преметастазных ниш (фибробласты, клетки миелоидного ряда, T-лимфоциты) формируют благоприятное микроокружение, лицензируя дальнейшее расселение метастазов. Фаза инициирования метастазирования заключается в росте сосудов, ангиогенезе, по которым метастазные клетки покидают первичную опухоль и приходят в преметастазные ниши. Прогрессирование — это финальный этап перехода микрометастазов в макрометастазы — вторичные сформированные опухоли. Он может занять от нескольких месяцев до нескольких лет (рис. 5).
Гетерогенность в механизмах формирования преметастазных ниш
При некоторых типах рака, таких как меланома, для успешного метастазирования в лимфатические узлы и органы необходимо формирование новых лимфатических сосудов в их преметастазной нише. Недавно ученые установили, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, и медиатором его запуска является фактор роста мидкин, секретируемый клетками меланомы в составе экзосом или в свободном виде [19].
Безусловно, механизмы формирования преметастазных ниш в комплексе позволяют лучше понять развитие рака и не перестают удивлять своей сложностью.
Причины органотропии
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропному метастазированию, но как раковые клетки, которые могут метастазировать сразу в несколько органов, выбирают только один из них?
Именно они адресуют доставку экзосом в определенный орган, который преимущественно имеет этот специфический ВКМ-белок в составе стромы. Сливаясь с мембранами клеток стромы того или иного органа, экзосомы доставляют содержимое и запускают свою программу: в фибробластах легких — через экспрессию одних генов S100, в клетках Купфера в печени — через экспрессию других. Активность этих генов стимулирует клеточную сигнализацию и воспалительные реакции, которые занимаются обучением преметастазной ниши (рис. 6) [21].
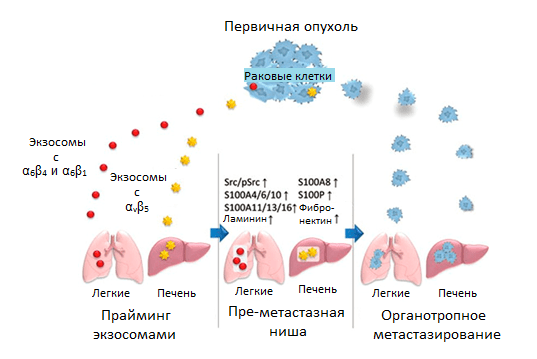
Рисунок 6. Регуляция органотропного метастазирования с помощью прайминга преметастазной ниши экзосомами со специфическими рецепторами интегринами. Условные обозначения: α6β4 и α6β1 — гетеродимеры интегринового рецептора; Src/pSrc — пропорция неактивной/активной форм киназы.
Перспективы в терапии метастазирования
Подведем итог: описанные здесь механизмы, очевидно, усложняют картину течения онкозаболеваний и развития тактик их лечения. Важно подчеркнуть, что гетерогенность первичной опухоли и метастазов по ряду рассмотренных здесь признаков (генетическая, метаболическая, нишевая) дает понимание того, что следует использовать комбинированное и таргетное лечение на разных стадиях течения болезни. Как подтверждение тому — результаты одного из последних исследований, проведенных на материалах пациента с рецидивами между курсами длительной иммунотерапии. Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны [22] и, следовательно, первичная, вторичные и т.д. опухоли по-разному отвечали на лечение.
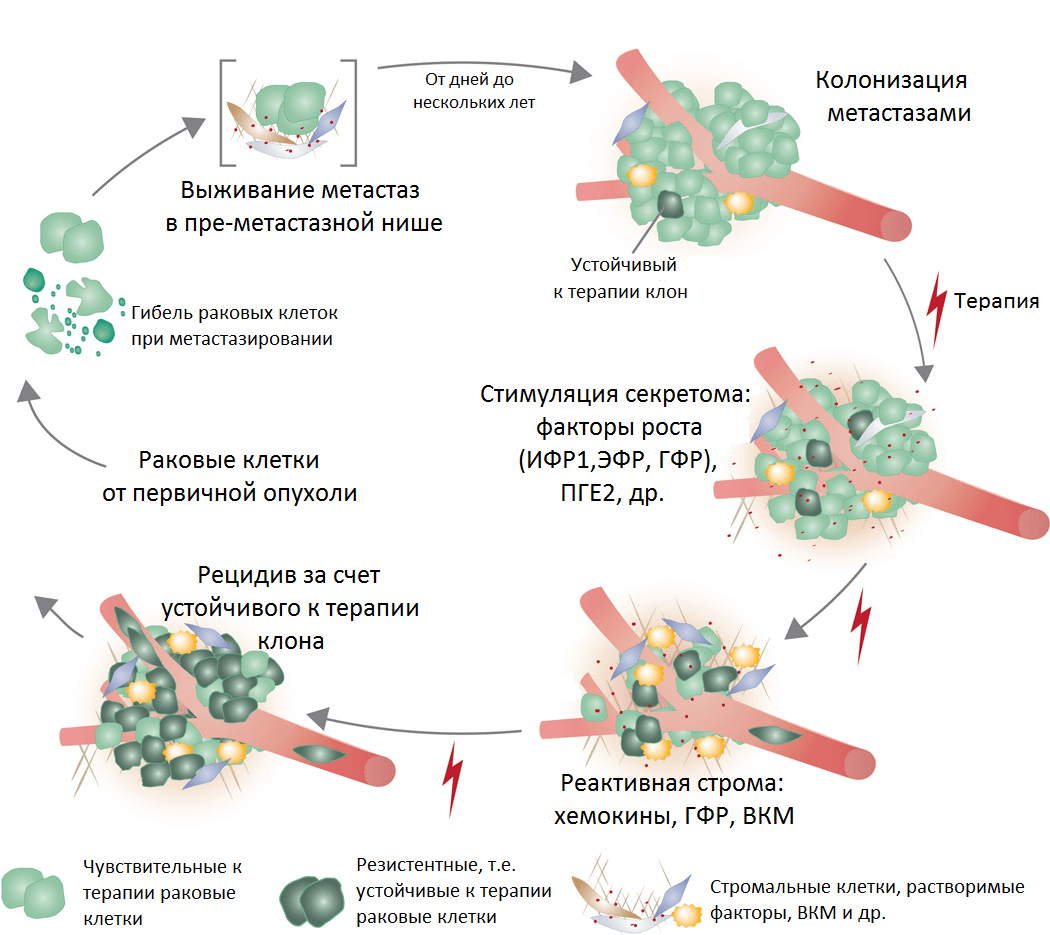
Рисунок 7. Реакция метастазов на терапию, образование резистентности и развитие рецидива. Условные обозначения: ИФР1 — инсулиноподобный фактор роста; ЭФР — эпидермальный фактор роста; ГФР — фактор роста гепатоцитов; ПГЕ2 — простагландин 2; ВКМ — внеклеточный матрикс.
Обнаружение преметастазных ниш и понимание их устройства предложили по-новому взглянуть на развитие подходов в терапии. Если бы стало возможным предотвратить формирование преметастазных ниш, то с большой вероятностью было бы остановлено метастазирование, а значит, и возможность ремиссии. Будем и дальше следить за прорывами в этой области.
Читайте также:








