Туберкулез при хроническом миелолейкозе

Что такое хронический миелолейкоз?

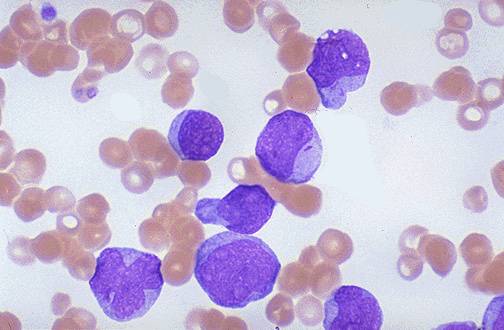
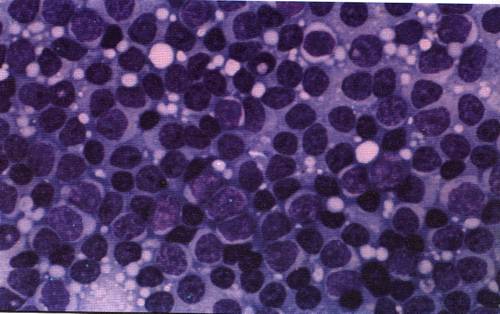
Мазок крови пациента с хроническим миелолейкозом
Хронический миелолейкоз (ХМЛ) — злокачественное новообразование кроветворной ткани, сопровождающееся прогрессирующей пролиферацией незрелых гранулоцитов. Заболевание изначально обладает вялотекущим характером, постепенно перетекая в стадию обострения с выраженной симптоматикой и образованием системных нарушений. Является одной из самых опасных и инвалидизирующих болезней.
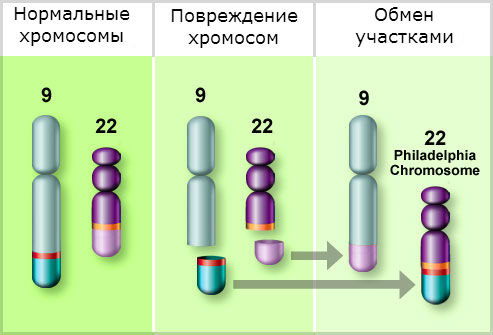
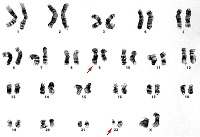
ХМЛ — первое онкологическое заболевание, у которого определена связь между развитием канцерогенеза и мутацией в гене. Характерная аномалия основана на транслокации 9-й и 22-й хромосом, то есть участки данных хромосом меняются местами, образуя аберрантную хромосому. Выявлена мутировавшая хромосома исследователями из Филадельфии, поэтому она получила название филадельфийская или Ph-хромосома.
Причины развития

Негативное воздействие на кроветворение оказывают ядохимикаты
Заболевание известно науке с 1811 года, но до сих пор факторы, провоцирующие мутацию в гене, определить не удалось. Существует ряд причин, способствующих развитию патологии:
- радиоактивное облучение, в том числе при лучевой терапии;
- химиотерапия иных онкологических заболеваний;
- ряд генетических заболеваний, характеризующихся хромосомной аномалией (например, синдром Дауна);
- взаимодействие с химическими соединениями (нефтепродукты, пестициды).
Патогенез хронического миелолейкоза

Патогенез хронического миелолейкоза
Гибридный ген BCR-ABL 1, образованный в результате транслокации хромосом, продуцирует синтез белка BCR-ABL. Данный белок представляет собой тирозинкиназу, которая в норме способствует передаче сигнальных импульсов для роста клетки. Созданная путём мутации тирозинкиназа становится активным фактором пролиферации клеток, они начинают делиться и распространяться уже независимо от факторов роста. Происходит процесс создания клонов мутировавшей клетки.
Бесконтрольное деление сопровождается нарушением апоптоза — запрограммированной гибели клеток. Также гибридная тирозинкиназа подавляет естественные функции восстановления в молекулах ДНК, создавая предпосылки для последующих мутаций, что усугубляет патологический процесс.
Размножающиеся клетки являются незрелыми, бластными предшественниками полноценных элементов крови. Постепенно бластные клетки вытесняют функциональные эритроциты, тромбоциты и лейкоциты. Добавляются нарушения и в других хромосомах, что запускает ускоренный процесс разрушения организма в целом.
Стадии хронического миелолейкоза

Бластный криз — одна из стадий миелолейкоза
- Хроническая — 30% бластных клеток. Стадия характеризуется агрессивным характером мутировавших клеток, состояние пациента резко ухудшается. Дополнительные аномалии как в гене BCR-ABL, так и в геноме в целом, провоцируют цепь патологических реакций, которые уже практически не поддаются лечению. На этом этапе могут поражаться ткани внутренних органов, кожные покровы и слизистые оболочки, миелоидные клетки преобразовываются в саркому.
Симптомы и признаки

Признаки ХМЛ становятся заметны ближе к прогрессирующей стадии.
- Симптомы опухолевой интоксикации: снижение массы тела, быстрая утомляемость, волнообразное повышение температуры, кожный зуд, тошнота, суставные боли.
- Симптомы опухолевой пролиферации — увеличение селезёнки и печени, боль в левом подреберье, поражение кожных покровов.
- Анемический синдром — головокружение, выраженная бледность, учащённое сердцебиение, чувство нехватки воздуха.
- Геморрагический синдром — склонность к кровоточивости слизистых оболочек, сыпь в виде красных точек, длительное кровотечение при незначительных порезах.
Диагностика заболевания

Один из методов диагностики заболевания — рентгенологический
Диагностика ХМЛ включает:
- Первичный осмотр пациента с изучением анамнеза, жалоб, а также исследование при помощи пальпации размеров селезёнки и печени.
- Общий анализ крови выявляет число и характеристики форменных элементов крови.
- Биохимический анализ проводится для определения уровня билирубина, электролитов, глюкозы, ЛДГ, АСТ, АЛТ.
- Гистологическое исследование костного мозга определяет скопления бластных клеток.
- Цитогенетический анализ выявляет транслокацию хромосом.
- На 3-й стадии проводится иммунофенотипирование для идентификации бластных клеток.
- Метод генного секвенирования применяется для выявления генных мутаций.
- Проводится УЗИ внутренних органов, в первую очередь селезёнки и печени.
- Дополнительно назначают рентгенографию органов грудной клетки, ЭКГ, эхокардиографию, ИФА на маркеры различных заболеваний, коагулограмму и другие исследования.
Лечение

Основа лечения — ингибиторы тирозинкиназы
Выбор препарата и доза определяются в зависимости от стадии ХМЛ и риска побочных эффектов. Обычно лечение начинается с приёма иматиниба в дозировке 400 мг/день при начальной стадии, 600 мг/день при последующих стадиях, затем дозу могут увеличивать или снижать. Различные аберрации в генах обусловливают низкую чувствительность к препаратам, поэтому пациенту могут менять одни ингибиторы на другие.

Трансплантация костного мозга
Если терапия не оказывает действия, рекомендуется аллогенная трансплантация костного мозга. Новые стволовые клетки могут выработать здоровые элементы кровеносной системы. Но операция сопряжена с рядом высоких рисков.
Терапия препаратами интерферона назначается обычно в 1-й стадии ХМЛ, так как не обладает эффективностью при последующих.
Для уменьшения массы опухоли и при отсутствии результата в лечении ингибиторами проводится химиотерапия. В стадии бластного криза используется полихимиотерапия аналогично лечению острого лейкоза.
Лучевая терапия может быть назначена в случае выраженной спленомегалии. При риске разрыва селезёнки проводят спленэктомию.
Профилактика и прогноз

Прогноз заболевания определяет врач
Причина образования ХМЛ не установлена, поэтому профилактикой являются меры по избеганию контактов с канцерогенными веществами, воздействия радиоактивного облучения.
Прогноз определяется стадией и тяжестью болезни. Одна из прогностических моделей (Kantarjian H.M.) включает факторы:
- преклонный возраст пациента при постановке диагноза;
- концентрация бластных клеток в крови ≥ 3%, в костном мозге ≥ 5%;
- концентрация базофилов ≥ 7%;
- концентрация тромбоцитов ≥ 700*10 9/л;
- выраженная спленомегалия.
ХМЛ - опухолевое заболевание, возникающее из ранних предшественников миелопоеза. Его морфологическим субстратом являются преимущественно созревающие и зрелые гранулоциты, главным образом, нейтрофильного ряда.
Эпидемиология
Среди всех гемобластозов ХМЛ занимает пятое место. Заболевание ХМЛ ежегодно составляет 1:100000 населения. Встречается во всех возрастных группах, но, преимущественно, в возрасте 30-50 лет. Болеют одинаково как мужчины, так и женщины.
Этиология и патогенез
В развитии ХМЛ играют роль разные мутагенные факторы. Значительное увеличение заболеваемости лейкозами в Хиросими и Нагасаки приходится на ХМЛ. Кроме радиации, имеет значение и мутагенная для ряда химических веществ, а также врожденные дефекты хромосом. В 90-98% случаев оказывается филадельфийская хромосома (Ph'-хромосома).
Клиническая картина
В начале заболевания протекает при незначительных или при полном отсутствии клинических проявлений. Некоторые больные отмечают небольшую общую слабость, боль в левом подреберье. Может оказаться немного увеличенной печень и селезенка.
Диагноз в этот период выставляется после анализа крови, проведенного по какому-либо поводу. Это первая начальная стадия заболевания.
Вторая стадия - стадия развернутых клинических проявлений. В этой стадии отмечается прогресс лейкемического процесса. Возростает общая слабость, происходит снижение или потеря работоспособности, потливость, снижение аппетита, периодически отмечается субфебрильная температура. Многие больные жалуются на боли в костях (оссалгии), на боли по ходу нервов (невралгии). В редких случаях наблюдаются явления геморрагического диатеза. Выявляется увеличение печени и селезенки. Особенно увеличивается селезенка, которая может занимать более половины живота. Селезенка плотная. Больные чувствуют тупую боль в левой половине живота из-за растяжения капсулы селезенки. У 50% больных возникают инфаркты селезенки, вызывающие острую боль. В такой селезенке могут происходить надрывы, разрывы. Нередко боль связана с периспленитом. Лимфоаденопатия встречается редко.
У больных могут возникать боли в животе и диспептические явления, связанные с повреждением слизистой оболочки желудка и кишечника из-за интоксикации, кровоизлияния и появления язв. Со стороны сердца возникает миокардиодистрофия. Нередко течение заболевания осложняется вторичной инфекцией. Особенно часты анемии, возможны плевриты, так как увеличенная селезенка сжимает нижние отделы легких, уменьшая их вентиляцию и нарушая кровообращение. Возможен переход опухолевого процесса из капсулы селезенки в плевру. В результате распада большого количества клеток при значительной лейкемии в крови растет количество мочекислых солей, которое может привести к вторичной подагре и к развитию мочекаменной болезни с почечной коликой.
Заболевание заканчивается ІІІ стадией - терминальной. В этой стадии развиваются все признаки интоксикации - стойкое повышение температуры, значительное снижение массы тела, вплоть до кахексии. Возникает геморрагический синдром, быстро прогрессирующая анемия. Отмечается рефрактерность к терапии, склонность к инфекционным осложнениям. В этой стадии наблюдается выход патологического кроветворения с развитием миелоидной инфильтрации за пределы костного мозга, селезенки, печени. Выявляется лейкозная инфильтрация почек, легких, плевры, перикарда и других органов, мозговых оболочек, кожи (лейкемиды), лимфатических узлов. Кровь наполняется бластными клетками. Возникает так называемый бластный криз, при этом течение заболевания похоже на течение острого лейкоза.
На этой стадии отмечаются все признаки опухолевой прогрессии, которая характеризуется:
1) ухудшением общего состояния больного,
2) увеличением массы опухоли в костном мозге, селезенке и рост ее вне органов кроветворения,
3) выраженным угнетением нормального кроветворения,
4) наполнением крови и костного мозга бластными клетками,
5) резистентностью к проведенной терапии.
Гематологическая картина
В 1 (начальной) стадии наблюдается:
- небольшой лейкоцитоз - до 20-30 г/л лейкоцитов;
- умеренная базофилия и эозинофилия - так называемая эозинофильно-базофильная ассоциация;
- сдвиг лейкоцитарной формулы влево к миелоцитам, реже - промиелоцитам;
- часто оказывается тромбоцитоз.
Во ІІ стадии (развернутых клинических проявлений) отмечается:
- гиперлейкоцитоз с количеством лейкоцитов до нескольких десятков и сотен г/л;
- сдвиг лейкоцитарной формулы влево, чаще к промиелоцитам;
- иногда оказываются единичные миелобласты;
- количество зрелых форм уменьшается
- умеренная анемия или отсутствует;
гипертромбоцитоз, возможна тенденция к тромбоцитопении.
В ІІІ стадии (терминальной) отмечаются:
- гиперлейкоцитоз, однако возможна лейкопения;
- наполнение крови самими молодыми клетками - миелобластами, недифференцированными бластами при бластном кризе (20% и более);
- растущая анемия, которая является важным признаком тяжести течения заболевания;
снижение количества тромбоцитов.
Пунктат костного мозга богат миелокариоцитами, гранулоцитопоез увеличен преимущественно за счет миелоцитов и метамиелоцитов, небольшого количества бластов - 2-7, возможен и больший процент. Уменьшается количество клеток эритропоэза. Соотношение количества лейкоцитов миелоидного ряда к эритроцитам - 8-10:1 и более (в норме 3:1 или 4:1). Выявляется накопление тромбоцитов. Характерно увеличение числа мегакариоцитов в течение длительного периода заболевания.
При бластном кризе в пунктате костного мозга основную массу клеток составляют миелобласты и недифференцированные бласты.
Отмечается значительное снижение активности щелочной фосфатазы в гранулоцитах.
С большим постоянством виявляеться РH'-хромосома, которая является хромосомным маркером лейкозных клеток при хроническом миелолейкозе.
Течение заболевания
Течение ХМЛ, чаще всего, волнообразное, с изменением рецидивов и ремиссий. Однако патологический процесс непрерывно прогрессирует и в терминальной стадии заканчивается бластным кризом. Прогноз всегда неблагоприятный. Чаще всего больные погибают от бластного криза. Они могут погибнуть и от присоединения вторичной инфекции, от кровоизлияния в мозг, от разрыва селезенки, от избыточного кровотечения, например, маточного.
Заболевание чаще всего заканчивается бластным кризом и смертью в 80-90% случаев. Реже бластный криз может возникнуть через несколько недель от начала заболевания. В 2-8% случаев встречается Рh'-негативний вариант ХМЛ, при котором Рh'-хромосома в кроветворных клетках не выявляется. Течение заболевания у больных с этим вариантом отличается большой злокачественностью и малой продолжительностью жизни.
Диагноз ХМЛ основан на выявлении характерных изменений в крови, спленомегалии. Трудности возникают только в начале заболевания, когда изменения в крови еще незначительные.
Дифференциальный диагноз в таких случаях следует проводить с лейкемоидной реакцией миелоидного типа, когда изменения в крови являются только реакцией костного мозга при каком-то инфекционном процессе (сепсис, нагноение, туберкулез и др.), а также при опухолях.
В отличие от ХМЛ при лейкемоидной реакции:
1. Возможно наличие какого-либо заболевания, с которым можно связать возникновение лейкемоидной реакции.
2. При благоприятном течении основного заболевания его изменения со стороны крови исчезают.
3. В крови отсутствует эозинофильно-базофильная ассоциация, гипер-тромбоцитоз. Однако опухолевый процесс, который вызывал лейкемоидную реакцию, может протекать с гипертромбоцитозом.
4. При лейкемоидной реакции миелограмма мало изменена.
5. При ХМЛ щелочная фосфатаза лейкоцитов снижена, при злокачественных новообразованиях она может быть, конечно, повышенной.
В период бластного криза иногда возникает необходимость в дифференциальной диагностике ХМЛ с острым. Трудности связаны с тем, что, как указано выше, при ХМЛ может быть очень небольшая продолжительность жизни, а острый лейкоз иногда протекает в таких формах атипизма, когда оказывается значительная гепато- и спленомегалия, свойственные ХМЛ и несвойственные острому.
В таких случаях помогает некоторая разница в картине крови - отсутствие при остром лейкозе эозинофильно-базофильной ассоциации и наличие в лейкоцитарной формуле провала (hiatus leucemicus) между самими молодыми бластными клетками и небольшим количеством зрелых клеток при отсутствии промежуточных форм, а также возникновение с самого начала острого лейкоза тромбоцитопении и анемии. Иногда придется проводить дифференциальный диагноз с циррозом печени, протекающим с выраженной спленопегалией.
Лечение
Лечение ХМЛ зависит от стадии заболевания. На начальной стадии, когда самочувствие больного остается удовлетворительным, клинико-гематологические симптомы мало выражены, следует проводить только общеукрепляющую терапию. Она включает у себя полноценное питание, богатое витаминами, организацию правильного режима труда и отдыха, прогулки на свежем воздухе, однако без избыточной инсоляции. Больные должны находиться под регулярным диспансерным наблюдением врача.
Основным видом лечения во ІІ стадии заболевания, в стадии развернутых клинических проявлений, является химиотерапия. Ее подключают тогда, когда начинается увеличение лейкоцитоза, размеров селезенки и печени, ухудшается самочувствие больного. Используются такие цитостатики, как миелосан (милеран), миелобромол, гидроксимочевина (гидреа). Это препараты, которые избирательно подавляют миелопоез. Миелосан, в основном, действует на родоначальную клетку, в итоге прекращается продукция лейкозных клеток; миелобромол тормозит развитие пролиферирующих клеток. Терапия чаще проводится миелосаном. Доза миелосана зависит от величины гиперлейкоцитоза и составляет от 2-4 до 6-8 мг/сутки. Снижение количества лейкоцитов отмечается после 10 дня от начала терапии. Нормализация картины крови, уменьшение размеров селезенки наступает на 3-5 неделю заболевания. Терапия миелосаном, как и другими цитостатиками, проводится под регулярным контролем анализов крови. При снижении количества лейкоцитов на 50% дозу препаратов снижают, а при количестве лейкоцитов равному 15 г/л, препарат отменяется, так как после отмены отмечается некоторый период его последействия. После этого проводится поддерживающая терапия миелосаном путем приема его в дозе 2-4 мг 1 раз в неделю. Длительность ремиссии после курса лечения миелосаном - от 6 месяцев до 1,5 лет.
Лечение миелобромолом проводят в случаях недостаточной эффектив-ности миелосана. Препарат назначается в дозе 125-250 мг в день. Нормализация картины крови происходит уже через 2-3 недели от начала терапии, после чего переходят на поддерживающее лечение препаратом в дозе 125-250 мг 1 раз в 5-10 дней. Ремиссии после курса лечения миелобромолом более короткие, чем после миелосанотерапии.
При длительном приеме миелосана и миелобромола возможно развитие лейкопении, тромбоцитопении и даже аплазии кроветворения, поэтому является необходимым контроль гемограммы 1 раз в неделю. К побочным эффектам относятся также пигментация и сухость кожи, временная аменорея у женщин, снижение половой функции у мужчин, реже - фиброз легких.
В настоящее время многие гематологи признают препаратом выбора гидроксимочевину (гидрея, литамир). Этот препарат ингибирует один из ключевых ферментов, которые принимают участие в биосинтезе ДНК. Начальная доза препарата - 1600 мг/м 2 тела больного. Употребляется ежедневно во внутрь. При отсутствии эффекта дозу можно увеличить до 3 г/сутки. Эффект наступает через 5-6 недель. Дальше поддерживающую дозу подбирают индивидуально. Гидроксимочевина чаще всего хорошо переносится больными, однако возможно появление диспептических явлений, стоматита, аллергических реакций, главных болей, головокружения. При лечении гидроксимочовиною возможно подавление функции костного мозга.
Эффективность гидроксимочевины повышается при ее соединении с -2-интерфероном. Механизм антипролиферативного действия -2-интерферона до конца не выяснен. Допускается, что он способен блокировать разнообразный онкоген и делать иммунномодулирующий эффект. По данным некоторых авторов, 5-летняя способность больных ХМЛ выживать при лечении -2-интерфероном достоверно выше, чем при лечении гидроксимочевиной. -2-интерферон может применяться или в виде монотерапии, или в соединении с гидроксимочевиной. Этот препарат вводится ежедневно подкожно, в дозе 4 млн.ед./м 2 в течение 10 дней. Потом по 3 млн. ед./м 2 2 раза в неделю в течение 6 месяцев. Успешным лечение считается, если исчезает Рh'-хромосома.
При бластном кризе проводится полихимиотерапия по программам лечения острого лейкоза, например, по схеме АВАМП (цитозар, винкристин, метатрексат, 6-меркаптопурин, преднизолон) или схеме ЦВАМП - те же препараты, но вместо цитозара вводится циклофосфан).
Существует точка зрения о необходимости после достижения эффекта проводить консолидирующую терапию в виде 5 циклов терапии цитозаром, к которому последовательно подключаются разные цитостатики.
Проводится и трансплантация костного мозга. Ее целью является замена здоровым костным мозгом костного мозга больного после полного уничтожения лейкозных и здоровых костномозговых клеток проведением интенсивной химио- и радиационной терапии. По данным Ф.Е.Файнштейн, она обеспечивает ремиссии в 70% случаев. Имеются данные, свидетельствующие о том, что, если трансплантация проводится в течение первого года от начала заболевания - может наступить клинико-гематологическая ремиссия в течение 5 лет и более, то есть, может наступить клиническое выздоровление.
Лучевая терапия проводится, главным образом, при значительной спленомегалии, при выраженном гиперлейкоцитозе (больше 100 г/л), а также при экстрамодулярных образованиях, угрожающих жизни больного, например, в миндалинах.
Спленэктомия проводится при следующих показаниях:
- развитии тромбоцитопении в результате лечения миелосаном;
- болях в результате периспленита;
- тяжелом абдоминальном дискомфорте, связанном с выраженой спленомегалией;
При недостаточной эффективности цитостатической терапии может быть использован лейкоцитофорез. Этот вид лечения особенно показан при появлении клинических признаков спазма в сосудах головного мозга, возникающего в результате гиперлейкоцитоза и гипертромбоцитоза. Они выражаются в появлении головных болей, ощущения тяжести в голове, головокружении, ощущении "приливов", снижении зрения и слуха.
При развитии анемии, геморрагического синдрома проводятся трансфузии эритроцитарной массы, тромбоконцентрата, введение кровоостанавливающих средств. Инфекционные осложнения являются показанием для введения антибиотиков.
Хронический миелолейкоз - опухолевое заболевание крови. Характеризуется бесконтрольным ростом и размножением всех ростковых клеток крови, при этом молодые злокачественные клетки способны созревать до зрелых форм.
Во время хронического миелолейкоза в крови повышается содержание особой разновидности лейкоцитов – гранулоцитов. Они образуются в красном костном мозге в огромном количестве и выходят в кровь, не успевая до конца созреть. Одновременно содержание всех остальных видов лейкоцитов снижается.
Причины хронического миелолейкоза
Причины хромосомного нарушения, приводящего к хроническому миелолейкозу, до сих пор изучены недостаточно.
Считается, что имеют значение следующие факторы:
![]()
Слабые дозы радиации. Их роль доказана только у 5% больных.- Электромагнитные излучения, вирусы и некоторые химические вещества – их влияние не доказано окончательно.
- Применение некоторых лекарственных препаратов. Известны случаи возникновения хронического миелолейкоза при лечении цитостатиками (противоопухолевые препараты) в сочетании с лучевой терапией.
- Наследственные причины. Люди с хромосомными нарушениями (синдром Клайнфелтера, синдром Дауна) имеют повышенный риск хронического миелоидного лейкоза.
- Клетки размножаются неконтролируемо, как раковые.
- Для этих клеток перестают работать естественные механизмы гибели.
Фазы хронического миелолейкоза
- Хроническая фаза. В этой фазе находится большинство пациентов, которые обращаются к врачу (около 85%). Средняя продолжительность – 3 – 4 года (зависит от того, насколько своевременно и правильно начато лечение). Это стадия относительной стабильности. Пациента беспокоят минимальные симптомы, на которые он может не обращать внимания. Иногда врачи выявляют хроническую фазу миелолейкоза случайно, при проведении общего анализа крови.
- Фаза акселерации. Во время этой фазы патологический процесс активируется. Количество незрелых белых кровяных телец в крови начинает быстро нарастать. Фаза акселерации является как бы переходной от хронической к последней, третьей.
- Терминальная фаза. Финальная стадия болезни. Возникает при нарастании изменений в хромосомах. Красный костный мозг практически полностью замещается злокачественными клетками. Во время терминальной стадии пациент погибает.
Проявления хронического миелолейкоза
![]()
Вначале симптомы могут полностью отсутствовать, либо они выражены настолько слабо, что больной не придает им особого значения, списывает на постоянное переутомление. Заболевание выявляется случайно, во время очередной сдачи общего анализа крови.- Нарушение общего состояния: слабость и недомогание, постепенная потеря веса, снижение аппетита, повышенная потливость по ночам.
- Признаки, обусловленные увеличением размеров селезенки: во время приема пищи больной быстро наедается, боли в левой части живота, наличие опухолевидного образования, которое можно прощупать.
- Признаки, связанные с нарушением функции тромбоцитов и белых кровяных телец: различные кровотечения либо, напротив, образование тромбов.
- Признаки, связанные с повышением количества тромбоцитов и, как следствие, повышением свертываемости крови: нарушение кровообращения в головном мозге (головные боли, головокружения, снижение памяти, внимания и пр.), инфаркт миокарда, нарушение зрения, одышка.
- Резкая слабость, значительное ухудшение общего самочувствия.
- Длительные ноющие боли в суставах и костях. Иногда они могут быть очень сильными. Это связано с разрастанием злокачественной ткани в красном костном мозге.
- Проливные поты.
- Периодическое беспричинное повышение температуры до 38 - 39⁰C, во время которого возникает сильный озноб.
- Снижение массы тела.
- Повышенная кровоточивость, появление кровоизлияний под кожей. Эти симптомы возникают в результате уменьшения количества тромбоцитов и снижением свертываемости крови.
- Быстрое увеличение размеров селезенки: живот увеличивается в размерах, появляется чувство тяжести, боли. Это происходит за счет роста опухолевой ткани в селезенке.
Диагностика заболевания
| Название исследования | Описание | Что выявляет? |
| Общий анализ крови | Рутинное клиническое исследование, выполняется при подозрении на любые заболевания. Общий анализ крови помогает определить общее содержание лейкоцитов, их отдельных разновидностей, незрелых форм. Кровь для анализа берут из пальца или вены в утренние часы. |
Симптомы
- Приапизм – болезненная, чрезмерно длительная эрекция.
Данные симптомы это предвестники тяжелого состояния (бластного криза), появляются за 6- 12 месяцев до его начала.
- Снижается эффективность лекарств (цитостатиков)
- Развивается анемия
- Увеличивается процент бластных клеток в крови
- Ухудшается общее состояние
- Увеличивается селезенка
- Симптомы соответствую клинической картине при остром лейкозе (см. Острый лимфолейоз).
Как лечат миелолейкоз?
Цель лечения снизить рост опухолевых клеток и уменьшить размеры селезенки.
Лечение заболевания должно быть начато сразу после того, как установлен диагноз. От качества и своевременности терапии во многом зависит прогноз.
Лечение включает различные методы: химиотерапия, лучевая терапия, удаление селезенки, пересадка костного мозга.
Химиотерапия
- Классические препараты: Миелосан (Милеран, Бусульфан), Гидроксиуреа (Гидреа, Литалир), Цитозар, 6-меркаптопурни, альфа-интерферон.
- Новые препараты: Гливек, Спрайсел.
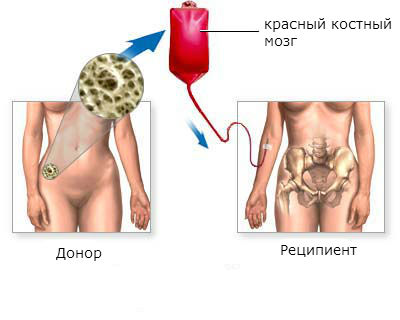
Пересадка костного мозга даёт возможность полностью выздороветь больным хроническим миелолейкозом. Эффективность пересадки выше в хронической фазе заболевания, в остальных фазах гораздо ниже.
Трансплантация красного костного мозга является наиболее эффективным методом лечения хронического миелоидного лейкоза. Более чем у половины пациентов, которым была произведена пересадка, наступает стойкое улучшение в течение 5 лет и дольше.
Чаще всего выздоровление происходит в том случае, когда красный костный мозг пересаживают больному моложе 50 лет в хроническую фазу заболевания.
Этапы трансплантации красного костного мозга:
- Поиск и подготовка донора. Лучшим донором стволовых клеток красного костного мозга является близкий родственник больного: близнец, брат, сестра. Если близких родственников нет, или они не подходят, ищут донора. Проводят ряд тестов для того, чтобы убедиться, что донорский материал приживется в теле пациента. Сегодня в развитых странах созданы большие банки доноров, в которых находятся десятки тысяч донорских образцов. Это дает шанс быстрее найти подходящие стволовые клетки.
- Подготовка пациента. Обычно этот этап продолжается от недели до 10 дней. Проводят лучевую терапию и химиотерапию для уничтожения как можно большего количества опухолевых клеток, предотвращения отторжения донорских клеток.
- Собственно пересадка красного костного мозга. Процедура похожа на переливание крови. В вену пациента заводят катетер, через который в кровь вводят стволовые клетки. Они какое-то время циркулируют в кровотоке, а потом оседают в костном мозге, приживаются там и начинают работать. Для предотвращения отторжения донорского материала врач назначает противовоспалительные и противоаллергические средства.
- Снижение иммунитета. Донорские клетки красного костного мозга не могут прижиться и начать функционировать сиюминутно. Для этого нужно время, обычно 2 – 4 недели. В течение этого срока у больного сильно снижен иммунитет. Его помещают в стационар, полностью ограждают от контакта с инфекциями, назначают антибиотики и противогрибковые средства. Этот период является одним из самых сложных. Сильно повышается температура тела, в организме могут активироваться хронические инфекции.
- Приживление донорских стволовых клеток. Самочувствие пациента начинает улучшаться.
- Восстановление. В течение нескольких месяцев или лет функция красного костного мозга продолжает восстанавливаться. Постепенно пациент выздоравливает, восстанавливается его работоспособность. Но он все еще должен находиться под наблюдением врача. Иногда новый иммунитет не может справиться с некоторыми инфекциями, в этом случае примерно через год после пересадки костного мозга делают прививки.
Проводится в случаи отсутствия эффекта от химиотерапии и при увеличенной селезенке после приема медикаментов (цитостатиков). Метод выбора при развитии локальной опухоли (гранулоцитарная саркома).
В какой фазе заболевания применяется лучевая терапия?
Лучевая терапия используется в развернутой стадии хронического миелолейкоза, которая характеризуется признаками:
- Значительное разрастание опухолевой ткани в красном костном мозге.
- Рост опухолевых клеток в трубчатых костях 2.
- Сильное увеличение печени и селезенки.
Применяется гамма-терапия – облучение области селезенки гамма-лучами. Основная задача – уничтожить или прекратить рост злокачественных опухолевых клеток. Лучевую дозу и режим облучения определяет лечащий врач.
| К длинным трубчатым костям относят кости плеча, предплечья, пальцев, голени, бедра. В детстве эти кости целиком заполнены красным костным мозгом. У взрослого человека красный костный мозг сохраняется только в головках костей, а в теле кости он замещается на желтый костный мозг (жир). При хроническом миелоидном лейкозе желтый костный мозг может быть вытеснен опухолевой тканью. |
Удаление селезенки используется редко по ограниченным показаниям (инфаркт селезенки, тромбоцитопения, выраженный дискомфорт в животе).
Операцию обычно проводят в терминальную фазу заболевания. Вместе с селезенкой из организма удаляют большое количество опухолевых клеток, тем самым облегчая течение заболевания. После операции обычно увеличивается эффективность медикаментозной терапии.
Каковы основные показания к операции?
- Разрыв селезенки.
- Угроза разрыва селезенки.
- Значительное увеличение органа в размерах, что приводит к сильному дискомфорту.
При высоких уровнях лейкоцитов (500,0 · 10 9 /л и выше), могут использовать лейкаферез для предотвращения осложнений (отек сетчатки, приапизм, микротромбозы ).
При развитии бластного криза, лечение будет таким же, как при острых лейкозах (см. острый лимфолейкоз).
Лейкоцитаферез – лечебная процедура, напоминающая плазмаферез (очищение крови). У пациента берут определенное количество крови и пропускают через центрифугу, в которой она очищается от опухолевых клеток.
В какой фазе заболевания проводят лейкоцитаферез?
Так же, как и лучевую терапию, лейкоцитаферез проводят во время развернутой стадии миелолейкоза. Нередко его применяют в тех случаях, когда отсутствует эффект от применения лекарственных средств. Иногда лейкоцитаферез дополняет медикаментозную терапию.
Читайте также: