Транссудат и экссудат при раке
Еще фото
Ключевые слова: транссудат, экссудат, выпот, асцит, плеврит
Key words: transudate, exudate, effusion, ascites, pleurisy
Исследование выпотных жидкостей в настоящее время имеет высокую значимость в диагностике патологических состояний. Полученные данные этого исследования позволяют врачу-клиницисту получить информацию о патогенезе образования выпота и корректно организовать лечебные мероприятия. Однако на пути диагностики всегда возникают определенные сложности, способные привести в диагностическую ловушку. Необходимость в данной работе появилась в связи с растущей потребностью в освоении и применении метода исследования выпотных жидкостей в клинике врачами клинической лабораторной диагностики и врачами-цитологами. Поэтому внимание будет уделено как главным задачам врачей-лаборантов – дифференцировать выпот на транссудат и экссудат, так и важнейшей задаче врачей-цитологов – верифицировать клеточный компонент жидкости и сформулировать цитологическое заключение.
Examination of effusion fluids currently has a high significance in the diagnosis of pathological conditions. The findings of this study allow the clinician to obtain information on the pathogenesis of effusion formation, and to correctly organize medical interventions. However, on the path of diagnosis, there are always certain difficulties that can lead to a diagnostic trap. The need for this work has emerged in connection with the growing need for mastering and applying the method of examining exudate fluids in the clinic by physicians of clinical laboratory diagnostics and cytologists. Therefore, attention will be paid, as well as the main tasks of laboratory assistants - to differentiate the effusion to transudate and exudate, and the most important task of cytologists is to verify the cellular component of the fluid and formulate a cytological conclusion.
Сокращения: ЭС – экссудат, ТС – транссудат, Ц – цитология, МК – мезотелиальные клетки.
История вопроса
В данной работе предпринята попытка осветить основы и суть лабораторного исследования выпотных жидкостей.
Общая характеристика
Выпотными жидкостями называются компоненты плазмы крови, лимфы, тканевой жидкости, которые накапливаются в серозных полостях. По общепринятому убеждению, выпот – это жидкость в полостях тела, а в тканях по тому же принципу скапливается отечная жидкость. Серозные полости тела – это узкий промежуток между двумя листками серозной оболочки. Серозные оболочки – это пленки, происходящие из мезодермы, представленные двумя листками: париетальным (пристеночным) и висцеральным (органным). Микроструктура париетального и висцерального листка представлена шестью слоями:
2. пограничная мембрана;
3. поверхностный волокнистый коллагеновый слой;
4. поверхностная неориентированная сеть эластических волокон;
5. глубокая продольная эластическая сеть;
6. глубокий решетчатый слой коллагеновых волокон.
Мезотелий – однослойный плоский эпителий, состоящий из плотно прилегающих друг к другу полигональных клеток. Несмотря на свою эпителиальную форму, мезотелий имеет мезодермальное происхождение. Клетки весьма разнообразны по своим морфологическим свойствам. Можно наблюдать двуядерные и трехъядерные клетки. Мезотелий постоянно секретирует жидкость, выполняющую скользяще-амортизационную функцию, способен к крайне интенсивной пролиферации, проявляет характеристики соединительной ткани. На поверхности МК находится множество микроворсинок, увеличивающих поверхность всей оболочки серозной полости приблизительно в 40 раз. Волокнистый слой соединительной ткани листков серозных оболочек определяет их подвижность. Кровоснабжение серозной оболочки висцерального листка осуществляется за счет сосудов того органа, который она покрывает. А для париетального листка основой системы кровообращения является широкопетлистая сеть артерио-артериолярных анастомозов. Капилляры располагаются сразу под мезотелием. Лимфоотток от серозных оболочек хорошо развит. Лимфатические сосуды сообщаются с серозными пространствами благодаря особым отверстиям – стоматам. По причине этого даже незначительная закупорка дренажной системы может привести к накоплению жидкости в серозной полости. А анатомические свойства кровоснабжения располагают к быстрому возникновению кровотечения при раздражении и повреждении мезотелия.
Клиническая лабораторная диагностика выпотных жидкостей
При лабораторном исследовании решается вопрос принадлежности выпота к транссудату или экссудату, оцениваются общие свойства (макроскопический вид жидкости): цвет, прозрачность, консистенция.
Жидкость, скапливающаяся в серозных полостях без воспалительной реакции, называется транссудатом. Если жидкость собирается в тканях, то имеем дело с отеком (edema). Транссудат может накапливаться в перикарде (hydropericardium), брюшной полости (ascites), плевральной полости (hydrothorax), между оболочками яичка (hydrocele).Транссудат обычно бывает прозрачным, почти бесцветным или с желтоватым оттенком, реже слегка мутноватым из-за примеси слущенного эпителия, лимфоцитов, жира и др. Удельный вес не превышает 1,015 г/мл.
Образование транссудата может быть вызвано следующими факторами.
- Увеличением венозного давления, которое имеет место при недостаточности кровообращения, заболеваниях почек, циррозе печени. Транссудация является результатом увеличением проницаемости капиллярных сосудов в результате токсического поражения, гипертермии, расстройствами питания.
- Уменьшением количества белка в крови, осмотическое давление коллоидов уменьшается при снижении альбумина плазмы крови менее 25 г/л (нефротический синдром различной этиологии, тяжелые поражения печени, кахексия).
- Закупоркой лимфатических сосудов. В этом случае образуются хилезные отеки и транссудаты.
- Нарушением обмена электролитов, главным образом повышение концентрации натрия (гемодинамическая сердечная недостаточность, нефротический синдром, цирроз печени).
- Увеличением продукции альдостерона.
Одной фразой охарактеризовать образование транссудата можно так: транссудат возникает, когда гидростатическое или коллоидно-осмотическое давление изменяется в той мере, что жидкость, фильтрующаяся в серозную полость, превышает объем реабсорбции.
Экссудатами называются жидкости, которые накапливаются в полостях тела в результате воспалительного процесса. Образование экссудата вызывается микрофлорой (бактерии, грибы), вирусами, паразитами, попаданием в полость желчи, секрета желудка, поджелудочной железы, содержимого желудочно-кишечного тракта, диссеминацией клеток опухоли по серозным полостям.
Макроскопические характеристики экссудатов позволяют отнести их к следующим видам.
1. Серозный экссудат может быть прозрачным или мутным, желтоватым или бесцветным (что определяется присутствием билирубина), разной степени мутности (рис. 1).
2. Серозно-гнойный и гнойный экссудат – мутная, желтовато-зеленая жидкость с обильным рыхлым осадком. Гнойный экссудат встречается при эмпиеме плевры, перитоните и др. (рис. 2).
3. Гнилостный экссудат – мутная жидкость серо-зеленого цвета с резким гнилостным запахом. Гнилостный экссудат характерен для гангрены легкого и других процессов, сопровождающихся распадом ткани.
4. Геморрагический экссудат – прозрачная или мутная жидкость, красновато- или буровато-коричневого цвета. Количество эритроцитов может быть различным: от небольшой примеси, когда жидкость имеет слабо-розовую окраску, до обильной, когда она сходна с цельной кровью. Наиболее частой причиной геморрагического выпота является новообразование, однако геморрагический характер жидкости большого диагностического значения не имеет, поскольку наблюдается и при ряде неопухолевых заболеваний (травма, инфаркт легкого, плеврит, геморрагический диатез). В то же время при злокачественных процессах с обширной диссеминацией опухоли по серозной оболочке может быть серозный, прозрачный выпот (рис. 3).
5. Хилезный экссудат – мутная жидкость молочного цвета, содержащая во взвешенном состоянии мельчайшие жировые капли. При добавлении эфира жидкость просветляется. Такой выпот обусловлен попаданием в серозную полость лимфы из разрушенных крупных лимфатических сосудов, абсцессом, инфильтрацией сосудов опухолью, филяриозом, лимфомой и др. (рис. 4).
6. Хилусоподобный экссудат – молочно-мутная жидкость, появляющаяся в результате обильного распада клеток с жировым перерождением. Так как кроме жира данный экссудат содержит большое число жироперерожденных клеток, добавление эфира оставляет жидкость мутной или просветляет ее незначительно. Хилусоподобный экссудат характерен для выпотных жидкостей, появление которых связано с атрофическим циррозом печени, злокачественными новообразованиями и др.
7. Холестериновый экссудат – густая желтоватого или буроватого цвета с перламутровым оттенком жидкость с блестящими хлопьями, состоящими из скоплений кристаллов холестерина. Примесь разрушенных эритроцитов может придавать выпоту шоколадный оттенок. На стенках пробирки, смоченной выпотом, видны слепки кристаллов холестерина в виде мельчайших блесток. Такой характер имеет осумковавшийся выпот, который длительно существует (иногда несколько лет) в серозной полости. При определенных условиях – обратном всасывании из серозной полости воды и некоторых минеральных компонентов экссудата, а также при отсутствии притока жидкости в замкнутую полость – экссудат любой этиологии может приобрести характер холестеринового.
8. Слизистый экссудат – содержит значительное количество муцина и псевдомуцина, может встречаться при мезотелиоме, слизеобразующих опухолях, псевдомиксоме.
9. Фибринозный экссудате– содержит значительное количество фибрина.
Встречаются также смешанные формы экссудата (серозно-геморрагический, слизисто-геморрагический, серозно-фибринозный).
В нативной выпотной жидкости необходимо провести исследование цитоза. Для этого сразу после пункции жидкость забирают в пробирку с ЭДТА, чтобы предотвратить ее сворачивание. Цитоз, или клеточность (в данном методе определяется только количество ядросодержащих клеток) проводят по стандартной методике в камере Горяева или на гематологическом анализаторе в режиме подсчета цельной крови. За количество ядерных клеток принимают значение WBC (white blood cell, или лейкоцитов) в тысячах клеток на миллилитр жидкости.
После определения цитоза жидкость можно центрифугировать с получением осадка для микроскопического исследования. Надосадочная жидкость, или супернатант, также может исследоваться на содержание белка, глюкозы и т.д. Однако не все биохимические параметры могут быть определены из жидкости с ЭДТА, поэтому рекомендовано также вместе с взятием выпота в пробирку с антикоагулянтом одновременно брать жидкость и в чистую сухую пробирку (например, центрифужную или для биохимического исследования). Отсюда следует, что для исследования выпотной жидкости в лаборатории необходимо получить материал как минимум в двух емкостях: пробирке с ЭДТА и в чистой сухой пробирке, а жидкость должна помещаться туда непосредственно сразу после эвакуации ее из полости тела.
Исследование осадка производится в лаборатории врачом-лаборантом или врачом-цитологом. Чтобы осадить выпотную жидкость, необходимо ее центрифугировать при 1500 об/мин в течение 15–25 минут. В зависимости от вида выпота образуется различный осадок по количеству и качеству (может быть сероватым, желтоватым, кровянистым, однослойным или двухслойным, изредка трехслойным). В серозном прозрачном выпоте осадка может быть крайне мало, его характер мелкозернистый, цвет серовато-белый. В мутном гнойном или хилезном выпоте с большим количеством клеток осадок образуется обильный, крупнозернистый. В геморрагическом выпоте с большой примесью эритроцитов образуется двухслойный осадок: верхний слой в виде белесоватой пленки и нижний в виде плотного скопления эритроцитов. А при разделении осадка на 3 слоя верхний чаще представлен компонентом разрушенных клеток и детрита. При приготовлении мазков на предметных стеклах материал из осадка берется из каждого слоя и приготавливается не менее 2-х мазков. При однослойном осадке рекомендовано изготавливать не менее 4-х стекол. При скудном количестве осадка готовится 1 мазок с максимальным количеством материала в нем.
Высушенные на воздухе при комнатной температуре мазки фиксируются и окрашиваются азур-эозином по стандартному методу (Романовского-Гимзы, Паппенгейма-Крюкова, Лейшмана, Нохта, Райта и т.д.).
Дифференциальная диагностика транссудатов и экссудатов
Чтобы дифференцировать транссудат от экссудата, можно пользоваться несколькими методами, в основе которых лежит определение физических и биохимических параметров жидкости. Различие основано на содержании белка, типе клеток, цвете жидкости и ее удельном весе.
Транссудат, в отличие от экссудата, — выпот невоспалительного происхождения, причем это жидкость, которая накапливается в полостях тела в результате влияния системных факторов регуляции гомеостаза на образование и резорбцию жидкости. Удельный вес транссудата ниже, чем у экссудатов, и составляет менее 1,015 г/мл против 1,015 и более у экссудатов. Содержание общего белка у транссудатов составляет менее 30 г/л против значения, превышающего 30 г/л у экссудатов. Существует качественная проба, позволяющая верифицировать транссудат от экссудата. Это широко известная проба Ривальта. Она вошла в лабораторную практику более 60 лет назад и занимала важное место в диагностике выпотных жидкостей вплоть до развития биохимических методов и их упрощения и доступности, что сделало возможным перейти от качественного метода пробы Ривальта к количественным характеристикам содержания белка. Однако сейчас многими исследователями предлагается использовать пробу Ривальта для быстрого и достаточно точного получения данных о выпоте. Поэтому необходимо немного описать эту пробу.
В узкий цилиндр со слабым раствором уксусной кислоты (100 мл дистиллированной воды + 1 капля ледяной уксусной кислоты) добавляют по каплям исследуемую выпотную жидкость. Если эта капля, падая вниз, дает тянущуюся за ней полоску помутнения, то жидкость является экссудатом. Транссудаты положительную пробу не дают или дают слабо положительную кратковременную реакцию помутнения.
В табл. 1 приведены параметры, определение которых позволяет верифицировать транссудат от экссудата.
Табл. 1. Дифференциальные характеристики транссудатов и экссудатов
Транссудатом называется жидкость невоспалительного происхождения, которая образуется вследствие пропотевания сыворотки крови через стенку сосудов в больше серозные полости (плевральную, брюшную, околосердечную) чаще при недостаточности кровообращения, а также при нарушении местного кровообращения.
Экссудат - жидкость, скапливающаяся в тех же полостях в результате воспалительного процесса. Воспалительный выпот наблюдается при туберкулезе, ревматизме, раке и некоторых других заболеваниях.
Определение физических свойств транссудатов и экссудатов
Определяют цвет, прозрачность, консистенцию, запах, удельный вес, характер выпота.
Транссудат и серозный экссудат прозрачны. Транссудат почти бесцветный или имеет бледножёлтый цвет. Серозный экссудат имеет различную окраску в зависимости от характера экссудата. Экссудат может быть следующего характера:
Серозный - прозрачная жидкость бдедно-желтого цвета.
Серозно-фибринозный - полупрозрачная жидкость, в которой при стоянии выпадает осадок,
Серозно-гнойный - мутная жидкость желтоватого цвета, гной, стоянии отмечается обильный осадок.
Гнойный - густая мутная жидкость желтовато-зеленого цвета. При примеси крови жидкость приобретает красно-бурый цвет.
Гнилостный - мутная желтовато-зеленая или буро-зеленая жидкость с гнилостным запахом.
Геморрагический - красного или буровато-коричневого цвета мутная жидкость.
Хилёзный - жидкость молочного характера с большим содержанием жира.
Псевдохилозный - имеет вид разбавленного молока без аира.
Консистенция выпота может быть жидкой, полужидкой, густой. Запах в большинство случаев отсутствует, неприятным запахом обладает только гнилостный экссудат.
Удельный вес жидкости определяют при помощи урометра. Полостную жидкость наливают в цилиндр, опускают урометр, чтобы он свободно в нем плавал. Транссудаты имеют более низкий удельный вес, чем экссудаты. Удельный вес транссудата колеблется в пределах I005-I0I5, удельный вес экссудата выше 1015. Характер выпота определяется путем оценки указанных сеойств с последующей проверкой при микроскопической исследовании.
Сюда относится определение белка. Белок в выпотных жидкостях определяется по методу Робертса-Стольннкова. Метод основан на том, что при наслаивании жидкости, содержащей белок, на 50% раствор азотной кислоты на границе двух жидкостей образуется белое кольцо, причем, если чёткое белое кольцо появляется на 3-ей минуте, то содержание белка разно 0,033% или 33 мг в 1000 мл жидкости.
Появление кольца раньше чем через 2 минуты свидетельствует о большом содержании белка в исследуемой жидкости, в этом случае экссудат следует развести физиологическим раствором или водой до появления тонкого белого кольца на 3-ей минуте. При разведении учитывают ширину кольца, его компактность, при этом каждое последущее разведение жидкости готовят из предыдущего. Определение кольца производят на черном фоне. Количество белка вычисляют, умножив полученное разведение на 0,033%. Содержание белка выражают в %. Белок в транссудате содержится в меньшем количестве, чем в экссудате, не более 3%(обычно 0,5-2,55%), а в экссудате свыше 3%:
По количеству белка МОЖНО судить,о характере выпота. Иногда содержание белка в транссудате доходит до 4%. Для отличия транссудата от экссудата в таких случаях пользуются реакциями открывающими особое белковое тело, серозомуцин, присущее только экссудатам.
Реакция Ривальта. В цилиндр емкостью 100-200 мл наливают дистиллированную воду, которую подкисляют ледяной уксусной кислотой (2 капли ледяной уксусной кислоты на 100 мл воды). В этот pacтвор опускают 1-2 капли исследуемой жидкости. Если жидкость - транссудат, то помутнения по ходу капли не будет, реакцию считают отрицательной; если жидкость - экссудат, то по ходу капли образуется беловатое облачко, в этом случае реакцию считают положительной.
Реакция Лукерини. На часовое стекло вносят 2 ил 3% раствора перекиси водорода, в нее добавляют I каплю исследуемой Жидкости, если появляется опалесцирующее помутнение, жидкость является экссудатом. Определение помутнения производят на черном фоне.
Для изучения клеточного состава жидкость центрифугируют. Проводят микроскопическое исследование нативных и окрашенных препаратов, приготовленных из осадка.
Нативные препараты готовят следующим образом: на предметное стекло помещают кашпо отцентрифугированного осадка, накрывают покровным стеклом и изучают под микроскопом вначале под малым, а затем под большим увеличением. При исследовании нативного препарата можно обнаружить: лейкоциты в небольшом количестве обнаруживаются в транссудатах, значительно больше их в экссудатах, особенно большое количество лейкоцитоз отмечается при гнойных выпотах. Эритроциты в небольшом количестве Встречаются во всяком выпоте, большое количество ИХ наблюдается при геморрагических экссудатах.
Клетки мезотелия - крупные клетки, обнаруживаются в большом количестве в транссудатах, при сердечных и почечных заболеваниях. Б экссудатах - при злокачественных новообразованиях и туберкулезной этиологии их обычно немного.
Окрашенные препараты. Небольшую каплю осадка помещают на предметное отекло, готовят мазок. Мазок высушивают на воздухе, затем фиксируют или абсолютным метиловым спиртом - 5 минут, или смесью Никифорова (равные объемы 96% этилового спирта и эфира) - 15 минут. Фиксированные препараты окрашивают краской Романовского-Гимза в течение 10 минут, затем смывают краску, мазок высушивают и исследуют под микроскопом с иммерсионной системой. В окрашенных препаратах подсчитывают процентное соотношение отдельных видов лейкоцитов, исследуют морфологию других клеточных элементов. В окрашенных препаратах можно обнаружить:
нейтрофильные лейкоциты - преобладающие клетки гнойного экссудата. При серозном воспалении нейтрофиллы можно обнаружить в начальной стадии процесса;
лимфоциты - встречаются в экссудате любой этиологии, в большом количестве наблюдаются при туберкулезках плевритах. Небольшое количество встречается в транссудатах;
клетки мезотелия - крупные, разной формы, с одним или двумя ядрами. Цитоплазма мезотелия окрашивается в синий дает. Постоянно обнаруживаются в транссудатах, в экссудатах - в начальной стадии воспалительного процесса;
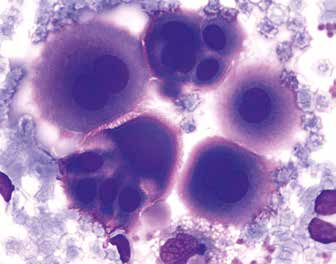
атипичные (опухолевые) клетки - различной величины и обычно крупные до 40-50 мкм. Ядро занимает большую часть цитоплазмы. В ядрах клеток обнаруживаются нуклеолы. Цитоплазма окрашивается базофильно.
Сухие фиксированные мазки окрашиваются по Цилю-Нильсону. Методику окрашивания см.раздел "Исследование мокроты".
Для исследования на туберкулезные бактерии экссудат подвергают длительному центрифугированию или обработке способом флотации.
ПРиложение: Посуда, оборудование, реактивы..
I.Пробирки. 2.Пипетки. 3. Цилиндры для определения удельного веса выпотных жидкостей и проведения реакции Ривальта. 4. Часовые стекла для проведения пробы Лукерини. 5. Черная бумага. 6. Урометры. 7. Предметные и покровные стекла. 8. Спиртовые горелки. 9. Центрифуга. 10. Микроскопы. II. Набор для окрашивания по Романовскому-Гимза. 12. Набор для окрашивания по Цилю-Нильсону. 13. Ледяная уксусная кислота. 14. 50% раствор азотной кислоты. 15. 3% раствор перекиси водорода.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Патологические процессы в плевре и плевральной полости, в том числе плеврит, носят обычно вторичный характер, чаще всего –это осложнения заболеваний легких, травм грудной клетки, заболеваний органов средостения и брюшной полости. При этом нередко симптоматика плеврального выпота является ведущей в клинической картине заболевания.
| Механизм образования плеврального выпота при злокачественных новообразованиях: |
| Прямое влияние опухоли 1. Метастазы в плевру (увеличение проницаемости капилляров плевры) 2. Метастазы в плевру (обструкция лимфатических узлов) 3. Поражение лимфатических узлов средостения (cнижение лимфатического оттока из плевры). 4. Обтурация грудного протока (хилоторакс). 5. Обтурация бронха (снижение внутриплеврального давления). 6. Опухолевый перикардит. Опосредованное влияние опухоли 1. Гипопротеинемия. 2. Опухолевые пневмонии. 3. Эмболия сосудов легких. 4. Состояние после лучевой терапии. |
Плевральный выпот может быть транссудатом и экссудатом. Причиной образования транссудата обычно является застойная сердечная недостаточность, в основном у больных с левожелудочковой недостаточностью и перикардитом. При скоплении транссудата (гидротораксе) листки плевры не вовлечены в первичный патологический процесс.
Гидроторакс наблюдается в тех случаях, когда изменяется системное или легочное капиллярное или онкотическое давление плазмы (левожелудочковая недостаточность, цирроз печени).
Плеврит (скопление экссудата в полости плевры) наиболее часто образуется у больных злокачественными новообразованиями. Наиболее распространенной причиной экссудативного плеврита является метастазирование в плевру и лимфатические узлы средочтения. Плевральный выпот при опухолях имеет сложное происхождение: накопление жидкости обусловлено увеличением проницаемости капилляров вследствие их воспаления или разрыва эндотелия, а также ухудшением лимфатического дренажа из-за обструкции лимфатических путей опухолью и прорастания опухоли в плевру. Накоплению выпота у онкологических больных могут способствовать нарушение питания и снижение содержания белка в сыворотке крови [1–4].
АЛГОРИТМ ЛЕЧЕНИЯ ОПУХОЛЕВЫХ ПЛЕВРИТОВ
Схема
Опухолевый (метастатический) плеврит является частым осложнением при раке легкого, молочной железы, яичников, а также при лимфомах и лейкозах. Так, при раке легкого он встречается у 24– 50% больных, молочной железы – до 48%, при лимфомах – до 26%, а раке яичников – до 10%. При других злокачественных опухолях опухолевый плеврит выявляется у 1 – 6% пациентов (рак желудка, толстой кишки, поджелудочной железы, саркомы, меланомы и др.). Наиболее частой причиной экссудативных плевритов является метастазирование в плевру и лимфатические узлы средостения. Плеврит, как правило, свидетельствует о далеко зашедшем опухолевом процессе и является следствием опухолевых высыпаний по плевре.
Диагностика
Цитологическое исследование плевральной жидкости на опухолевые клетки (содержание эритролитов более 1 млн/мм3) является важным методом диагностики. Получение при плевральной пункции геморрагического экссудата с высокой степенью вероятности свидетельствует об опухолевой этиологии выпота. Частота обнаружения опухолевых клеток при этом достигает 80– 70%. На основании цитологического исследования плевральной жидкости часто удается определить морфологический тип первичной опухоли.
Таблица 1. Частота выпотов различной этиологии (Р. Лайт, 1986) [1]
Частота выпотов, %
Накопление жидкости в плевральной полости приводит к сдавлению легкого, смещению средостения, что в свою очередь вызывает усиление одышки, нарушение дыхательной и сердечной деятельности. Часто плеврит, являясь единственным проявлением опухолевого процесса, может быть причиной смерти больного.
Лечение больных с выпотом в плевральную полость заключается прежде всего в эвакуации жидкости, внутриплевральном введении лекарственных препаратов с целью прекращения накопления жидкости в плевральной полости и рассасывания экссудата. Это приводит к улучшению состояния больного, уменьшению одышки, болей, легочно-сердечной недостаточности и тем самым к удлинению жизни. Алгоритм диагностики и лечения опухолевых плевритов представлен на схеме.
Перед решением вопроса о введении внутриплеврально тех или иных лекарственных препаратов необходимо уточнить локализацию первичного процесса, так как при раке молочной железы, яичников, мелкоклеточном раке легкого, лимфомах проведение системной химиотерапии может привести к ликвидации плеврального выпота у 30– 60% пациентов.
Таблица 2. Препараты, используемые для плевродеза (сводные данные)
В тех случаях, когда системная химиотерапия не показана или она была неэффективной, необходимо внутриплевральное введение лекарственных препаратов. Показанием для плевральных пункций и внутриплеврального введения лекарств является наличие выпота в плевральной полости выше уровня II– III ребра спереди, выраженной одышки с явлениями легочной или легочно-сердечной недостаточности, при ожидаемой продолжительности жизни более 2 нед. При наличии выпота без клинической симптоматики нет смысла производить плевральные пункции и вводить те или иные лекарственные препараты.
Таким образом, можно отметить следующие показания для плевродеза:
1. Наличие субъективных симптомов плеврита (выраженная одышка, боли, кашель).
2. Наличие выпота, рефрактерного к современной химио- и гормонотерапии.
3. Наличие бронхиальной обструкции.
В табл. 2 представлены препараты, используемые в настоящее время для плевродеза.
Методика введения цитостатиков, их разовые и суммарные дозы, а также режим лечения:
| 1. Эмбихин 10–30 мг 1 раз в 7–14 дней, 3–4 введения, всего 40–120 мг. 2. Тиофосфамид 30–40 мг 1 раз в 7–14 дней, 3–4 введения, всего 120–160 мг. 3. Фторурацил 500–1000 мг 1 раз в 7 дней, 3–4 введения, всего 2000–3000 мг. 4. Блеомицин 15–30 мг 1 раз в 7 дней, 4–5 введений, всего 60–150 мг. 5. Адриамицин 30–40 мг 1 раз в 7 дней, 3–4 введения, всего 90–120 мг. 6. Цисплатин 50–60 мг 1 раз в 7 дней, 2–3 введения, всего 100–180 мг. 7. Митоксантрон (новантрон) по 20–25 мг, 2–3 введения. 8. Вепезид 100–150 мг 2 раза в 7 дней, 3–4 введения, всего 600 мг. 9. Тиофосфамид 30 – 40 мг + фторурацил 500 мг 1 раз в 7 дней, 3 введения. |
Эффективность внутриплеврального введения отдельных цитостатиков при раке легкого и молочной железы колеблется от 60 до 80%. В табл. 3 представлены данные РОНЦ им. Н.Н. Блохина РАМН по эффективности химиотерапии опухолевых плевритов [5].
Особого внимания заслуживают методы неспецифической терапии с использованием различных склерозирующих средств для получения химического серозита, склеивания плевральных листков и таким образом ликвидации выпота в плевральной полости. К этим веществам относятся тальк, хинакрин (акрихин), делагил и тетрациклин. Эффективность введения талька, акрихина, делагила достигает 55–60%, а тетрациклина – 80–70% [6–10].
Методика введения тетрациклина. Тетрациклина гидрохлорид наиболее эффективен в больших дозах (20 мг/кг или 1200–1600 мг -12–16 ампул по 100 мг). У больного под местной анестезией производят пункцию плевральной полости с введением тонкой силиконовой трубки, по которой с помощью вакуум-отсоса эвакуируют жидкость. После этого трубку зажимают и под рентгеновским контролем убеждаются, что легкое расправилось. В случае, если легкое не расправилось или имеется смещение средостения в сторону плеврального выпота, не следует вводить тетрациклин из-за возможности образования Тпанцирного легкогоУ. Поскольку введение тетрациклина может сопровождаться болевыми ощущениями, то его предварительно разводят в 50 мл 0,5% раствора новокаина и затем вводят в дренажную трубку. Последнюю прижимают на 2 ч, а больного просят несколько раз менять положение тела. Через 2 ч зажим снимают, а дренажную трубку подключают к вакуум-отсосу с постоянным давлением (от 15 до 20 см вод. ст.). Аспирацию продолжают не менее 24 ч, пока объем выводимой жидкости не будет менее 150–200 мл в сутки. После этого дренажную трубку удаляют.
Таблица 3. Эффективность химиотерапии опухолевых плевритов (данные РОНЦ)
Читайте также:

