Трансплантация костного мозга при остром миелобластном лейкозе

-
6 минут на чтение

Пересадка костного мозга при лейкозе – это один из наиболее эффективных методов терапии онкологического поражения крови. Суть процедуры заключается в том, чтобы заполнить кровеносное русло здоровыми кровеносными тельцами, что часто способствует восстановлению нормального функционирования системы кроветворения. Операция по трансплантации – это последний шанс сохранить больному полноценную жизнь.
- Зачем нужна
- Показания
- Противопоказания
- Кто может стать донором
- Этапы операции
- Прогноз
Зачем нужна
Пересадку костного мозга проводят в том случае, когда стволовые клетки прекращают свое нормальное функционирование, в результате чего начинают вырабатываться генетически аномальные кровяные элементы.

- Онкогематология
![]()
Наталья Геннадьевна Буцык- 6 декабря 2019 г.
Таким образом, трансплантация – это обязательная процедура при диагностировании иммунодефицита, лейкоза, апластической анемии и прочих патологий. Для приостановления выработки патологических элементов кровяной жидкости, а также повышения концентрации лейкоцитов в обязательном порядке требуется оказание медицинской помощи.
При лечении лейкоза, как правило, применяется интенсивная лучевая и химиотерапия, что приводит к разрушению и отмиранию не только незрелых, но и здоровых клеток. Для восстановления функционирования костного вещества проводится его пересадка. Кроме того, данная методика повышает шансы на выздоровление больного.
Показания
Трансплантация костного мозг назначается в том случае, когда есть высокая вероятность рецидивирования онкологического заболевания. Кроме того, необходимость в проведении хирургического вмешательства возникает при развитии острой формы патологического процесса. Основная задача такого лечения заключается в том, чтобы уничтожить патогенные клетки-возбудители.
При повторном появлении болезни единственно правильным решением будет уничтожение раковых клеток. Также в ходе процедуры они замещаются на здоровые элементы.
Однако важно запомнить, что при неполном устранении патогенных клеток риск рецидивов сохраняется.
Противопоказания
Несмотря на то, что пересадка костного мозга считается одним из последних шансов сохранения жизни больного, операция имеет и определенные ограничения к проведению. Прежде всего среди противопоказаний выделяют:
- гепатит В и С;
- ВИЧ;
- сифилис;
- период вынашивания ребенка;
- различные аутоиммунные нарушения.
Кроме того, хирургическое вмешательство, подразумевающее замещение онкологических стволовых клеток на здоровые, не рекомендуется проводить при слабом физическом состоянии организма, а также людям, достигшим пожилого возраста.
Также противопоказанием являются патологии жизненно важных внутренних органов, протекающих в тяжелой форме, и прием гормональных средств или антибиотиков на протяжении длительного периода времени.
К донорству не допускаются лица, у которых были диагностированы аутоиммунные патологии или заболевания инфекционной природы происхождения. Чтобы выявить любую из болезней, донор в обязательном порядке проходит соответствующее диагностическое обследование.
Однако на сегодняшний день наиболее серьезным ограничением к операции по замене костного мозга считается несовместимость больного и лица, выступающего в качестве донора. В большинстве случаев материал для донорства берут у самого больного или его близких родственников, которые подходят по физиологической совместимости.
Кто может стать донором
Прежде всего специалисты проверяют на совместимость донорства всех родных сестер и братьев. При трансплантации стволового вещества от кого-либо из родственников в 90 процентах случаев удается достичь положительного результата от оперативного вмешательства.
При взятии клеток у близнеца успех от операции возрастает до 99 процентов. Однако в будущем не исключается вероятность повторного развития онкологического процесса, что объясняется сходством клеточных структур на генетическом уровне.
При отсутствии ближайших родственников проверяются братья и сестры до 4-го поколения.

- Онкогематология
![]()
Ольга Владимировна Хазова- 5 декабря 2019 г.
В качестве донора также могут быть родители для своего ребенка или, наоборот, дети для матери или отца. В этих ситуациях подразумевается гаплотрансплантация. Поскольку изначально клетки имеют совпадение только на 50%, то успешность такого хирургического вмешательства будет наблюдаться только в 25 процентах случаев.
Также важно помнить, что на момент совершения оперативного вмешательства у донора не должно быть никаких патологических отклонений в организме. Также в крови не должны присутствовать раковые клетки.
Если донор не является родственником, то его имя не разглашается, и его только вносят в единый реестр после того, как он пройдет полное медицинское обследование, которое является бесплатным.
Кроме того, получение разрешения на донорство при отсутствии родства возможно только лицам, достигшими совершеннолетия.
Кроме того, не исключается момент неприживания стволовых клеток или их атака организма хозяина. Данная разновидность трансплантации применяется только в том случае, когда донор не был найден, а общее состояние больного ухудшается быстрыми темпами. К примеру, при снижении уровня эритроцитов организм перестает получать необходимое для его нормальной работы количество кислорода.
Согласно статистическим данным, которые предоставляет Всемирная сеть трансплантации костного мозга и крови, родственная совместимость отмечается только для 30 процентов пациентов. В остальных ситуациях требуется поиск подходящего донора. Здесь специалисты используют международные и национальные банковские подразделения.
Этапы операции
Хирургическая процедура по извлечению стволового вещества осуществляется исключительно в операционной палате. Как правило, перед проведением операции больному делают общий наркоз, что способствует максимальному снижению болевых ощущений.
После этого в бедренную полость вводится специальная игла, через которую всасывается жидкость красного цвета. Для изъятия необходимого количества кровяного элемента необходимо применение не одной пункции.
Общий объем костного мозга, который извлекается из больного, будет зависеть от его веса и содержания стволовых клеток в жидкости, которая была изъята.
- Онкогематология
![]()
Ольга Владимировна Хазова- 4 декабря 2019 г.
В большинстве случаев требуется около одного-двух литров смеси, состав которой состоит из мозга и кровяной жидкости.
Часто большинству людей кажется, что такой объем изъятого вещества слишком завышен. Однако он составляет только два процента от всего количества костного мозга. Для восстановления запасов донорским организмом уходит, как правило, не больше месяца.
После того как наркоз перестанет действовать, в месте прокола человек будет чувствовать неприятные ощущения, которые имеют определенное сходство с последствиями падения на лед. Однако после введения обезболивающего препарата неприятные симптомы проходят. Выписка донора происходит уже на вторые сутки после проведения хирургического вмешательства.
В случае когда вещество извлекается у самого больного, оно подвергается заморозке и хранению в помещении с очень низкими температурами до того момента, пока не будет осуществлена пересадка.
Когда трансплантация проводится при диагностировании лейкоза хронической формы, то стволовой элемент вначале очищают и только после этого вводят в организм больного.
Процедуру осуществляют в несколько этапов:
- Пациент повергается радиоактивному облучению или назначается курс химиотерапии. Обычно она проводится за два дня до назначения оперативного вмешательства.
- Трансплантируемое вещество вливается больному посредством внутривенного введения при помощи капельницы.
- Так как операция не представляет сложностей, то необходимость во введении анестезирующего средства отсутствует. При этом пациента помещают в обычную палату.
- Периодически измеряется температура тела. Это необходимо для определения отсутствия отторжения донорского костного мозга.
Сама по себе операция имеет определенное сходство с классической процедурой по переливанию крови. По продолжительности такое мероприятие не занимает больше часа, что дает возможность проводить ее не в операционной, а в обычной палате.
Как правило, для получения достоверных результатов требуется ждать несколько недель с момента окончания операции по трансплантации.
В случае когда в качестве донора выступает неродственное лицо, то из красного вещества извлекаются Т-лимфоциты. Такая мера необходима для предупреждения отторжения донорского элемента.
Прогноз
Не мене актуальным после трансплантации костного мозг остается вопрос об имеющихся шансах на выздоровление.
Прежде чем делать прогнозы продолжительности жизни после операции, необходимо принимать во внимание несколько важных показателей. Прежде всего речь идет об имеющихся сопутствующих патологических процессах, а также возрастной категории, к которой принадлежит больной. Кроме того, не менее важную роль играет совместимость донора и реципиента, а также характер течения патологии и ее форма.
При успешном проведении хирургического вмешательства выживаемость в течение 10-15 лет отмечается в 100 процентах случаев.
Если после переливания бластные клетки отторглись организмом больного, то потребуется повторное осуществление процедуры, что влечет за собой определенные риски.
Современная стратегия терапии острого миелоидного лейкоза (ОМЛ) определяется максимально возможным использованием потенциала интенсивной индукции, консолидации и поддерживающего лечения.
Во-первых, трансплантация стволовых гемопоэтических клеток всегда является этапом в лечении больных острым миелоидным лейкозом; во-вторых, всегда подразумевается отбор больных в соответствии с их возрастом и соматическим статусом, адекватностью химиотерапии, развитием рецидива до выполнения ТКМ, наличием HLA-совместимого донора (для аллогенной ТКМ); в-третьих, сравнение результатов лечения больными, которым проводят химиотерапию или выполняют трансплантацию, возможно лишь на основе анализа рандомизированных групп в рамках многоцентровых кооперированных исследований; в-четвертых, эффективность выполнения ТКМ необходимо оценивать в зависимости от цитогенетических аномалий, которые определяют течение заболевания.
К концу 2001 г. завершены 4 многоцентровых рандомизированных исследования, проведенных в Европе и США. Их цель — сравнить эффективность постремиссионной терапии острого миелоидного лейкоза, выполненной в 3 вариантах: в виде интенсивной химиотерапии, аутологичной и аллогенной ТКМ. В настоящем анализе данные отдельных исследовательских центров не учитываются.
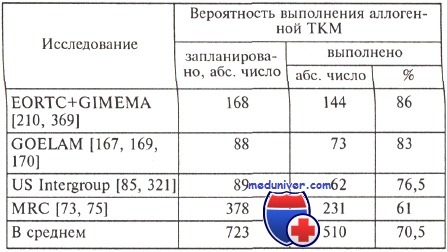
В таблице приводится описание основных этапов лечения в рандомизированных исследованиях, проведенных итальянской исследовательской группой (GIMEMA) совместно с общеевропейской (EORTC), а также французской (GOELAM), американской (US Intergroup) и английской (MRC) группами.
Аутологичная трансплантация костного мозга является высокодозной консолидацией полной ремиссии острого миелоидного лейкоза (ОМЛ). Удалось полностью выполнить программу лечения, предусмотренного в исследованиях, по данным группы EORTC+GIMEMA, в 74,2 % случаях при запланированной аутотрансплантации и в 82,5 % — химиотерапии, во французском исследовании GOELAM в 87,2 и в 71 % соответственно, в объединенной американской группе — в 60 и 92 % соответственно и в Великобритании в 66,3 % в случае запланированной аутологичной ТКМ.
Таким образом, процент выполняемости запланированной терапии достоверно отличается в зависимости от выбранной по случайному признаку программы лечения: аутологичная ТКМ — 71 %, химиотерапия — 88 %. Эти различия, по-видимому, характеризуют аутологичную ТКМ как рискованный метод лечения, требующий принятия очень ответственных решений как больным, так и врачом.
Результаты исследования MRC-10 целесообразно рассмотреть отдельно, поскольку в нем оценивали эффективность аутологичной ТКМ, выполняемой как пятый курс химиотерапии, в сравнении с 4 курсами химиотерапии и прекращением лечения после них. Это исследование доказало, что аутологичная трансплантация костного мозга достоверно улучшает безрецидивную выживаемость больных — 54 % в сравнении с 40 %, при этом авторы подчеркивают, что неясно, сама ли трансплантация костного мозга или дополнительный пятый курс химиотерапии сыграли принципиальную роль.
Последующее исследование MRC-12, сравнивающее эффективность 5 курсов химиотерапии и 4 в сочетании с аутологичной трансплантации костного мозга, показало отсутствие различий между двумя подходами. Общая выживаемость 1224 больных, включенных в исследование, одинакова при проведении 4 или 5 курсов. Тем не менее исследователи отмечают некоторые преимущества у больных в возрасте 15—35 лет после проведения им 5-го курса химиотерапии.
Достоверные различия по безрецидивной выживаемости у больных ОМЛ при проведении аутологичной трансплантации костного мозга получены еще в одном из приведенных в таблице исследований — EORTC+GIMEMA. При выполнении аутологичной трансплантации костного мозга безрецидивная выживаемость составила 48 % в сравнении с 30 % при химиотерапии. Предметом критики в этом исследовании стали результаты стандартной химиотерапии. Некоторые авторы расценивают 30 % безрецидивную выживаемость у больных моложе 55 лет как крайне низкий показатель, обусловленный недостаточной адекватностью химиотерапии.
Основными причинами неудач химиотерапии у больных ОМЛ с достигнутой полной ремиссией являются рецидивы и смерть от проведенного лечения. Вероятность развития этих событий при проведении аутологичной трансплантации или химиотерапии отражена в таблице.
Как видно из таблицы, вероятность развития рецидивов после выполнения аутологичной трансплантации костного мозга значительно меньше (притом, что аутологичная трансплантация костного мозга осуществлена лишь 70 % больных из всех рандомизированных на этот вариант терапии). Однако высокая летальность, обусловленная трансплантацией, нивелирует преимущества последней при анализе безрецидивной выживаемости.
Анализ эффективности аутологичной трансплантации костного мозга в зависимости от группы прогноза, определенной по цитогенетическим маркерам, не позволяет сделать однозначные выводы. Это связано как с противоречивостью данных, так и с малым числом больных. Данные представлены в таблице.
Как видно из таблице, по результатам исследований MRC и US Intergroup безрецидивная выживаемость после выполнения аутологичной трансплантации костного мозга у больных из группы благоприятного прогноза выше. У больных из группы среднего прогноза преимущества аутологичной трансплантации костного мозга выявлены лишь в исследовании US Intergroup. Одинаково малоэффективной трансплантации костного мозга оказалась у больных из группы неблагоприятного прогноза, однако следует отметить, что показатели безрецидивной выживаемости у этих больных значительно отличаются в каждом исследовании. Это позволяет сделать вывод о том, что в американском исследовании программа химиотерапии менее интенсивная.
При отсутствии возможности оценивать цитогенетические маркеры в анализ прогностических факторов могут быть включены такие простые параметры, как число лейкоцитов в дебюте заболевания и вариант острого миелоидного лейкоза (ОМЛ).
Данные французского исследования GOELAM демонстрируют, что различий в 4-летней безрецидивной выживаемости в зависимости от числа лейкоцитов в дебюте заболевания (более или менее 30 • 109/л) и варианта ОМЛ при сравнении эффективности аутологичной трансплантации костного мозга и интенсивной консолидации не получено. Вывод этого исследования — выполнение аутологичной трансплантации костного мозга больным ОМЛ в период первой полной ремиссии не обязательно. Однако число больных в группах крайне невелико, и большинство исследователей указывают, что аутологичная трансплантация костного мозга может быть включена в программу терапии больных в период первой полной ремиссии ОМЛ при условии снижения летальности, связанной с самой трансплантацией.
Эффективность аллогенной трансплантации костного мозга зависит не только от мощного лучевого и выраженного цитостатического воздействий, но и от реакции иммунной системы донора костного мозга на опухолевые клетки больного (реакция трансплантат против лейкоза). Именно иммунные механизмы обеспечивают основное противоопухолевое воздействие. К сожалению, у большинства пациентов HLA-совместимого донора нет. По данным обсуждаемых исследований, HLA-совместимого донора определяли у 22—26 % больных, у которых была достигнута полная ремиссия.
Причем учитывали только больных в возрасте максимально до 45 лет, при котором возможно было проведение аллогенной трансплантации костного мозга. Число больных, которым выполнили запланированную ранее аллогенную трансплантацию костного мозга, по данным разных исследований, колеблется от 60 до 86 %. Данные по выполняемости аллогенной трансплантации костного мозга представлены в таблице.
Существенные различия между запланированными и реально выполненными трансплантациями могут быть связаны с токсичностью предшествующей химиотерапии, с развитием ранних рецидивов, отказами пациентов.
В таблице приведены показатели 5-летней безрецидивной выживаемости больных в зависимости от наличия или отсутствия у них HLA-совместимого донора и группы прогноза, определенного по цитогенетическим маркерам, в трех исследованиях: MRC, US Intergroup, EORTC+GIMEMA.
В европейском исследовании EORTC+GIMEMA, итоги которого подводились в 2001 г., показатели безрецидивной выживаемости во всех группах статистически не отличаются. По данным 2004 г., показатели безрецидивной выживаемости больных из разных прогностических групп были практически такими же, за исключением группы высокого риска: у больных из группы благоприятного прогноза — 61 % (донор есть) и 66 % (донора нет), промежуточного прогноза — 45 % (донор есть) и 49 % (донора нет), плохого прогноза —43 % (донор есть) и 18,4 % (донора нет).
В этом исследовании AMLCG из 340 больных моложе 60 лет, у которых была получена полная ремиссия, лишь 56 (16 %) выполнена аллогенная ТКМ. В предшествующих исследованиях немецкой группы AMLCG аллогенная ТКМ была выполнена 10 % больных — 51 и 42 соответственно. При выполнении анализа с помощью близнецового метода авторы вновь убедительно демонстрируют преимущества аллогенной ТКМ. Трехлетняя безрецидивная выживаемость больных при выполнении химиотерапии составляет 39,3 %, аллогенной ТКМ - 60,1 % (р = 0,02).
Бесспорным доказательством преимущества аллогенной трансплантации костного мозга может служить анализ терапии 149 больных ОМЛ (15—55 лет), которых наблюдали и лечили в Северном регионе Великобритании. Так, полная ремиссия была достигнута у 74 % больных в возрасте до 40 лет и у 58 % — в возрасте от 40 до 55 лет. После проведения двух курсов индукции и двух курсов консолидации (протокол MRC-10) всем больным терапию прекращали. Тем больным, у которых были HLA-совместимые доноры, выполняли аллогенную ТКМ. У 28 больных моложе 40 лет выявили HLA-совместимых родственных доноров, 22 из них провели аллогенную ТКМ (одну — сингенную). Безрецидивная 4-летняя выживаемость с момента достижения полной ремиссии составила 24 % у больных, которым выполнили программу химиотерапии, и 62 % у больных, которым провели аллогенную ТКМ. Конечно, число анализируемых больных невелико.
Кроме того, приведены результаты лечения, которое осуществляли в одном исследовательском центре, однако преимуществом этого исследования является то, что в анализ включены все заболевшие ОМЛ в одном географическом регионе и им четко выполнили программу лечения. Вывод однозначный — при наличии донора следует выполнять аллогенную ТКМ.
По данным Международного регистра, за период с 1988 по 1995 г. больным ОНЛЛ было выполнено в общей сложности 3503 аллогенных ТКМ от родственного донора и 208 от неродственного, 1403 аутологичных ТКМ. С учетом значительной селекции пациентов получены хорошие результаты у больных в первой ремиссии, во второй ремиссии и в развернутой фазе болезни. Более 5 лет без рецидива живут 59 % больных ОНЛЛ в первой ремиссии, 35 % во второй полной ремисии и 25 % больных, которым ТКМ была выполнена вне полной ремиссии.
Последние цифры — действительно уникальные результаты, поскольку при лечении больных ОМЛ во второй ремиссии и тех, у кого ремиссию не удается достичь, стандартные и даже агрессивные программы химиотерапии неэффективны. Выполнение аутоло-гичной ТКМ больным в первой полной ремиссии позволяет практически 50 % из них прожить более 5 лет. В том случае если аутологичную ТКМ выполняют больным во второй ремиссии, то безрецидивная выживаемость в течение 5—6 лет составляет 35— 40 %. Из тех больных, у которых не была достигнута полная ремиссия, без рецидива более 4 лет живут лишь 10 %. ТКМ от неродственного донора уступает по долгосрочным результатам как аутологичной, так и аллогенной родственной: более 4 лет без рецидива живут 40 % больных. Аллогенная ТКМ от неродственного донора характеризуется очень высокой летальностью в первые 100 дней и в течение 1-го года.
Приведенные данные свидетельствуют о том, что трансплантация костного мозга, как аллогенного, так и аутологичного костного мозга, можно рассматривать в качестве альтернативы стандартной современной химиотерапии для больных в первой ремиссии и считать единственным подходом, который предоставляет возможность определенному проценту больных во второй ремиссии или вне ремиссии прожить более 5 лет. Однако вновь хотелось бы остановиться на вопросах селекции, поскольку речь идет лишь о той категории больных, которым вообще возможно проведение ТКМ (возраст менее 45 лет, хороший соматический статус).
Выполнение как аутологичной, так и аллогенной трансплантации костного мозга у больных в период первой полной ремиссии ОМЛ не решает основных вопросов терапии этого заболевания, так как половина больных — лица старше 60 лет, полные ремиссии достигаются лишь у 2/3 больных моложе 60 лет, часть больных умирают в период консолидации, некоторые отказываются от предложенного лечения и т. д., однако ТКМ, особенно аллогенная, — это новый способ воздействия на опухолевые клетки. Аллогенная ТКМ, индуцируя такой феномен, как трансплантат против лейкоза, является эффективным противоопухолевым воздействием. Она может служить основой для моделирования и создания новых методов биологического лечения ОМЛ, не сопряженных, как сама ТКМ, с большим числом побочных эффектов.
Таким образом, трансплантация костного мозга — это этап в терапии ОЛ. Эту процедуру необходимо выполнять в специализированных центрах, где осуществляют не менее 10 аллогенных и 10 аутологичных ТКМ в год. Это условие представляется важным, иначе летальность, обусловленная развитием осложнений вследствие самой процедуры, будет очень высока, что естественным образом отразится на общей выживаемости больных.
Лейкозы, или, говоря языком медицины, гемобластозы – это злокачественные опухоли, происходящие из кроветворных клеток. В зависимости от того, возник ли лейкемический клон из бластных (молодых) клеток крови, или зрелых их форм, лейкозы могут быть острыми и хроническими. Острый миелобластный лейкоз составляет 20% всех случаев детских гемобластозов. Среди взрослых заболеваемость резко возрастает после 60 лет.
Общая характеристика

Таким образом, острый миелобластный лейкоз – это опухоль, возникшая из незрелых клеток миелоцитарного ростка кроветворения.
Диагноз считается установленным, если в анализе костного мозга (миелограмме) оказывается более 20% бластных клеток.
Причины и механизмы развития
Острый миелоидный лейкоз (ОМЛ), как любые лейкозы, возникает из одной мутировавшей клетки, которая теряет способность созревать и начинает бесконтрольно размножаться. Сказать точно, какие именно из известных канцерогенных факторов спровоцировали мутации в каждом конкретном случае обычно невозможно, особенно если речь идет о детях. В целом это могут быть:
- синдром Дауна;
- нейрофиброматоз 2 типа;
- анемия Фалькони;
- тяжелая врожденная анемия;
- врожденная тромбоцитопения или тромбоцитопатия.
Именно замена здоровых клеток крови на массу бластов, неспособных выполнять их функции в силу незрелости, формирует симптомы белокровия.
Клиническая картина
Проявления острого миелолейкоза неспецифичны – это значит, что на начальном этапе симптомы напоминают признаки других заболеваний.
Из-за недостаточности кроветворения уменьшается количество эритроцитов. Общая слабость, бледность, ломкость ногтей и выпадение волос обычно либо не привлекают внимания пациента или его родственников, либо связываются с другими проблемами. По мере развития болезни слабость нарастает появляется одышка даже при минимальных нагрузках, дети перестают играть в подвижные игры (вообще, снижение активности ребенка – повод внимательно присмотреться к его здоровью).
В крови становится мало не только эритроцитов, но и тромбоцитов. Нарушается свертываемость крови. Возникают кровотечения различной интенсивности: от точечных подкожных кровоизлияний до обильных внутриполостных (желудочно-кишечных, маточных и т.д.).
Гранулоцитарные лейкоциты, принадлежащие к миелодиному ростку – это клетки, чья функция – защищать организм от микробов. Они содержат множество белков – естественных антибиотиков, перекисей, других веществ, направленных на уничтожение инфекционного агента. Угнетение кроветворного ростка затрагивает и их, нарушая способность организма бороться с болезнетворными микробами. Это проявляется различными гнойными воспалениями: кожными абсцессами, флегмонами, вплоть до сепсиса. Любое воспаление вызывает интоксикацию – отравление продуктами обмена веществ патогенных микроорганизмов. Интоксикационный синдром проявляется такими признаками как:
- слабость;
- повышение температуры;
- потливость;
- потеря аппетита, снижение веса;
- неопределенные боли в мышцах.
Отмечается у 30-50% пациентов. Опухолевые клетки заполняют не только костный мозг, но и лимфоузлы, печень, селезенку. Органы увеличиваются, оставаясь безболезненными, их консистенция становится тестообразной. Сама по себе гиперплазия не опасна, но если разрастаются лимфоузлы, которые находятся в замкнутом пространстве (например, полости средостения, где расположено сердце) они могут сдавить жизненно важные органы.
Лейкозные клетки могут образовывать участки экстрамедуллярных (в дословном переводе – расположенных вне костного мозга) опухолей в костях, на коже и слизистых, молочных железах, матке и придатках, простате, легких. При этом возникают симптомы, характерные для патологии этих органов.
Диагностика
Основным признаком лейкоза в анализах крови считается так называемый лейкемический провал: когда в анализе видны множество бластов, мало зрелых клеток и полностью отсутствуют переходные формы. Но на практике, как отмечается в клинических рекомендациях, на ранних стадиях болезни лейкозных клеток в гемограмме (анализе крови) может и не быть. Главное основание для постановки диагноза острого миелобластного лейкоза – более 20% бластов в миелограмме (анализе пунктата костного мозга).
Теоретически диагностика должна включать в себя и цитогенетические тесты, когда изучаются конкретные мутации генов, вызвавшие лейкоз. Это один из важнейших прогностических факторов и современная классификация ВОЗ включает в себя описание более десяти геннных аномалий которые напрямую влияют на прогноз. К сожалению, в России цитохимию, цитогенетические, молекулярно-генетические и другие подобного рода исследования можно сделать только в крупных центрах.
Лечение: общие принципы
В период полихимиотерапии – лечения, направленного на гибель лейкозного клона, пациенту требуется госпитализация и особый уход: условия, близкие к стерильности. Питание должно быть полноценным, с высоким содержанием белка. Вся пища обязательно подвергается температурной обработке.
Помимо химиотерапии, направленной на причину болезни, при лейкозе обязательно проводят и поддерживающую терапию. Она нужна для того, чтобы лечить и корректировать основные синдромы болезни: при анемии переливают эритроцитарную масса, при геморрагиях – тромбоциты, инфекции лечат антибиотиками и так далее. Поддерживающее лечение бывает нужно и для профилактики осложнений химиотерапии.
Подходы к лечению детей и взрослых отличаются.
В детском возрасте стандарт – интенсивная полихимиотерапия, дополненная трансплантацией костного мозга.
Сначала нужно вызвать ремиссию. Для этого используют комбинацию из 5 препаратов которые вводят по определенной схеме. После того, как бластных клеток в костном мозге станет меньше 5%, переходят на поддерживающую терапию: до 4 курсов цитостатического препарата. Далее если есть возможность, делается пересадка костного мозга (за исключением пациентов из группы благоприятного прогноза). Но возможность трансплантации зависит от того, найдется ли подходящий донор. На практике это означает, что если его не окажется среди близких родственников, возможность трансплантации стремится у нулю: регистр доноров костного мозга в России составляется, но пока даже пройти типирование можно далеко не во всех крупных городах.
Принадлежность к группе благоприятного, промежуточного и неблагоприятного прогноза зависит от генотипических характеристик лейкоза. Кроме того, имеет значение индивидуальная реакция пациента на терапию: если через 2 недели после ее начала количество бластов в костном мозге снижается до 5-15%, вероятность благоприятного исхода резко возрастает.
Если ремиссия продолжается дольше 5 лет, лейкоз считается излеченным. Но возможны и рецидивы. Цикл рецидив-ремиссия может продолжаться либо до стабилизации состояния, либо до полного истощения ресурсов кроветворения – в этом случае прогноз неблагоприятен.
При рецидиве полихимиотерапию проводят в 3 этапа: индукция ремиссии, консолидация ремиссии и курс поддерживающей терапии.
В общих чертах прогноз выживаемости можно описать с помощью таблицы:
| Достижение ремиссии, % | Вероятность общей выживаемости в ближайшие 4 года, % | Вероятность безрецидивной выживаемости в ближайшие 4 года, % | |
| Все пациенты | 90 | 67 | 61 |
| Группа стандартного риска | 91 | 78 | 71 |
| Группа высокого риска | 87 | 55 | 46 |
Как видно, излечить острый миелоидный лейкоз у детей в принципе возможно.
Факторы, влияющие на прогноз у взрослых пациентов, можно разделить на 3 группы:
- Индивидуальные особенности организма и состояния здоровья;
- Биологические характеристики лейкемического клона;
- Правильный подбор метода лечения.
Как сам лейкоз, так и его лечение – огромная нагрузка на организм. Поэтому чем старше пациент, тем хуже прогноз. Во-первых, с возрастом хронических патология становится все больше, и протекают они тяжелее. И даже относительно здоровые пациенты старше 60 хуже переносят лечение, чем молодые.
Во-вторых, с возрастом накапливаются неблагоприятные воздействия на генотип, и вероятность мутаций с плохим прогнозом становится выше.
Точно так же, как и у детей, важнейший фактор прогноза – генотип клеток лейкемии. Цитогенетическое исследование и отнесение к группе благоприятного, неблагоприятного или промежуточного прогноза необходимо для правильного подбора схемы терапии. На практике в России такое исследование проводится не более 60% пациентов. Отсюда вытекает и третий фактор.

- возраст старше 40 лет;
- лейкоцитов крови > 100 х 10 9 /л;
- наличие экстрамедуллярных поражений;
- после первого курса химиотерапии не наступила ремиссия;
- вторичный ОМЛ (возник после курса химиотерапии другого злокачественного новообразования);
Полихимиотерапия – единственная возможность уничтожить клон лейкозных клеток. Но когда речь идет о взрослых пациентов с сопутствующими заболеваниями, приходится рассматривать противопоказания:
- инфаркт миокарда менее чем за месяц до начала лечения;
- застойная сердечная недостаточность;
- нарушения сердечного ритма, сопровождающиеся нестабильной гемодинамикой;
- почечная недостаточность кроме случаев, когда она вызвана лейкозным инфильтратом;
- острый вирусный гепатит;
- печеночная недостаточность кроме случаев, вызванных лейкозным инфильтратом;
- тяжелая пневмония, кроме вызванной лейкозными клетками;
- сепсис;
- кровотечение, угрожающее жизни;
- тяжелые патологии психики;
- истощение;
- сахарный диабет с показателем глюкозы крови >15 ммоль/л, не поддающийся компенсации;
- сопутствующая онкологическая патология с неконтролируемым течением.
- При этих состояниях агрессивная полихимиотерапия однозначно принесет больше вреда, чем пользы. Но если состояние удалось стабилизировать, то через неделю можно начать курс лечения.
Сама химиотерапия делится на 3 этапа:
- индукции ремиссии (1-2 курса);
- консолидации ремиссии (1-2 курса) – самый агрессивный и высокодозный этап;
- противорецидивное лечение.
Конкретные схемы и продолжительность курса различаются в зависимости от прогноза и предшествующих рецидивов.
После достижения ремиссии пациентам из группы высокого риска рекомендуется трансплантация костного мозга от совместимого донора. Как и при лечении детей, возможность использования этого метода ограничена доступностью донора. Несмотря на опасность трансплантации для возрастных пациентов (летальность 15-50%), рецидивов после нее практически не бывает.
Поддерживающая химиотерапия назначается в течение 1-2 лет после начала ремиссии (возможны варианты от 4 до 12 курсов). Количество и длительность курсов, а также интервалы между ними зависит от принадлежности больного к группе риска и реакции на лечение.
К сожалению, минимум у 60% взрослых пациентов рецидив наступает в течение 3 лет. Поэтому говорить о перспективах вылечиться довольно сложно.
Пятилетняя выживаемость колеблется от 4 до 46%. Прогноз зависит от генетических особенностей лейкоза, общего состояния больного и продолжительности ремиссии.
Читайте также:



