Сторожевой лимфоузел при меланоме что это
О меланоме лимфатических узлов говорят, когда меланома пускает метастазы в лимфатическую систему. Опухолевые клетки распространяются из первичного очага меланомы по лимфатическим сосудам, похожим на кровеносные. Таким образом, начинают поражаться лимфатические узлы, располагающиеся в области шеи, над ключицами, в паху и подмышечных впадинах. Лимфатическое поражение при меланоме значительно ухудшает прогностические данные. Попадание злокачественных клеток в лимфоток приводит к тому, что рак начинает поражать всё новые и новые органы, ткани, системы. Диагностика и лечение заболевания проводится докторами онкологами.
Меланома – это злокачественное новообразование, состоящее из меланоцитов. Течение меланомы часто скрытое, вплоть до стадии появления метастазов. Именно по этой причине злокачественные опухоли данного вида часто становятся причиной смерти больных. Патологические образования могут возникать на разных частях тела и поражают преимущественно кожный покров. Однако могут формироваться и на слизистых оболочках, а также глазных яблоках. На теле человека множество родинок, но не все они являются опасными. Меланома развивается из пигментного новообразования (невуса). Такие родинки имеют неправильную форму и быстро увеличиваются в размере. Распространенность меланомы – 6:100000.

Причины возникновения
Возможными причинами возникновения заболевания кожи меланомы могут быть:
- воздействие ультрафиолета;
- генетическая предрасположенность;
- травматизация родинок;
- гормональные перестройки.
Опухоль при меланобластоме метастазирует в лимфоузлы чаще у пожилых и ослабленных пациентов, однако, остальные возрастные группы больных также подвержены риску распространения метастазов.
Меланома может распространяться по организму гематогенным путем (по кровеносным сосудам) и лимфогенным. При втором варианте злокачественные клетки накапливаются в лимфатических узлах, разрастаются, становятся больше в диаметре. Первые лимфоузлы, которые поражают метастазы, в медицинской практике называют сторожевыми. Они могут располагаться в любой части тела, что зависит от локализации первичного очага рака.
Виды и степени
Меланома кожного покрова начинает метастазировать на третьей стадии развития.
Распространенность опухолевого процесса доктора обозначают буквой N в сочетании с цифрой:
- N0 – поражение лимфатических узлов отсутствует.
- N1 – новообразование поразило один близлежащий лимфатический узел.
- N2 – обнаружено поражение двух и более регионарных и сторожевых лимфоузлов.
- N3 – поражению подверглись дальние лимфоузлы, например, при меланоме головы происходит поражение паховых лимфоузлов.
Существует еще одна классификация, которая, помимо буквы N, содержит строчную букву:
- Na – злокачественный процесс уже выявлен в лимфоузлах, но увидеть его можно только с помощью микроскопа;
- Nb – раковые клетки достигли большого размера, а их наличие уже определяется при проведении тестов;
- N2c – злокачественные клетки находятся в лимфатических каналах около новообразования, но в сами лимфоузлы еще не проникли.
Меланома может метастазировать даже после проведения операции по иссечению новообразования. Несмотря на то что опухоль удаляется с частью здоровых тканей (отступая несколько сантиметров), она очень часто рецидивирует, и этого не могут предотвратить даже химическая и лучевая терапии. Меланома, удаленная на второй A стадии, возвращается в пятнадцати – тридцати процентах случаев. Если новообразование удалялось на второй B и C стадиях, то оно рецидивирует в сорока и семидесяти процентах случаев соответственно.
Симптомы
При появлении метастазов меланомы в лимфоузлах первым делом происходит увеличение размеров узлов, расположенных недалеко от первичного очага. Большой размер метастазов приводит к тому, что лимфоузлы становятся чрезмерно плотными, срастаются между собой и с окружающими тканями.
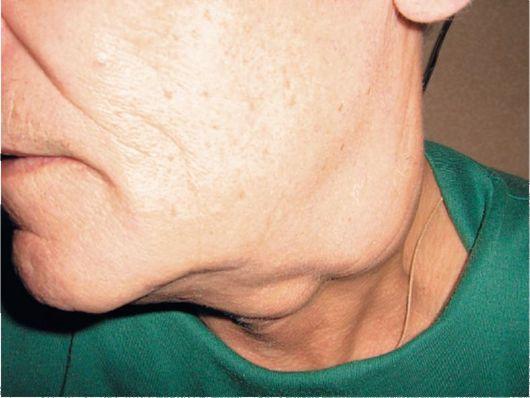
Больной резко теряет в весе, становится слабым, происходит развитие анемии, возникают головные боли и гипертермия. Могут присутствовать и дополнительные признаки, такие как мигрень, невроз, частые ОРВИ, воспалительные процессы кожных покровов.
Диагностика
- рентген пораженной области;
- биопсию сторожевых лимфоузлов для проведения гистологии;
- тонкоигольную аспирационную биопсию;
- ПЭТ (позитронно-эмиссионную томографию);
- КТ (компьютерную томографию);
- МРТ (магнитно-резонансную томографию);
- УЗИ (ультразвуковое исследование);
- лимфосцинтиграфию;
- анализ крови на онкомаркеры.
После диагностических мероприятий больной направляется на лечение в онкологическое отделение.
Методы лечения
Меланома лимфоузлов является злокачественным заболеванием, требующим лечения в неотложном порядке. Методов терапии может быть несколько. Если новообразование на коже имеет локальную форму, то доктор удаляет его, захватывая небольшой участок окружающих здоровых тканей, а также ближайшие группы лимфатических узлов. Если метастазы обнаруживаются в лимфоузлах, проводится их радикальное удаление. При регрессе меланомы проводится расширенное оперативное вмешательство, но оно не дает большого шанса на благоприятный прогноз. На последней стадии адъювантная терапия меланомы состоит из химиотерапии и облучения.

Кроме стандартной операции, существуют и другие методы лечения данной патологии:
- Лимфодиссекция – наличие клеток в лимфатических узлах служит показанием к удалению не только самих лимфоузлов места локализации, а и сосудов, жировых и других тканей конкретной лимфоидной структуры.
- Лучевая терапия – облучение ионизирующей радиацией проводится для того, чтобы опухоль прекратила развитие. Облучение также может применяться на последней стадии онкопатологии, чтобы уменьшить выраженность симптоматики и облегчить состояние больного.
- Химиотерапия – применяется для уменьшения новообразования до пятнадцати процентов от изначального размера, а также уменьшения клинической картины. После химиотерапии практически всегда возникают такие побочные эффекты, как тошнота, рвота, облысение, угнетение иммунной системы, потеря веса. Доктора подбирают лекарства для уменьшения побочного действия химиопрепаратов.
- Иммунологическая терапия – при помощи иммунотерапии доктора активизируют работу иммунитета, что улучшает прогностические данные.
Комплексное лечение помогает уменьшить метастазирование в лимфоузлы на сорок процентов. При опухоли последней стадии оперативное вмешательство не проводится. Таким больным назначается паллиативная терапия, состоящая из приема химических препаратов, облучения, наркотических обезболивающих препаратов.
Реабилитация
После оперативного вмешательства больной должен посещать доктора ежеквартально первые два года, а следующие десять лет – дважды в год.

На каждом приеме онколог оценивает состояние кожных покровов и лимфоузлов больного. В зависимости от того, на какой стадии была проведена операция, могут назначаться и другие методы обследования. В реабилитационный период пациенту назначается специальная диета, иммуностимуляторы и другие необходимые препараты.
Важно, чтобы больному была оказана психологическая поддержка родными или специалистами.
Прогноз и профилактика
Если метастазы меланомы обнаружены в одном лимфатическом узле, прогноз для больного составляет сорок три процента. Если поражен не один лимфоузел, через 5 лет болезнь возвращается в семидесяти пяти процентах случаев. При паллиативном лечении четвертой стадии онкопатологии больные, как правило, погибают в течение полугода или чуть больше. После проведения операции онкологическое заболевание чаще рецидивирует у мужчин, нежели у женщин.
Предотвратить появление метастазов меланомы в области лимфатических узлов можно при своевременном диагностировании болезни.

Уберечься от возникновения первичных очагов рака на коже помогут:
- Ведение здорового образа жизни (правильное питание, отказ от вредных привычек).
- Ограничение воздействия на кожу ультрафиолета (солнечных лучей и загорания в солярии).
- Избегание воздействия на кожу агрессивных веществ и химикатов.
- Предотвращение травматизации кожных покровов и родинок.
Чтобы раньше выявить наличие патологии на коже и обратиться к доктору за лечением, не стоит пренебрегать периодическим самостоятельным осмотром. Если на теле обнаружатся родинки или родимые пятна неправильной формы, которые увеличиваются в размерах или болят, необходимо сразу же посетить дерматолога или онколога.
При меланоме биопсия сторожевого лимфоузла производится, как и при раке молочной железы, только в том случае, если все остальные диагностические методы не показали наличие отдаленных метастазов. Если уже есть метастазы в отдаленных органах и лимфоузлах, биопсия будет бесполезна, она ничего не изменит для пациента. Тем не менее, если стандартные исследования не показали наличие метастазов, мы не можем быть уверены, что в лимфоузлах не осталось микрометастазов, и поэтому проводим биопсию сторожевого лимфоузла.
Чаще всего к моменту этого исследования сама опухоль уже удалена, известны ее гистологические характеристики. В зависимости от этих характеристик принимаются диагностические решения. Если глубина прорастания большая, то желательно сделать ПЭТ-КТ для того, чтобы удостовериться в том, что нет отдаленных матастазов. Если их нет, проводят биопсию сторожевого лимфоузла. Если прорастание меньше 2 мм (по Breslow), то сразу проводится биопсия сторожевого лимфоузла.
Радиофармпрепарат, представляющий из себя меченый изотопом коллоид, вводится внутрикожно, вокруг меланомы, если она ещё не удалена, либо вокруг рубца, который остался после ее иссечения на расстоянии 1,5-2 см. Обычно точек введения 4, но если рубец длинный, то может быть и 6. Через 15-20 минут, когда лимфа уже начинает оттекать достаточно активно, проводится визуализация. Чаще всего – при помощи гамма-камеры. Если непонятно расположение лимфоузла (что часто бывает при меланоме туловища, когда отток лимфы непредсказуемый), то дополнительно проводится ОФЭКТ-КТ. Это гибридный метод визуализации, который позволяет не только увидеть сторожевой лимфоузел, но и привязать его к анатомии и четко показать хирургам, где он находится.
После этого проводится разметка на коже, а во время операции (в тот же день, или на следующий) хирург с помощью гамма-зонда также, как в случае рака молочной железы, подводит к небольшому разрезу на коже лимфоузлы и проверяет. Если они активны, их удаляют, если неактивны, их оставляют на месте.
Обычно удаляется от 1 до 4 лимфоузлов, и они отправляются на гистологическое исследование. Если все они чисты, вероятность того, что меланома метастазировала, составляет менее 2%.
Что будет, если не проводить биопсию сторожевого лимфоузла при меланоме?
Первый вариант – расширенная лимфодиссекция при иссечении меланомы. Это калечащая операция, которая, имеет огромные объемы, травматизирует и инвалидизирует пациента. Учитывая, что лимфоотток от меланомы при некоторых локализациях непредсказуем, эта операция может проводиться не в той области, в которую действительно оттекает лимфа и является бесполезной.
Если же не проводить расширенную лимфодиссекцию, остается вероятность того, что остались микрометастазы, которые могут привести к рецидиву.
Биопсия сторожевого лимфоузла - широко используемая в мире стандартная методика диагностики микрометастазов при меланоме и раке молочной железы, но её можно использовать и при других заболеваниях, таких как рак простаты, рак шейки матки, рак полостей рта, носа, носоглотки. Ведутся множественные исследования в этой области, однако такие методики пока не являются стандартными и могут рекомендоваться пациентам лишь по индивидуальным показаниям лечащими врачами.

Меланома Биопсия сторожевых лимфатических узлов (СЛУ) является рутинной диагностической процедурой при меланоме кожи. Прогностическое значение для появления микрометастазов в регионарных лимфатических узлах имеют толщина опухоли по Breslow, ее изъязвление, уровень инвазии по Clark IV-V, возраст больного. От наличия или отсутствия метастазов в СЛУ зависит прогноз заболевания, в связи с чем этот критерий включен в современную классификацию меланомы кожи. Вопрос о необходимости выполнения регионарной лимфодиссекции у больных с микрометастазами меланомы в лимфатических узлах до настоящего времени остается дискутабельным и требует дальнейшего исследования.
Меланома кожи представляет собой злокачественную опухоль, развивающуюся из меланоцитов и характеризующуюся лимфогенным и гематогенным метастазированием. Наиболее часто заболевание прогрессирует, поражая лимфатические узлы: опухоли, расположенные на туловище, метастазируют в лимфатические узлы с частотой 67-87,7%, а меланомы других локализаций - с частотой 39-46%. Появление гематогенных метастазов без этапа поражения лимфатической системы - относительно редкое явление, которое встречается в 8 до 10% случаев.
Целесообразность профилактической лимфодиссекции обсуждалась на протяжении многих лет. В ряде исследований 70-80 годов было показано преимущество ее выполнения, однако эти исследования были ретроспективными и не учитывали ряд прогностических факторов. Следует отметить, что в двух исследованиях (Duke University, 1983, и Sydney Melanoma Unit, 1985) вначале было сообщено о преимуществе профилактической лимфодиссекции для меланомы средней толщины, однако через 10 лет эти данные были опровергнуты самими авторами.
В 90-х годах были опубликованы результаты четырех рандомизированных исследований по изучению влияния профилактической лимфодиссекции на общую выживаемость больных меланомой кожи. Ни одно из этих исследований не показало преимущество ее выполнения. Однако в одном из них (WHO-14) было продемонстрировано повышение общей выживаемости больных, подвергшихся профилактической лимфодиссекции, у которых были обнаружены метастазы в регионарных лимфоузлах, по сравнению с больными, которым была выполнена отсроченная (терапевтическая) регионарная лимфодиссекции после появления клинических признаков метастазирования. Эти данные свидетельствовали в поддержку так называемой концепции биопсии сторожевого лимфатического узла (СЛУ) как идеального метода стадирования меланомы кожи и гипотезы о потенциальном влиянии на общую выживаемость путем выполнения регионарной лимфодиссекции у больных с метастазами в СЛУ.
В 1977 году Е. Holmes сообщил об успешном применении предоперационной лимфосцинтиграфии для идентификации регионарных лимфоузлов у 32 больных меланомой кожи. Во время исследования на лимфосцинтиграммах отмечалось накопление изотопа в одном или нескольких лимфатических узлах, которые получили название сторожевых. Было высказано предположение, что так как СЛУ является первым регионарным лимфоузлом, получающим лимфу от первичной опухоли, то в него в первую очередь попадают опухолевые клетки при распространении по лимфатическим путям. Следовательно, биопсия СЛУ может быть использована для оценки поражения всего регионарного лимфоколлектора.
Следующим шагом явилось внедрение в практику портативного гамма-сканера для интраоперационного поиска СЛУ, который был описан J.C. Alex в моделях на животных. Клиническое использование данного метода было представлено в 1994 году R. Essner с соавт. Обществу хирургов-онкологов. При этом предоперационная лимфосцинтиграфия осуществлялась при помощи стационарного гамма-томографа, а интраоперационный поиск СЛУ при помощи портативного гамма-сканера. Важным преимуществом метода явилась возможность определять расположение СЛУ непосредственно через кожу. Кроме того, стало возможным контролировать локализацию узла при разрезе тканей, а также удостоверится, что удален действительно СЛУ по степени накопления в нем радиофармпрепарата, определяемого гамма-датчиком.
В настоящее время для идентификации СЛУ используется радиологический метод, как самостоятельно, так и в сочетании с красителем. Использование красителя позволяет обнаруживать СЛУ в 82-87% случаев, а комбинированное использование красителя и радиоизотопа - в 99%.
Биопсия СЛУ показана большинству пациентов с первично-локализованной меланомой кожи. Прогностическое значение для появления метастазов опухоли в СЛУ имеют толщина опухоли по Breslow, ее изъязвление, уровень инвазии по Clark IV-V, возраст больного.
Вторым по значимости прогностическим фактором является изъязвление первичной опухоли. В частности, у больных с изъязвлением меланомы микрометастазы в СЛУ выявляются в 30-35% случаев. Уровень инвазии по Clark на протяжении многих лет рассматривался как независимый прогностический фактор. Рядом исследований показано, что при IV-V уровне инвазии по Clark поражение СЛУ имеет место у 20-25% пациентов.
Важным прогностическим фактором для развития регионарных метастазов является возраст больного. Интересно, что увеличение возраста характеризуется снижением частоты поражения регионарных лимфатических узлов и повышением частоты поражения внутренних органов и ассоциируется с худшим прогнозом в отношении общей выживаемости. Таким образом, у пациентов старше 50 лет частота поражения регионарных лимфатических узлов, в т.ч. сторожевых, достоверно снижается по сравнению с пациентами молодого возраста, и при этом увеличивается риск возникновения отдаленных метастазов.
Кроме того, в некоторых публикациях показано, что митотический индекс >0, отсутствие опухоль-инфильтрирующих лимфоцитов, мужской пол, регрессия первичной опухоли также повышают риск развития метастазов в СЛУ.
Однако данные этих исследований зачастую противоречивы. К примеру, S.C. Раек, изучив данные 910 больных, подвергшихся биопсии СЛУ, считает, что прогностическое значение имеют толщина опухоли по Breslow, молодой возраст, ангиолимфатическая инвазия, митотический индекс и локализация опухоли в области туловища и нижних конечностей. В то же время L.L. Kruper, основываясь на данных исследования 628 пациентов, отмечает прогностическое значение только толщины опухоли по Breslow, опухоль-инфильтрирующих лимфоцитов и митотического индекса.
Многочисленные исследования, проведенные в этом направлении, не привели к изменению показаний к биопсии СЛУ. По мнению A. Cadili и К. Dabbs, это связано с их противоречивыми результатами, обусловленными отсутствием стандартизированного гистологического исследования СЛУ, что приводит к вариабельности измерений и техники рапортирования в различных клиниках. В частности, толщина опухоли по Breslow является наиболее объективной и точно выполнимой процедурой по сравнению с другими, поэтому данный показатель единственный отнесен к прогностическим факторам практически во всех исследованиях. В связи с этим авторы считают необходимым изучение относительных прогностических факторов в каждой клинике, где биопсия СЛУ является рутинной процедурой.
Техника выполнения биопсии СЛУ при меланоме кожи достаточно проста.
Накануне операции выполняется предоперационная лимфосцинтиграфия с использованием 99m Тс, который вводится интрадермально вокруг опухоли для идентификации регионарного лимфоколлектора и приблизительного местонахождения СЛУ внутри него. Коллоид изотопа фагоцитируется макрофагами внутри лимфатического узла. Это удерживает его в дренирующем узле и предотвращает его дальнейший пассаж по лимфатическим путям.
Лимфосцитиграфия выполняется непосредственно после введения РФП и через 2 часа после его введения. Динамическая лимфосцинтиграфия помогает отличить истинные СЛУ, в которые происходит непосредственный дренаж лимфы от первичной опухоли, от не-СЛУ, которые могут находиться радом. Предоперационная лимфосцинтиграфия также позволяет обнаруживать эктопические лимфатические узлы, которые обнаруживаются приблизительно в 5-10% случаев при локализации меланомы на коже конечностей, в 30-32% случаев при локализации на коже туловища и в 60% при меланоме кожи головы и шеи. Кроме того, лимфосцинтиграфия позволяет выявить больных, у которых отток лимфы происходит в 2 лимфоколлектора.
Выбор радиофармпрепарата является весьма важным. 99m Тс-серный коллоид имеет размер частиц от 100 до 4000 нм, что обуславливает медленную миграцию от места введения и затрудняет выполнение динамической лимфосцинтиграфии. 99m Тс-коллоид альбумин и 99m Тс-человеческий сывороточный альбумин являются более предпочтительными, так как достигают СЛУ в течение 20 мин у 97% больных и сохраняются в них на протяжении 24 часов, не распространяясь далее. 99m Тс-человеческий сывороточный альбумин быстрее распространяется от места инъекции и лучше определяется в путях лимфооттока, в то время как другие РФП дольше сохраняются в лимфоузлах и визуализируются в отсроченном периоде в большем количестве лимфоузлов, чем непосредственно после введения РФП.
Местонахождение СЛУ отмечается радиологом на коже пациента маркером. Следует отметить, что вследствие релаксации больного во время операции и его положения на операционном столе расположение СЛУ может не совсем точно совпадать с меткой на коже. Поэтому хирург должен уточнить локализацию узлов в операционной с помощью портативного гамма-сканера.
Непосредственно перед операцией пациенту интрадермально вокруг первичной опухоли вводится 1,0 мл красителя. Наиболее часто применяемыми являются Patent blue V и Isosulfan blue. Methylene blue считается менее эффективным и может вызывать некроз мягких тканей.
Во время операции в первую очередь широко иссекается меланома кожи, а затем выполняется биопсия СЛУ.
Оптимальным является использование красителя и радиоизотопа: датчик облегчает идентификацию окрашенных СЛУ и может идентифицировать СЛУ, которые не окрасились. Однако в настоящее время нет четкого представления об уровне радиоактивности в сторожевых и не-СЛУ. Некоторые исследователи считают, что уровень радиоактивности в СЛУ должен превышать уровень фона в 2 раза, другие полагают, что он должен превосходить его на 10%. McMasters с коллегами представили обзор данных, полученных в ходе Sunbelt Melanoma Trial: удаление всех окрашенных лимфатических узлов и всех узлов с уровнем радиоактивности, превышающим 10%, ассоциировалось с 0,4% ложноположительных результатов.
В связи с тем, что только 1% от введенной дозы РФП достигает СЛУ, близкое расположение первичной опухоли и регионарного лимфоколлектора может препятствовать эффективному использованию гамма-сканера, даже если она предварительно иссечена. Это особенно актуально для меланомы в области головы и шеи, где первичная опухоль и лимфоузлы близко расположены. Поэтому достаточно часто бывает трудно определить истинный уровень радиоактивности лимфоузла до его удаления: ex vivo уровень радиоактивности может быть в 2-3 раза выше, чем in vivo.
После удаления СЛУ рана в обязательном порядке повторно исследуется гамма-датчиком.
Биопсия СЛУ характеризуется высокой чувствительностью и специфичностью. В ряде исследований чувствительность метода оценивается как 100%, а специфичность — 97%: только у 1-3% больных с гистологически негативными СЛУ развились метастазы в регионарных узлах в течение 2 лет.
Микрометастазы в СЛУ, по данным разных авторов, определяют в 15-26% случаев. Один СЛУ находят у 59% больных, два - у 37%, три - у 3%. Среднее количество СЛУ колеблется от 1,3 до 1,8.
Биопсия СЛУ сопровождается небольшим числом осложнений: формирование серомы/гематомы (2,3- 5,5%), инфицирование раны (1,1-4,6%), лимфостаз (0,6- 0,7%), окрашивание мочи и длительный татуаж в месте введения красителя. Редко отмечается аллергическая реакция на краситель.
Сообщения о том, что биопсия СЛУ вызывает развитие транзитных метастазов, не были подтверждены. В 2006 г. были опубликованы данные проспективного рандомизированного исследования, которые доказали отсутствие влияния биопсии СЛУ на развитие транзитных метастазов. Среди 500 больных, которым выполнялось широкое иссечение опухоли, транзитные метастазы развились у 42 (8,4%) пациентов, а среди 769 больных, которым одновременно с иссечением опухоли кожи выполнялась биопсия СЛУ, транзитные метастазы были зафиксированы у 54 (7,0%) человек.
Гистопрепараты окрашиваются гематоксилином- эозином. В случае отрицательного результата проводится иммуногистохимическое исследование с использованием меланоцитарных маркеров (S-100, НМВ-45, Melan А). 90% меланом сопровождаются положительным окрашиванием S-100, однако он также окрашивает нейроны, меланоциты и дендритные клетки. НМВ-45 более специфичен, но менее чувствителен (70%), чем S-100. Melan А используется с подтверждающей целью. Наивысшей чувствительностью и специфичностью обладает коктейль из антител, включающий S-100, НМВ-45, Melan А и тирозиназу (PanMel+ (Biocare Medical, USA)), однако это дорогостоящая и технически более сложная методика.
Важность иммуногистохимического метода продемонстрирована в исследовании J. Gershenwald, в которое были включены 243 пациента с гистологически негативными СЛУ после рутинного окрашивания гематоксилином-эозином. У 27 (11%) из них в отсроченном периоде развились местные, транзитные, регионарные и отдаленные метастазы; у 10 (4,1%) развились метастазы в зоне предшествующей биопсии СЛУ. Пересмотр гистопрепаратов с использованием иммуногистохимического окрашивания S-100 и НМВ-45 показал наличие в СЛУ этих больных скрытых микрометастазов.
Наличие метастазов в СЛУ является важным прогностическим фактором (табл. 1). В 2002 г. в классификацию меланомы кожи American Joint Committee on Cancer (AJCC) введено понятие регионарных микрометастазов (обозначаются буквой а) и макрометастазов (обозначаются буквой b). Макрометастазы - это клинически и/или радиологически определяемые метастазы в регионарных лимфатических узлах, подтвержденные гистологически после выполнения терапевтической лимфодиссекции. Микрометастазы - это клинически и радиологически неизмененные лимфатические узлы, подтвержденные гистологически после выполнения биопсии СЛУ либо профилактической регионарной лимфодиссекции. Согласно классификации AJCC 2009 г., наличие микрометастазов в лимфатических узлах может подтверждаться иммуногистохимическим методом. В данной классификации микрометасгаз в 1 СЛУ классифицируется как N1 а, в 2 или 3 узлах - как N 2а (табл. 2,3).
Стадия
TNM
Общая 5-летняя выживаемость, %
Для того чтобы назначить эффективное лечение при онкологическом заболевании и определиться с объемом хирургического вмешательства, врачу важно понимать, насколько сильно злокачественная опухоль успела распространиться по организму. Зачастую раковые клетки распространяются через лимфатическую систему.
Лимфатические сосуды присутствуют во всех органах. Они собирают межклеточную жидкость, которая просачивается в ткани из мелких кровеносных сосудов — капилляров. В лимфатических сосудах межклеточная жидкость превращается в лимфу и оттекает в лимфатические узлы. Эти иммунные органы, разбросанные по всему телу, содержат клетки-лимфоциты, которые умеют распознавать чужеродные частицы и при необходимости вызывать иммунный ответ. В некоторых местах, например, в области шеи, подмышек, паха, находятся скопления (группы) лимфатических узлов. В конечном итоге лимфа поступает в венозное русло.
Попав в лимфатические сосуды вместе с межклеточной жидкостью, раковые клетки в первую очередь окажутся в ближайшем лимфатическом узле. Врачи-онкологи называют такие лимфоузлы сторожевыми. Иногда сторожевой узел всего один, а иногда их несколько.
В каких случаях проводят сентинель-биопсию?
Чаще всего биопсию сторожевого лимфоузла, или сентинель-биопсию, применяют при меланоме и раке молочных желез. Иногда её используют при злокачественных опухолях легких, кишечника, щитовидной железы, желудка, головы и шеи.
Подготовка к процедуре
Сентинель-биопсия может быть проведена как самостоятельная процедура или прямо во время операции по удалению опухоли.
Как и перед любым хирургическим вмешательством, за 8 часов до процедуры нельзя ничего есть и пить. Сообщите врачу заранее о том, какие лекарства вы принимаете, какими хроническими заболеваниями страдаете, на какие лекарства у вас аллергия.
Как проводят биопсию сторожевого лимфатического узла?
Процедуру проводят под наркозом. В первую очередь врачу нужно понять, где находится сторожевой лимфатический узел. Его можно обнаружить одним из двух способов:
- При помощи специального красителя. Непосредственно перед процедурой врач вводит рядом с опухолью специальный красящий раствор синего цвета. Он проникает в лимфатические сосуды и, вместе с лимфой, попадает в ближайший лимфоузел, отчего тот приобретает ярко-синюю окраску и становится виден.
- При помощи гамма-детектора. За несколько часов до процедуры врач вводит рядом с опухолью безопасный радиопрепарат. Он, аналогично красителю, проникает в лимфатические сосуды и сторожевой узел. Во время операции врач обнаруживает лимфоузел при помощи небольшого прибора — гамма-детектора.
Хирург удаляет все обнаруженные сторожевые лимфоузлы и отправляет их в лабораторию для изучения под микроскопом. Результат исследования может быть получен прямо во время операции. Это помогает врачу понять, нужно ли удалять регионарные лимфоузлы, или можно ограничиться только удалением опухоли.

Как изменится дальнейшее лечение, в зависимости от результата?
Если хирург не знает наверняка, распространились ли раковые клетки в близлежащие (регионарные) лимфатические узлы, без сентинель-биопсии он перестрахуется и удалит их вместе с опухолью. Из-за этого операция будет более сложной, травматичной. Из-за нарушения оттока лимфы повышается риск возникновения лимфедемы — отека.
Биопсия сторожевого лимфоузла помогает повысить точность диагностики и удалять регионарные лимфатические узлы только в случаях, когда это действительно необходимо, если достоверно известно, что в них есть раковые клетки.
Если в ходе сентинель-биопсии были обнаружены раковые клетки, есть вероятность, что они распространились не только в лимфатические узлы, но и в другие органы. Эта информация помогает врачу более точно определить стадию опухоли, правильно спланировать обследование и лечение.

Может ли сентинель-биопсия приводить к осложнениям?
Сентинель-биопсия не имеет специфических осложнений. Как и после любой операции, после неё могут беспокоить боли, отек в области вмешательства. Послеоперационная рана может кровоточить или нагноиться. Это происходит редко.
У некоторых пациентов может возникать аллергическая реакция на краситель. Очень редко, если удалено много лимфатических узлов, развивается лимфедема — отек. В большинстве же случаев сентинель-биопсия, напротив, помогает предотвратить лимфедему — после неоправданного удаления регионарных лимфоузлов риск этого осложнения намного выше.
Несмотря на то, что сентинель-биопсия обладает высокой точностью, иногда все же могут быть получены ложноотрицательные результаты. В образце не обнаруживают раковые клетки, но на самом деле они уже успели проникнуть в лимфатическую систему.
В Европейской клинике применяются современные диагностические методики, которые помогают выбрать оптимальный объем операции и правильно, в соответствии со стадией и индивидуальными особенностями опухоли, разработать план лечения. Наша цель — максимально эффективное, безопасное и комфортное лечение онкологических заболеваний. Мы знаем, как помочь.
Читайте также:

