Стадирование рака пищевода по тнм
Основная морфологическая форма рака пищевода – плоскоклеточный рак (ороговевающий или неороговевающий) (95%), в 5% случаев наблюдается аденокарцинома, редко – мелкоклеточный рак.
Выделяются экзофитная, язвенно-инфильтративная и инфильтративная формы роста рака пищевода. Среди последних прогностически неблагоприятное значение имеют язвенно-инфильтративная и инфильтративно-стенозирующая.
Пути метастазирования рака пищевода – лимфогенный, гематогенный, им- плантационный.
Чаще всего отдаленные метастазы выявляются в печени, легких, костях, го- ловном мозгу и надпочечниках.
TNM-классификация рака пищевода (7-е изд., 2009)
Анатомические области.
- Шейный отдел пищевода (C15.0): от нижней границы перстневидногохряща до входа в грудную полость (вырезка грудины) (около 20 см от верхних резцов).
- Внутригрудной отдел пищевода (C15.1).
- Верхняя грудная часть (С15.3): от входа в грудную полость до уровня бифуркации трахеи (около 25 см от верхних резцов).
- Средняя грудная часть (С15.4): проксимальная половина пищевода распространяется от уровня бифуркации трахеи до пищеводно-желудочного соединения (нижняя граница около 30 см от передних резцов).
- Нижняя грудная часть (С15.5): дистальная половина пищевода око- ло 10 см длиной (включая абдоминальный отдел пищевода (C15.2)) распространяется от уровня бифуркации трахеи до пищеводно-желудочного соединения (нижняя граница около 40 см от передних резцов).
Примечание: карциномы желудка, локализованные в кардиальной части, могут вовлекать в процесс дистальную часть пищевода так же, как пер- вичные опухоли пищевода могут вовлекать кардиальную часть желудка. Для опухолей, расцененных как гастроэзофагеальные, при дифференциальной диа- гностике между раком желудка и пищевода могут быть применены следующие положения:
Если более 50% опухоли вовлекает в себя пищевод, опухоль классифицируется как пищеводная, если менее 50% – как исходящая из желудка.
Если опухоль одинаково расположена выше и ниже гастроэзофагеального соединения либо определена как находящаяся на уровне соединения, то плоскоклеточный рак, мелкоклеточный и недифференцированные опухоли классифицируются как исходящие из пищевода, а аденокарцинома и перстневидно-клеточный рак – из желудка.
Регионарные лимфатические узлы.
Регионарными лимфатическими узлами являются:
Шейный отдел пищевода:
- скаленные;
- внутренние яремные;
- верхние и нижние шейные;
- шейные околопищеводные;
- надключичные.
Внутригрудной отдел пищевода (верхний, средний и нижний):
- верхние околопищеводные (выше v. azygos);
- бифуркационные;
- нижние околопищеводные (ниже v. azygos);
- медиастинальные;
- перигастральные, исключая черные.
Для грудного отдела пищевода пораженные шейные лимфатические узлы расцениваются, как отдаленные метастазы. Для шейного отдела пищевода метастазы в медиастинальных лимфоузлах и лимфоузлах брюшной полости расцениваются, как отдаленные.
Поражение чревных лимфоузлов трактуется, как отдаленные метастазы вне зависимости от локализации карциномы в пищеводе.
Классификация TNM
T – первичная опухоль:
- TX – недостаточно данных для оценки первичной опухоли;
- T0 – первичная опухоль не определяется;
- Tis – преинвазивная карцинома: интраэпителиальная опухоль без инвазии базальной мембраны (рак in situ);
- T1 – опухоль инфильтрирует слизистую и подслизистый слой стенки пищевода;
- T2 – опухоль инфильтрирует мышечную оболочку стенки пищевода;
- T3 – опухоль инфильтрирует слои стенки пищевода, включая адвентицию;
- T4a – резектабельная опухоль с распространением на такие соседние структуры средостения, как плевра, перикард и диафрагма;
- T4b – нерезектабельная опухоль с инвазией в аорту, позвоночник, трахею.
N – регионарные лимфатические узлы:
- NX – недостаточно данных для оценки состояния регионарных лимфатических узлов;
- N0 – нет признаков метастатического поражения регионарных лимфатических узлов;
- N1 – имеется поражение от 1 до 2 регионарных лимфатических узлов;
- N2 – имеется поражение от 3 до 6 регионарных лимфатических узлов;
- N3 – имеется поражение 7 и более регионарных лимфатических узлов.
M – отдаленные метастазы.
- MX – недостаточно данных для определения отдаленных метастазов;
- M0 – нет признаков отдаленных метастазов;
- M1 – имеются отдаленные метастазы.
Степень дифференцировки опухоли:
- Gx - Степень дифференцировки опухоли не может быть определена.
- G1- Высокодифференцированная опухоль.
- G2 - Умеренно дифференцированная опухоль.
- G3 - Низкодифференцированная опухоль.
- G4 - Недифференцированная опухоль.
Согласно клинико-морфологической классификации, принятой в РФ, различают четыре стадии развития онкологического поражения пищевода.
Наблюдается чётко ограниченная небольшая опухоль, которая прорастает только подслизистый и слизистый слои, мало затрудняет прохождение пищи и не суживает просвет. Метастазов нет.
Язва или опухоль прорастают мышечный слой, но за пределы стенки пищевода не выходят. Проходимость пищевода значительно нарушена. Наблюдаются единичные метастазы в регионарных лимфоузлах.
Язва или опухоль занимают более полуокружности пищевода или циркулярно охватывают его. Новообразование прорастает всю стенку пищевода и клетчатку, наличествуют спайки с другими органами. Значительно или полностью нарушена проходимость пищевода, в регионарных лимфатических узлах наблюдаются множественные метастазы.
Новообразование прорастает все слои стенки пищевода и выходит за его пределы, проникает в соседние органы. В наличии конгломераты неподвижных регионарных метастатических узлов, а также метастазы в отдалённые органы.
При использовании вышеприведённой классификации в практической работе часто возникают затруднения при оценке стадийности опухолевого процесса и его распространённости. Для более точной оценки стадии развития заболевания рекомендуется использовать классификацию TNM, предложенную Международным Противораковым Союзом. (T – Tumor, опухоль; N – Nodulus, лимфатический узел; M – Metastasis, метастазы).
По данному варианту классификации:
Т. Первичное новообразование:
- Т1. Новообразование прорастает подслизистый и слизистый слои стенки пищевода;
- Т2. Новообразование прорастает в мышечный слой стенки;
- Т3. Новообразование прорастает адвентицию пищевода;
- Т4. Новообразование выходит за пределы стенок пищевода.
N. Регионарные лимфоузлы:
- N-. В регионарных лимфоузлах нет метастазов;
- N+. В регионарных лимфоузлах есть метастазы.
M. Отдалённые метастазы:
- M0. Отдалённых метастазов нет;
- M1. Наблюдаются отдалённые метастазы.
Если рассматривать данный вариант классификации, можно заметить расплывчатость характеристик первичной опухоли, отсутствие чёткой характеристики для регионарных метастазов и т. д. Исходя из этого, многие онкологи используются другой вариант классификации онкологического процесса – к примеру, следующую систему TNM:
Т. Первичное новообразование:
- Tis. Карцинома in situ;
- Т1. Первичное новообразование, протяжённость по пищеводу до 3 сантиметров;
- Т2. Новообразование протяженностью 3-5 сантиметров;
- Т3. Новообразование протяженностью 5-8 сантиметров;
- Т4. Новообразование протяжённостью более 8 сантиметров или распространяющееся на другой орган.
N. Регионарные лимфоузлы:
M. Отдалённые метастазы:
Р. Глубина инвазии новообразованием:
- Р1. Новообразование прорастает слизистую оболочку;
- Р2. Новообразование поражает подслизистый слой пищеводной стенки;
- Р3. Новообразование инфильтрирует мышечный слой стенки пищевода, до адвентиции;
- Р4. Новообразование выходит за пределы пищеводной стенки.
Способ лечения рака пищевода выбирается в зависимости от стадии заболевания, размера и локализации опухоли, а также пожеланий пациента (многие предпочитают более радикальные методы терапии).
- Общие принципы терапии рака пищевода
- У пациентов со стадией 0, I, или IIа, наблюдаются хорошие результаты при хирургической резекции. Химио и радиотерапия не дают значительных улучшений.
- При стадиях IIb и III, показатели выживаемости при использовании только хирургического лечения значительно ухудшаются. Выживаемость повышается при применении предоперационной радиационной и химиотерапии для снижения объёма опухоли. У пациентов, которым нельзя проводить хирургическое лечение, комбинация радио- и химиотерапии дает небольшое улучшение. Применение радиотерапии и химиотерапии по отдельности не дают ощутимого эффекта.
- Пациентам c IV стадией патологического процесса проводят только паллиативную терапию.
- Методы лечения рака пищевода
- Хирургическое лечение
Операбельных больных не более 30-35%.
Обычно производится субтотальная эзофагоэктомия и формирование искусственного пищевода.
- Показания к хирургическому лечению
- Возраст менее 70 лет.
- Отсутствие данных за метастазирование.
Таких больных обычно менее 1/3 от всех диагностированных случаев рака пищевода. Операционная летальность 10%.
- Противопоказания к проведению хирургического лечения -
- Метастазы в лимфатические узлы – N2 (чревные, шейные или надключичные) или паренхиматозные органы (печень, легкие).
- Пенетрация в прилежащие органы (возвратный гортанный нерв, трахеобронхиальное дерево, аорта, перикард).
- Тяжелые сопутствующие заболевания (например, сердечно-сосудистые заболевания), которые могут создать угрозу жизни в ходе операции.
- Перед операцию тщательно оценивают функцию дыхательной и сердечно-сосудистой систем. ОФВ1 менее 1,2 л и фракция выброса левого желудочка менее 40% являются относительными противопоказаниями к операции.
- Эзофагоэктомия
Резекция пищевода (эзофагоэктомия) – основной метод лечения рака пищевода. В настоящее время применяется только в качестве радикального метода лечения и не применяется в качестве паллиативного метода, так как для лечения дисфагии существует множество других методов.
Эзофагоэктомия может проводиться закрытым способом с помощью доступа через отверстие пищевода при брюшном или грудном разрезе (трансхиатальная эзофагоэктомия- ТХЭ)) или через брюшной или правый грудной доступ (трансторакальная эзофаготомия - ТТЭ)).
Основное преимущество ТХЭ – это отсутствие разрезов грудной клетки, которые обычно удлиняют восстановительный период и ухудшают состояние пациентов с ослабленной функцией органов дыхания.
После удаления пищевода, непрерывность желудочно-кишечного тракта обеспечивается с помощью тканей желудка.
Некоторые авторы считают, что ценность ТХЭ как онкологической операции довольно низка, поскольку часть операции проводится в отсутствии прямого наблюдения и при этом удаляется меньше лимфатических узлов, чем при ТТЭ. Тем не менее, множество ретроспективных и два проспективных исследования показали отсутствие отличий в выживаемости пациентов в зависимости от типа проводящейся операции. На выживаемость сильно влияет стадия и время проведения операции.
-
Методика проведения трансторакальной эзофаготомии (ТТЭ).
Положение пациента: лежа на спине на операционном столе. Вводятся артериальный катетер, центральный венозный катетер, катетер Фолли и двухпросветная эндотрахеальная трубка. Предоперационно вводятся антибиотики. Делается верхний срединный разрез. После обследования брюшной полости на предмет метастазов (если обнаруживаются метастазы, операцию дальше не продолжают), желудок мобилизуется. Правая желудочная и правая желудочно-сальниковая артерия сохраняются, в то время как короткие желудочные артерии и левая желудочная артерия. Затем гастроэзофагальное соединение мобилизуется, пищеводное отверстие увеличивается. Проводится пилоромиотомия, ставится еюностома для обеспечения питания больного в послеоперационном периоде. После зашивания абдоминального доступа, пациент перемещается в положение лежа на левом боку, и проводится заднебоковой разрез в 5-ом межреберье. Выделяется непарная вена для обеспечения полной мобилизации пищевода. Желудок проводится в полость грудной клетки и иссекается на протяжении 5 см ниже гастроэзофагального соединения. Создается анастомоз между пищеводом и желудком. Затем разрез грудной клетки зашивается.
Методика проведения трансхиатальной эзафаготомии (ТХЭ).
Предоперационная подготовка аналогична таковой при ТТЭ, за исключением того, что вместо двухпросветной устанавливается однопросветная эндотрахеальная трубка. В качестве операционного поля готовится шея. Абдоминальная часть операции, такая же как и при ТТЭ. Затем на левой стороне шеи делается разрез длиной 6 см . Внутренняя яремная вена и каротидная артерия отводятся латерально, пищевод отделяется кзади от трахеи. Для предупреждения повреждения левого возвратного гортанного нерва, при ретракции трахеи не применяются механические ретракторы. Затем, после резекции проксимального отдела желудка и грудной части пищевода, оставшаяся часть желудка проводится через заднее средостение до уровня сохраненного пищевода. Формируется анастомоз с выведением дренажной трубки на поверхность шеи. Разрезы закрываются.
Преимущества малоинвазивных методик.
Применение лапароскопических и торакоскопических методик, революционизировало лечение доброкачественных заболеваний пищевода, таких как ахалазия, и гастроэзофагальную рефлюксную болезнь. По сравнению с открытой хирургией, время нахождения в стационаре меньше, и время послеоперационного восстановления выше. В ближайшем будущем эти методики будут играть большую роль в лечении рака пищевод, что позволит снизить количество осложнений со стороны дыхательной и сердечно-сосудистой систем.
- Постоперационное ведение пациентов
- Средняя длительность постоперационного нахождения в госпитале 9-14 дней.
- Ночь после операции пациенты обычно проводят в палате интенсивной терапии.
- Пациенты должны быть экстубированы сразу же после операции, но искусственная вентиляция легких проводится немедленно, если возникают какие-либо отклонения со стороны дыхательной системы. Осложнения со стороны дыхательной (например, ателектазы, плевральный выпот, пневмония) и сердечно-сосудистой (нарушения ритма сердца) систем обычно развиваются в первые дни послеоперационного периода.
- Пациенты переводятся из палаты интенсивной терапии в хирургическое отделение в том случае, если основные показатели деятельности дыхательной и сердечно-сосудистой систем в норме.
- Питание посредством еюностомы начинается в 1-ый день после операции. Подробнее: Лечебное питание больных после операций на пищеводе .
- На 6-ой день после операции проводится исследование с целью проверки состоятельности швов.
- Если нарушений нет, пациент получается пероральное питание.
- Если наблюдается несостоятельность швов, то дренажные трубки оставляются на месте, и питание осуществляется при помощи еюностомы до тех пор, пока швы не закроются полностью.
- Постоперационные осложнения
Осложнения возникают у приблизительно 40% пациентов.
- Осложнения со стороны дыхательной системы (15-20%) включают в себя ателектаз, плевральный выпот и пневмонию.
- Осложнения со стороны сердечно-сосудистой системы (15-20%) включают в себя сердечные аритмии и инфаркт миокарда.
- Септические осложнения (10%) включают раневую инфекцию, недостаточность анастомозов, и пневмонию.
- При формировании стриктуры анастомоза может потребоваться дилатация (в 20% случаев).
- Показатели смертности зависят от функционального состояния пациента, а также опытности оперирующего хирурга и хирургической бригады. Показателем хорошего уровня проведения операций эзофаготомии при раке пищевода является интраоперационная смертность менее 5%. За редкими исключениями, такой уровень достигается только в крупных хирургических центрах.
- В результате недостаточности швов может развиться подтекание в грудную полость, что может привести к развитию сепсиса и смерти.
- Дальнейшее амбулаторное ведение пациентов
Пациенты осматриваются хирургом через 2 и через 4 недели после операции и впоследствии каждые 6 месяцев онкологом.
Большинство пациентов возвращаются к своему обычно уровню активности в течение 2 месяцев.
Пациенты проходят скрининговое обследование с помощью эндоскопии и компьютерной томографии шеи, грудной клетки и брюшной полости с интервалом в 6 месяцев в течение 3 лет, и затем ежегодно.
- Показания к хирургическому лечению
-
Паллиативное хирургическое лечение
Паллиативное лечение направлено на снижении степени обструкции пищевода для обеспечения возможности орального приема пищи. Проявления обструкции пищевода могут быть довольно значительными, сопровождаться повышенным слюноотделением и возвратной аспирацией.
Применяется мануальная дилатационная терапия (бужирование), установка зонда, радиационная терапия, лазерная фотокоагуляция и фотодинамическая терапия. В некоторых случаях требуется установка еюностомы. Облегчение после дилатации пищевода длится обычно не более нескольких дней. Для сохранения проходимости пищевода более эффективны гибкие сетчатые металлические стенты. Некоторые модели с пластиковым покрытием применяются для закрытия трахеопищеводных фистул, а на некоторых модификациях конструкцией предусмотрен клапан для предупреждения рефлюкса в случае, если стент устанавливается около нижнего пищеводного сфинктера.
Эндоскопическая лазерная терапия может применяться для паллиативного лечения дисфагии. При этом прожигается канал в ткани опухоли с целью восстановления проходимости. Может повторяться в случае необходимости.
При проведении фотодинамической терапии применяется Фотофрин II , Porfimer Sodium или Эфир дигематопорфирина (DHE), которые абсорбируются тканями и действуют как фотосенсибилизатор. Когда лазерный луч направляется на опухоль, это вещество высвобождает кислородные радикалы, разрушающие опухолевые клетки. Пациенты, которым проводится фотодинамическая терапия, должны избегать прямых солнечных лучей в течение 6 недель после лечения, так как кожа сенсибилизирована к солнечным лучам.
При распространенном раке рентгенотерапия не эффективна, при локализованном – способна уменьшить дисфагию. Однако данный метод лечения характеризуется большим числом побочных эффектов и применяется редко.
- Хирургическое лечение
-
Нехирургические методы лечения
Нехирургические методы лечения обычно применяются у пациентов с карциномой пищевода, у которых имеются противопоказания к хирургическому лечению.
Цель терапии – это уменьшение проявлений дисфагии и восстановление возможности питаться.
Нельзя назвать какой-либо один самый лучший метод паллиативной терапии, подходящий в любой ситуации. У большинства пациентов необходимо применять несколько паллиативных методов для поддержания проходимости просвета пищевода (см. паллиативное лечение). Наиболее подходящий метод паллиативной терапии должен подбираться для каждого пациента индивидуально, в зависимости от характеристик опухоли, предпочтений пациента, и индивидуальных особенностей, выявляемых врачом.
-
Химиотерапия
Химиотерапия как самостоятельный метод терапии применяется ограниченно. Только у небольшого числа пациентов достигается небольшое и кратковременное улучшение. Каких-либо выраженных предпочтений в отношении препаратов для химиотерапии не выявлено.
Наиболее часто применяются цисплатин (Бластолем, Платидиам, Платинол, Цитоплатин), фторурацил (Флурокс, 5-Фторурацил-Эбеве , Фторурацил-ЛЭНС ), митомицин (Веро-Митомицин, митомицин С, Митомицин-С Киова), доксорубицин (Адрибластин быстрорастворимый, Доксолем, Доксорубифер, Доксорубицин –Тева, Келикс, Растоцин), блеомицин (Бленамакс, Блеомицетина гидрохлорид, Блеоцин), метотрексат ( Веро-Метотрексат , Метотрексат- Эбеве ).
-
Радиационная и другие виды терапии
- Высокодифференцированный. Строение аномальных клеточных структур, соответствующих данной степени опухолевого новообразования, фактически не имеет каких-либо отличий от нормальных. Такие новообразования характеризует низкая агрессивность, замедленный рост и редкие прорастания в регионарные лимфоузлы, благодаря чему они легче всего поддаются полному излечению. Но в то же самое отмечается их высокое коварство – они могут длительное время протекать совершенно бессимптомно и проявиться только на последних этапах, когда результативность терапевтических мероприятий значительно снижается, а прогнозы к выздоровлению пациента становятся неблагоприятными.
- Умеренно дифференцированный рак пищевода. Злокачественное новообразование, имеющее только отдалённые морфологические признаки сходства с нормальными тканевыми структурами. Они легче поддаются диагностике, так как мутировавшие клетки постоянно бесконтрольно делятся и имеют специфическое строение. Также их выявлению способствует повышенное выделение в кровь антигена SCCA. Именно благодаря высокой концентрации маркеров возможно раннее обнаружение патологического состояния и проведение своевременной терапии.
- Низкодифференцированный. Данный тип опухолевых структур состоит из неспецифических веретенообразных клеток, полностью по своему строению напоминающих таковые при саркоме. Они характеризуются ярко выраженным полиморфизм (разнородностью морфологических признаков) и атипией. Для клеточных структур низкой дифференциации характерно ускоренное деление, провоцирующее их быструю мутацию и высокий потенциал злокачественности.
- Реже диагностируется недифференцированный рак пищевода (аденокарцинома). Данная патология относится специалистами к одной из самых агрессивных разновидностей злокачественных новообразований органов ЖКТ, так как начинает активно метастазировать имплантационным (контактным или тканевым), гематогенным (через кровеносное русло) и/или лимфогенным путями очень рано.
- Т – tumor (опухоль):
- Т0 — новообразование не выявлено;
- ТX — обнаружена первичная опухоль, которая не может быть полностью оценена по клиническим показаниям;
- Тis — (in situ) хорошо развитая карцинома, для излечения которой требуется операция. При раке пищевода, находящемся на данном этапе развития, хирургическое вмешательство будет результативным только в том случае, если одновременно с ним назначаются химиотерапия и лучевая терапия;
- T1 — опухоль инфильтрирует слизистую и подслизистый слой стенки пищевода;
- Т2 — опухоль инфильтрирует мышечную оболочку стенки пищевода;
- Т3 — опухоль инфильтрирует все слои стенки пищевода, включая адвентицию;
- Т4 — опухоль распространяется на соседние структуры средостения: Т4а — опухоль поражает плевру, перикард и/или диафрагму, Т4b — опухоль распространяется на другие соседние структуры: аорту, тела позвонков или трахею.
- N – nodulus (узел):
- NX региональные лимфатические узлы не могут быть оценены
- N0 – метастазы отсутствуют;
- N1- метастазы в 1-2 региональных лимфатических узлах;
- N2 — метастазы в 3-6 региональных лимфатических узлах;
- N3 – метастазы в 7 и более региональных лимфатических узлах
- M – metastasis (метастазы):
- M0 – находящиеся в отдалении внутренние органы не поражены прорастанием в них злокачественных клеточных структур;
- M1 – отдалённые метастазы в почках, печени, лёгких или костях и костном (головном) мозге присутствуют.
- GX – степень дифференцировки не определена;
- G1 – высокодифференцированная опухоль;
- G2 – умеренно дифференцированная опухоль;
- G3 – низкодифференцированная опухоль;
- G4 – недифференцированная опухоль.
- Полноценное лечение, приводящее к полному выздоровлению, возможно только на первой стадии. Самый благоприятный прогноз даёт оперативное вмешательство, одновременно с которым назначаются курсы химии и облучения, особенно если злокачественная опухолевая структура локализована на внешней, а не на внутренней стороне пищеводной трубки. В этом случае протокол лечения предусматривает только операцию по удалению части поражённого органа. Чаще всего используют эндоскопическую резекцию, после которой, для предупреждения рецидива, проводят курсы радио- и химиотерапии.
- Протокол лечения на второй стадии опирается на общее состояние здоровья пациента и тип новообразования. При аденокарциноме и удовлетворительном самочувствии человека терапевтические мероприятия проводятся посредством радикального удаления карциномы с применением перед операцией и после неё курсов медикаментозного лечения. При развитии в пищеводном канале плоскоклеточной формы ракового новообразования, методом выбора становится сочетанная химиорадиация, после которой проводится оперативное вмешательство.
- Все терапевтические мероприятия на третьей стадии проводятся исключительно в условиях стационара, где ведущий онколог может постоянно отслеживать любые изменения в состоянии человека. Протокол лечения на этом этапе развития болезни практически такой же, как и на второй стадии, небольшие отличия в курсах и схемах лечения могут быть только по медицинским показаниям.
- На терминальной (последней, необратимой) стадии патологическое состояние переходит в разряд неоперабельных, поэтому хирургическое вмешательство, а так же химия и облучение, применяются исключительно в паллиативных целях, для облегчения мучительного состояния человека путём устранения негативных проявлений тяжёлой симптоматики и сдерживания активного роста злокачественного новообразования.
- 0 стадия патологического состояния характеризуется локализацией опухоли непосредственно в верхних слоях эпителиальной ткани. Такое злокачественное новообразование может быть полностью излечено при условии своевременного его выявления и проведении курса адекватной терапии.
- 1 стадия. На этом этапе происходит постепенное расширение границ опухолевой структуры, но она ещё не способна прорастать в другие органы и лимфоузлы, поэтому прогноз болезни более-менее благоприятный – полное выздоровление отмечается у 90% пациентов.
- 2 стадия. Патологический процесс начинает активно прогрессировать, причём не только в первичном очаге поражения, но и в регионарных лимфатических узлах. Прогнозы жизни в это время значительно ухудшаются, и к полному выздоровлению приходит не более половины онкобольных.
- 3 стадия. На этом этапе развития недуга специалисты при помощи адекватного лечения могут дать шансы на выздоровление не более, чем 10% пациентов с карциномой пищеводного канала. На этом этапе отмечается высокая смертность даже в случае отсутствия отдалённого метастазирования. Такая опасная тенденция связана с тем, что онкологический процесс уже взял над организмом человека полную власть и будет, несмотря ни на что, активно прогрессировать.
- 4 стадия. Она является терминальной, то есть последней и неизлечимой. Если у пациента диагностируют данный этап развития патологического состояния, даже при отсутствии отдалённых метастазов, жить ему остаётся не более нескольких месяцев.
Радиационная терапия эффективна в устранении дисфагии приблизительно у 50% пациентов.
У пациентов на поздних стадиях заболевания хорошие результаты дает применение комбинации химиотерапии и радиационной терапии.
Лазерная терапия помогает достичь улучшения дисфагии у 70% пациентов. Для поддержания просвета необходимо повторять курсы лечения.
Интубация с помощью гибкого металлического стента, который вводится эндоскопически, под флюрографическим контролем. Это метод позволяет поддерживать просвет пищевода в открытом состоянии и особенно полезен при наличии трахеопищеводных фистул.
Фотодинамическая терапия - весьма перспективный нехирургический метод терапии. Назначаются фотосенсибилизирующие препараты, которые избирательно адсорбируются злокачественно измененными тканями. Затем область подвергается прямому световому воздействию, происходит распад фотосенсибилизатора на свободные радикалы, непосредственно повреждающие ткань опухоли. Побочные эффекты фотодинамической терапии – это формирование стриктур пищевода у 34% пациентов.
Любой человек, услышавший от специалиста диагноз онкология, первым делом придёт в ужас и потеряет самообладание. Первым, что необходимо сделать — это выяснять у лечащего врача стадию развития патологического процесса и степень его злокачественности. Такое поведение является наиболее правильным, ведь именно эти факторы обуславливают дальнейшие прогнозы и определяют выбор наиболее подходящего в каждом конкретном случае лечения, которое всегда бывает длительным и мучительным.
Гистологическая диагностика рака пищевода в 95% случаев выявляет плоскоклеточные новообразования с более-менее спокойным течением. Все они имеют различную степень дифференцировки, знание которой необходимо ведущим онкологам для назначения адекватного лечения, способного если не избавить человека полностью от этого недуга, то хотя бы значительно продлить ему жизнь с сохранением уровня качества.
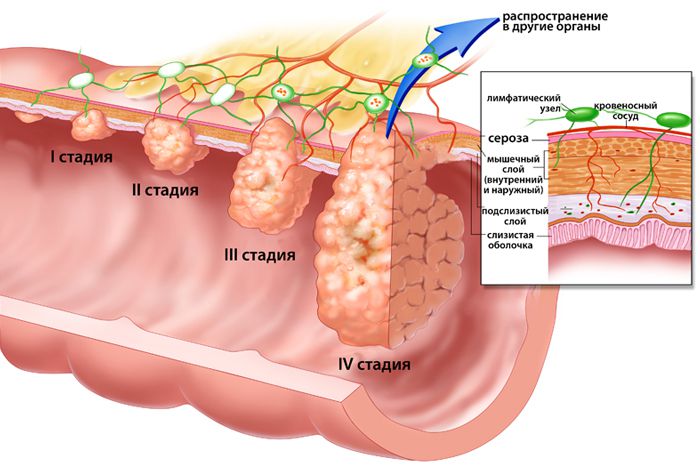
Стадии развития болезни
В современной медицине принято различать по типу дифференциации следующие степени рака пищевода (морфологического развития аномальных клеток):
Важно! От степени дифференцировки раковых новообразований зависит скорость их распространения по организму, что оказывает непосредственное влияние на благоприятность прогнозов проводимых лечебных мероприятий. Помимо этого такое разграничение опухолей по степени злокачественности даёт специалистам возможность подобрать наиболее действенный в каждом конкретном случае протокол лечения.
Стадии рака пищевода
В современной медицинской практике выделяется 4 стадии рака пищевода и предраковый этап развития недуга, на котором определить наличие патологического мутирования клеточных структур практически невозможно.
Зародившееся в плоском эпителии и не диагностированное своевременно аномальное новообразование прогрессирует следующим образом:
Важно! Успешно вылечить раковую опухоль пищеводного канала можно исключительно на начальных этапах и то только с помощью специально подобранного квалифицированным специалистом медикаментозного протокола лечения. Нередко появляющиеся в интернете рассказы о том, что человек успешно победил рак пищевода, имеющий 3 степень развития, народными или гомеопатическими средствами относятся к разряду фантастики и публикуются на мошеннических сайтах с целью выкачивания из безнадёжно больных людей денег.
TNM классификация
Ключевым моментом в постановке правильного диагноза при онкологии, поразившей пищеводный канал, считается определение стадии рака пищевода. В современной международной клинической практике онкологов применяется TNM классификация, где для обозначения степени злокачественного процесса и облегчения выбора адекватного лечения, а также прогнозирования его результатов, используют следующие обозначения:
Для информации! Применявшиеся ранее в градации стадии рака пищевода данные об отдалённом метастазировании (обозначение MX, указывающее на отсутствие сведений о прорастании метастазов в дальние органы) в современной клинической практике исключены в силу своей нецелесообразности.
Дополнительно ведущие онкологи применяют такие параметры классификации TNM, как G, gradus, или степень злокачественности, где цифрой 1 обозначается плоскоклеточный рак, а 2 и 3 – железистый (аденокарцинома). То есть, если сказать проще, при помощи этих критериев лечащий врач легко может понять степень злокачественности диагностированного новообразования. Вторым дополнительным показателем является значение P(1-4), где цифрой обозначается степень дифференцировки (прорастания) клеточных структур, то есть определяется их местоположение – в пределах слизистого, подслизистого, мышечного или серозного (с выходом за пределы пищевода) слоёв.
Степень дифференцировки опухоли:
Согласно применяемой в современной онкологической практике классификации TNM, онкобольному могут быть поставлены различные диагнозы, раковой опухоли пищеводного канала. На примере это выглядит следующим образом – T2N1M0G1P2 (плоскоклеточное новообразование небольшого участка пищеводного канала, проросшее в подслизистый слой, с поражением одного регионарного лимфоузла) или T4N2M1G3P4 (аденокарцинома всей поверхности начального органа ЖКТ, вышедшая за его пределы и сопровождающаяся появлением злокачественных очагов в нескольких регионарных лимфоузлах и отдалённых тканях).
Вышеперечисленные обозначения очень удобны, так как с их помощью можно достаточно легко детально охарактеризовать карциному пищеводного канала. Но данная классификация опухолей пищевода имеет один недостаток – она не даёт необходимой специалистам при выборе метода лечения информации о тяжести протекания недуга, имеющей непосредственную связь с возможностями терапии. Именно поэтому практикующими онкологами используется и дополнительная клиническая классификация, поясняющая стадию развития карциномы.
В ней применяются следующие цифровые обозначения:
Стадии рака пищевода могут определяться по данным первичного осмотра, проведённого по его показаниям инструментального исследования, и полученным результатам гистологического анализа биоматериала, взятого во время оперативного вмешательства.
Проводимое лечение относительно каждой стадии заболевания
Для выбора способа терапии при появлении и активном развитии в пищеварительном канале раковой опухоли, специалисты ориентируются на общее самочувствие человека, стадию развития патологического состояния и степень распространённости по организму злокачественного процесса. Для лечебных мероприятий могут быть назначены оперативное вмешательство, радио- и химиотерапия по отдельности или в определённых комбинациях, подбираемых после проведения диагностики и оценки состояния онкобольного.
В зависимости от стадии развития в начальном органе ЖКТ онкологического процесса, возможны следующие терапевтические варианты:
Адекватных вариантов терапии онкоопухолей достаточно много, специалисту необходимо только правильно подобрать и сочетать между собой наиболее подходящие в каждом конкретном случае процедуры. Лечебные мероприятия, подобранные правильно, практически в 70% случаев даёт онкобольным шанс вернуться к привычной, полноценной жизни, без присутствия в ней длительных периодов мучительного состояния, связанного с появлением непереносимых болей.
Прогноз и продолжительность жизни на каждой стадии развития заболевания
Исход этой опасной болезни, до сих пор считающейся чумой современности, имеет непосредственную взаимосвязь с тем, сколько времени она продолжает прогрессировать и насколько адекватно проводились терапевтические мероприятия. На начальных (I и II) этапах развития в пищеводном канале онкологического процесса прогноз практически всегда благоприятный, так как карцинома в это время достаточно легко поддаётся полному излечению. Последний же этап болезни полностью неоперабелен и неизлечим, вследствие чего у онкобольных с такой стадией раковой опухоли не остаётся шансов на продление жизни.
Прогноз и продолжительность жизни человека с карциномой пищеводного канала непосредственно зависит от выявленной у него степени рака пищевода.
Всего их существует пять:
Читайте также:

