Стадии иммунологических взаимоотношений между опухолью и организмом
Взаимодействие опухоли и организма-опухоленосителя складывается из действия опухоли на организм и защиты организма-опухоленосителя от опухоли.
Действие опухоли на организм хозяина.Проявляется в локальном и общем воздействии.
Локальное воздействие включает в себя нарушения метаболизма, сдавление прилежащих и разрушение растущей опухолью сохранных тканей, прорастание стенок сосудов, что может приводить к местному венозному застою. Некроз и изъязвление опухоли могут сопровождаться кровотечением, присоединением вторичных инфекций.
Общее воздействие опухоли на организм хозяина может приводить к развитию различных анемий, раковой интоксикации, раковой кахексии и паранеопластических синдромов. Остановимся на двух последних проявлениях.
Раковая кахексия. Характеризуется истощением больного с развитием бурой атрофии миокарда, печени и скелетной мускулатуры. Возникновение раковой кахексии связывают с увеличением уровня белкового обмена в ткани опухоли, которая становится ловушкой всех питательных веществ и обрекает организм на "голодание". В последние годы развитие раковой кахексии связывают также с усиленной продукцией α-ФНО макрофагами и другими клетками в организме-опухоленосителе. а-ФНО называется кахектином, и его патогенетическая роль в возникновении кахексии доказана пока только в экспериментах на животных.
Паранеопластические синдромы. Это синдромы, обусловленные наличием опухоли в организме. Патогенез их различен, но всегда ключевое событие обусловлено воздействием неоплазмы. При гормонально-активных опухолях могут возникнуть различные эндокринопатии, как, например, синдром Иценко — Кушинга при аденомах передней доли гипофиза или нейроэндокринных опухолях легких; гиперкальциемия и остеопороз при аденомах околощитовидных желез и раке легкого. Опухоль, особенно на стадии метастазирования, воздействует на свертывающую и противосвертывающую систему крови, сама продуцирует факторы, усиливающие коагуляцию крови, и способствует развитию различных тромбопатий (мигрирующие тромбофлебиты, небактериальный тромбоэндокардит) и афибриногенемии. При опухолевом росте описан широкий спектр иммунопатологических процессов с иммунокомплексными, анти-тельными и цитотоксическими механизмами развития. Эти процессы приводят к возникновению у онкологических больных нейропатий, миопатий и дерматопатий.
Механизмы противоопухолевой защиты организма.Они разнообразны и складываются из защитных реакций с участием процессов репарации мутированного участка ДНК, сбалансирован' ной работы генов-супрессоров и клеточных онкогенов, а также из факторов неспецифической и специфической, иммунной и неиммунной защиты.
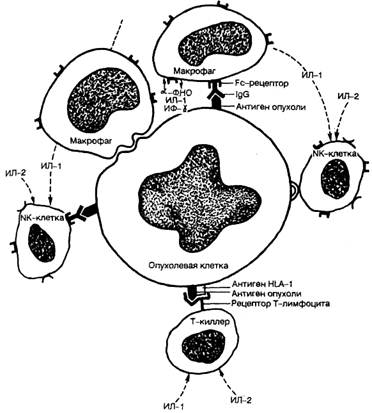
Рис. 6. Противоопухолевая иммунная реакция.
В защите от опухоли имеют значение реакции клеточного и гуморального иммунитета (рис. 6). Основными клетками, участвующими в противоопухолевой иммунной защите, являются специфические цитотоксические Т-лимфоциты, способные распознать мембраносвязанные опухолевые антигены (см. лекцию 20), а также антигены, относящиеся к антигенам I класса основного комплекса гистосовместимости; натуральные Т-киллеры (NK-клетки), вызывающие деструкцию опухолевых клеток предварительной сенсибилизации. Лизис осуществляется за счет непосредственного связывания с опухолевыми клетками или через Fc-фрагменты противоопухолевых антител; макрофаги осуществляют как неспецифическое повреждение опухолевых клеток через выделение а-ФНО и других факторов, так и специфическое иммунное повреждение путем присоединения к Fc. фрагментам противоопухолевых антител и через активацию Т-лимфоцитов, выделяющих 7-интерферон и другие цитокины.
Антительный механизм противоопухолевого иммунитета может осуществляться связыванием противоопухолевыми антителами комплемента с формированием литического комплекса, который взаимодействует с опухолевой клеткой, присоединением к опухолевой клетке через Fc-фрагмент противоопухолевых антител NK-клеток и макрофагов.
Интересным является вопрос о неэффективности иммунных реакций в защите от опухоли. Эту неэффективность, вероятно, можно объяснить развитием иммуносупрессии у онкологических больных, наличием феномена антигенного ускользания опухоли в связи с антигенной лабильностью, антигенным упрощением ее клеток, а также усилением роста опухоли под влиянием противоопухолевых антител.
Взаимодействие опухоли и организма состоит из влияния опухоли на организм и защиты организма от опухоли. Действие опухоли на организм хозяина может быть локальным и общим.
● Локальное воздействие включает нарушения метаболизма, сдавление прилежащих сохранных тканей, их разрушение растущей опухолью, прорастание стенок сосудов, что может приводить к местному венозному застою. Некроз и изъязвление опухоли могут вызвать кровотечение, присоединение вторичных инфекций.
● Общее воздействие опухоли на организм может приводить к развитию различных видов анемии, раковой интоксикации, раковой кахексии и паранеопластических синдромов.
Раковая кахексия. Характерно истощение больного с развитием бурой атрофии миокарда, печени и скелетных мышц. Возникновение раковой кахексии связывают с усилением белкового обмена в ткани опухоли, а в последние годы — также с усиленной продукцией ФНО-α макрофагами и другими клетками. Роль ФНО-α в возникновении кахексии доказана пока только в экспериментах на животных.
Паранеопластические синдромы связаны с наличием опухоли в организме и имеют различный патогенез. При гормонально активных опухолях могут возникнуть эндокринопатии (болезнь и синдром Иценко–Кушинга при аденомах передней доли гипофиза или нейроэндокринных опухолях лёгких, гиперкальциемия и остеопороз при аденомах паращитовидных желёз и раке лёгкого). Опухоль, особенно на стадии метастазирования, действует на свёртывающую и противосвёртывающую системы крови, сама синтезирует факторы, усиливающие коагуляцию крови, способствует развитию тромбопатий (мигрирующие тромбофлебиты, небактериальный тромбоэндокардит) и афибриногенемии. При опухолях описано множество иммунопатологических процессов с иммунокомплексными, антительными и цитотоксическими механизмами развития, приводящими к возникновению у онкологических больных невропатий, миопатий и дерматопатий.
Противоопухолевый иммунитет. Механизмы противоопухолевой защиты организма разнообразны. Это процессы репарации мутированного участка ДНК, сбалансированная работа генов-супрессоров и клеточных онкогенов, факторы неспецифической и специфической, иммунной и неиммунной защиты. В защите от опухоли имеют значение реакции клеточного и гуморального иммунитета. Основные клетки, участвующие в противоопухолевой иммунной защите, — специфические цитотоксические T-лимфоциты, способные распознать мембраносвязанные опухолевые антигены, NK-клетки, вызывающие деструкцию опухолевых клеток без предварительной сенсибилизации. Это происходит при непосредственном связывании с опухолевыми клетками или через Fc-фрагменты противоопухолевых антител. Макрофаги осуществляют неспецифическое (выделение ФНО-α и др.) и специфическое иммунное повреждение опухолевых клеток (присоединение к Fc-фрагментам противоопухолевых антител, активация T-лимфоцитов, выделяющих γ-ИФ и другие цитокины).
Осуществление антительного механизма противоопухолевого иммунитета возможно при связывании противоопухолевыми антителами комплемента с образованием литического комплекса, взаимодействующего с опухолевой клеткой, присоединении к опухолевой клетке через Fc-фрагмент противоопухолевых антител, NK-клеток и макрофагов.
Неэффективность иммунных реакций в защите от опухоли, вероятно, можно объяснить развитием иммуносупрессии, наличием феномена антигенного ускользания опухоли из-за антигенного непостоянства, антигенным упрощением её клеток, усилением роста опухоли под влиянием противоопухолевых антител.
КЛАССИФИКАЦИЯ ОПУХОЛЕЙ
Современные классификации опухолей основаны на их клинических и особенно морфологических проявлениях. Последние учитывают при диагностике, выборе лечения и прогнозировании продолжительности жизни.
Выделяют оккультные опухоли — не имевшие проявлений и не диагностированные при клиническом обследовании пациентов.
Морфологические критерииклассификации опухолей делят на макроскопические и микроскопические.
● Макроскопические критерии включают размеры, наличие метастазов в лимфатических узлах и отдалённых органах, а также характер роста. По характеру роста выделяют опухоли с преимущественным экзофитным, экспансивным, эндофитным, инфильтрирующим ростом. Возможны различные макроскопические варианты. Например, карцинома желудка с преимущественным экзофитным ростом имеет бляшковидную, полиповидную, грибовидную и блюдцеобразную макроскопические формы. Карцинома лёгкого с преимущественным эндофитным, инфильтрирующим ростом представлена узловатой, разветвлённой и узловато-разветвлённой формами.
● Микроскопические критерии классификации опухолей включают следующие признаки:
степень зрелости опухолевых клеток (доброкачественные и злокачественные опухоли);
гисто- и цитогенез — тканевое и клеточное происхождение опухоли;
уровень дифференцировки (как правило, только для злокачественных опухолей).
Часто гисто- и цитогенез опухоли можно определить, только изучая препараты, окрашенные гематоксилином и эозином. Например, о принадлежности карциномы к плоскому эпителию говорят признаки ороговения, стратификации опухолевых клеток, наличие межклеточных мостиков, выявляемых при окраске препаратов гематоксилином и эозином. Однако в низкодифференцированных и недифференцированных опухолях гистогенетическую принадлежность определяют только с помощью специальных методов: иммуногистохимических, ПЦР, анализа генома клеток, электронной микроскопии.
Условно выделяют органоспецифические и органонеспецифические опухоли.
● Органоспецифические опухоли возникают только в определённых органах. Обычно это опухоли эндокринных органов, рак печени (печёночноклеточная карцинома), почек (почечноклеточная карцинома).
● Органонеспецифические опухоли возникают из тканей и клеток, распространённых в разных органах. Например, опухоли из покровного эпителия обнаруживают в коже, слизистых оболочках, лёгких.
Уровень дифференцировки злокачественных опухолей определяют по степени выраженности маркёров гистогенетической дифференцировки, сохранности функциональной активности и выраженности клеточного атипизма опухолевых клеток. В соответствии с этим выделяют высоко-, умеренно и низкодифференцированные карциномы и саркомы.
Иммуногистохимические маркёры опухолей—онкомаркёры белковой природы, определяемые в тканях и клетках иммуногистохимическими методами.
В последние годы используют классификации опухолей, основанные на экспрессии гистогенетических онкомаркёров, особенно в случаях низкодифференцированных и недифференцированных опухолей. Однако все методы следует использовать в комплексе, так как при прогрессировании злокачественной опухоли возможна метаплазия опухолевых клеток. В настоящее время основным методом диагностики опухолей считают морфологический, а остальные методы — вспомогательными.
Групповые иммуногистохимические маркёры карцином — промежуточные филаменты (цитокератины). Отдельные виды карцином также имеют органоспецифические маркёры. Например, клетки рака щитовидной железы могут выделять тиреоглобулин, рака яичников — СА 19-9, кишечника — раковоэмбриональный антиген, предстательной железы — рацемазу и тирозин.
Нейроэндокринные опухоли, как и карциномы, содержат цитокератины, но специфические маркёры этих опухолей — хромогранины, нейрон-специфическая енолаза, синаптофизин, Дуг-7 (CD57). Отдельные виды нейроэндокринных опухолей могут содержать серотонин и пептидные гормоны (кальцитонин, гастрин, бомбезин, адренокортикотропный гормон, инсулин, глюкагон, соматостатин).
Злокачественная меланома экспрессирует антиген меланомы, HMB-45 и протеин S-100. Выявление этих маркёров особо важно при беспигментных злокачественных меланомах, когда их необходимо отличить от недифференцированных и низкодифференцированных карцином и сарком. Злокачественные меланомы, в отличие от карцином, не содержат цитокератинов.
Саркомы мягких тканей фибробластического происхождения синтезируют виментин, также входящий в группу промежуточных филаментов, мышечные — десмин, гладкомышечные — гладкомышечный актин, нейрогенные — белки нейрофиламентов, нейрон-специфическую енолазу, глиальный фибриллярный кислый белок.
Сосудистые саркомы экспрессируют фактор VIII свёртывающей системы, CD34 и другие маркёры эндотелиальных клеток.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Взаимодействие опухоли и организма состоит из влияния опухоли на организм и защиты организма от опухоли. Действие опухоли на организм хозяина может быть локальным и общим.
· Локальное воздействие включает нарушения метаболизма, сдавление прилежащих сохранных тканей, их разрушение растущей опухолью, прорастание стенок сосудов, что может приводить к местному венозному застою. Некроз и изъязвление опухоли могут вызвать кровотечение, присоединение вторичных инфекций.
· Общее воздействие опухоли на организм может приводить к развитию различных видов анемии, раковой интоксикации, раковой кахексии и паранеопластических синдромов.
Раковая кахексия. Характерно истощение больного с развитием бурой атрофии миокарда, печени и скелетных мышц. Возникновение раковой кахексии связывают с усилением белкового обмена в ткани опухоли, а в последние годы — также с усиленной продукцией ФНО-a
макрофагами и другими клетками. Роль ФНО-a в возникновении кахексии доказана пока только в экспериментах на животных.
Паранеопластические синдромы связаны с наличием опухоли в организме и имеют различный патогенез. При гормонально активных опухолях могут возникнуть эндокринопатии (болезнь и синдром Иценко–Кушинга при аденомах передней доли гипофиза или нейроэндокринных опухолях лёгких, гиперкальциемия и остеопороз при аденомах паращитовидных желёз и раке лёгкого). Опухоль, особенно на стадии метастазирования, действует на свёртывающую и противосвёртывающую системы крови, сама синтезирует факторы, усиливающие коагуляцию крови, способствует развитию тромбопатий (мигрирующие тромбофлебиты, небактериальный тромбоэндокардит) и афибриногенемии. При опухолях описано множество иммунопатологических процессов с иммунокомплексными, антительными и цитотоксическими механизмами развития, приводящими к возникновению у онкологических больных невропатий, миопатий и дерматопатий.
Противоопухолевый иммунитет. Механизмы противоопухолевой защиты организма разнообразны. Это процессы репарации мутированного участка ДНК, сбалансированная работа генов-супрессоров и клеточных онкогенов, факторы неспецифической и специфической, иммунной и неиммунной защиты. В защите от опухоли имеют значение реакции клеточного и гуморального иммунитета. Основные клетки, участвующие в противоопухолевой иммунной защите, — специфические цитотоксические T-лимфоциты, способные распознать мембраносвязанные опухолевые антигены, NK-клетки, вызывающие деструкцию опухолевых клеток без предварительной сенсибилизации. Это происходит при непосредственном связывании с опухолевыми клетками или через Fc-фрагменты противоопухолевых антител. Макрофаги осуществляют неспецифическое (выделение ФНО-a и др.) и специфическое иммунное повреждение опухолевых клеток (присоединение к Fc-фрагментам противоопухолевых антител, активация
T-лимфоцитов, выделяющих g-ИФ и другие цитокины).
Осуществление антительного механизма противоопухолевого иммунитета возможно при связывании противоопухолевыми антителами комплемента с образованием литического комплекса, взаимодействующего с опухолевой клеткой, присоединении к опухолевой клетке через Fc-фрагмент противоопухолевых антител, NK-клеток и макрофагов.
Неэффективность иммунных реакций в защите от опухоли, вероятно, можно объяснить развитием иммуносупрессии, наличием феномена антигенного ускользания опухоли из-за антигенного непостоянства, антигенным упрощением её клеток, усилением роста опухоли под влиянием противоопухолевых антител.
Классификация опухолей
Современные классификации опухолей основаны на их клинических и особенно морфологических проявлениях. Последние учитывают при диагностике, выборе лечения и прогнозировании продолжительности жизни.
Выделяют оккультные опухоли — не имевшие проявлений и не диагностированные при клиническом обследовании пациентов.
Морфологические критерииклассификации опухолей делят на макроскопические и микроскопические.
· Макроскопические критерии включают размеры, наличие метастазов в лимфатических узлах и отдалённых органах, а также характер роста. По характеру роста выделяют опухоли с преимущественным экзофитным, экспансивным, эндофитным, инфильтрирующим ростом. Возможны различные макроскопические варианты. Например, карцинома желудка с преимущественным экзофитным ростом имеет бляшковидную, полиповидную, грибовидную и блюдцеобразную макроскопические формы. Карцинома лёгкого с преимущественным эндофитным, инфильтрирующим ростом представлена узловатой, разветвлённой и узловато-разветвлённой формами.
· Микроскопические критерии классификации опухолей включают следующие признаки:
G степень зрелости опухолевых клеток (доброкачественные и злокачественные опухоли);
G гисто- и цитогенез — тканевое и клеточное происхождение опухоли;
G уровень дифференцировки (как правило, только для злокачественных опухолей).
Часто гисто- и цитогенез опухоли можно определить, только изучая препараты, окрашенные гематоксилином и эозином. Например, о принадлежности карциномы к плоскому эпителию говорят признаки ороговения, стратификации опухолевых клеток, наличие межклеточных мостиков, выявляемых при окраске препаратов гематоксилином и эозином. Однако в низкодифференцированных и недифференцированных опухолях гистогенетическую принадлежность определяют только с помощью специальных методов: иммуногистохимических, ПЦР, анализа генома клеток, электронной микроскопии.
Условно выделяют органоспецифические и органонеспецифические опухоли.
· Органоспецифические опухоли возникают только в определённых органах. Обычно это опухоли эндокринных органов, рак печени (печёночно-клеточная карцинома), почек (почечно-клеточная карцинома).
· Органонеспецифические опухоли возникают из тканей и клеток, распространённых в разных органах. Например, опухоли из покровного эпителия обнаруживают в коже, слизистых оболочках, лёгких.
Уровень дифференцировки злокачественных опухолей определяют по степени выраженности маркёров гистогенетической дифференцировки, сохранности функциональной активности и выраженности клеточного атипизма опухолевых клеток. В соответствии с этим выделяют высоко-, умеренно и низкодифференцированные карциномы и саркомы.
Онкомаркеры белковой природы могут быть определены в тканях и клетках иммуногистохимическими методами, в связи с чем именуются иммуногистохимическими маркерами опухолей (см. ³).
Опухоли из эпителия
Выделяют следующие виды опухолей из эпителия.
· По степени зрелости:
G злокачественные (из покровного эпителия — плоскоклеточный и переходно-клеточный рак, из железистого — аденокарцинома);
G доброкачественные (из покровного эпителия — папилломы, из железистого — аденомы).
G опухоли из покровного эпителия (плоского и переходного — папилломы, плоскоклеточный и переходно-клеточный рак);
G опухоли из железистого эпителия (аденомы, аденоматозные полипы, аденокарциномы).
· По уровню дифференцировки (для аденокарцином).
Папилломы развиваются на коже, слизистых оболочках мочевого пузыря, пищевода, влагалища, реже в бронхиальном дереве (органонеспецифические опухоли). Макроскопически папиллома имеет сосочковую поверхность и напоминает цветную капусту. Папилломы, растущие эндофитно, можно выявить только при микроскопическом исследовании (инвертированные папилломы). Характерны сосочковые разрастания покровного эпителия, имеющие фиброваскулярный стержень (рис. 7-8). При этом сохранены все основные свойства плоского эпителия: базальная мембрана, полярность, стратификация и комплексность. В папилломах обнаруживают признаки тканевого атипизма: увеличение количества слоёв плоского эпителия, его разрастания в виде сосочков. В папилломах из плоского эпителия нередко находят выраженное ороговение, поэтому их называют также кератомами. Не исключена вирусная природа папиллом. Их малигнизация крайне редка. Однако папилломы гортани, мочевого пузыря и кожи считают опасными предраковыми заболеваниями.
Аденомы — доброкачественные новообразования из железистого эпителия. Они развиваются в органах, где паренхима состоит полностью из эпителия (печень, почки, эндокринные органы), а также в трубчатых и полых органах, имеющих железы в слизистой оболочке. Таким образом, аденомы бывают как органоспецифические, так и органонеспецифические. При экзофитном росте опухоль имеет вид пальцевидного выроста — полипа. При эндофитном росте выявление возможно только при микроскопическом исследовании (плоская аденома). В зависимости от структур, образованных железистым эпителием, выделяют следующие типы аденом: тубулярные (трубчатые структуры), трабекулярные (балочные структуры), альвеолярные, папиллярные (сосочковые) и цистаденомы (кистозные). Аденому с развитой стромой — фиброаденому (рис. 7-9) обнаруживают в молочной железе, яичниках и других органах. В отличие от папиллом, в аденомах нередко находят диспластические изменения и даже рак in situ, чаще происходит малигнизация с развитием аденокарцином. Об опухолях эндокринных органов также см. главу 18.
Плоскоклеточный рак возникает в тех же органах и тканях, что и папилломы из клеток-предшественниц плоского эпителия, а также в очагах метаплазии. Наиболее часто плоскоклеточный рак развивается в коже, лёгких, гортани, пищеводе, шейке матки, влагалище, мочевом пузыре. Выделяют рак in situ и инвазивный плоскоклеточный рак, классифицируемый по уровню дифференцировки. Метастазирует плоскоклеточный рак прежде всего лимфогенным путём, поэтому его первые метастазы обнаруживают в регионарных лимфатических узлах. На поздних стадиях возникают гематогенные метастазы.
· Высокодифференцированный плоскоклеточный рак. Характерно экстрацеллюлярное ороговение с формированием раковых жемчужин, стратификация, комплексность, наличие межклеточных мостиков (рис. 7-10).
· Умеренно дифференцированный рак — внутриклеточное ороговение, стратификация, комплексность, наличие межклеточных мостиков.
· Низкодифференцированный рак — только стратификация, комплексность, наличие межклеточных мостиков.
Аденокарцинома — злокачественная органонеспецифическая опухоль из железистого эпителия. Развивается в желудке, кишечнике, молочных железах, лёгких, матке и других органах, где есть железистый эпителий или возможна железистая метаплазия эпителия (например, в пищеводе).
· По гистологическому строению выделяют следующие типы аденокарцином: тубулярные (рис. 7-11), трабекулярные, альвеолярные, папиллярные, цистаденомы.
· По уровню дифференцировки — высоко-, умеренно и низкодиффенцированные опухоли.
· Специальные варианты аденокарцином в зависимости от их клеточного происхождения (эндометриоидный рак яичника, B-клеточный рак щитовидной железы и др.). Иногда клетки аденокарциномы содержат много слизи, но не образуют железистых структур (перстневидно-клеточный рак).
· В зависимости от характера роста, соотношения паренхимы и стромы выделяют аденокарциномы со слаборазвитой стромой (медуллярный рак), с развитой стромой и скиррозным характером роста (скиррозный рак), а также с солидным характером роста (солидный рак).
· Метастазирует аденокарцинома, как и плоскоклеточный рак, прежде всего лимфогенным путём, на поздних стадиях — гематогенным.
Нейроэндокринные опухоли
Нейроэндокринные опухоли развиваются из клеток-предшественниц апудоцитов, расположенных почти во всех органах и имеющих общее происхождение с эпителиальными клетками данного органа. В норме апудо
Рис. 7-8.Папиллома кожи. Окраска гематоксилином и эозином (´100)
циты осуществляют местную нейроэндокринную регуляцию органов и условно объединены в диффузную APUD-систему. Клетки этой системы синтезируют множество биогенных аминов и полипептидных гормонов (серотонин, кальцитонин, АКТГ и др.).
Опухоли из нейроэндокринных клеток называют апудомами. Они могут быть доброкачественными (карциноид) и злокачественными (атипичный карциноид, высоко- и низкодифференцированные нейроэндокринные карциномы). Часто опухоль называют по синтезируемому гормону (гастринома, инсулома, ВИПома и др.). Чаще всего карциноиды возникают в червеобразном отростке, желудке и лёгком (см. ³).
Опухоли мягких тканей
Опухоли мягких тканей относительно часты. Число случаев впервые выявленных доброкачественных опухолей мягких тканей — 3 млрд пациентов в год, а злокачественных — около 30 млн. Злокачественные опухоли мягких тканей составляют примерно 1% всех злокачественных опухолей человека (см. ³).
Гистологическая классификация опухолей мягких тканей объединяет более 50 их разновидностей и основана на общепринятых критериях. Выделяют следующие виды опухолей.
Рис. 7-9.Фиброаденома молочной железы. Окраска гематоксилином и эозином (´100)
· По степени зрелости:
G доброкачественные опухоли из производных мезенхимы (фиброма, липома и др.);
G злокачественные опухоли (саркома).
· По гистогенезу и цитогенезу:
G из жировой ткани (адипозоцита) — липома, липосаркома;
G из фиброзной ткани (фибробласта и миофибробласта) — фиброма (рис. 7-12), фибросаркома (рис. 7-13);
G из фиброгистиоцитарных элементов — гистиоцитома, плеоморфная саркома;
G из гладкомышечной ткани — лейомиома, лейомиосаркома;
G из перицитов — перицитома;
G из скелетных мышц — рабдомиома, рабдомиосаркома;
G из сосудистой ткани — ангиома, ангиосаркома;
G из хрящевой и остеоидной ткани — хондрома, саркома;
G из примитивной мезенхимальной клетки — мезенхимомы, миксомы, гамартомы и их злокачественные аналоги.
Около 1 /3 опухолей мягких тканей составляют липомы, 10% — сосудистые опухоли. Свойства опухолей зависят не только от гистогенеза, но и
Рис. 7-10.Плоскоклеточный высокодифференцированный ороговевающий рак лёгкого. Окраска гематоксилином и эозином (´100)
Рис. 7-11.Тубулярная умеренно дифференцированная аденокарцинома лёгкого. Окраска гематоксилином и эозином (´100)
локализации, возраста, пола пациента. Например, липомы чаще бывают у взрослых, обычно безболезненны, крайне редкая локализация — кисти рук и нижние конечности. Множественные липомы и ангиолипомы свойственны молодым мужчинам, болезненны при пальпации. Большинство сосудистых опухолей развивается у детей и взрослых до 20-летнего возраста, а ангиолейомиомы — в основном у женщин среднего возраста на нижних конечностях.
Этиология большинства опухолей мягких тканей не установлена. Их развитие может быть связано с воздействием химических канцерогенов (саркомы после действия диоксидов, входящих в состав гербицидов, пластмасс), радиации (пострадиационные злокачественные гистиоцитомы и остеосаркомы), онкогенных вирусов (герпеса, Эпстайна–Барр). Описаны опухоли мягких тканей с наследственной предрасположенностью, опухоли у членов одной семьи: липомы, ангиолипомы, саркомы при синдроме Ли–Фромени (мутации гена-супрессора ТР53) и у пациентов с наследственной ретинобластомой (мутации гена-супрессора Rb).
Для прогнозирования злокачественного потенциала сарком Национальным раковым центром Франции и Национальным институтом здоровья США разработаны системы количественной оценки параметров опухолей (количество митотических фигур на единицу площади, площадь некроза, уровень дифференцировки опухолевой ткани). Существует также система TNM определения стадии заболевания (I–IV стадии). По ней оценивают размеры опухоли, наличие метастазов в регионарные лимфатические узлы и органы.
Опухоли из жировой ткани бывают доброкачественными (липома, липоматоз, липобластома, липобластоматоз, ангиолипома, миолипома, хондроидная липома, веретёно-клеточная, или плеоморфная липома, гибернома) и злокачественными (дифференцированная саркома, недифференцированная, миксоидная, плеоморфная липосаркома, липосаркома смешанного типа). В данной группе опухолей нередко обнаруживают хромосомные аберрации типа 12q13-15 (ген HMGIC), 8q11-13 (ген PLAG1), амплификацию участка 12q13-14, 12q13-21 (ген MDM2), транслокации t(12;16) и t(q13; p11).
· Липома —органонеспецифическая опухоль, может быть расположена в поверхностных (на глубине менее 5 см) и глубоких (более 5 см) слоях подкожной жировой клетчатки, синовиальной оболочке суставов, между мышцами. Макроскопически липома обычно имеет вид инкапсулированного образования жёлтого цвета, дольчатого вида, при локализации в суставах может иметь сосочковую поверхность. Микроскопически опухоль состоит из адипозоцитов. Они формируют дольковые структуры, разделённые фиброзно-сосудистыми перегородками. Изредка обнаруживают участки костной ткани (остеолипома), хрящевой (хондролипома), фиброзной (фибролипома), очаги миксоматоза (миксолипома).
· Липосаркома — органонеспецифическая опухоль, расположена чаще глубоко в жировой ткани (забрюшинной, паратестикулярной, средостения). Макроскопически обычно имеет вид инкапсулированного образования, редко с мультицентрическим ростом, дольчатого вида, бело-жёлтого цвета. Микроскопически высокодифференцированная липосаркома имеет липомоподобный, склерозирующий, воспалительный и веретёно-клеточный подтипы. В недифференцированной липосаркоме обнаруживают атипичные адипозоциты и саркоматозные элементы иного строения. Прогноз зависит от локализации и гистологического варианта опухоли. Наихудший прогноз имеют ретроперитонеальные липосаркомы недифференцированного типа. Метастазирование во внутренние органы происходит гематогенным
Рис. 7-12.Фиброма пищевода. Окраска гематоксилином и эозином (´100)
Рис. 7-13.Фибросаркома. Окраска гематоксилином и эозином (´200)
путём. Иммуногистохимическое типирование опухолевых клеток производят с помощью антител к протеину S-100.
Опухоли из фиброзной ткани построены из клеток, напоминающих фибробласты и миофибробласты. По классификации ВОЗ (2002 г.) в эту группу входят опухолеподобные процессы и доброкачественные опухоли (нодулярный фасциит, пролиферативный фасциит, пролиферативный миозит, ишемический фасциит, эластофиброма, фиброзная гамартома детей, миофиброма/миофиброматоз, фиброматоз, фиброма оболочек сухожилий, десмопластическая фибробластома, миофибробластома, кальцифицирующаяся фиброма апоневроза, ангиомиофибробластома, фиброма Гарднера, воспалительная миофибробластическая опухоль) и саркомы (низкодифференцированная миофибробластическая саркома, миксоматозно-воспалительная фибробластическая саркома, фибросаркома детей и взрослых, миксоидная фибросаркома, склерозирующаяся эпителиоидная фибросаркома).
Лейомиома — наиболее частая доброкачественная опухоль, она может быть обнаружена в матке, желудочно-кишечном тракте, мочевом пузыре. Полагают, что лейомиома развивается из перицитов сосудистой стенки вне зависимости от органной локализации. Лейомиомы матки имеют развитую строму, поэтому правильнее их называть лейомиофибромами. Лейомиосаркомы, как правило, отличают выраженные признаки злокачественности: быстрый инфильтрирующий (инвазивный) рост, ранние гематогенные метастазы, нередко вторичные изменения (некроз, ослизнение, кровоизлияния, кальцификация).
Стромальные опухоли — особая разновидность мезенхимальных опухолей с неизвестным прогнозом. Их находят в желудочно-кишечном тракте, прежде всего в желудке и кишечнике. Клетки стромальных опухолей экспрессируют маркёры различных производных мезенхимы (гладкомышечных, шванновских клеток). Диагноз ставят при иммуногистохимическом выявлении экспрессии клетками маркёра CD117 (c-kit).
Дата добавления: 2018-05-09 ; просмотров: 216 ;
Читайте также:

