Соединения йода с хлором

Монохлорид йода — интергалогенид, бинарное неорганическое соединение йода и хлора с формулой ICl, тёмно-красная жидкость или рубиново-красные (α-форма) или красно-коричневые (β-форма) кристаллы. Реагирует с водой.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение в органическом синтезе
Получение
- Действие хлора на йод:
- Разложение гексахлорида дииода:
Физические свойства
Монохлорид йода — тёмно-красная жидкость или кристаллы: рубиново-красные (α-форма) или красно-коричневые (β-форма).
Имеет две полиморфные формы:
- α-ICl, рубиново-красные кристаллы моноклинной сингонии, пространственная группа P 21/c, параметры ячейки a = 1,260 нм , b = 0,438 нм , c = 1,190 нм , β = 119,5° , Z = 8 , d = 3,85 г/см 3 ; плавится при 27,2 °C;
- β-ICl, красно-коричневые кристаллы моноклинной сингонии, пространственная группа P 21/c, параметры ячейки a = 0,8883 нм , b = 0,8400 нм , c = 0,7568 нм , β = 91,35° , Z = 8 , d = 3,66 г/см 3 ; плавится при 13,9 °C.
Растворяется в этаноле, сероуглероде и диэтиловом эфире, в трихлориде мышьяка, диоксиде серы, оксихлориде серы, безводной уксусной кислоте.
В газовой фазе энтальпия образования 17,4 кДж/моль , теплоёмкость при постоянном давлении 35,5 Дж/(моль·К) , энтропия 239,9 Дж/(моль·К) .
Кипит (с разложением) при 97,4 °C.
Химические свойства
Свойства монохлорида йода определяются непрочностью и сильной поляризованностью связи I + − Cl −
Так, монохлорид йода обратимо разлагается при нагревании выше температуры кипения:
Поляризация связи приводит к тому, что во многих случаях монохлорид йода выступает в роли источника катиона йода. Так, он реагирует с холодной водой с образованием иодноватистой кислоты:
ICl + H2O → HCl + HIO
При взаимодействии с горячей водой образовавшаяся образующаяся иодноватистая кислота in situ диспропорционирует на йод и йодноватую кислоту:
5 ICl + 3 H2O → 90oC 5 HCl + HIO3 + 2 I2 ↓
аналогично протекает реакция при взаимодействии с щелочами:
3 ICl + 6 NaOH → 3 NaCl + 2 NaI + NaIO3 + 3 H2O
Хлорид йода может выступать как акцептором, так и донором хлорид-аниона. Так, в присутствии хлорид-анионов он образует комплексы — например, с концентрированной соляной кислотой и хлоридами тяжёлых щелочных металлов :
ICl + HCl ⇄ H[ICl2] ICl + CsCl ⇄ Cs[ICl2]
При взаимодействии с кислотами Льюиса (AlCl3, SbCl5 и т.п.) монохлорид йода отщепляет хлорид-анион, образуя соли катиона I2Cl + :
Горячая серная кислота окисляет хлорид йода до йодноватой кислоты:
Применение в органическом синтезе
Монохлорид йода применяется в органическом синтезе при прямом иодировании ароматических соединений: благодаря поляризации связи атом йода в ICl более электрофилен, чем в I2, и хлорид йода является более энергичным йодирующим агентом, чем элементарный йод.
Монохлорид йода также способен присоединяться к двойным связям алкенов с образованием 1,2-хлорйодалканов.
Йод представляет собой серовато-черные (фиолетовые) кристаллы с характерным запахом. Источником его получения является зола морских водорослей. Иод хорошо растворим в спиртах, а также в водных растворах калия йодида и натрия, плохо растворим в воде (1:5000). Наряду со спиртовым раствором йода широко используется раствор Люголя , содержащий 1 часть йода, 2 части калия йодида и 17 частей воды. Йод как микроэлемент имеет важное значение для организма. Он необходим для синтеза тироксина - гормона щитовидной железы, повышающего интенсивность обмена веществ. Элементарный йод в малых дозах ("микройод"), освобождающийся в щитовидной железе из йодидов, оказывает угнетающее влияние на образование тиреотропного гормона гипофиза, повышает липопротеиназную и фибринолитическую активность крови, способствует снижению уровня холестерина крови и рефлекторному повышению секреции слизи в железах дыхательных путей. Йод увеличивает проницаемость тканей, способствуя рассасыванию воспалительных инфильтратов. Ионы йода, обладая раздражающими свойствами и секретируясь бронхиальными, слюнными железами, увеличивают количество секрета, разжижают мокроту, способствуя выведению воды.
Препараты йода можно разделить на 4 группы:
1. Содержащие элементарный йод ( раствор йода спиртовой, раствор Люголя ).
3. Органические препараты йода, медленно высвобождающие йод ( йодоформ, йодинол ).
4. Органические препараты йода, в молекуле которых йод прочно связан (рентгеноконтрастные вещества).
При местном применении препараты йода уничтожают микроорганизмы и грибы. Йод вызывает денатурацию белка, окисляет органические вещества, оказывает бактерицидное и дезодорирующее действие. Спиртовой раствор йода, в зависимости от концентрации, обладает либо вяжущими, либо раздражающими, либо прижигающими свойствами. Это позволяет использовать его в малых концентрациях как противовоспалительное (при катаральных поражениях слизистой оболочки), в более высоких концентрациях как раздражающее (для отвлекающей терапии) и прижигающее (для остановки кровотечений при ссадинах, ранениях и т.д.) средство.
При длительном применении препаратов йода и повышенной к ним чувствительности могут возникать явления йодизма (насморк. гайморит, фронтит, крапивница, отек Квинке, слезотечение, слюнотечение, кашель, отечность тканей и др.). Для их купирования следует прекратить прием препаратов йода, назначить препараты кальция (уменьшают проницаемость клеточных мембран).
Препараты хлора. Бактерицидный эффект оказывает освобождающийся в водных растворах свободный хлор и хлорноватистая кислота. Атомарный хлор вызывает денатурацию белков в цитоплазме микроорганизмов. Атомарный кислород, образующийся при распаде хлорноватистой кислоты, усиливает бактерицидный эффект. Для препаратов хлора типичны дезодорирующая, инсектицидная и дегазирующая активности. В белковой среде их антибактериальное действие снижается. Следует иметь в виду, что большинство из них вызывает коррозию металлов, обесцвечивает и разрушает ткани.
Наиболее быстро отщепляет свободный хлор хлорная известь (оказывает сильный, но кратковременный эффект). Она состоит из смеси кальция гипохлорида, кальция хлорида и кальция гидроокиси. Применяются только для грубой наружной дезинфекции.
Выраженными антисептическими и дезодорирующими свойствами обладают органические соединения хлора - хлорамин и моналазон динатрий ( пантоцид ). Хлорамин (белый кристаллический порошок со слабым запахом хлора) растворим в воде (лучше горячей), спирте.
№53 Йод
История открытия:
Йод был открыт в 1811 г. парижским фабрикантом селитры, по имени Куртуа в соде, приготовленной из золы прибрежных растений. В 1813 г. Гей-Люссак исследовал новое вещество и дал ему название по фиолетовой окраске паров - иод. Оно произведено от греческого слова - темно-синий, фиалковый. Затем, когда было установлено его сходство с хлором, Дэви предложил именовать элемент иодином (аналогичное хлорином); это название принято в Англии и США до сих пор.
Получение:
Главным источником получения иода в СССР служат подземные буровые воды, которые содержат до 10 - 50 мг/л иода. Соединения иода также имеются в морской воде, но в столь малых количествах, что непосредственное выделение их из воды очень затруднительно. Однако существуют некоторые водоросли, которые накапливают иод в своих тканях. Зола этих водорослей служит сырьем для получения иода. Иод встречается также в виде солей калия - иодата КIO3 и периодата КIO4, сопутствующих залежам нитрата натрия (селитры) в Чили и Боливии.
Йод может быть получен аналогично хлору окислением HI различными окислителями. В промышленности его обычно получают из иодидов, действуя на их растворы хлором. Таким образом, получение иода основано на окислении его ионов, причем в качестве окислителя применяется хлор.
Физические свойства:
Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей. Мало растворим в воде, хорошо во многих органических растворителях.
Химические свойства:
Свободный йод проявляет чрезвычайно высокую химическую активность. Он вступает во взаимодействие почти со всеми простыми веществами. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения йода с металлами.
С водородом реагирует только при достаточно сильном нагревании и не полностью, так как начинает идти обратная реакция - разложение иодоводорода:
H2 + I2 = 2HI - 53,1 кДж
Растворяется в растворах иодидов, образуя неустойчивые комплексы. Со щелочами диспропорционирует, образуя иодиды и гипоиодиты. Азотной кислотой окисляется до иодной кислоты.
Если к желтоватому водному раствора йода добавить сероводородной воды (водный раствор H2S), то жидкость обесцвечивается и становится мутной от выделившейся серы:
H2S + I2 = S + 2HI
В соединениях проявляет степени окисления -1, +1, +3, +5, +7.
Важнейшие соединения:
Йодоводород, газ, очень похож по своим свойствам на хлороводород, но отличается более выраженными восстановительными свойствами. Очень хорошо растворим в воде (425:1), концентрированный раствор йодоводорода дымит вследствие выделения HI, образующего с водяными парами туман.
В водном растворе принадлежит к числу наиболее сильных кислот.
Иодоводород уже при комнатной температуре постепенно окисляется кислородом воздуха, причем под действием света реакция сильно ускоряется:
4HI + O2 = 2I2 + 2H2O
Восстановительные свойства иодоводорода заметно проявляются при взаимодействии с концентрированной серной кислотой, которая при этом восстанавливается до свободной серы или даже до H2S. Поэтому HI невозможно получить действием серной кислоты на иодиды. Обычно иодоводород получают действием воды на соединения иода с фосфором - РI3. Последний подвергается при этом полному гидролизу, образуя фосфористую кислоту и йодоводород:
РI3 + ЗН2О = Н3РО3 + 3HI
Раствор иодоводорода (вплоть до 50%-ной концентрации) можно также получить, пропуская H2S в водную суспензию иода.
Иодиды , соли иодоводородной кислоты. Иодид калия применяют в медицине - в частности, при заболеваниях эндокринной системы, фотореактивы.
Иодноватистая кислота - HOI является амфотерным соединением, у которого основные свойства несколько преобладают над кислотными. Может быть получена в растворе взаимодействием йода с водой
I2 + Н2О = НI + НОI
Иодноватая кислота - НIO3 может быть получена окислением йодной воды хлором:
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
Бесцветные кристаллы, вполне устойчивые при комнатной температуре. Сильная кислота, энергичный окислитель. Соли - иодаты, сильные окислители в кислой среде.
Оксид йода(V) , иодноватый ангидрид, может быть получен при осторожном нагревании НIO3 до 200°С, порошок. При нагревании выше 300°С распадается на иод и кислород, проявляет окислительные свойства, в частности используется для поглощения CO в анализе:
5СО + I2O5 = I2 + 5CO2
Иодная кислота - HIO4 и ее соли (периодаты) хорошо изучены. Сама кислота может быть получена действием НСlO4 на иод: 2НСIО4 + I2=2НIO4 + Сl2
или электролизом раствора НIO3: НIO3+Н2О = Н2 (катод) + НIO4 (анод)
Из раствора иодная кислота выделяется в виде бесцветных кристаллов, имеющих состав НIO4 ·2Н2О. Этот гидрат следует рассматривать как пятиосновную кислоту H5IO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5IO6). Иодная кислота - слабая, но более сильный окислитель, чем НСlO4.
Оксид иода (VII) I2О7 не получен.
Фториды йода, IF5, IF7 - жидкости, гидролизуются водой, фторирующие агенты.
Хлориды йода, ICl, ICl3 - крист. вещества, в растворах хлоридов растворяются с образованием комплексов [ICl2] - и [ICl4] - , иодирующие агенты.
Применение:
Иод широко применяются в химической промышленности (иодидное рафинирование Zr и Ti), для синтеза полуповодниковых материалов.
Иод и его соединения используются в аналитической химии (иодометрия) В медицине в виде так называемой йодной тинктуры (10% раствор иода в этиловом спирте), антисептического и кровоостанавливающего средства. Соединения иода для профилактики (иодирование продуктов) и лечения заболеваний щитовидной железы, там же используются радиоактивные изотопы 125 I, 131 I, 132 I .
Мировое производство (без СССР) - около 10 тыс. т/год (1976).
ПДК около 1 мг/м 3 .
Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой вещества более или менее неустойчивые. Наиболее устойчивы соли кислородных кислот, наименее устойчивы — окислы. Во всех кислородных соединениях галогены проявляют положительную валентность, достигающую семи у высших кислородных соединений хлора и иода.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
В табл. 20 для общей ориентировки приведены формулы окислов и кислот, образуемых хлором, а также названия кислот и соответствующих им солей. В скобки заключены предполагаемые, но не полученные пока соединения.
| Кислоты | |||
| Окислы | формула | название | Название солей |
| Сl2O | HClO | Хлорноватистая | Гипохлориты |
| (Cl2O3) | HClO2 | Хлористая | Хлориты |
| СlO2 | — | — | — |
| (Сl2O3) | HClO3 | Хлорноватая | Хлораты |
| Cl2O7 | HClO4 | Хлорная | Перхлораты |
Все кислородные соединения хлора являются сильными окислителями. Производя окисление, положительно валентные атомы хлора обычно восстанавливаются или до нейтрального хлора или до отрицательно заряженных ионов Сl’. Важное практическое применение имеют соли хлорноватистой и хлорноватой кислот — гипохлориты и хлораты.
Гипохлориты. В основе их получения лежит реакция хлора с водой, приводящая к образованию хлорноватистой кислоты:
Эта реакция представляет собой не что иное, как гидролиз хлора. Можно предполагать, что гидролизу предшествует поляризация ковалентной связи между атомами хлора в. молекуле Сl2, т. е. смещение общей пары электронов в сторону одного из атомов под влиянием полярных молекул воды. Затем положительно зарядившийся атом хлора соединяется с гидроксилом воды, вытесняя протон, и одновременно другой атом хлора превращается в ион [:Сl:] — , как это показано на следующей схеме:
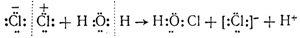
Из схемы видно, что гидролиз хлора является окислительно-восстановительной реакцией, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется:
Сl − e — = Cl (+1)
Cl + e — = C (-1)
Такой процесс, когда одни атомы одного и того же элемента являются окислителями, а другие — восстановителями, называется самоокислением-самовосстановлением.
Получающиеся при гидролизе хлора НСl и НСlO могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается когда прореагирует приблизительно 1 /3растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество соляной и хлорноватистой кислот.
Расщепление ковалентной связи между атомами хлора при его гидролизе имеет иной характер, чем расщепление связи между ними же, происходящее при действии света на хлор и сопровождающееся образованием свободных атомов хлора

расщепление связи расщепление связи при гидролизе при действии света
Первый вид расщепления ковалентной связи называется неоднород-н ы м, а второй — однородным.
Примерами однородного и неоднородного расщепления связи могут также служить термическая диссоциация йодистого водорода при нагревании:
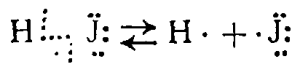
и электролитическая диссоциация иодистого водорода при растворении в воде:
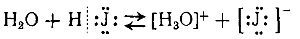
Хлорноватистая кислота НСlO очень неустойчива и в растворе постепенно распадается на хлористый водород и кислород:
По мере разложения хлорноватистой кислоты равновесие приведенной на стр. 324 реакции между хлором и водой смещается вправо и в конце концов весь хлор вступает во взаимодействие с водой, а в растворе остается только НСl. Свет очень ускоряет эту реакцию, поэтому хлорную воду следует всегда хранить в темноте.
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять понемногу щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие реакции гидролиза хлора тоже сдвигается вправо; в результате получается раствор, содержащий соли хлорноватистой и соляной кислот:
HCl + НСlO + 2КОН = КСl + КClO + 2Н2O
Тот же результат, очевидно, получится, если непосредственно пропускать хлор в холодный раствор щелочи: 2КОН + Сl2 = КСl + КСlO + Н2O
или в ионной форме:
Полученная таким путем жидкость, содержащая в растворе смесь солей хлорноватистой и соляной кислот, называется ж а-велевой водой (Javelle — местечко около Парижа, где впервые стали изготовлять эту воду) и применяется для беления; ее белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже под влиянием углекислого газа воздуха, причем выделяется хлорноватистая кислота:
Последняя и действует обесцвечивающим образом на красящие вещества.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор едкого натра. Оба раствора могут быть получены также путем электролиза КCl и NaCl, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами .
При действии хлора на сухую гашеную известь получается так называемая белильная или хлорная известь. Главной составной частью ее является гипохлорит кальция Са(СlO)2, образующийся по реакции
наряду с ним хлорная известь содержит также и другие соли кальция.
Хлорная известь представляет собою белый порошок с резким запахом, обладающий сильными окислительными свойствами. Во влажном воздухе под действием углекислого газа она постепенно разлагается, выделяя хлорноватистую кислоту, чем и обусловливается ее характерный запах:
При действии на хлорную известь соляной кислоты выделяется хлор:
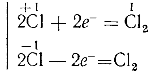
Хлорная известь широко применяется для отбелки растительного волокна (тканей, бумаги), для дезинфекции выгребных ям, отхожих мест, сточных канав и пр. В противохимической обороне хлорная известь играет важную роль как средство дегазации местности, зараженной отравляющими веществами.
В последнее время промышленностью освоено изготовление хлорной извести с очень высоким содержанием активного хлора, состоящей из почти чистого гипохлорита кальция Са(СlO)2. Для ее получения действуют хлором на известковое молоко — смесь гашеной извести с небольшим количеством воды. Образующийся гипохлорит кальция выделяется в виде мелких кристаллов состава Са(СlO )2 • 3Н2О. По окончании реакции осадок отфильтровывают и высушивают. Полученный таким образом технический продукт содержит до 70% активного хлора.
Хлораты представляют собой соли довольно неустойчивой хлорноватой кислоты НСlO3. Общеизвестной и самой важной из этих’солей является хлорат калия КСlO3, или бертолетова соль.
Если нагревать раствор гипохлорита калия, то он утрачивает свои белящие свойства. Это происходит вследствие разложения КСlO с образованием бертолетовой соли по следующему уравнению:
3КСlO = КСlO3 + 2КСl
или в ионной форме
При этой реакции 2 /3 атомов хлора, входящих в состав ионов СlO’ и имеющих валентность +1, превращается в ионы Сl’, т. е. восстанавливается, в то время как 1 /3 тех же атомов из валент ного состояния +1 переходит в валентное состояние +5, т. е. окисляется.
Если пропускать хлор в горячий раствор едкого кали, то вместо КСlO сразу получается КСlO3:
При этом 1 /6 часть атомов хлора окисляется до ионов СlO3‘, а 5 /6 восстанавливаются до ионов Сl’.
Так как бертолетова соль трудно растворима в холодной воде, то при охлаждении раствора она выпадает в виде кристаллов и таким образом отделяется от остающегося в растворе хлористого калия.
При нагревании бертолетова соль легко разлагается с выделением кислорода:
С различными горючими веществами (серой, углем, фосфор ром) бертолетова соль образует смеси, сильно взрывающие при ударе. На этом основано ее применение в артиллерийском деле для устройства запалов. Бертолетова соль употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главнейшим же потребителем бертолетовой соли является спичечная промышленность. В головке обычной спички содержится около 50% бертолетовой соли.
Соответствующая бертолетовой соли хлорноватая кислота НСlO3 известна только в виде водного раствора, который может быть сгущен выпариванием до концентрации в 50%. Хлорноватая кислота действует как сильный окислитель. Структурная формула хлорноватой кислоты:
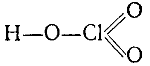
Ангидрид хлорноватой кислоты неизвестен. Вместо него при разложении хлорноватой кислоты, например при действии концентрированной серной .кислоты на бертолетову соль, выделяется желто-бурый газ с характерным запахом — двуокись хлора СlO2. Двуокись хлора очень неустойчива и легко разлагается со взрывом на хлор и кислород от нагревания, соприкосновения с органическими веществами и т. п. Смесь бертолетовой соли с сахаром воспламеняется при смачивании ее каплей серной кислоты, так как выделяющаяся двуокись хлора является сильным окислителем.
При осторожном нагревании в отсутствие катализатора бертолетова соль частично разлагается с выделением кислорода частично же переходит в соль хлорной кислоты — перхлорат калия КСlO4:
Перхлораты — более прочные соединения, чем хлораты. Действуя на перхлорат калия серной кислотой, можно получить свободную хлорную кислоту HClO4, которая в чистом виде представляет собой бесцветную жидкость, замерзающую при —112°.
Хлорная кислота HClO4 наиболее устойчивая из кислородных кислот хлора. В то же время она самая сильная из всех известных кислот: ее кажущаяся степень диссоциации в 0,5 н. растворе равна 88%, т. е. больше, чем кажущаяся степень диссоциация соляной кислоты при тех же условиях. Окислительные свойства у хлорной кислоты выражены слабее, чем у хлорноватой.
Строение хлорной кислоты выражается формулой
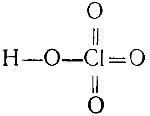
Если нагревать хлорную кислоту с фосфорным ангидридом, отнимающим от нее воду, то образуется хлорный ангидрид:
Хлорный ангидрид — маслянистая жидкость, кипящая при 83°; сильно взрывает при ударе.
Сопоставление свойств важнейших кислородных соединений хлора позволяет сделать следующий общий вывод:С увеличением валентности хлора растет устойчивость его кислородных кислот, и их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота. Наоборот, сила кислородных кислот хлора увеличивается с увеличением валентности последнего. Наиболее слабой является хлорноватистая кислота (константа ее диссоциации около 10 -8 ), наиболее сильной — хлорная кислота.
Кислородные соединения фтора. Наиболее изученным соединением
фтора с кислородом является окись фтора, или фтористый кислород OF2, впервые полученный только в 1927; г. Это — бесцветный газ, сгущающийся в жидкость при —145°, очень ядовитый, малорастворимый в воде.
Фтористый кислород получается при действии фтора на 2%-ный раствор щелочи:
По всем признакам (низкая температура кипения, плохая растворимость в воде) фтористый кислород представляет собой соединение, в котором связи фтора с кислородом ковалентны. Строение его может быть изображено так:

Так как металлоидные свойства выражены у фтора сильнее, чем у кислорода, то следует считать, что во фтористом кислороде фтор отрицательно одновалентен, а кислород положительно двухвалентен.
Кислородные соединения брома и йода
Из кислородных соединений брома известны бромноватистая НВrО и бромноватая НВrО3 кислоты и их соли, которые получаются аналогично соответствующим соединениям хлора, но отличаются меньшей устойчивостью. Бромная кислота и ее соли неизвестны. Окислы брома очень неустойчивые соединения, существующие только при низких температурах.
Иод образует высший окисел J2O5 — йодноватый ангидрид, которому соответствует йодноватая кислота HJO3. Натриевая соль этой кислоты встречается как примесь к чилийской селитре. Калиевую соль можно получить тем же способом, что и бертолетову соль, действуя иодом на горячий раствор щелочи.
Свободная йодноватая кислота получается окислением иода в присутствии воды. Если в качестве окислителя взять хлор, то реакция идет по следующему уравнению:
Йодноватая кислота представляет собой кристаллическое вещество, вполне устойчивое при обычной температуре. При нагревании до 200° йодноватая кислота теряет элементы воды и переходит в твердый йодноватый ангидрид:
Выше 300° йодноватый ангидрид, в свою очередь, распадается на иод и кислород.
Кроме йодноватой кислоты, известна еще йодная кислота HJO4, которая может быть получена действием иода на НСlO4:
При выпаривании раствора HJO4 получаются бесцветные кристаллы, имеющие состав HJO4 x 2H2O и плавящиеся при 130°. Этот кристаллогидрат следует, однако, рассматривать как новую пятиосновную кислоту H5JO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5JO6).
Йодный ангидрид J2O7 не получен.
Вы читаете, статья на тему Кислородные соединения галогенов
СОСТАВ И ФОРМА ВЫПУСКА
Препарат йод однохлористый представляет собой однородную жидкость оранжево-желтого цвета, содержащую однохлористый йод и соляную кислоту. В воде и глицериноподобных растворителях типа триэтилен гликоль растворяется в любых соотношениях. На воздухе дымит. Выпускают в герметично закрытых стеклянных бутылках или банках, флаконах и другой стеклянной или полимерной таре, обеспечивающей сохранность продукции, вместимостью 0,5 — 20 л.
Йод однохлористый, как и все йодхлорсодержащие препараты, в оптимальных концентрациях обладает антисептическими, санирующими свойствами. Активен против бактерий (в т. ч. микобактерий), грибов, вирусов, яиц ряда гельминтов, спор и ооцист кокцидий.
Йод однохлористый назначают для влажной дезинфекции, дезинвазии поверхностей животноводческих, птицеводческих помещений и всего оборудования в них, холодильных камер, обеззараживания скорлупы яиц, а также для аэрозольной дезинфекции воздуха животноводческих и птицеводческих помещений, лечения животных, пораженных стригущим лишаем и преддоильной обработки вымени коров.
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
Влажную дезинфекцию, дезинвазию помещений и других объектов проводят водными растворами однохлористого йода, приготовленными непосредственно перед обработкой.
При сибирской язве 10% раствором однохлористого йода из расчета 1 л/м². Раствор наносят двукратно по 0,5 л/м² с интервалом 15-25 минут. Экспозиция 3 часа.
При отрицательных температурах (до минус 40 °С) указанные растворы наносят на поверхность дробно в три приема по 0,3-0,4 л/м². Перед каждым нанесением дезинфицирующего раствора, поверхность предварительно обрабатывают горячей водой (70 °С) или насыщенным (15-20%) раствором поваренной соли из расчета 0,5 л/м². Экспозиция после последнего нанесения дезраствора 3 часа.
При инфекционном атрофическом рините, роже свиней, вирусном гепатите утят, ящуре (текущая дезинфекция) 5% раствором однохлористого йода однократно из расчета 0,5 л/м² с интервалом 1 час. Экспозиция во всех случаях 6 часов.
При инфекционной энтеротоксемии и брадзоте овец, туберкулезе животных и птиц 10% раствором однохлористого йода, подогретым до 45-50 °С, двукратно с интервалом 1 час по 0,5 л/м². Экспозиция после второго орошения 3 часа.
При респираторном микоплазмозе птиц и сальмонеллезах 3% раствором однохлористого йода из расчета 1 л/м². Экспозиция 1 час.
При кокцидиозе кроликов и птиц 10% раствором однохлористого йода подогретым до 70 °С однократно из расчета 1 л/м². Экспозиция 5 часов.
При параскаридозе лошадей и аскаридозе свиней 5% раствором однохлористого йода, подогретым до 70 °С, из расчета 1 л/м². Экспозиция 5 часов.
При стронгилятозах и стронгилоидозах 3% раствором однохлористого йода из расчета 1 л/м². Экспозиция 1 час.
При заразных болезнях гусениц тутового шелкопряда (мертвенность, чахлость, септицемия, желтуха) помещения для выкормки гусениц (червоводни), инкубационные залы, листохранилища и находящееся в них оборудование за 6 дней до закладки грены шелкопряда, а также после окончания выкормки гусениц и освобождения червоводен от коконов, 10% раствором однохлористого йода из расчета 1 л/м². Экспозиция 9 часов.
Для предотвращения коррозийного действия целесообразно проводить дезинфекцию металлического оборудования (отдельно от поверхностей помещений) однохлористым йодом, растворенным в триэтиленгликоле в соотношении 1:9 (к одной части препарата добавляют 9 частей триэтиленгликоля) и тщательно перемешивают. Полученный таким образом 10% раствор маслянистой консистенции сокращенно именуется . Аэрозольную дезинфекцию воздуха помещений при возникновении респираторных заболеваний животных (птиц) проводят одним из способов, приведенных ниже. Путем распыления 30% водного раствора Охлосана-Р (содержащего 3% однохлористого йода), аэрозольными аппаратами, дающими величину частиц 0,5-20 мкм, из расчета 1,2 мл/м². Проводят 10-12 распылений в четыре цикла — по 2-3 дня подряд каждый цикл с интервалом между ними 2-3 дня. Экспозиция после каждого распыления 25-30 минут. На время распыления и экспозиции помещение плотно закрывают, вентиляцию отключают. Путем экзотермической возгонки паров йодалюминия и хлоралюминия, получаемых от соединения однохлористого йода с алюминием (стружкой, порошком, кусочками алюминиевой проволоки или выбракованной посуды и прочих алюминиевых изделий). Для этого берут стеклянные или эмалированные емкости не менее 2-3 литров (одна емкость на 400-500 м³) и расставляют или развешивают равномерно (на ровном расстоянии одна от другой и от стен обрабатываемого помещения) на высоте 1-1,5 м и заполняют их однохлористым йодом из расчета 3 мл/м³, в который опускают алюминий из расчета 50 г на 1 л препарата. Экзотермическая реакция начинается через 1-2 минуты и продолжается 5-10 минут, в зависимости от чистоты алюминия и температуры препарата. Экспозиция от начала паровыделительной реакции 35-37 минут. На время экспозиции помещение плотно закрывают, вентиляцию отключают. Дезинфекция парами экзотермической реакции проводится 3-4 раза с интервалом 3 дня. Для исключения бурного вспенивания, разбрызгивания и возможного выброса из емкости препарата в процессе химической реакции и для более полного выделения йода целесообразно использовать смесь однохлористого йода с триэтиленгликолем в соотношении 9 : 1, сокращенно именуемую . После окончания каждой аэрозольной обработки помещение проветривают — открывают двери, окна, вентиляционные люки и включают вентиляцию. Обеззараживание яиц, поверхностно инфицированных возбудителями пастереллеза птиц, проводят путем их погружения в 4% водный раствор однохлористого йода на 15 минут с последующим обсушиванием на воздухе. Для лечения животных, больных стригущим лишаем, пораженные участки кожи обрабатывают 10% водным раствором однохлористого йода или раствором Охлосан-Р, хорошо проникающим благодаря маслянистой консистенции в пораженную огрубевшую кожу. Препарат наносят на пораженные участки кожи небольшими порциями и щеткой или ватно-марлевым тампоном тщательно втирают в кожу в местах поражения и вокруг них. В свежих случаях достаточно 1-2-кратной обработки с интервалом 20-30 минут. В запущенных случаях при наличии твердых корочек, обработку проводят 3-5 раз в день в течение 3 дней. При этом раствор втирают с особой тщательностью, чтобы обеспечить его проникновение в толщу корочек, под корочки и волосяные луковицы. Обработку животных против стригущего лишая следует проводить на открытом воздухе или хорошо вентилируемом помещении. Для обработки каждого животного используют новый тампон, а щетки периодически очищают от загрязнений, промывая водой, и обеззараживают путем погружения на 10-15 минут в отдельную емкость с 10% раствором однохлористого йода. Для преддоильной обработки вымени коров применяют 0,5% раствор однохлористого йода или 5% водный раствор Охлосана-Р. Контроль качества дезинфекции осуществляют в соответствии с методикой, изложенной в действующей Инструкции по проведению ветеринарной дезинфекции, дезинвазии, дезинсекции и дератизации.
Следует учитывать, что пары концентрированного (неразведенного) препарата вызывают сильное раздражение слизистых оболочек дыхательных путей и глаз, при длительном воздействии паров — катар верхних дыхательных путей, конъюнктивит, помутнение роговицы глаз. При сильном воздействии на кожу препарат вызывает ожоги и изъязвления.
Не допускать завышения предельно-допустимой концентрации паров препарата в воздухе рабочей зоны (контроль по хлористому водороду) 5 мг/м³.
Йод однохлористый, как и все йод-хлорсодержащие препараты, в оптимальных концентрациях обладает антисептическими, санирующими свойствами. Активен против бактерий (в т. ч. микобактерий), грибов, вирусов, яиц ряда гельминтов, спор и ооцист кокцидий.
В плотно закрытой заводской упаковке в складских помещениях, защищенных от прямых солнечных лучей при температуре окружающей среды. Срок годности — 2 года.
Завод Ветеринарные препараты ОАО, Россия
Товары для животных:
Разделы каталога:
Подпишись на новости
ветаптеки VETLEK!
Читайте также:

