Смесь алюминия и магния с хлором
Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
Необходимые теоретические сведения.
- Массовая доля компонента в смеси — отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
- С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это +2.
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| NO2 | NO | N2O | N2 | NH4NO3 |
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. кислота | Неактивные металлы (правее железа) + разб. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления | Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют: Al, Cr, Fe, Be, Co. | ||||
| Не реагируют с азотной кислотой ни при какой концентрации: Au, Pt, Pd. | ||||
| SO2 | S | H2S | H2 | |
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. кислота | Щелочноземельные металлы + конц. кислота | Щелочные металлы и цинк + концентрированная кислота. | Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная) | |
| Пассивация: с холодной концентрированной серной кислотой не реагируют: Al, Cr, Fe, Be, Co. | ||||
| Не реагируют с серной кислотой ни при какой концентрации: Au, Pt, Pd. | ||||
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы (Li, Na, K, Rb, Cs), а также металлы IIA группы: Са, Sr, Ba. При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
- Находим количество водорода:
n = V / Vm = 5,6 / 22,4 = 0,25 моль. - По уравнению реакции:
| 0,25 | 0,25 | |
| Fe + | 2HCl = FeCl2 + | H2 |
| 1 моль | 1 моль |
Количество железа тоже 0,25 моль. Можно найти его массу:
mFe = 0,25 • 56 = 14 г.
Теперь можно рассчитать массовые доли металлов в смеси:
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за х — число моль одного из металлов, а за у — количество вещества второго.
- Находим количество водорода:
n = V / Vm = 8,96 / 22,4 = 0,4 моль. - Пусть количество алюминия — х моль, а железа у моль. Тогда можно выразить через х и у количество выделившегося водорода:
| x | 1,5x (мольное соотношение Al:Н2 = 2:3) | |
| 2Al | + 6HCl = 2AlCl3 + | 3H2 |
| y | y | |
| Fe | + 2HCl = FeCl2 + | H2 |
| < | 1,5x + y = 0,4 |
| 27x + 56y = 11 |
Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:
27х + 18у = 7,2
и вычитая первое уравнение из второго:
соответственно,
ωAl = 100% − 50,91% = 49,09%
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
- С концентрированной серной кислотой реагирует только медь, число моль газа:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 моль
| 0,25 | 0,25 | |
| Cu + | 2H2SO4 (конц.) = CuSO4 + | SO2 + 2H2O |
(не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)
Так как мольное соотношение меди и сернистого газа 1:1, то меди тоже 0,25 моль.
Можно найти массу меди:
mCu = n • M = 0,25 • 64 = 16 г.
В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
| Al 0 − 3e = Al 3+ | | | 2 |
| 2H + + 2e = H2 | 3 |
- Определяем количество вещества газа:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 моль. - Определяем массу раствора азотной кислоты, массу и количество вещества растворенной HNO3:
Обратите внимание, что так как металлы полностью растворились, значит — кислоты точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не оказалась ли кислота в избытке, и сколько ее осталось после реакции в полученном растворе. Составляем уравнения реакций (не забудьте про электронный баланс) и, для удобства расчетов, принимаем за 5х — количество цинка, а за 10у — количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится х моль, а во второй — 3у моль:
| 5x | x | ||
| 5Zn | + 12HNO3 = 5Zn(NO3)2 + | N2 | + 6H2O |
| Zn 0 − 2e = Zn 2+ | | | 5 |
| 2N +5 + 10e = N2 | 1 |
| 10y | 3y | ||
| 10Al | + 36HNO3 = 10Al(NO3)3 + | 3N2 | + 18H2O |
| Al 0 − 3e = Al 3+ | | | 10 |
| 2N +5 + 10e = N2 | 3 |
| < | х + 3у = 0,13 (количество азота) |
| 65 • 5х + 27 • 10у = 21,1 (масса смеси двух металлов) |
Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
Проверим массу смеси:
0,2 • 65 + 0,3 • 27 = 21,1 г.
Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
| 0,2 | 0,48 | 0,2 | 0,03 | |
| 5Zn | + 12HNO3 = | 5Zn(NO3)2 | + N2 + | 6H2O |
| 0,3 | 1,08 | 0,3 | 0,09 | |
| 10Al | + 36HNO3 = | 10Al(NO3)3 | + 3N2 + | 18H2O |
| Масса нового раствора | = | Сумма масс смешиваемых растворов и/или веществ | - | Масса осадков | - | Масса газов |
Тогда для нашей задачи:
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт NO2, а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
Выберите книгу со скидкой:

Биология желания. Зависимость — не болезнь
350 руб. 240.00 руб.

Биология. Большой сборник тренировочных вариантов проверочных работ для подготовки к ВПР. 5 класс
350 руб. 189.00 руб.

ОГЭ-2020. Биология (60х90/16) 10 тренировочных вариантов экзаменационных работ для подготовки к основному государственному экзамену
350 руб. 98.00 руб.

ОГЭ. Биология в таблицах и схемах. Справочное пособие для подготовки к ОГЭ
350 руб. 77.00 руб.

Биология добра и зла. Как наука объясняет наши поступки +
350 руб. 1140.00 руб.

Биология. Для тех, кто хочет все успеть
350 руб. 154.00 руб.

Биология. Обязательные понятия, термины школьного курса
350 руб. 74.00 руб.

Математика. Новый полный справочник школьника для подготовки к ЕГЭ
350 руб. 222.00 руб.

Дошкольная педагогика с основами методик воспитания и обучения. Учебник для вузов. Стандарт третьего поколения. 2-е изд.
350 руб. 963.00 руб.

Считаю и решаю: для детей 5-6 лет. Ч. 1, 2-е изд., испр. и перераб.
350 руб. 169.00 руб.

Начинаю считать: для детей 4-5 лет. Ч. 1, 2-е изд., испр. и перераб.
350 руб. 169.00 руб.

Считаю и решаю: для детей 5-6 лет. Ч. 2, 2-е изд., испр. и перераб.
350 руб. 169.00 руб.
БОЛЕЕ 58 000 КНИГ И ШИРОКИЙ ВЫБОР КАНЦТОВАРОВ! ИНФОЛАВКА



- Все материалы
- Статьи
- Научные работы
- Видеоуроки
- Презентации
- Конспекты
- Тесты
- Рабочие программы
- Другие методич. материалы
- Гиниатуллина Лариса РинатовнаНаписать 8904 05.01.2017
Номер материала: ДБ-067855
- Химия
- 11 класс
- Другие методич. материалы
Добавляйте авторские материалы и получите призы от Инфоурок
Еженедельный призовой фонд 100 000 Р
-
05.01.2017 278
-
05.01.2017 5635
-
05.01.2017 507
-
05.01.2017 1174
-
05.01.2017 1581
-
05.01.2017 865
-
05.01.2017 1094
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
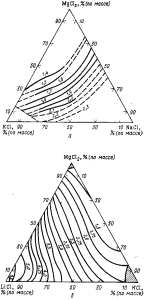
Электропроводимость — одно из важнейших свойств электролита, которое оказывает существенное влияние на показатели работы магниевого электролизера. Повышение электропроводимости электролита позволяет увеличить плотность тока и междуполюсное расстояние а, следовательно, интенсифицировать процесс электролиза без увеличения удельного расхода электроэнергии.
Рис. 87. Изотермы удельной электропроводимости расплавов при 700 °С (цифры у кривых — электропроводимость, 0,1 См/м: а —система КCl—NaCl—MgCl2; б —система LiCl— KCl-MgCl
Величины удельной электропроводимости индивидуальных солей при температурах немного выше точек их плавления приведены ранее. Наиболее высокие величины удельной электропроводимости имеют расплавлен ный NaCl и LiCl и наименьшую MgCl. Поэтому целесообразно для повышения электропроводимости иметь электролиты с высокими концентрациями NaCl и LiCl. С повышением температуры проводимость хлоридных расплавов увеличивается. На рис. 87 показано изменение удельной электропроводимости расплавов тройной системы КCl—NaCl—MgCl2 и LiCl—КCl—MgCl2 соответственно в зависимости от состава при 700°С. Максимальной электропроводимостью обладают расплавы тройной системы LiCl—КCl—MgCl2, содержащие более 60% LiCl и 10—20% MgCl2. Электропроводимость таких расплавов при 700 °С равна (4,2÷5,3) · 10 -2 См/м. Применяемые в магниевой промышленности электролиты при этой температуре имеют электропроводимость порядка (1,7÷2,2) ·10 -2 См/м. Отсюда следует, что применение «солей лития может дать существенный экономический эффект за счет интенсификации электролиза.
При изучении механизма переноса тока в расплавах системы КCl—MgCl2 было показано, что концентрация ионов магния возрастает у анода и убывает у катода, а концентрация ионов калия убывает у анода и увеличивается у катода. Данные о числах переноса ионов в расплавах системы КCl—MgCl2 приведены в табл. 18.
Таблица 18. Числа переноса ионов в расплаве системы KCl—MgCl2
Ток к катоду переносится ионами калия и магния. С повышением концентрации КCl в расплаве доля тока, переносимая ионами магния, уменьшается. При концентрации MgCl2 меньше 28% (мол.) весь ток к катоду в основном переносится ионами калия.
Строение расплавов хлоридов щелочных металлов и хлорида магния
Электролиты магниевых ванн, которые состоят в основном из смеси расплавленных хлоридов калия и натрия с добавками хлорида магния, относятся к классу ионных жидкостей. В них находятся преимущественно отдельные ионы, хотя могут присутствовать также ион-но-ассоциированные группы и ионные пары.
Основными силами взаимодействия между частицами в таких расплавах являются электростатические: ион-ионные, ион-дипольные, диполь-дипольные.
В настоящее время еще не разработана до конца теория строения расплавленных солей, которая могла бы однозначно ответить на вопрос: из каких структурных частиц состоит тот или иной расплав, как происходит взаимодействие между отдельными частицами, какие изменения произойдут в расплаве при введении в него другой соли. Наибольшее признание получили две модели строения ионных расплавов: первая квазирешеточная, вторая — аутокомплексная. Согласно первой, ионный расплав рассматривается как несовершенный кристалл, в котором возможны различного рода дефекты: межузловое размещение ионов, образование свободных вакансий и т. д. Сравнение значений тепло-емкостей для одной и той же соли, находящейся в жидком и твердом состоянии вблизи ее точки плавления, показывает, что при плавлении теплоемкость увеличивается не более чем на 10%:
Теплоемкость соли, Дж/(моль·К):
твердой…… 84,0 155,7 262,9
жидкой…… 92,4 168,0 283,8
Исследования ионных расплавов с помощью рентгеновских лучей указывают на то, что при плавлении в этих расплавах сохраняется ближний порядок расположения частиц твердого кристалла и уменьшаются межионные расстояния. Полученные экспериментальные данные позволяют рассматривать ионные расплавы, особенно при температурах, близких к температурам их плавления, как жидкости, у которых сохранились основные элементы строения твердого кристалла, но имеющего большое число дефектов (вакансий).
Другая, аутокомплексная модель (М. В. Смирнов) представляет расплав как раствор вещества в себе самом. Согласно этой модели, часть катионов в расплавах галогенидов солей щелочных металлов являются центрами комплексов, в которые входят все галоген-ионы, а остальные катионы образуют вторую, более подвижную координационную сферу. Структура расплавов галогенидов щелочных металлов представляется в видеМеХ 3 4 — +Ме + +пустоты, где Ме + — Ионы щелочных металлов. Обычно принимается, что первое координационное число 4, хотя предполагается, что оно может иметь и другие значения. Эта модель строения ионного расплава удобна для объяснения его транспортных свойств: коэффициентов диффузии, электропроводимости и др.
Точных данных о строении расплавленного MgCl 2H его смесей с хлоридами других щелочных металлов нет. Предложенные в последнее время представления о структуре хлормагниевых расплавов в основном базируются на вышеприведенных моделях строения ионных расплавов и изученных физико-химических свойствах этих расплавов. Кристаллический MgCl2 имеет слоистую решетку. Предполагается, что MgCl2 в расплавленном состоянии в значительной мере сохраняет структурную упорядоченность, характерную для его кристаллической решетки в твердом состоянии. Диссоциация, возможно, протекает по следующей схеме:
MgCl2 ⇄ MgCl + + Cl — ⇄ Mg 2+ + 2Сl — .
Для системы MgCl2 с хлоридами других металлов, где при изучении диаграмм состояния установлено наличие химических соединений в твердом состоянии, предполагается, что и в расплавленном состоянии будут существовать соответствующие сложные комплексные ионы. Эти предположения подтверждаются данными, полученными при исследовании плотности, вязкости, поверхностного натяжения, электропроводимости, летучести, чисел переноса и других физико-химических свойств сложных расплавов. Так, было установлено нарушение монотонности хода кривых состав — свойство для расплавов КСl—MgCl2 и NaCl—MgCl2 в области экви-мольных составов. Отсюда можно предположить, что при расплавлении химические соединения KMgCl3 и NaMgCU диссоциируют по следующей схеме:
KMgCl3⇄ K + + MgCl3 — ⇄ K + + MgCl + + 2Сl — ⇄ K + + Mg 2+ + 3Cl — ,
NaMgCl3 ⇄ Na + + MgCl3 — + Na+ + MgCl + + 2Cl — ⇄ Na+ + Mg 2+ + 3Cl — .
В расплавах данного состава ток переносится как ионами калия (натрия), так и ионами магния. По мере повышения содержания в расплаве КCl и NaCl доля тока, переносимая ионами магния, уменьшается, они связываются в малоподвижные комплексные анионы, и вероятная схема диссоциации уже будет такой:
K2MgCl4 ⇄ 2К + + MgCl4 2- ⇄ 2К + + MgCl3 — + Cl — .
аналогично и для NaCl. Очевидно, при введении в расплав MgCl2 хлорида щелочного металла часть ионов Mg 2+ будут замещаться ионами другого металла. Это приведет к усилению связи между ионами магния и хлора и, как следствие, к образованию комплексных ионов.
Прочность комплексов определяется концентрацией щелочного металла и радиусом его иона: чем больше радиус иона щелочного металла, тем сильнее комплексо-образование в расплаве. Радиус Na + меньше радиуса К + , поэтому при равных концентрациях MgCl2 активность MgCl2 в расплаве КCl—MgCl2 значительно мень ше, чем в расплаве NaCl—MgCl2. В системе RbCl— MgCl2 отрицательные отклонения от идеального состояния еще больше, чем в системе КCl—MgCl2, так как радиус Rb + больше радиуса К + . В хлоридных расплавах, содержащих Mg + и Rb + , комплексы магния будут еще прочнее, чем в расплавах КCl—MgCl2.
Таким образом, наличие ионов магния (Mg 2+ , Mg + ) или его различных комплексных ионов (MgO 2 4 — , MgCl3 — MgCl + ) и их строение в хлормагниевых расплавах будет определяться силами сложного взаимодействия между отдельными частицами. На характер этих междуионных взаимодействий будет оказывать влияние химический состав расплава, концентрация отдельных компонентов в нем и температура.
Растворимость магния и хлора в электролите
В значительной мере потери магния в процессе электролиза хлоридных расплавов определяются взаимодействием металла с компонентами электролита. До сих пор нет единой точки зрения на механизм процесса растворения металлов в расплавленных солях, содержащих ионы этих же металлов. Большинство исследователей придерживаются мнения, что магний в хлоридных расплавах, содержащих MgCl2, растворяется за счет образования ионов низшей степени окисления.
Mg 2+ ⇄ Mg ⇄ 2Mg + , Mg 2+ + Mg ⇄ Mg2 2 + .
Между магнием и его ионами в расплаве устанавливается равновесие. Сдвиг равновесия в ту или другую сторону и стабильная степень окисления ионов в расплаве зависит от строения внешних 1 оболочек атомов изучаемого металла. Для магния это равновесие сдвинуто влево и устойчивыми в расплаве являются ионы с высшей степенью окисления. Установлено, что значение средней степени окисления ионов магния в расплавах КCl—NaCl—MgCl2 при 720—750°С составляет около 1,98—1,94.
Не исключается возможность растворения магния в расплавленных солях и в виде атомов с образованием истинного атомно-молекулярного раствора Mg—Mg°. Растворимость магния в жидком MgCl2 и в хлормагниевых расплавах при 700—850°С сравнительно невелика (табл. 19).
Таблица 19. Значения растворимости магния в хлоридных расплавах
| Состав расплава, % мол. | Температура, К | Растворимость магния на 1 моль расплава, г | ||
| MgCl2 | NaCl | KCl | ||
| 100 | 1023 | 10,2·10 -2 | ||
| 100 | — | 1073 | 11,5·10 -2 | |
| 100 | — | — | 1123 | 12,5·10 -2 |
| 10,76 | 52,6 | 36,64 | 973 | 1,8·10 -2 |
| 10,76 | 52,6 | 36,64 | 1023 | 2,2·10 -2 |
| 10,76 | 52,6 | 36,64 | 1073 | 2,5·10 -2 |
| 11,48 | 24,96 | 63,56 | 973 | 1,5·10 -2 |
| 11,48 | 24,96 | 63,56 | 1023 | 1,7·10 -2 |
| 11,48 | 24,96 | 63,56 | 1073 | 2,0·10 -2 |
Из приведенной таблицы видно, что повышение температуры расплава увеличивает растворимость магния. При добавлении к расплавленному MgCl2 хлоридов щелочных (LiCl, КCl, NaCl) и щелочно-земельных (СаСl2, ВаСl2) металлов растворимость магния в расплаве падает. Наиболее сильно на растворимости магния сказываются добавки КCl и в меньшей степени — NaCl и LiCl. Это связано с понижением активности MgCl2 при добавлении КCl в расплав в большей степени, чем при добавлении NaCl и LiCl.
Потери магния также связаны с растворимостью хлора, выделяющегося на аноде, и с его диффузией в объем электролита. Вопрос о механизме растворения хлора в хлоридных расплавах пока остается дискуссионным. Эндотермический характер процесса растворения хлора в хлоридных расплавах и его малая растворимость говорят о физическом механизме растворения, аналогичном растворимости инертных газов в расплавах.
С другой стороны, результаты измерения показывают, что зависимость растворимости хлора в хлоридных расплавах системы NaCl—KCl от состава лишь незначительно отклоняется от линейной, а для систем KCl—MgCl2 и NaCl—MgCl2 эти отклонения велики, особенно в случае расплавов, содержащих KCl. Это, по-видимому, связано с тем, что растворение хлора в хло-ридных расплавах возможно также и за счет сольвата-ционного взаимодействия молекул газообразного хлора с хлор-ионами по реакции Сl2+Сl — ⇄ Сl3 —
В системах, содержащих MgCl2, отклонения от линейной зависимости растворимости хлора от состава связано с образованием комплексных ионов, что ведет к уменьшению концентрации свободных ионов Сl — в расплаве. Равновесие вышеприведенной реакции сдвигается влево, уменьшая общую растворимость хлора. Косвенным подтверждением существования этой равновесной реакции является изменение окраски хлоридных расплавов при растворении в них хлора.
Растворимость хлора в чистом MgCl2 в интервале температур 750—900° С составляет около 0,6·10 -6 моль/см 3 . Растворимость хлора в хлоридных расплавах растет с температурой, и эта зависимость описывается уравнением lgC·7=A—В/Т, где Т — абсолютная температура; А и В — эмпирические константы.
В расплавленных смесях хлоридов щелочных металлов и магния растворенные молекулы хлора не диссоциируют, так как растворимость хлора прямо пропорциональна парциальному давлению хлора над расплавом, т. е. подчиняется закону Генри.
Статья на тему Электропроводимость перенос ионов магния
Читайте также:

