Случай из практики острый лейкоз


После косметической процедуры у меня возникли осложнения, которые сопровождались отеком и температурой — я выглядела ужасно. Нужно было сдать анализы, чтобы установить причину. Анализ крови показал 50% бластов. Я не поверила и сдала кровь еще раз, но результаты оказались такими же. На следующий день мы с мужем поехали в Симферополь, в крупную клинику, где врачи и диагностировали мне лейкоз.
У нас в Феодосии небольшая гостиница, и, оказавшись в больнице, я старалась продолжать вести дела по телефону. Моя дочь в то время сдавала ЕГЭ и прошла весь путь самостоятельно — ни я, ни муж, не могли быть с ней рядом. Мне пришлось пропустить ее выпускной вечер в школе. Я была настроена бороться, но тогда я совсем не представляла, что меня ждет.

Я знала, что лейкоз лечится и опускать руки нельзя. Мне начали химиотерапию: первый курс, второй, третий… Но все без толку. Перед четвертым курсом химии, после разговора с врачом, я поняла — шансов нет. Они ничем не могли мне помочь — лейкоз не поддавался лечению.
Четвертый курс химии чудом избавил меня от бластов, и через несколько дней после него мне сделали пересадку костного мозга, несмотря на остаточную пневмонию. Однако, все проходило под пристальным контролем микробиолога. Донором стал мой брат — он подошел мне на 100% и это было, по‑настоящему, чудом.

В течение полугода муж был со мной рядом целыми днями. В Крыму у нас был бизнес и муж оставил все, чтобы помогать мне. Дело без него не выжило и пришлось все закрыть — ему было совершенно все равно. Главное — быть вместе.
Пока я лежала под капельницами, он приходил рано утром и уходил поздно вечером, когда я засыпала. Целыми днями он держал меня за руку. Я не могла быть одна — у меня начинались жуткие панические атаки. Мой муж — самый родной и близкий человек. Я знала, что если мне и суждено умереть, то я хочу умирать только рядом с ним — только так мне не будет больно и страшно.

Наша дочка Вика тоже жила в Москве, в съемной квартире. Моя болезнь совпала с ее поступлением в ВУЗ. Мы боялись ее отпускать одну в чужой город, но, когда стало ясно, что мне самой придется лечиться в Москве, то вопрос решился сам собой. Муж разрывался между мной и Викой — ей тоже нужно было помогать, и он каким-то образом успевал везде.
Перед Новым Годом меня выписали и перевели в дневной стационар — мы сняли квартиру неподалеку. Этот праздник Нового Года мы встречали с мужем и дочкой, смотрели в окно на московский салют, и мне больше ничего не было нужно. Это был праздник счастья и целостности семьи. Ни один Новый Год я не встречала вот так — в полной гармонии с собой и миром.
Мне нужно было провести под контролем специалистов в Москве три месяца. В это время началось активное распространение короновируса. Было страшно. Я выходила только в маске, перчатках, обрабатывала руки антисептиками. Когда мы вернулись домой, где эпидемиологическая ситуации в несколько раз лучше, чем в Москве, я все равно соблюдала все правила. Мы изолировались — ни с кем не встречались и никуда не ходили.

После того, что я пережила в течение года в больнице, необходимость переждать этот карантин мне совершенно не страшна. Наверное, только люди после тяжелых болезней могут серьезно относиться к таким вещам. Все будет — и друзья, и магазины, и рестораны, но чуть позже. Сейчас нужно перетерпеть, чтобы после жить дальше.
Сейчас я дома, и прохожу контрольный курс противоопухолевого препарата. Так как моя болезнь долго не поддавалась лечению, то необходимо закрепить ремиссию. Сколько будет длиться терапия — никто не знает. Врачи из НМИЦ Гематологии держат мое состояние под контролем.
Единственное, что у меня отобрала болезнь — это покой. Тревога о том, что я могу умереть, никуда не уходит. Но эта тревога формирует собственную ответственность за жизнь. Если нужно ходить в маске — я буду в маске, нужно сидеть дома — никуда не выйду. Большинство людей все это время пандемии боялись и не хотели режима самоизоляции. Я же боюсь одного — заболеть. Остаться дома — это не страшно. Страшно не остаться в живых.
Помочь тем, кто лечится от рака крови сейчас, можно тут .

В.В. Бадяев, И.Н. Лазарева, К.А. Десятников
Случай скоропостижной смерти при остром лейкозе / Бадяев В.В., Лазарева И.Н., Десятников К.А. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 41-45.
библиографическое описание:
Случай скоропостижной смерти при остром лейкозе / Бадяев В.В., Лазарева И.Н., Десятников К.А. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 41-45.
код для вставки на форум:
Заболеваемость всеми видами лейкозов в целом составляет приблизительно 13 случаев на 100 тысяч населения в год, чаще болеют лица мужского пола. К острым лейкозам относят формы, при которых морфологический субстрат опухолевых разрастаний и, соответственно, клетки, циркулирующие в крови, представлены недифференцированными или малодифференцированными элементами (бластными клетками) (Ф.Э. Файнштейн, 1987). Острые лейкозы – быстропрогрессирующие формы лейкоза, характеризующиеся замещением нормального костного мозга незрелыми бластными гемопоэтическими клетками без дифференциации их в нормальные зрелые клетки крови.
Клиническая симптоматика острого лейкоза зависит от степени угнетения нормального кроветворения и выраженности внекостномозговых проявлений. Абсолютно патогномоничных симптомов острого лейкоза не существует, это особенно относится к начальному периоду заболевания. Можно выделить следующие варианты начала острого лейкоза: острое начало заболевания – наблюдается у ½ больных и характеризуется высокой температурой тела (иногда с ознобами), выраженной слабостью, интоксикацией, болями в суставах, болями при глотании, болями в животе. Такое начало заболевания, как правило, трактуют как грипп, ангину, ревматизм, острое респираторное заболевание, а при болях в животе принимают за острый аппендицит. Начало заболевания с выраженными геморрагическими явлениями наблюдается у 10 % больных и характеризуется профузным кровотечением различной локализации (носовым, желудочно-кишечным, церебральным и др.).
Судебно-медицинские эксперты, в отличие от патологоанатомов, редко встречаются с данной патологией, но и патологоанатомы имеют дело в основном с хроническими формами лейкоза. Их пациенты длительно наблюдаются у онкологов, и исследования проводятся с целью уточнения диагноза, оценки качества лечения или с научной целью.
Нами исследовался случай скоропостижной смерти военнослужащего срочной службы – рядового К. Известно, что первичное медицинское обследование при поступлении в часть прошел 29.11.2017 года, признан здоровым и годным к военной службе. 10.03.2018 года был освидетельствован медицинской комиссией по направлению правоохранительных органов в связи со случаем неуставных взаимоотношений. Из материалов проверки следует, что рядовой К. получил один удар в область верхней губы от сослуживца. При осмотре установлено: общее состояние удовлетворительное. Контактен, в пространстве и времени ориентирован, активно отвечает на вопросы. В позе Ромберга устойчив, сухожильные рефлексы живые. Объективный статус. Кожные покровы: в области левого угла рта на верхней губе гематома размерами 3,8 на 2,5 см. В области правой лопатки гематома с переходом на правый плечевой сустав и ключицу. В правой подмышечной области, на пересечении задней подмышечной линии и седьмого ребра гематома округлой формы, размерами 6,5 на 3,5 см. На левом плече две гематомы округлой формы, размерами 4,5 на 3,0 см и 2,0 на 1,5 см. На правом предплечье обширная гематома размерами 14,0 на 12,0 см. На левой половине грудной клетки от среднеключичной линии до левой лопаточной линии подковообразная гематома размерами 23,0 на 10,0 см. Гематома в сердечной проекции округлой формы 7,0 на 5,0 см. На внешней поверхности правого бедра самая крупная гематома – размерами 28,0 на 10,5 см. По органам и системам без патологии.
16.03.2018 года был исследован труп рядового К. При наружном исследовании трупа выявлены множественные кровоподтеки различной формы и размеров, давности, локализующиеся в области туловища и конечностей. Границы кровоподтеков не имели четких очертаний, а глубина варьировала от внутрикожных до межмышечных (в области правого бедра). При внутреннем исследовании трупа кожно-апоневротический лоскут без кровоизлияний, кости черепа целы, при этом под мягкой мозговой оболочкой, по всей поверхности головного мозга кровоизлияния красного цвета. В желудочках головного мозга эластичные свертки крови, заполняющие объем всех желудочков мозга (боковых, третьего, четвертого), вторичные ишемические очаги перивентрикулярной мозговой ткани (рис. 1).
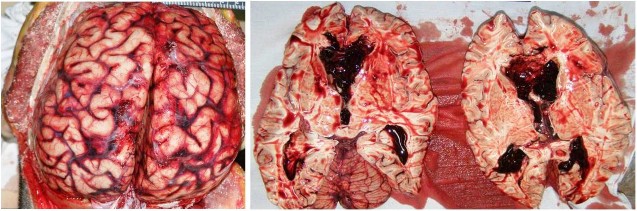
Рис. 1. Субарахноидальные кровоизлияния, кровоизлияния в желудочки головного мозга
Купола диафрагмы расположены: справа – на уровне V ребра, слева – на уровне VI ребра, сплошь покрыты мелкопятнистыми кровоизлияниями красного цвета, размерами от 0,2 × 0,2 до 0,4 × 0,4 см. В области желудочков сердца массивные фиолетовые сливные пятнистые кровоизлияния под наружную оболочку, сплошь покрывающие поверхность миокарда (рис. 2).
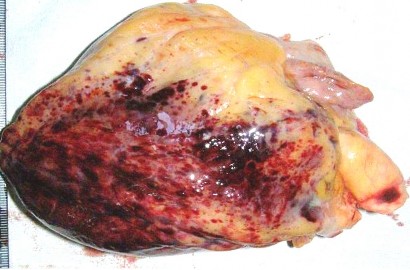
Рис. 2. Эпикардиальные кровоизлияния
Селезенка эллипсовидной формы, размерами 10,0 × 9,0 × 6,0 см, плотная, покрыта капсулой, массой 200 г. На разрезах ткань селезенки желтоватокоричневого цвета, мелкозернистого строения. В соскобе с поверхности разрезов пульпа с примесью крови. В желудке 40 мл слизистого содержимого красноватого цвета. Слизистая желудка серого цвета, с синюшным оттенком, тускловатая, с выраженной складчатостью, по малой кривизне слизистая резко гиперемирована, на вершинах складок множественные мелкоточечные кровоизлияния около 0,1 см. Печень размерами 26,0 × 19,0 × 14,0 × 9,0 см, на разрезах ткань ее желтовато-коричневого цвета, дряблая. Иных особенностей при внутреннем исследовании трупа не выявлено. При дальнейшем гистологическом изучении внутренних органов от трупа К. установлено: головной мозг – обширные кровоизлияния в белом веществе субэпендимарной области с разрежением вещества головного мозга, с выраженным отеком, дистрофическими изменениями нервных клеток, с наличием очаговых опухолевых лейкозных инфильтратов (рис. 3), преимущественно вокруг сосудов; инфильтраты состоят из клеток неправильной формы, ближе к округлой, имеют вариабельные размеры, цитоплазма клеток умеренно широкая, содержит большое количество мелких гранул, ядра разнообразной формы и размеров, встречаются бобовидной и двудольчатой формы (далее – лейкозные пролифераты или лейкемическая инфильтрация). Внутрижелудочковая гематома представлена гемолизированными эритроцитами с очаговыми опухолевыми лейкозными пролифератами.
Легкое – в просветах альвеол гомогенные и слегка зернистые эозинофильные массы (отечная жидкость), субплевральные кровоизлияния в виде скоплений гемолизированных эритроцитов в альвеолах с наличием очаговых лейкозных инфильтратов в межальвеолярных перегородках. Сердце – выраженный отек и полнокровие интерстициальной ткани, с наличием внутрисосудистых и околососудистых скоплений лейкозных клеток, дистрофические изменения кардиомиоцитов, очаговая жировая инфильтрация миокарда, в эпикарде и эпикардиальной клетчатке очаговые кровоизлияния, среди которых видны опухолевые лейкозные инфильтраты. Печень – балочно-радиарная структура сохранена, гепатоциты с очаговой крупнои мелкокапельной жировой дистрофией цитоплазмы, центральные вены и межбалочные пространства малокровны, портальные тракты с лейкемической инфильтрацией. Диафрагма – в межмышечной ткани очаговые скопления лейкозных опухолевых клеток. Селезенка – лимфоидные фолликулы с нечеткими размытыми контурами, без светлых центров, красная пульпа малокровная, с лейкозной инфильтрацией. Кожа груди – в дерме и подкожной жировой клетчатке очаговые кровоизлияния с наличием лейкозных пролифератов. Мышечно-жировая ткань правого бедра – гематома из гемолизированных эритроцитов с очаговыми скопления- ми опухолевых лейкозных клеток. Заключение: морфологические признаки лейкоза – системного опухолевого заболевания кроветворной ткани в виде разрастания очаговых лейкозных инфильтратов в головном мозге, легких, сердце, печени, селезенке, коже, жировой и мышечной ткани.
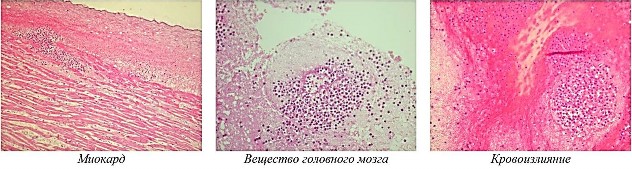
Рис. 3. Микроскопическая картина из патологических областей с наличием опухолевых лейкозных инфильтратов (х400)
Таким образом, на основании проведенного исследования мы пришли к выводу, что в данном случае имело место заболевание – промиелоцитарный лейкоз (одна из восьми разновидностей острого миелоидного лейкоза), который отличается злокачественным, внезапно возникающим и быстро развивающимся заболеванием с выраженным геморрагическим синдромом. Причиной смерти больных с этой формой лейкоза почти в 100 % случаев является кровоизлияние в мозг.
Список литературы
1. Окороков, А.Н. Диагностика болезней внутренних органов: Т. 4. Диагностика болезней системы крови. – М. : Мед. лит., 2001. – Текст : непосредственный.
Алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
Ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
АЧТВ – активированное частичное тромбопластиновое время
БРВ – безрецидивная выживаемость
ВКЛ – волосатоклеточный лейкоз
ВОЗ классификация – классификация Всемирной организации здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
ИТ – индукционная терапия
ИТК – тирозинкиназный ингибитор
КИ – клинические исследования
КМ – костный мозг
КТ – компьютерная томография
ЛБ – лимфома Беркитта
ЛБЛ – лимфобластная лимфома
МОБ – минимальная остаточная болезнь
НХЛ – неходжкинские лимфомы
ОАК – общий (клинический) анализ крови
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОРДС – острый респираторный дистресс-синдром
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронно-эмиссионная компьютерная томография
ТГСК – трансплантация гемопоэтических стволовых клеток
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХМЛ – хронический миелолейкоз
ЦНС – центральная нервная система
CD – кластер дифференцировки
ECOG (Eastern Cooperative Oncology Group status) – шкала оценки состояния пациента по критериям Восточной кооперативной онкологической группы
EWALL – Европейская исследовательская группа по изучению острого лимфобластного лейкоза
FISH-исследование – исследование методом флуоресцентной гибридизации in situ
GMALL – Немецкая исследовательская группа по изучению острого лимфобластного лейкоза
GRAALL – Французская исследовательская группа по изучению острого лимфобластного лейкоза
MD Anderson CRC – Американская исследовательская группа онкологического научного центра имени М.Д. Андерсона
Ph+ ОЛЛ или Ph-позитивный ОЛЛ – острый лимфобластный лейкоз, при котором определеяется транслокация t(9;22)
Ph– ОЛЛ или Ph-негативный ОЛЛ – острый лимфобластный лейкоз, при котором не обнаруживается транслокация t(9;22)
RALL – Российская исследовательская группа по лечению острого лимфолейкоза у взрослых
TdT – терминальная дезоксинуклеотидилтрансфераза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
1. 2020 Клинические рекомендации "Острые лимфобластные лейкозы" (Общероссийский национальный союз "Ассоциация онкологов России"; Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество").
Определение
Острые лимфобластные лейкозы (далее – ОЛЛ)/острые лимфобластные лимфомы (ЛБЛ) – это гетерогенная группа злокачественных клональных заболеваний системы крови, происходящих из клеток-предшественниц гемопоэза преимущественно лимфоидной направленности дифференцировки и характеризующиеся чаще всего исходным поражением костного мозга (далее – КМ), вытеснением нормального кроветворения и вовлечением в процесс различных органов и систем организма (центральная нервная система (далее – ЦНС), яички, лимфатическая ткань любой локализации), а также возможностью исходного поражения органов лимфатической ткани без вовлечения КМ.
Терминология
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах.
Ph-негативные острые лимфобластные лейкозы – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых не обнаруживается филадельфийская хромосома (Ph-t(9;22)). В нее включены все В-клеточные и Т-клеточные острые лимфобластные лейкозы и лимфобластные лимфомы.
Ph-позитивный острый лимфобластный лейкоз – это вариант острого лимфобластного лейкоза, при котором методом стандартного цитогенетического исследования (G-banding) или методом FISH определяется транслокация t (9;22). Диагноз Ph-позитивного острого лимфобластного лейкоза не может быть основан только на методе молекулярной детекции химерного транскрипта. Цитогенетическое или FISH (метод флуоресцентной гибридизации in situ) исследования являются обязательными. Методом полимеразной цепной реакции определяется вариант химерного транскрипта, который в дальнейшем используется для мониторинга минимальной остаточной болезни.
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0×10 9 /л, при количестве тромбоцитов более или равном 100×10 9 /л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. В этой связи необходимо подчеркнуть, что у ряда пациентов после завершения второй фазы индукционной терапии на фоне восстановления кроветворения после цитостатического воздействия в ранние сроки после его завершения может определяться увеличенный процент бластных клеток (до 10–12 %). В этом случае (особенно если полная ремиссия была зафиксирована после первой фазы индукционной терапии) через неделю на фоне восстановленного кроветворения целесообразно выполнить повторную стернальную пункцию.
Полная ремиссия подразделяется на три основных типа: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1×10 9 /л, а тромбоцитов менее 10×10 9 /л. Последняя категория оговаривается специально, поскольку, по ряду данных, прогноз у таких пациентов несколько хуже. При этом эксперты не рекомендуют констатировать у таких пациентов полную ремиссию. Тем не менее вне клинических исследований эту формулировку ответа применяют редко.
Частичная ремиссия (частичный ответ) – этот термин рекомендуют использовать только в клинических исследованиях I–II фазы, оценивающих противоопухолевую эффективность, токсичность, переносимость новых препаратов и определяющих оптимальные дозы этих препаратов.
Резистентная форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения двух фаз индукционной терапии.
Рецидив – это состояние констатируется при обнаружении в пунктате костного мозга более 5 % бластных клеток. Рецидив заболевания не констатируется при обнаружении в очередном контрольном пунктате костного мозга более 5 % бластных клеток, но менее 10 %, в тех случаях, когда пункция костного мозга производится в ранние сроки после курса химиотерапии или использовались ростовые гемопоэтические факторы с целью сокращения периода нейтропении, при этом анализ периферической крови нормальный и отсутствуют экстрамедуллярные поражения. Вторая диагностическая пункция осуществляется через 7–10 дней после первой. Если сохраняется процент бластных клеток выше 5 или отмечается их увеличение (например, с 7 до 13 %), то констатируется рецидив.
Ранний рецидив – эта форма рецидива называется в том случае, если он регистрируется раньше, чем через полгода от момента окончания поддерживающей терапии или на терапии после достижения ремиссии. Поздним считается тот рецидив, который возникает через полгода и более от окончания поддерживающей терапии. Рецидивом также является и внекостномозговое поражение (нейролейкемия, поражение яичек, увеличение селезенки и т. д.) даже при отсутствии изменений в крови и костном мозге. Внекостномозговые рецидивы (особенно поражение центральной нервной системы) при использовании современных протоколов лечения встречаются приблизительно в 4–8 % случаев. Если констатирован изолированный внекостномозговой рецидив, то, кроме локальной терапии (лечение нейролейкемии, облучение/удаление яичка, удаление лейкемического очага в яичнике и т. д.), обязательно проведение и системной индукционной терапии по протоколам, предусмотренным для таких рецидивов.
Минимальная остаточная болезнь, или минимальная резидуальная болезнь – это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 10 4–6 исследуемых. Основными методами детекции минимальной остаточной болезни являются проточная цитометрия и полимеразная цепная реакция. Методы стандартного цитогенетического исследования и метод FISH не используются в целях оценки минимальной остаточной болезни.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом методами стандартной цитогенетики не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным, а число проанализированных метафаз должно составлять не менее 20. Цитогенетическая ремиссия – новое понятие, появившееся при регулярном использовании методов цитогенетики для исследований пунктатов костного мозга в период полной ремиссии.
Цитогенетический рецидив – это рецидив, который констатируется при наличии в пунктате костного мозга митозов с хромосомными аберрациями, которые обнаружены в дебюте заболевания на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия при отсутствии в костном мозге исходно определявшихся методом полимеразной цепной реакции молекулярных маркеров острого лейкоза с чувствительностью метода 10 –4 . Это также новое понятие, ставшее в настоящее время ключевым. Следует отметить, что может быть достигнута цитогенетическая ремиссия, но при этом молекулярные маркеры могут еще определяться.
Молекулярный рецидив – это появление исходно определявшихся молекулярных маркеров острых лейкозов в двух повторных анализах (проведенных с коротким интервалом времени) на фоне сохраняющейся клинико-гематологической ремиссии.
Важным и одним из самых точных способов оценки эффективности терапии острых лейкозов являются применение статистических методов и построение кривых выживаемости пациентов, которым проводили то или иное лечение. Чаще всего оценивают общую, безрецидивную, бессобытийную выживаемость и вероятность сохранения полной ремиссии (или обратное понятие – вероятность развития рецидива).
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Событие на кривой выживаемости графически отображается ступенькой, идущей вниз. Пациентов, живых во время проведения анализа, расценивают как случай и отмечают на кривой черточкой, т. е. цензурируют. Пациентов, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы. Больных, отказавшихся от лечения, цензурируют в день отказа от терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив или смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в полной ремиссии в момент проведения анализа. Больных, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия, но они отказались от лечения в ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только тех пациентов, у которых достигнута полная ремиссия. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания. Цензурируют всех больных, кто жив в полной ремиссии в момент проведения анализа. Пациенты, умершие в период полной ремиссии от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как больных, находившихся в полной ремиссии. Пациентов, судьба которых неизвестна, цензурируют на тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия и которые отказались от лечения в период ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех больных, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения полной ремиссии через два месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута полная ремиссия в течение первых двух курсов химиотерапии, и они остаются живыми, сохраняя полную ремиссию, на момент проведения анализа.
Индукция – это период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии, называется периодом индукции (обычно 1–2 курса). Именно в этот период на фоне применения цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации полной ремиссии в костном мозге морфологически определяется менее 5 % опухолевых клеток.
Консолидация. Второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Лейкоз/лимфома Беркитта – это высокоагрессивное лимфопролиферативное заболевание из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией. Клинически выделяют 3 варианта лимфомы Беркитта: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант лимфомы Беркитта – это вариант лимфомы Беркитта характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант лимфомы Беркитта – это типичная лимфома Беркитта по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант лимфомы Беркитта – это лимфома Беркитта, возникающая на фоне иммунодефицитных состояний (у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами). Чаще всего встречается у ВИЧ- инфицированных пациентов, причем на ранних этапах развития (до снижения CD 4+ -клеток).
Читайте также:

