Синдром рихтера при лимфолейкозе сколько живут
Лимфолейкоз – это злокачественная опухоль, поражающая клетки лимфоидной ткани, из которой состоят лимфоузлы и другие внутренние органы. Согласно международной классификации заболеваний присвоен код по МКБ-10 С91.
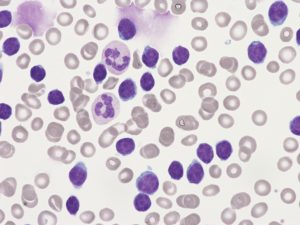
Находящиеся в крови клетки – лейкоциты призваны для защиты человеческого организма от заболеваний и формируют иммунитет. При лимфолейкозе анализ крови показывает, что лимфоцит мутировал и изменил строение. Постепенно накопленные мутированные клетки начинают вытеснять здоровые и, когда превышают количество, отмечается снижение иммунитета. На последней стадии болезни анализ крови включает 98% нетипичных клеток и 2% здоровых.
Признаки лимфолейкоза
Проявления патологии отмечаются на последней стадии болезни. Но возникают тревожные признаки заболевания, на которые стоит обратить внимание. Симптомы лимфолейкоза:
- воспаление лимфоузлов, которое диагностируется при прощупывании;
- болезненные ощущения в селезенке и печени из-за увеличения размера;
- появление желтушного оттенка кожи;
- признаки анемии: предобморочные состояния, бледная кожа;
- ломота в суставах, слабость;
- частые простудные заболевания.
По статистике, заболеванию подвергаются дети возрастом от 5 лет, а также возможно возникновение у пожилых людей после 70 лет.
Медицина не может сказать, каковы причины возникновения патологии. Одна из главных версий – генетическая предрасположенность. На генетическом уровне в хромосомах лимфоцитов происходит бесконтрольное деление и рост. Предрасположенность, передающаяся по наследству, зафиксирована при хроническом лимфолейкозе. Ученые выяснили, что в семьях со случаями болезни риск заболевания родственников увеличивается в 6 раз.
Выделяют 2 формы лимфоидного лейкоза: острую и хроническую.
Хронический лимфолейкоз
Хронический лимфатический лейкоз – это процесс, при котором нарушается b-клеточный круговорот лимфоцитов. Изменённые лимфоциты воспроизводятся, не погибают и накапливаются в органах. Создаваемые антитела не выполняют защитную функцию.
Распространённость ХЛЛ составляет третью часть заболеваний. В 90% случаев болезнь развивается после 50 лет, при этом мужчины болеют чаще в 2 раза. Причины возникновения заболевания: наследственность, иммунитет, нарушения на генетическом уровне. Для хронического лимфолейкоза характерно развитие иммунодефицита, который повышает чувствительность к вирусам и порождает опухолевые клетки.
Классификация форм хронического типа:
- Доброкачественный лимфолейкоз характеризуется удовлетворительным состоянием пациента. Показатели лейкоцитов в крови растут медленно. Продолжительность жизни с момента констатирования болезни составляет 15-30 лет.
- Прогрессирующий лимфоидный лейкоз начинается так же, как и доброкачественный. Однако повышение лейкоцитов в крови наблюдается из месяца в месяц. Отмечается характерный симптом: увеличение лимфоузлов с мягкой консистенцией.
- Спленомегалическая форма характеризуется увеличением селезёнки и выраженными признаками анемии.
- Опухолевый вид ХХЛ характеризуется такой клинической картиной: лимфоузлы увеличены, с плотной консистенцией. Из-за поражения медиастинальных лимфоузлов происходит сдавливание органов. Показатель лейкоцитов в крови около 100 тыс.
- Т-клеточный лимфолейкоз может характеризоваться увеличением лимфоузлов, поражением кожи в виде бляшек, язв и опухоли.
Выделяют стадии протекания болезни: начальную, развернутую и терминальную. При начальной стадии жалобы отсутствуют. Но с течением времени человек ощущает постоянную утомляемость, слабость, повышенную потливость. В крови количество лейкоцитов превышают 50 тыс., констатируется наличие клеток Боткина-Гумпрехта. Костный мозг характеризуется большим количеством лимфоцитов. Развёрнутая стадия представляет генерализованное увеличение лимфоузлов, увеличение размеров печени и селезенки. Из характерных признаков: отек лица, анемия, шум в ушных раковинах. При хроническом лимфолейкозе терминальной стадии выражен интоксикационный синдром. Увеличенные лимфоузлы сдавливают ткани, на фоне этого возникает болевой синдром. Развивается бластный криз.
Инфекционные осложнения при ХЛЛ возникают на любой стадии, наиболее часто проявляются в виде лёгочных инфекций.
Помимо доброкачественного течения болезни, хронический лимфоцитарный лейкоз становится причиной развития таких патологий, как волосатоклеточный лейкоз (ВЛЛ) и болезнь Рихтера. ВВЛ – редкая опухоль, поражающая лимфоидные клетки костного мозга, селезенки и крови. Синдром Рихтера – заболевание, при котором происходит развитие крупноклеточного образования – лимфомы.
Хронический лимфолейкоз обычно имеет доброкачественный характер. Начальные стадии отличаются отсутствием симптоматики. При большой скорости прогрессирования назначается химиотерапия. Показаниями к терапии являются такие симптомы: увеличение лимфоузлов, провоцирующих сдавливание внутренних органов, потеря веса и анемические признаки. Выбор терапии основан на 3 факторах: характер болезни, возраст и состояние пациента, наличие сопутствующих осложнений. В зависимости от возрастной категории, в развитии патологии выделяют пациентов молодого, преклонного и старческого возраста.
Используется также метод лучевой терапии. Он эффективен при лечении лимфоузлов, находящихся в локальной зоне.
Острый лимфолейкоз
Острый лимфолейкоз – злокачественный вид поражения кровеносной системы, характеризующийся увеличением количества лимфобластов. Для типичного течения болезни характерно наличие анемии, увеличения лимфоузлов, постоянная кровоточивость, расстройство дыхательной системы и поражение центральной нервной системы.
ОЛЛ – онкологическое образование, которое имеет распространение среди детей дошкольного возраста. У детей наблюдается первичное появление болезни, у взрослых выступает в виде осложнения после хронического лимфолейкоза. Прогнозы выздоровления у ребенка являются неоднозначными, так как патология характеризуется рецидивами.
Этиология болезни основана на предположениях ученых о возможных факторах риска. Болезнь возникает из-за образования быстроразмножающихся клеток. Генетические нарушения, вызывающие патологические изменения, возникают ещё в утробе матери.
В группу повышенного риска также попадают люди, подвергнутые воздействию радиационных лучей.
Лучевые воздействия от радиотерапии, которыми устранялась опухоль другого вида, или облучение рентгенологическим аппаратом тоже могут способствовать развитию патологии. Риск развития острого лейкоза повышается при контакте беременной женщины с некоторыми группами токсических веществ.
Болезнь характеризуется стремительным развитием и разнообразной симптоматикой. Наиболее часто начало болезни носит симптомы: повышенная и субфебрильная температура, слабость, признаки интоксикации, дискомфорт и ощущение распирания в животе, частые боли. А также кровотечения из носа, отёки ног, появление кожных высыпаний, ноющие суставы.
Группы симптомов формируют синдромы, приводящие к сбою работы внутренних органов:
- анемический синдром – характеризуется субфебрильной температурой, предобморочным состоянием, быстрой утомляемостью;
- гиперпластический – внутренние органы увеличиваются в размере;
- геморрагический – кровоизлияния на кожных участках проявляются в виде мелких точек и крупных бляшек;
- болевой синдром – из-за интоксикации организма ощущается боль и ломота в суставах.
Происходит повреждение костной системы, головного мозга, черепно-мозговых нервов, органов пищеварения, почек. Есть вероятность лейкозной инфильтрация яичников.
Рак может привести также к патологии под названием миелолейкоз, при которой поражаются стволовые клетки костного мозга.
Формулировка диагноза осуществляется с помощью результатов ОАМ и биохимического анализа крови. Обязательный метод исследования – миелограмма. С его помощью берут мазок из костного мозга для дальнейшего исследования. В крови выявляется повышенное СОЭ, анемия и лейкоцитоз. Результат миелограммы говорит о наличии бластных клеток. Чтобы отследить онкологический процесс, назначается спинномозговая пункция. С помощью этого метода отслеживается состояние нервной системы.
На основании результатов исследования пациенту присваивают группу риска и назначают лечение. УЗИ проводят с целью обследовать селезёнку и печень, отследить размеры и степень поражения. Рентген помогает выявить распространение метастазов.
Дополнительная диагностика осуществляется методом иммунофенотипирования. Он дает возможность определить иммунофенотип бластных клеток опухолевого образования костного мозга. Это помогает достоверно диагностировать патологию, разделить пациентов на группы риска и предупредить возможные рецидивы.
Проводится также дифференциальная диагностика, исключающая все возможные варианты болезней и помогающая поставить правильный диагноз.
Для лечения ОЛЛ используется химиотерапия. Выделяют регионарную, комбинированную и интратекальную химиотерапии.
При регионарной химиотерапии вещество препарата вводится во внутренние органы. Комбинированная терапия предполагает введение нескольких противораковых препаратов. При интратекальной терапии препараты вводятся прямо в позвоночник, при наличии опухоли в спинном мозге. При этом пациент дополнительно лечится с помощью внутримышечных инъекций.
Химическая терапия имеет 3 этапа:
- Этап индукции характеризуется введением в организм вещества с целью достичь первой ремиссии. На этапе индукции происходит разрушение раковых клеток. Длительность лечения составляет 2 недели.
- На этапе консолидации уничтожается оставшаяся часть клеток. Для этой цели препараты вводятся через вену.
- Этап реиндукции длится несколько лет для поддержки ремиссии и исключения вероятности рецидивов. Во время поддерживающей терапии применяются антибиотики.
Переносимость химиотерапии носит личностный характер. Применение противоопухолевых препаратов имеет достаточно тяжелые последствия для организма. Это связано с активным распадом злокачественных клеток, которые приводят к образованию большого количества продуктов обмена, что вызывает интоксикацию организма. Также из-за низкого содержания лейкоцитов в крови высока вероятность заражения инфекциями. Поэтому важно соблюдать принципы ухода за пациентами в клиниках: полная изоляция, частые влажные уборки в палате, использование стерильной одежды медперсонала.
Если по истечению 33 дней терапии не наступает улучшений либо происходят ранние рецидивы, пациенту назначается пересадка костного мозга.

Внутренняя и внешняя лучевая терапия используются при распространении опухоли в спинном мозге. Применяется в виде излучения радиации в области опухолевого образования или введения специального вещества в ткань опухоли.
Лечить острый лимфолейкоз у детей и взрослых наиболее эффективно в зарубежных странах. В благоприятном исходе лечения способна помочь клиника в Израиле. Медики страны применяют в своей практике высококачественные препараты и современные технологии.
Прогноз жизни
Хронический лимфолейкоз – заболевание, не поддающееся лечению, но имеющее удовлетворительный прогноз. Агрессивное течение болезни с возможным летальным исходом составляет 15%. В других случаях продолжительность жизни составляет 15-20 лет с момента заболевания. Пациент может жить полноценной жизнью, выполняя при этом клинические рекомендации – систематически обследоваться, соблюдать здоровый образ жизни, наладить питание и исключить алкоголь. Обязательным условием является постоянная диета.
Острый лимфолейкоз имеет большую вероятность неблагоприятных прогнозов. По статистике, дети лучше поддаются лечению. У 70% детей после лечения наступает 5-летний период ремиссии. Взрослые поддаются ремиссии в 40-45% случаев. Детям с диагнозом возможно оформить инвалидность и получать денежное пособие.
Если своевременно начать лечить заболевание у детей, есть вероятность полного выздоровления. Для взрослых вероятность подобного исхода достаточно низкая.
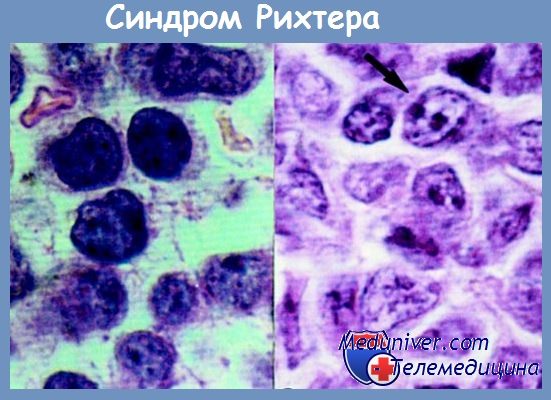
Причины развития синдрома Рихтера
Впервые случай возникновения крупноклеточной диффузной опухоли у пациента с хроническим лимфолейкозом был описан Рихтером ещё в 1928 году. До сих пор достоверно не известно, является ли возникшая опухоль клоном первичной, или же это два независимо возникших злокачественных образования. По данным иммунологических и генетических исследований, в 1/3 случаев диффузная крупноклеточная опухоль развивается из клональных клеток зрелоклеточной лимфомы, а в 2/3 случаев их взаимосвязь не доказана. Соответственно и точной причины, почему у некоторых пациентов развивается вторая опухоль, достоверно не известно. Считается, что предрасполагающими факторами являются:
- Вирус. При исследовании крупноклеточных лимфом у пациентов с синдромом Рихтера было выявлено ДНК вируса Эпштейна-Барра, являющегося предрасполагающим фактором развития и других типов лимфом.
- Иммуносупрессия из-за интенсивной химеотерапии. Частота развития синдрома Рихтера у больных хроническим лимфолейкозом увеличивается при приёме флударабина. При приёме пуриновых аналогов такая закономерность не обнаружена.
- Прогрессирование лимфопролиферативного заболевания. Некоторые исследователи считают, что синдром Рихтера является следствием развития хронического лимфолейкоза. Возникает у пациентов с индивидуальной предрасположенностью к такому осложнению.
Чтобы подтвердить или опровергнуть эти причины развития синдрома Рихтера, проведённых исследований недостаточно.
К тому же встречается синдром Рихтера крайне редко. Он развивается у 3-10 % пациентов со зрелоклеточными лимфопролиферативными патологиями. Появление крупноклеточной лимфомы ухудшает состояние пациента и сопровождается определёнными признаками.
Симптомы патологии
Чаще синдром Рихтера развивается на поздних стадиях и значительно осложняет течение хронического лимфолейкоза. Он проявляется:
- массивной лимфаденопатией;
- быстрым увеличением лимфоузла.
У некоторых пациентов по мере развития крупноклеточной диффузной лимфомы исчезает основной признак лимфолейкоза – увеличенное количество лимфоцитов в крови. У других же наоборот, лимфоцитоз значительно возрастает.
Помимо этого у больных проявляются симптомы опухолевой интоксикации и признаки ослабления гуморального иммунитета. Пациенты жалуются:
- на обильное потоотделение ночью;
- интенсивное беспричинное похудание;
- повышенную температуру тела;
- частые простуды;
- постоянно возникающие инфекционные заболевания мочевых путей;
- длительно заживающие кожные раны.
Боль возникает там, где расположены поражённые лимфоузлы.
Осложняется течение заболевания, если в патологический процесс вовлекается костный мозг и другие органы кроветворения. Нередко при синдроме Рихтера врач выявляет увеличенную селезёнку. И тогда пациенты жалуются на боль, давящее ощущение в брюшной полости.
Чтобы поставить точный диагноз, необходимы анализ крови, биопсия лимфоузла. Для гистологического исследования материал берут из наиболее подозрительных участков. Забор биоптата проводят с различных мест.
Прогноз при синдроме Рихтера
Дальнейшее прогрессирование болезни зависит от тактики лечения и индивидуальных особенностей пациентов. Часть пациентов после появления крупноклеточной лимфосаркомы умирают в течение полугода, даже если использовать адекватные для агрессивных лимфом комбинированные методы терапии.
Не всегда синдром Рихтера приводит к скорому летальному исходу. Особенно если самочувствие не изменяется. В этом случае продолжительность жизни при синдроме Рихтера значительно варьирует. Пациент может прожить от 3,5 месяцев до 9 лет.
При синдроме Рихтера пациенты нуждаются:
- в паллиативном лечении;
- спленэктомии (при значительно увеличенной селезёнке);
- комбинированном лечении.
При подборе схемы химеотерапии учитывают тип лимфом. Нередко цитостатики, цитотоксины дополняют противовоспалительными препаратами.
Пациентам с лимфомами, особенно при развитии синдрома Рихтера, необходимо избегать инфекционных заболеваний. Часто причиной смерти становится не сама опухоль, а неспособность иммунитета противостоять болезнетворным микроорганизмам.
К какому врачу обратиться
Синдром Рихтера развивается у пациентов с лимфопролиферативными заболеваниями. Такие больные находятся под наблюдением у врачей-гематологов, онкогематологов. Следует периодически проходить необходимые исследования, а при ухудшении самочувствия обязательно обратиться к лечащему врачу, чтобы вовремя выявить синдром Рихтера и изменить тактику лечения.
Долгое время существовали две противоположные концепции на природу синдрома Рихтера. Согласно одной из них, синдром Рихтера представляет собой сочетание двух генетически не связанных друг с другом заболеваний. В клинической практике эта гипотеза находит прямое подтверждение только в тех исключительных случаях, когда течение В-клеточной лимфатической опухоли осложняется присоединением крупноклеточной лимфомы с иным (Т-клеточным) иммунологическим фенотипом.
Сложнее трактовка наблюдений, когда обе болезни имеют одинаковую, реже Т-, а чаще В-линейную, принадлежность.
В тех случаях, когда на мембране клеток лимфоцитарной и крупноклеточной опухолей обнаруживают иммуноглобулины, идентичные по типу Н- и L-цепей, кажется очевидным, что обе болезни развиваются из одного исходного клона. Иногда экспрессия идентичных по типу L-цепей может сочетаться с разными изотипами (классами) иммуноглобулинов. Такие находки тоже скорее подтверждают, чем опровергают, идею о клональной прогрессии при синдроме Рихтера, поскольку в отличие от лимфоцитарной лимфомы/хронического лимфолейкоза на опухолевых элементах крупноклеточной лимфомы обнаруживались изотипы, свойственные более поздним этапам иммунного ответа —(М + D) => М => G => А (феномен переключения изотипов Н-цепей).
Если на мембране лимфоцитов и крупных опухолевых элементов определяются иммуноглобулины одного класса, но с разным типом L-цепей, например Igrvk—IgMA или IgMh—IgMk, предполагают, что заболевания происходят из разных клонов опухолевых клеток.
Установлено, что каждая полипептидная цепь иммуноглобулина кодируется несколькими генетическим элементами, которые в зародышевой конфигурации пространственно разобщены. В предшественниках В-лимфоцитов эти элементы в результате рекомбинации ДНК должны расположиться рядом, чтобы образовался единый активный генный комплекс, способный кодировать синтез тяжелых (VHD-JH + СH) или легких (VLJL + CL) полипептидных цепей.
Иными словами, в результате соматической перестройки молекулы ДНК происходит объединение рассредоточенных (V1=>n — variable, D1-5 — diversity, J1-4 — joining, Cu,q,y,a,e — constat) генных сегментов, и из множества вариантов производится сборка одного, уникального для данной популяции клеток кло-нального маркера. Этот процесс, обозначаемый как реаранжировка генов иммуноглобулинов, приводит к образованию фрагмента ДНК, отличающегося от зародышевой конфигурации.
Образец перестройки (реаранжировки) генов тяжелых и к или X легких цепей является уникальным в каждой конкретной В-клеточной опухоли. В опухоли при этом имеются множественные копии идентичных V(D).1-объединений, отражающих принадлежность клеток к одному клону. При синдроме Рихтера анализ реаранжировки генов иммуноглобулинов методом блоттинга по Саузерну используется как важный дополнительный молекулярно-биологический способ изучения клональной связи между двумя различными по своим морфологическим характеристикам популяциями опухолевых клеток.
Метод блот-гибридизации позволяет не только выявить рестрикционные фрагменты ДНК, отражающие генные объединения V(D)J в лимфоцитах крови/костного мозга и клетках экстрамедуллярной опухолевой ткани, но и сравнивать их. Обнаружение одинаковых клональных полос реаранжировки генов Н- и/или L-цепей дает основание полагать, что синдром Рихтера чаще всего представляет собой моноклоновый злокачественный процесс. Обычно в таких случаях обе популяции опухолевых клеток экспрессируют на своей поверхности только один тип L-цепей — либо к, либо X. В тех случаях, когда в лимфоцитах и крупных опухолевых элементах гены иммуноглобулинов перестроены по-разному, утверждается, что заболевания при синдроме Рихтера не имеют клональной связи друг с другом. В этих случаях опухоли, как правило, отличаются по типу синтезируемых L-цепей.
Затруднительными для интерпретации представляются ситуации, при которых из двух типов перестройки генов иммуноглобулинов, присутствующих в опухоли, только один совпадает с образцом реаранжировки в В-лимфоцитах крови/костного мозга. Серьезные затруднения в трактовке могут возникать, если результаты генных исследований вступают в противоречие с данными, полученными при иммунологическом фенотипировании опухолевых клеток. Подобная ситуация описана К. Miyamura и соавт..
В публикации речь идет о пациенте 71 года с лимфоцитозом крови/костного мозга, шейной лимфаденопатией, гепато- и спленомегалией и симптомами общей интоксикации. Морфологически в препаратах лимфатического узла обнаружена картина диффузной крупноклеточной лимфомы.
В представленном наблюдении клетки лимфоцитарной и крупноклеточной опухолей, с одной стороны, имели идентичный иммунофенотип (CD5+CD19+CD20+HLA-DR+) и одинаковые реаранжировки генов IgH, с другой — они различались по типу экспрессируемых L-цепей — X и к соответственно. Последнее обстоятельство не помешало авторам сделать вывод о том, что обе болезни, вероятнее всего, имели общее клональное происхождение, по крайней мере на начальных этапах малигнизации.
Длительное время было неясно, насколько лимфоциты лимфоцитарной лимфомы/хронического лимфолейкоза являются функционально активными и способными к дальнейшей дифференцировке. Решению этой проблемы в определенной степени способствовала работа L. F. Bertoli и соавт., в которой, кроме того, продемонстрирован иной подход к изучению клональных взаимоотношений при синдроме Рихтера. Авторы получили моноклональные антитела к идиотипической (антигенной) детерминанте молекул Ig(M+D) Х-типа, экспрессированных на лимфоцитах больной хроническим лимфолейкозом.
В двухцветной иммунофлюоресценции В-клетки с мембранным Ig(M+D)A. идентифицировались с помощью антиидиотипических антител как преобладающая в лейкемическом клоне клеточная популяция. Вместе с тем было показано, что в определенной части IgG и IgA В-клеток, а также в большинстве IgG плазмоцитов костного мозга и крови обнаруживалась идиотипическая детерминанта, аналогичная таковой в лейкемических В-лимфоцитах. Следовательно, лейкозные лимфоциты или по крайней мере их некоторая часть способны к восприятию антигенных стимулов, изотипическому переключению и дифференцировке в плазматические клетки.
Через 6 лет после установления диагноза хронического лимфолейкоза больная умерла при явлениях дыхательной недостаточности, обусловленной опухолевой инфильтрацией легочной ткани. На вскрытии выявлена диффузная крупноклеточная лимфома, клетки которой экспрессировали на своей поверхности IgMh с таким же идиотипом, как и лимфоциты исходного клона. Кроме того, при блоттинге по Саузерну в лейкемических клетках крови и ткани лимфомы были получены идентичные клональные полосы перестройки генов Н-цепей иммуноглобулинов.
Таким образом, в данном наблюдении общее клональное происхождение хронического лимфолейкоза и диффузной крупноклеточной лимфомы было подтверждено не только при изучении иммунофенотипа, генных реаранжировок, но и с помощью антиидиотипических антител к молекулам иммуноглобулинов, экспрессированным на опухолевых клетках. В результате этих исследований одновременно получены косвенные доказательства способности В-лимфоцитов хронического лимфолейкоза к дифференцировке вплоть до плазмоцитов на протяжении самой болезни. При блоке развития лейкемических клеток на более позднем этапе дифференцировки, по-видимому, возможна трансформация в крупноклеточную лимфому.
Подобная возможность подтверждается наблюдением Е. Cofrancesco и соавт.. У больной с 6-летним анамнезом хронического лимфолейкоза развилась крупноклеточная лимфома с генерализованным поражением лимфатических узлов, печени, селезенки, кишечника, надпочечников, почек, костей. Обе популяции лимфоидных клеток (мелкие и крупные) имели идентичные реаранжировки генов иммуноглобулинов и сходные иммунофенотипические характеристики (CD5+CD19+CD20+HLA-DR+CD10). Однако крупные клетки лимфомы отличались от лимфоцитов (клеток лимфолейкоза) большей степенью иммунологической дифференцировки в направлении плазмоцитов. Это подтверждалось появлением цитоплазматических IgM, экспрессией CD38, утратой мембранных IgD и снижением розеткоообразования с мышиными эритроцитами.
При комбинированных В-клеточных опухолях клональная связь между злокачественными процессами изучали также посредством структурного анализа генов иммуноглобулинов. Работа V. Cherepa-khin и соавт. была первой, в которой по последовательности нуклеотидов ДНК показано, что клетки крупноклеточной лимфомы и хронического лимфолейкоза при синдроме Рихтера могут происходить из одного клона, несмотря на разный иммунофенотип: клетки крупноклеточной опухоли у больного были CD5-негативными.
J. Seymour и J. Campbell проанализировали известные исследованные современными методами случаи синдрома Рихтера. Они установили, что примерно в 2/3 случаев хронический лимфолейкоз и развившаяся крупноклеточная лимфома происходят из одного клона, в 1/3 — из разных.
Гематологам известно, что далеко не всегда при наличии зрелоклеточной лимфатической опухоли развивается крупноклеточная лимфома. Более того, синдром Рихтера — это редкий клинико-морфологический феномен. По данным различных авторов, он встречается только у 3—10 % больных лимфоцитарной лимфомой/хроническим лимфолейкозом. В такой ситуации понятны попытки выяснить, чем основная масса лимфоцитарных опухолей отличается от той небольшой части, которая осложняется развитием крупноклеточной лимфомы. Выдвигается и обосновывается довольно логичное предположение о возможном существовании подгруппы В-клеточных лимфатических опухолей, более подверженных внешним воздействиям и/или неконтролируемой бласттрансформации.
Подтверждением этому может служить обнаружение в лимфоцитах при ХЛЛ, осложненном развитием крупноклеточной лимфомы, замещающей мутации в D- и/или Jн-сегментах генов иммуноглобулинов. Большинство же случаев лимфоцитарной лимфомы/ хронического лимфолейкоза обычно представлено популяцией В-лимфоцитов, не имеющих таких мутаций. Результаты изучения реаранжировки протоонкогенов BCL-1, BCL-2, c-MYC, некоторых супрессорных генов, а также ТР53 иногда представляют большую сложность для интерпретации. Например, при различной реаранжировке генов иммуноглобулинов в опухолевых клетках при лимфолейкозе и крупноклеточной лимфоме могут обнаруживаться идентичные перестройки протоонкогена BCL-2.
Пока до конца неясны механизмы развития крупноклеточной опухоли в тех случаях, когда она происходит из того же клеточного клона, что и хронический лимфолейкоз. Изучение влияния ростовых факторов (TGF-p, G-CSF), цитогенетических изменений, мутаций генов ТР53 и р16, чаще наблюдающихся при синдроме Рихтера, чем при ХЛЛ, c-MYC, реаранжировка которого обнаружена в некоторых случаях синдрома Рихтера, не внесло определенности.
Много работ посвящено изучению роли вируса Эпштейна — Барр в развитии синдрома Рихтера. Показано, что ДНК вируса обнаружена только при развитии крупноклеточной лимфомы с клетками, напоминающими клетки Рид — Штернберга, и крупноклеточной опухоли с Т-клеточным иммунофенотипом. Во всех этих случаях доказано, что лимфоциты ХЛЛ и клетки лимфомы происходят из разных клонов.
Неясной остается роль иммуносупрессии, в частности, вызываемой лечением флударабином. В некоторых сообщениях, основанных на небольшом количестве наблюдений, показано определенное увеличение частоты синдрома Рихтера у больных ХЛЛ, получавших флударабин. В больших сериях, основанных на наблюдениях нескольких сотен длительно прослеженных больных, увеличения синдрома Рихтера у получавших пуриновые аналоги не отмечено. Возможно, указанное некоторыми авторами увеличение частоты крупноклеточной лимфомы при лечении флударабином объясняется более агрессивным течением ХЛЛ у этих больных, что и потребовало применения флударабина.
Развитие крупноклеточной лимфомы у больных со зрелоклеточными лимфопролиферативными заболеваниями является плохим в прогностическом отношении признаком и, как правило, сопровождается появлением ряда новых клинических симптомов. Чаще всего наблюдаются следующие:
1) резкое увеличение лимфатических узлов, особенно брюшной полости, значительное, иногда изолированное поражение селезенки и/или появление изолированных экстранодальных опухолевых образований;
2) появление общих симптомов: повышение температуры тела до 38 С и более без видимой инфекционной причины, снижение массы тела, выраженная потливость;
3) повышение уровня ЛДГ;
4) гиперкальциемия;
5) регрессия лимфоцитоза крови и/или костного мозга, совпадающая, а иногда предшествующая по времени появлению общих симптомов и генерализации экстрамедуллярного опухолевого процесса;
6) резкое ухудшение состояния больного.
Продолжительность жизни после обнаружения крупноклеточной опухоли обычно колеблется от 6 до 12 мес, несмотря на применение адекватных при лимфомах высокой степени злокачественности методов комбинированной химиотерапии.
При синдроме Рихтера иногда наблюдается изолированная экстранодальная локализация очагов крупноклеточной лимфомы. Так, описано поражение кожи, мягких тканей с прорастанием в позвонок и его деструкцией, вещества мозга, яичек, желудка и/или кишечника, бронхиального дерева с эндобронхиальным ростом опухоли. Появление перечисленных признаков у больных с лимфоцитарной опухолью должно служить основанием для проведения диагностической биопсии.
В последующем необходимо иммуноморфологическое исследование опухолевой ткани с обязательным цитологическим изучением отпечатков для исключения синдрома Рихтера.
Мы наблюдали 13 больных со злокачественными лимфопролиферативными заболеваниями, протекавшими с лимфоцитозом крови и костного мозга, у которых развилась крупноклеточная лимфома. Эти больные составили 3,2 % от общего числа больных с периферическими мелкоклеточными В-лимфомами. Среди больных с синдромом Рихтера было 6 женщин и 7 мужчин в возрасте от 40 до 77 лет.
Основным клиническим проявлением злокачественного процесса у 12 больных было увеличение лимфатических узлов разных групп с лимфоцитозом крови и костного мозга. У одного пациента экстрамедуллярный компонент лимфоцитарной опухоли характеризовался изолированным поражением селезенки.
В морфологическом субстрате у всех больных преобладали малые лимфоциты. Субстрат лимфоцитарной опухоли характеризовался типичной коэкспрессией зрелыми В-лимфоцитами маркеров CD5 и CD23. Опухолевые элементы крупноклеточной В-лимфомы отличались иммунофенотипически от субстрата лимфоцитарной лимфомы отсутствием экспрессии CD5 во всех, a CD23 — в половине исследованных случаев.
Продолжительность жизни после установления диагноза крупноклеточной лимфомы широко варьировала — от 1 до 106 мес (медиана 8 мес).
Читайте также:

