Схема метастаз колоректального рака
Колоректальный рак
Рак, первоначально возникший в толстом кишечнике, называется раком толстого кишечника. Опухоль, первоначально возникшая в прямой кишке, называется раком прямой кишки или ректальным раком.
Рак толстой и прямой кишки возникает при перерождении и неконтролируемом росте некоторых клеток этих органов, что приводит к возникновению злокачественной опухоли, т.е. рака.
Злокачественные опухоли толстого кишечника и прямой кишки часто объединяют под общим названием колоректальный рак.
Колоректальный рак растет медленно, и прежде чем появляются достаточно отчетливые симптомы, проходит длительное время. Симптомы зависят от вида, расположения и распространенности злокачественной опухоли. Восходящая ободочная кишка имеет большой диаметр и тонкие стенки. Поскольку ее содержимое жидкое, непроходимость развивается лишь в поздних стадиях заболевания. Опухоль в восходящей ободочной кишке бывает таких больших размеров, что врач может прощупать ее через брюшную стенку. Тем не менее утомляемость и слабость вследствие тяжелой анемии иногда являются единственными симптомами. Нисходящая ободочная кишка имеет меньший диаметр и более толстую стенку, каловые массы в ее просвете почти твердые. Опухоль этой части толстой кишки обычно растет по ее окружности, вызывая чередование запоров и поносов. Поскольку нисходящая ободочная кишка более узкая и имеет более толстые стенки, рак этой локализации раньше приводит к развитию непроходимости. Человек может обратиться к врачу из-за сильных болей в животе и запора. В кале иногда обнаруживаются прожилки или примесь крови, но часто видимая кровь отсутствует; чтобы ее определить, необходимо лабораторное исследование.
Все злокачественные опухоли, как правило, кровоточат; кровотечение обычно скудное. Наиболее распространенным первым симптомом при колоректальном раке является кровотечение во время дефекации. Врачи рассматривают возможность рака при любом кровотечении из прямой кишки, даже если известно, что у человека геморрой или дивертикулез. При колоректальном раке дефекации болезненные; характерно чувство неполного опорожнения прямой кишки. Сидеть бывает больно. Однако, если опухоль не распространяется на ткани вне прямой кишки, пациент обычно не чувствует боли, непосредственно связанной с ее развитием.
Каковы причины возникновения лейкоза у детей по ссылке.
Раннее обнаружение КРР – залог успешного лечения. Именно поэтому важным является своевременное обращение к врачу при возникновении настораживающих симптомов.
В диагностике колоректального рака используются различные методы исследования – лабораторные, эндоскопические, рентгенологические – они дополняют друг друга и помогают подобрать наиболее оптимальную схему лечения.
При подозрении на КРР проводят лабораторные исследования, которые включают клинический и биохимический анализ крови, тесты на обнаружение крови в кале, а также специфический тест – определение онкомаркера РЭА (раковоэмбриональный антиген). Существуют и другие маркеры опухолевого роста при КРР: СА 19-9, СА 242.
Эндоскопическими методами диагностики КРР являются ректороманоскопия и колоноскопия. Перед их выполнением обязательно проводится пальцевое ректальное исследование. В ходе ректороманоскопии обследуется прямая кишка и дистальный отдел (нижняя часть) сигмовидной кишки путем осмотра слизистой оболочки до уровня 20—35 см от ануса. При ректороманоскопии можно обнаружить патологические изменения слизистой оболочки этого участка кишечника, а также произвести удаление полипов, взять материал для биопсии.
В отличие от ректоскопии, при колоноскопии исследуется вся толстая кишка. Процедура колоноскопии позволяет провести осмотр слизистой оболочки толстой кишки с помощью введенного в задний проход гибкого зонда с миниатюрной камерой. Для подтверждения диагноза КРР необходимо выполнение колоноскопии с биопсией.
Колоректальный рак имеет разный прогноз. Он зависит от стадии. Десятилетняя выживаемость при раке, ограниченном слизистой оболочкой, приближается к 90 %; при прорастании через стенку кишки — 70-80 %; при поражении лимфатических узлов — 30-50 %; при метастазировании — менее 20 %.
Метастатический колоректальный рак это поздняя стадия рака кишечника, когда опухоль не просто получила значительное распространение вглубь тканей, но и дала дочерние опухоли – метастазы. Метастатический колоректальный рак может быть первичным – когда заболевание впервые было продиагностировано уже на этой стадии, или же вторичным, когда предшествующая терапия оказалась неэффективной. Согласно статистическим данным, колоректальный рак на поздней стадии является первичным почти в 50% случаев – это очень большая цифра, отягощающая прогноз по данной онкопатологии, поскольку лечение на этой стадии достаточно сложное, и не всегда успешное ввиду запущенности процесса.
Хирургическое лечение. Хирургическое лечение колоректального рака может быть показано 70% пациентов без признаков метастатической болезни. Хирургическое лечение состоит из широкой резекции опухоли и ее регионарного лимфатического оттока с анастомозированием концов кишки. Если имеется
Появление новых препаратов, внедрение в практику агентов, повышающих биологическую доступность лекарственного средства, и усовершенствование комбинаций препаратов и последовательности их назначения улучшили перспективы больных с метастазами колоректального рака (КРР): в настоящее время общая выживаемость увеличилась с 6 до > 22 месяцев.
Цели лечения при метастазах:
• Приостановка прогрессии опухоли, уменьшение опухоли (=> возможность дальнейшей резекции по поводу метастатических очагов).
• Поддержание/улучшение общего качества жизни.
• Приемлемый профиль побочных эффектов.
• Длительная выживаемость.Хотя радикальная резекция с лечебной целью по-прежнему выполняется при ограниченном метастатическом поражении, комбинация с химиотерапией считается наиболее обоснованным выбором. Пути введения: системное назначение (вну-тривенное/пероральное) = стандарт. Регионарная терапия (инфузия в печеночную артерию, внутрибрюшная химиотерапия) в большинстве случаев не имеет преимуществ.
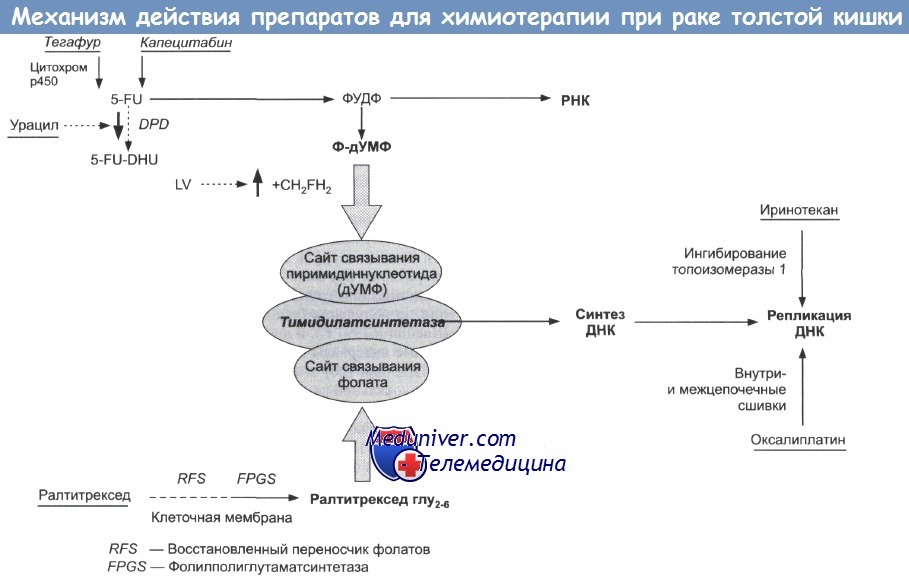
Все обычные режимы химиотерапии основаны на 5-FU/LV (непрерывная инфузия) или его пероральном предшественнике (Кселода) в комбинации с оксалиплатином или иринотеканом.
Добавление таргетных препаратов: бевацизумаб или цетуксимаб (против фактора роста эндотелия сосудов [VEGF], эпидермального фактора роста [EGFR]) увеличивают эффективность химиотерапии с иринотеканом и оксалиплатином => FOLFIRI, FOLFOX или XELOX плюс бевацизумаб показали одинаковую эффективность в отношении ответа и выживаемости без прогрессии в терапии первой линии при метастазах. Возможен даже более выраженный ответ при комбинации иринотекана и оксалиплатина (FOLFOXIRI).
Химиотерапию необходимо продолжать как компонент поддерживающего лечения настолько длительно, насколько она переносима и эффективна. Нет никакого преимущества в полном прерывании химиотерапии, за исключением перерывов в назначении оксалиплатина после 3-х месяцев для предотвращения кумулятивной токсичности (нейропатии); повторное назначение, если имеется прогрессия на фоне 5-FU/LV. Определение наилучшей последовательности схем является предметом текущих исследований.
Показания для химиотерапии метастазов рака толстой кишки:
• колоректальный рак (КРР) IV стадии.
• Нерезектабельный местный рецидив колоректального рака (КРР).Сумма доказательств эффективности химиотерапии метастазов колоректального рака:
- Стадия IV (с возможной радикальной резекцией).
• Комбинация 5-FU/LV с иринотеканом или оксалиплатином лучше, чем только 5-FU/LV.
• Эффективность капецитабина сопоставима или немного выше, чем 5-FU/LV в/в.
• Бевацизумаб или цетуксимаб, добавленные в базовую комбинацию, улучшают ответ на лечение и увеличивают выживаемость без прогрессии и общую выживаемость.
• Отмена лечения за 4-6 недель до операции.
- Стадия IV (инкурабельная): вышеперечисленное, а также отсутствие преимуществ от прекращения химиотерапии.
- Стадия IV (канцероматоз брюшины): внутрибрюшинная химиотерапия может иметь преимущества после полной макроскопической циторедукции, в противном случае наиболее предпочтительна системная химиотерапия.Альтернативы:
• Наилучшая поддерживающая терапия
Схемы химиотерапии при метастазах колоректального рака
1. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 4) ± бевацизумаб
Оксалиплатин в/в в первый день; лейковорин в/в в первый и второй дни; 5-FU в/в болюсно с последующей непрерывной инфузией в течение первого и второго дня => циклы повторяются каждые 14 дней.
Возможное дополнение: бевацизумаб в/в каждые 2 недели. Показания. Стандартный режим интенсивной химиотерапии при метастазах или рецидиве колоректального рака (КРР).
Противопоказания. Аллергические реакции. Предшествующая нейропатия. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты. Нейтропения (> 40%), фебрильная нейтропения, периферическая нейропатия (острая III степени - 12%, отдаленная персистирующая - 1%).2. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 6) ± бевацизумаб
Оксалиплатин в/в в первый день; лейковорин в/в только в первый день; 5-FU в/в болюсно с последующей непрерывной инфузией (более высокая доза, чем при FOLFOX4) в течение первого и второго дней => циклы повторяются каждые 14 дней. Возможное дополнение: бевацизумаб в/в каждые 2 недели.
Показания. Такие же, как при FOLFOX4, но доза оксалиплатина выше, назначения более удобны для больного: необходимость госпитализации только в первый день каждого цикла.
Противопоказания. Такие же, как и при FOLFOX4.
Токсичность и побочные эффекты. По существу такие же, как при FOLFOX4.3. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 7) ± бевацизумаб
Оксалиплатин в/в в первый день; лейковорин в/в только в первый день; 5-FU в/в болюсно с непрерывной инфузией (более высокая доза, чем при FOLFOX4) в течение первого и второго дней => общее число циклов шесть каждые 14 дней.
После этого: обычный курс 5-FU/LV (без оксалиплатина): LV в первый день, 5-FU в/в болюсно с непрерывной инфузией в течение первого и второго дней => 12 циклов каждые 2 недели, повторное назначение оксалиплатина при прогрессировании заболевания. Возможное дополнение: бевацизумаб в/в каждые 2 недели.
Показания. Такие же, как при FOLFOX6, но с ограниченной продолжительностью назначения оксалиплатина => поддерживающее лечение 5-FU/LV или капецитабином.
Противопоказания. Такие же, как и при FOLFOX4.
Токсичность и побочные эффекты. По существу такие же, как при FOLFOX6, снижение частоты возникновения отдаленной нейропатии.
4. КАПЕцитабин (КСЕЛода) + ОКСалиплатин (CАРЕОХ, XELOX) ± бевацизумаб
Оксалиплатин в/в в первый день; капецитабин перорально два раза в день ежедневно с 1 по 14 дни + 7 дней перерыв => циклы повторяются каждый 21 день. Возможное дополнение: бевацизумаб в/в каждые 2 недели.
Показания. Альтернативная схема FOLFOX с удобным режимом приема.
Противопоказания. Аллергические реакции. Предшествующая нейропатия. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты. Сравнимый с FOLFOX или несколько лучший профиль токсичности.5. ФОЛиниевая кислота + Фторурацил + ИРИнотекан (FOLFIRI) ± цетуксимаб
Иринотекан в/в в первый день; лейковорин в/в в первый день; 5-FU в/в болюсно с последующей непрерывной инфузией в течение первого и второго дней —> всего 12 циклов каждые 14 дней.
Возможна комбинация с цетуксимабом.
Показания. Схема лечения первой линии при метастазах КРР. Альтернатива FOLFOX.
Противопоказания. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты:
• Диарея, тошнота/рвота, обезвоживание.
• Подавление активности костного мозга.
• Сердечно-легочные осложнения.6. Иринотекан + 5-FU + лейковорин (IFL, схема Salz) ± цетуксимаб
Иринотекан в/в + еженедельно болюсно 5-FU/LV в течение 4 недель с последующим 2-х недельным перерывом => циклы повторяются каждые 6 недель.
Возможна комбинация с цетуксимабом.
Показания. Схема лечения первой линии при метастазах КРР, возможна комбинация с беваци-зумабом или цетуксимабом.
Противопоказания. Текущий сепсис, нейтропения, печеночная /почечная недостаточность.
Токсичность и побочные эффекты:
• Гастроинтестинальная: диарея, тошнота/рвота, анорексия, боли в животе => тяжелое обезвоживание, электролитный дисбаланс, нейтропения/лихорадка.
• Васкулярный синдром: острый/фатальный инфаркт миокарда, тромбоэмболия легочной артерии, нарушения мозгового кровоснабжения.
Коррекция дозы. Мониторинг признаков угрожающей тяжелой токсичности.
Осложнения. Увеличение летальности, связанной с лечением, вследствие комбинации конкурирующей токсичности (диарея, фебрильная нейтропения, дегидратация).7. ИРинотекан + ОКСалиплатин (IROX) ± бевацизумаб или цетуксимаб
Оксалиплатин в/в в первый день с последующим в/в введением иринотекана => каждые 3 недели. Возможна комбинация с бевацизумабом или цетуксимабом.
Показания. Схема в разработке.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Лучший профиль токсичности.8. КАПЕцитабин (КСЕЛода)+ ИРИнотекан (CAPEIRI) ± бевацизумаб или цетуксимаб
Иринотекан в/в в первый день; капецитабин перорально два раза в день ежедневно с 1 по 14 дни + 7 дней перерыв => циклы повторяются через 21 день. Возможна комбинация с бевацизумабом или цетуксимабом.
Показания. Схема лечения второй линии.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Высокая частота тяжелой рвоты, диареи, дегидратации.
- Вернуться в оглавление раздела "Хирургия"
Диагностика метастазов в печени и легких у онкологических больных остается сложной проблемой современной онкологии.
Это связано со скудной симптоматикой и недостаточной информативностью общеклинических методов исследований.
В настоящее время идет поиск новых диагностических алгоритмов при метастазах колоректального рака в печень и легкие.
Точное определение объема метастатического поражения остается решающим моментом для выбора тактики ведения больных.
Целью инструментального исследования толстой кишки было определение локализации и распространенности опухолевого процесса у первичных больных, а также исключение прогрессии и рецидива после проведенного ранее радикального удаления опухоли.
Общепринятыми методами диагностики метастатического поражения печени и легких являются лучевые: ультразвуковое исследование (УЗИ) печени, рентгенография легких, компьютерная томография (КТ), магнитно-резонансная томография (МРТ).
Они позволяют установить локализацию, рассчитать суммарную массу опухолевой ткани, а также контролировать эффективность хирургического лечения. Каждый метод лучевой диагностики направлен на решение конкретных специфических задач: скрининг, характеристика метастатического поражения.
Ошибочное заключение по результатам инструментального исследования об объеме поражения печени на фоне ее послеоперационных деформаций может привести к необоснованным хирургическим вмешательствам или, наоборот, отказу от необходимой операции.
Ультразвуковое исследование
Достоинствами метода УЗИ брюшной полости являются простота выполнения, возможность проведения повторных исследований в короткие промежутки времени. В ГБУЗ СОКОД ультразвуковое исследование печени и брюшной полости выполнялось на аппарате LOGIQ 7 с применением конвексного датчика (3,5 МГц).
При проведении УЗИ печени оценивались расположение, контуры, размеры и эхогенность паренхимы органа (рис. 1).
Рис. 1. Ультразвуковая картина метастатического поражения печени (А — во 2-м сегменте печени, Б — на границе 6-го и 7-го сегментов печени)В качестве основных ультразвуковых критериев метастатического поражения указывались размеры, количество, локализация по сегментам.
При доплеровском исследовании оценивались также степень васкуляризации очага, его взаимоотношения с магистральными сосудами печени и наличие безопасных трасс для проведения пункции и введения электрода.
Компьютерная томография метастазов
Спиральная КТ с контрастным усилением играет большую роль в дифференциальной диагностике опухолевого поражения печени. Современная компьютерная томография является высокоинформативным методом дифференциальной диагностики. Применение контрастных средств при проведении томографии позволяет визуализировать сосуды и точно определить распространенность опухолевого поражения.
Точность спиральной компьютерной томографии при выявлении метастазов рака толстой кишки в печени составляет 88 %, в легких — 97 %. Чувствительность и специфичность КТ при диагностике метастатических узлов печени — 97 и 85 %, легких — 97 и 89 % соответственно. При проведении компьютерной томографии легких и печени у 10-20 % больных выявляются дополнительные узлы.
В ГБУЗ СОКОД с целью уточнения распространенности, локализации метастатических образований и оценки эффективности проводимого лечения проводилась КТ брюшной полости на спиральном компьютерном томографе Lightspeed Ultra СТ (16 — срезовый, диагностический) (рис. 2).
Рис. 2. Метастатические очаги (1) на компьютерных томограммах печениКомпьютерные исследования метастазов в печени выполнялись при задержке дыхания в фазу неглубокого вдоха. Сканирование проводилось от купола диафрагмы до крыльев подвздошных костей, толщина среза составляла 5 мм. Для улучшения визуализации новообразований применялся метод внутривенного болюсного контрастирования с оценкой изображения в артериальную и венозную фазы исследования с внутривенным введением 100 мл омнипака (350 мг/мл) или ультрависта-370. При КТ-исследовании оценивались размеры, контуры печени.
При наличии очагов отмечались их сегментарная локализация, число, форма, размеры. Определялись характер контуров очаговых образований печени, гомогенность структуры, состояние желчных протоков, наличие или отсутствие метастатических забрюшинных лимфатических узлов.
Магнитно-резонансная томография
Для уточнения результатов компьютерной томографии назначается магнитно-резонансная томография брюшной полости с контрастным усилением на аппарате Signa EXCITE с напряженностью магнитного поля 1,5 Тл с получением Т1- и Т2-взвешенных изображений в различных проекциях (рис. 3).
Рис. 3. Метастатические очаги (1) на магнитно-резонансных томограммах печени (А — горизонтальная, Б — сагиттальная плоскости)Изображение оценивалось в артериальную и венозную фазы. МРТ паренхиматозных органов отличается высокой анатомической информацией, чувствительностью к потоку крови и контрастному насыщению, возможностью многоплоскостного сканирования.
Данный метод рекомендуется для дифференциальной диагностики заболевания, его чувствительность составляет 90 %. К сожалению, проведение МРТ для скринингового исследования является прерогативой крупных медицинских центров, что связано с ее высокой стоимостью.
Симптоматика метастатических опухолей в легких крайне скудна и не отличается от таковой при периферическом раке. Наиболее часто встречаются: сухой кашель, одышка, кровохарканье. При цитологическом исследовании мокроты у больных со множественными метастазами в легких опухолевые клетки встречаются лишь у 10-25 %.
Рентгенография легких является основным методом диагностики при метастатическом поражении. Постоянный рентгенологический контроль при мониторинге больных дает возможность своевременно выявить метастазы. Для диагностики метастатических образований легкого выполнялось рентгенологическое исследование на аппарате Proteus XR/a в прямой и боковой проекциях (рис. 4).
Рис. 4. Рентгенография легких: метастаз на рентгенограммах легких (А — передняя, Б — боковая плоскости)Для уточнения локализации, распространенности процесса проводится КТ легких на аппарате Lightspeed Ultra СТ (16 — срезовый, диагностический) с монофазным контрастированием и внутривенным введением 100 мл омнипака (350 мг/мл) или ультрависта-370 (рис. 5).
Рис. 5. Метастаз колоректального рака в легких на компьютерных томограммах (А — передняя, Б — боковая плоскости)При выявлении округлых образований в легких и печени с целью верификации процесса была показана аспирационная пункционная биопсия с последующим цитологическим и гистологическим исследованием.
С.В. Козлов, О.И. Каганов, А.А. Морятов
Informo, ergo sum!
ПАЦИЕНТЫ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
БОЛЕЕ 30% ИЗ НИХ ПЕРЕЖИВАЮТ 5-ЛЕТНИЙ СРОК
ПОСЛЕ СОВРЕМЕННОГО КОМБИНИРОВАННОГО ЛЕЧЕНИЯ
(Конспект материалов заседания)
Интернет: www. ronc.ru //www.oncology.ru //www.elibrary.ru //www.oncodome.narod.ru
№ 3 (596)
ИНФОРМАЦИОННЫЙ БЮЛЛЕТЕНЬ МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА. ИЗДАЕТСЯ С 1994 г.
ОБЩЕСТВО ОСНОВАНО В 1954 г.
ЗАСЕДАНИЕ № 000
СОСТОИТСЯ В ЧЕТВЕРГ, 28 МАРТА 2013 г., в 17.00
В КОНФЕРЕНЦ-ЗАЛЕ КЛИНИКИ РОССИЙСКОГО О НКОЛОГИЧЕСКОГО НАУЧНОГО ЦЕНТРА им. Н. Н.БЛОХИНА
ПОВЕСТКА ДНЯ:
ЛЕЧЕБНАЯ СТРАТЕГИЯ
ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
Президиум:
академик РАН, проф. М.Р. Личиницер, проф. Ю.И. Патютко, д. м.н. Д. Л.Cтрояковский, проф.
Доклад: СТРАТЕГИЯ ЛЕЧЕНИЯ ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
Доклад: РОЛЬ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ
БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Cтрояковский Д. Л.,
(Московская онкологическая больница № 62)
Дискуссия, прения:
• ЛЕЧЕНИЕ БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ С МЕТАСТАЗАМИ В ПЕЧЕНЬ. – , , (РОНЦ им. )
• ЛЕЧЕНИЕ БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ С МЕТАСТАЗАМИ В ЛЕГКИЕ. – , (РОНЦ им. )
• ЛЕЧЕНИЕ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ – , с соавт. (РОНЦ им. )
СОСТОЯНИЕ и ПЕРСПЕКТИВЫ
ЛЕЧЕНИЯ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Колоректальный рак – третья по частоте злокачественная опухоль (после рака легкого и желудка). В России ежегодно выявляется порядка 50.000 пациентов. Отдаленные метастазы, прежде всего – в печени, выявляются при выборе метода лечения у каждого третьего, а при наблюдении после условно радикальных операций – у каждого второго больного. В 25% случаев поражения печени длительно остаются единственным проявлением заболевания, что обосновывает показания к хирургическим вмешательствам.
В плане комбинированного лечения больных метастатическим КРР резекция печени является оптимальным объемом хирургического вмешательства. По статистике 10-25% больных метастатическим колоректальным раком могут быть оперированы при лостаточно низких показателях частоты осложнений и летальности. Химиотерапия, по данным современных рандомизированных исследований – G.Portier, et al. (2006); B.Nordlinger, et al.(2008) – улучшает отдаленные результаты лечения.
(Продолжение – см. с. 2.)
СОСТОЯНИЕ, ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Хирургическое удаление радикально (R0) резектабельных метастазов колоректального рака в печень потенциально может привести к излечению больного. По данным литературы показатели 5-летней выживаемости соответствуют 20–45%. Пятилетняя общая и безрецидивная выживаемость составила после резекции печени 41,1-26,7%, но повышалась до 51,1-33,5% в группе больных после резекций с адъювантной химиотерапией. Получено достоверное увеличение показателей безрецидивной выживаемости при комбинированном лечении.
•Патютко лечение злокачественных опухолей печени. практическая медицина. Москва 2005.
•Laweus D., I. Taylor. Chemotherapy for colorectal cancer – an overview of current managements for surgeons. EJSO, 2005.
•Guillaume Portier, Dominique Elias et al. Multicenter Randomized Trial of Adjuvant Fluorouracil and Folinic Acid Compared
With Surgery Alone After Resection of Colorectal Liver Metastases. FFCD ACHBTH AURC 9002 Trial. J Clin Oncol, 2006.
•Nordlinger, B. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from
colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial / B. Nordlinger, H. Sorbye, B. Glimelius et al. //
Lancet. – 2008. - Vol.371, N 9617. – P. .
•ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making.
По материалам Н. ВДобровой, , .
ТРУДЫ
МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY (№ #596; March 28, 2013)
THE TREATMENT STRATEGY FOR METASTATIC COLORECTAL CARCINOMA
Report-1 TREATMENT’S STRATEGY FOR METASTATIC COLORECTAL CANCER. THE DATA FROM CURRENT CLINICAL PRACTICE AND RESEARCH MATERIALS OF INTERNATIONAL Dr. N. Dobrova, et al. (The N. N.Blokhin Russian Cancer Research Center).
Report-2 COMBINED TREATMENT FOR PATIENTS WITH METASTATIC COLORECTAL Prof. D. Strojakovsky et al. (Moscow City Cancer Hospital N#62)
Discussion CURRENT PROBLEMS OF TREATMENT STRATEGY FOR METASTATIC COLORECTAL CARCINOMA. •Surgery for hepatic metastases of colorectal Dr. N. Podlujny, et al. • Surgery for pulmonary metastases of colorectal Dr. A. Allaxverdiev, et al. • Тhe results of surgical and combined treatment in patients with metastatic colorectal Dr. V. Aliev, et al. (The materials for discussion are presented by the stuff of the N. N.Blokhin Russian Cancer Research Center).
Доклад: СТРАТЕГИЯ ЛЕЧЕНИЯ ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
При колоректальном раке (КРР) метастазы выявляются у 20-25% больных при установлении диагноза и еще у 20-25% – после удаления первичной опухоли. Современная таргетная и химиотерапия метастатического КРР в сочетании с удалением первичной опухоли, резекцией печени и легких (как наиболее частых локализаций метастазов) позволяют добиться длительной выживаемости и улучшения качества жизни, достигнуть клинического излечения.
В научных исследованиях продолжают изучаться вопросы выбора противоопухолевой терапии, сочетания таргетных и химиопрепаратов, продолжительности и индивидуализации лечения. Сложившиеся представления формулируются следующим образом:
Принципы лечения при наличии первичной опухоли и потенциально резектабельных метастазов. Лечебная стратегия должна предусматривать возможность достижения радикализма (выполнения R0 хирургического вмешательства). Стандартом является назначение пред-и послеоперационной химиотерапии (в режиме FOLFOX; продолжительностью 3 мес до и 3 – после операции) Возможно первым этапом удаление первичной опухоли и метастазов, затем послеоперационная адъювантная терапия в режиме FOLFOX в течение 6 месяцев.
Химиотерапия при резектабельных метастазах в печень. Современным стандартом является периоперационная химиотерапия в течение 3 мес до операции и 3 – после. Такой подход доказан в исследовании EORTC 40983 для режима FOLFOX в группе больных единичными (до 4) метастазами в печень и нелеченными оксалиплатином. У больных, не ответивших в пределах предшествующих 12 месяцев на адъювантную терапию на основе оксалиплатина, необходимо использовать другой режим (например, FOLFIRI) или сразу выполнить операцию. Больным с благоприятным прогнозом, например, при солитарном (
По данным исследования, проведенного на медицинском факультете Стэнфордского университета (Stanford University School of Medicine), до 80% случаев метастатического колоректального рака, вероятно, распространились в отдаленные части тела, прежде чем размер исходной опухоли превысил размер макового семени. Данное исследование опубликовано в Nature Genetics.
Выявление пациентов с ранней стадией колоректальной опухоли может помочь врачам определить, кто должен получать раннее лечение, такое как системная химиотерапия, чтобы убить раковые клетки, скрывающиеся далеко от первоначального местоположения опухоли.
Актуальность исследования
Исследователи и клиницисты предположили, что рак приобретает способность метастазировать за счет постепенного накопления молекулярных изменений с течением времени. Эти изменения придают особые черты, которые в конечном итоге позволяют раковым клеткам выходить из окружающей ткани, попадают в кровоток и поселяются в новых местах. В этом случае метастазирование, если оно произойдет, будет относительно поздним событием в развитии первичного рака.
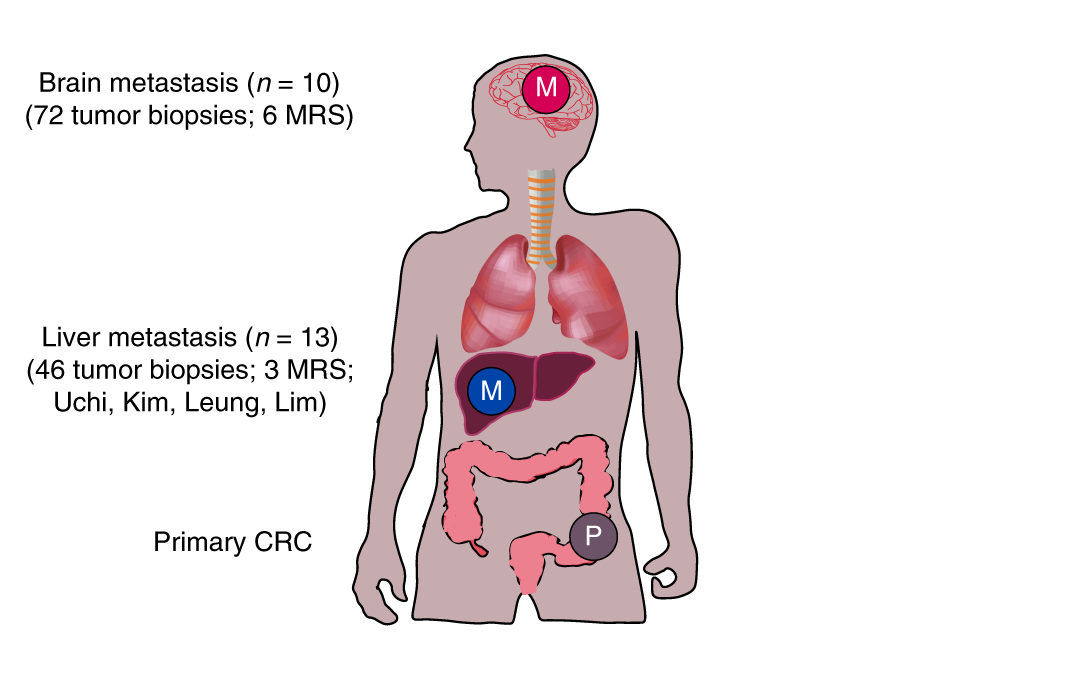
Рак ободочной и прямой кишки является второй по значимости причиной смерти от рака у мужчин и женщин в Соединенных Штатах. Метастазирует он чаще всего в печень, редко метастазирует в мозг, где это почти всегда заканчивается смертельно.
Первоначальные изменения в геноме, вызывающие развитие колоректального рака, хорошо известны, что делает его хорошей моделью, чтобы узнать больше о том, как и когда заболевание прогрессирует. Кертис пыталась восстановить, когда метастазирование происходило от пациента к пациенту, и идентифицировать его причины, анализируя данные генома опухоли.
Материалы и методы исследования
Изучая биопсию опухоли, исследователи сравнили образцы генетических мутаций в первичных опухолях 23 пациентов с образцами их метастазов в печени или головном мозге. Ученые искали сходства или различия между первичным и метастатическим раком, полученным от одного и того же человека. Затем авторы исследования использовали эти паттерны для создания своего рода эволюционного дерева рака каждого пациента — подобного тому, которое биолог мог бы сделать, чтобы проследить эволюцию вида животных от одного предка.
Результаты научного исследования
Результаты исследования показали, что у 17 из 21 пациента (два из исходных пациентов были исключены из анализа) метастатические опухоли были вызваны только одной клеткой или небольшой группой генетически сходных клеток, которые откололись в начале своего развития.
Выводы
Приглашаем подписаться на наш канал в Яндекс Дзен
Читайте также: